ARTICLE D’EXAMEN
TAVARES, Marcela Marçolla [1]
TAVARES, Marcela Marçolla. Utilisation des Colloïdes et des Crystalloïdes dans la période périopératoire des patients graves : Controversias. Revue scientifique pluridisciplinaire de la base de connaissances. An 05, Ed. 01, vol. 01, p. 05-21. janvier 2020. ISSN : 2448-0959, Lien d’accès: https://www.nucleodoconhecimento.com.br/sante/colloides-et-cristalloides
RÉSUMÉ
Comme la gestion du remplacement du liquide influence le pronostic du patient, la recherche fondamentale et clinique a abordé les différents aspects qui contribuent à l’administration des fluides et du volume dans la période périopératoire. Il n’y a toujours pas de consensus sur quand et en qui indiquer l’optimisation hémodynamique périopératoire. D’autres questions telles que le rôle relatif de l’optimisation du ratio cristalloïde par rapport au rapport colloïde n’ont pas été résolues. Ce travail consiste en une revue de littérature, menée entre février et octobre 2019, au cours de laquelle une consultation a été faite à diverses publications scientifiques, présentes sur Internet, par la consultation dans les bases de données : ScienceDirect, UptoDate, Medline/PubMed, Lilacs, sciELO, avec les termes Thérapie périopératoire, Hémodynamique, Volume Reposition, Crystalloid, Colloid. De là, il a été observé que les fluides devraient être appliqués comme n’importe quel autre médicament, en respectant leurs indications et limitations individuelles, qui est la base du concept de thérapie guidée par les objectifs – un nouveau concept qui encourage le patient à encadrer les critères d’inclusion pour l’optimisation des fluides. En faisant référence à cela, des aspects avantageux du remplacement du volume périopératoire par des solutions iso-oncotiques sont compréhensibles, bien que d’autres essais contrôlés randomisés soient nécessaires pour prouver sa pertinence pour le résultat.
Mots-clés: Thérapie périopératoire de fluide, Hemodynamics, Remplacement du volume.
1. INTRODUCTION
Comme la gestion du remplacement du liquide influence le pronostic du patient, la recherche fondamentale et clinique a abordé les différents aspects qui contribuent à l’administration des fluides et du volume dans la période périopératoire. La recherche fondamentale a amélioré les connaissances sur la fonction de la barrière vasculaire endothéliale et ses altérations fonctionnelles responsables de l’extravasation vasculaire. Les études cliniques proclamant différentes approches de contrôle des fluides ont montré des résultats contradictoires et, dans la plupart des cas, ne se réfèrent pas à la base physiologique de la barrière vasculaire. Sur la base de la méta-analyse des 30 dernières années, il ya eu une série d’études menées pour réduire la mortalité et la morbidité chirurgicale par la manipulation délibérée et préventive de l’hémodynamique périopératoire, évoquant une tendance de la communauté scientifique à clarifier si l’optimisation hémodynamique est effectivement bénéfiqu[2]e.
Il est responsable des études qui se sont concentrées principalement sur les objectifs cliniques pour guider la thérapie volumétrique dans la période périopératoire. Cependant, un raisonnement devrait généralement être dérivé de faits physiologiques et d’études significatives et comparables. Ainsi, cette revue résume les connaissances pertinentes sur l’effet de différents fluides intraveineux et sur la surveillance hémodynamique. Comme il n’y a toujours pas de consensus sur ce sujet d’un grand intérêt pour tous les anesthésistes, le but de cet article est de clarifier certains avantages et inconvénients des principaux fluides utilisés dans le remplacement du volume périopératoire.
Le rôle relatif d’optimiser la relation cristalloïde contre colloïde, bien qu’il ne soit pas résolu, il y a des preuves que favorise des solutions équilibrées avec une concentration d’électrolyte semblable à celle trouvée dans le plasma, et de grands volumes de solution saline devraient être évités, car ils induisent l’acidose hyperchlorémiqu[3]e.
2. MATÉRIEL ET MÉTHODES
Ce travail consiste en une revue de littérature, menée entre février et octobre 2019, au cours de laquelle une consultation a été faite à diverses publications scientifiques, présentes sur Internet, à travers une recherche, à partir des bases de données de ScienceDirect, UptoDate, Medline/PubMed, Lilacs, sciELO, principalement avec les termes Thérapie de fluide periopératoire, Hemodynamics, Repositionmation volemique, Crystalloid, Colloid.
Les critères d’inclusion dans cette étude étaient des articles scientifiques décrivant les principales différences entre les colloïdes et les cristalloïdes ainsi que leurs principales indications dans la période périopératoire. Plusieurs modalités d’études entre 1980 et 2019 ont été revues, y compris des études prospectives randomisées et multicentériques, des méta-analyses, des études d’observation rétrospectives et des revues de littérature.
3. EXAMEN
3.1 LA PHYSIOLOGIE DE LA COMPARTIMENTATION DES FLUIDES
L’eau corporelle totale pour un individu de 75 kg est d’environ 45 L (60%). Les deux tiers de cette (30 L) est l’eau intracellulaire. Le tiers restant (15 L) dans le compartiment extracellulaire est divisé entre les compartiments intravasculaires (3 L) et extravasculaires (12 L) (Fig. 1[4]). Le volume intravasculaire total est d’environ 5 L et a des composants cellulaires (globules rouges et blancs et plaquettes: 40%)[2 L] et non cellulaire (plasma: 60%[3 L]). Le plasma est une solution aqueuse d’ions inorganiques (principalement du chlorure de sodium), de molécules simples comme l’urée et de plus grandes molécules organiques comme l’albumine et les globulines.
FIGURE 01: Modèle explicatif de la distribution des fluides dans le corps

Comme le montre la figure 01, il est noté qu’une grande partie du volume liquide est concentrée dans le milieu intracellulaire, étant composé de solution glycosate.
Une perméabilité vasculaire accrue due à l’activation inflammatoire avec la fonction endotheliale altérée de cellules peut se produire pour une série de raisons pendant de plus grandes procédures chirurgicale[5]s. Plus précisément, le trauma chirurgical de tissu, l’hypoperfusion de tissu due à la thérapie organique inadéquate, les dommages/réperfusion d’ischémie, la septicémie (locale ou de sang) et l’utilisation du pontage cardio-pulmonaire (p. ex. pontage cardio-pulmonaire) sont identifiées comme stimulus inflammatoires qui peuvent compromettre la fonction vasculair[6]e.
3.2 VOLUME DE REMPLACEMENT
Le remplacement du volume doit être indiqué chaque fois qu’il est nécessaire de : 1) remplacer la perte de sang pendant la chirurgie, 2) Remplacer les pertes par la transpiration et la production d’urine 3) chirurgies préopératoires d’entrailles et 4) l’entretien des pertes de troisième espac[7]e.
Il est entendu par troisième espace comme un terme proposé par Randall en 1952, pour décrire la situation dans laquelle le liquide extracellulaire est perdu ou enlevé dans une zone du corps où il ne participe pas aux échanges, et ne répond donc pas aux besoins en eau du patient[8].
3.3 STRATÉGIE PÉRIOPÉRATOIRE OPTIMISÉE HEMODYNAMIQUEMENT
Les patients qui pourraient bénéficier de ce traitement sont ceux à haut risque selon l’indice révisé du risque cardiaque et le test d’exercice cardio-respiratoire préopératoire[6],[9],[10]
Selon une revue systématique de littérature sur l’optimisation périopératoire dans les patients à haut risque chirurgical, des facteurs importants ont été trouvés qui aideraient à identifier des patients qui bénéficieraient le plus de l’optimisation du fluide perioparatoir[11]e. Les résultats sont décrits dans le tableau 01, basé sur les études de Mangano et coll. (1996), Poldermans et coll. (1999) et Shoemaker et coll. (1988).
TABLE 01 – Critères d’inclusion pour l’optimisation périopératoire
| Histórico de enfermidade cardíaca ou pulmonar severa, como por exemplo DPOC, infarto agudo do miocárdio, e insuficiência cardíaca. |
| Cirurgias extensas que envolvam anastomoses do trato gastrointestinal (por exemplo, esofagectomia). |
| Perda massiva e abrupta de sangue (>2,5L) |
| Idade maior ou igual a 70 anos com reserve fisiológica limitada em um ou mais órgãos vitais. |
| Septicemia |
| Insuficiência Respiratória (PaO2 <60 mmHg e FIO2 >0.4) |
| Acometimento abdominal agudo como pancreatite, perfuração de vísceras ou sangramentos do TGI. |
| Insuficiência Renal Aguda |
| Doença vascular em estágio avançado |
Source: Fourre-tout; Motifs (2006)
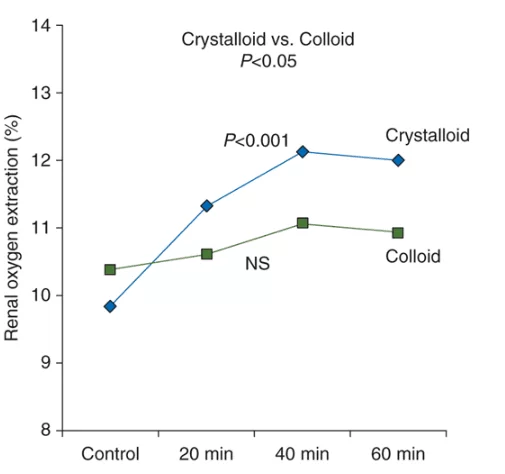
Basé sur une étude impliquant 30 patients graves qui ont subi des chirurgies cardiaques, il a été démontré que malgré l’augmentation de l’index cardiaque et le flux sanguin rénal avec les deux fluides, aucun des fluides amélioré l’oxygénation rénale, parce que les deux hémodilution induite. GFR a augmenté dans le cristalloï (28%), mais pas dans le groupe colloïde, comme le montre la figure 0[12]2.
La même étude a montré que l’utilisation de cristalloïdes a augmenté le taux de filtration (24%) ainsi que l’extraction rénale d’oxygène (23%), même sans augmenter l’approvisionnement vasculaire de la composante, ce qui suggère que l’augmentation du GFR – le principal déterminant de la consommation d’oxygène – n’a pas été accompagnée d’une augmentation proportionnelle de la fraction d’oxygène fournie aux reins. En d’autres termes, leurs résultats résument en graphique (figure 02) que l’extraction d’oxygène rénal cristallide accrue (P 0,001) 20, 40 et 60 min après le bolus, contrairement au colloïde (NS), suggérant une oxygénation rénale altérée dans le deuxième cas. Le changement dans l’extraction rénale d’oxygène a été sensiblement (P 0.05) plus prononcé dans le groupe cristalloïde comparé au groupe colloïd[11]e.
FIGURE 02 : Effets de la cristalloïde (10 ml/kg) et de l’infusion colloïde (20 ml/kg) sur l’extraction rénale d’oxygène après chirurgie cardiaque
3.4 LE TYPE DE FLUIDE POUR LA STRATÉGIE D’OPTIMISATION HÉMODYNAMIQUE
De nombreuses présentations de solutions sont disponibles pour le remplacement du volume, elles varient en fonction de la composition des ions et de la présence ou de l’absence de composés organiques. Nous avons donc la présence de colloïdes et de cristalloïdes.
Les colloïdes sont considérés comme des extenseurs plasmatiques parce qu’ils causent moins de perte capillaire et moins d’oedème pulmonaire que les cristalloïdes. Ils réduisent l’expression des médiateurs inflammatoires, améliorent la microcirculation et l’oxygénation des tissus, et favorisent une réanimation plus élevée du volume que les cristalloïdes. Cependant, des effets secondaires (CS) ont déjà été observé[5]s.
Les cristalloïdes, d’autre part, quittent le compartiment intravasculaire plus tôt et en plus grande quantité que les colloïdes et, par conséquent, un plus grand volume est nécessaire pour reconstituer les déficits (3 à 4 fois le volume de cristalloïdes[6]). Certaines des principales caractéristiques des crystalloïdes sont présentées dans les tableaux 02 et les colloïdes dans le tableau 0[3]3.
TABLE 2 – Les principaux cristalloïdes et leurs osmolarités et concentrations de sodium (Na) et de potassium (K)
| Cristaloide | Osmolaridade (mOsm/L) | Na+ | K+ |
| Glucose 5% | 252 | — | — |
| Glucose 25% | 1260 | — | — |
| Glucose 50% | 2520 | — | — |
| Sodium chloride 0.9% | 308 | 154.0 | 154.0 |
| Sodium chloride and glucose | 264 | 31.0 | 31.0 |
| Ringer’s solution | 309 | 147.0 | 156.0 |
| Compound sodium lactatea | 278 | 131.0 | 111.0 |
| Plasmalyte B | 298.5 | 140 | 98 |
| Normasol | 280 | 140 | 98 |
Source: Adapté de Grocott. Et al (2005)
Dans une étude prospective et aveugle dans les patients électifs qui ont eu la chirurgie non-cardiaque, la réanimation intraopératoire de fluide avec l’utilisation colloïde (6% HES), l’incidence de la nausée postopératoire et des vomissements, la douleur grave, l’œdème périiorbital et la vision double a été réduit[13]e.
Dans les patients subissant la chirurgie abdominale principale, quand ils ont reçu des cristalloïdes seuls, ils ont eu comme conséquence l’accumulation intestinale de fluide comparée à ceux qui ont également reçu des colloïdes (6% HES[14]). Ceci mène à l’oedème accru de tissu. L’association de l’oedème tissulaire avec perfusion altérée et l’oxygénation est controversée[15]
TABLEAU 3 : Les principaux colloïdes et leurs valeurs respectives de poids moléculaire moyen pondéré (PMMP), de nombre moléculaire moyen pondéré (PNM) et de sodium (NaMD) et de chlore (Cl-)
| Solução | Coloide | PMMP(Da) | NMMP (Da) | Na+(mmol/L) | Cl- (mmol/L) |
| Gelofusine (4%) | Succinylated gelatin | 30,000 | 22,600 | 154 | 125 |
| Haemaccel (3.5%) | Polygeline | 35,000 | 24,300 | 145 | 145 |
| Voluven | Tetrastarch | 130,000 | 60,000 | 154 | 154 |
| Pentaspan | Pentastarch | 264,000 | 63,000 | 154 | 154 |
| HAES-steril 6% or 10% | Pentastarch | 200,000 | 60,000 | 154 | 154 |
| EloHase 6% | Hexastarch | 200,000 | 60,000 | 154 | 154 |
| Hespan 6% | Hetastarch | 450,000 | 70,000 | 150 | 150 |
| Hextend | Hetastarch | 670,000 | 70,000 | 143 | 124 |
| Gentran 40 | Dextran 40 | 40,000 | 25,000 | 154 | 154 |
| Gentran 70 | Dextran 70 | 70,000 | 39,000 | 154 | 154 |
| Rheomacrodex | Dextran 40 | 40,000 | 25,000 | 154 | 154 |
| Macrodex | Dextran 70 | 70,000 | 39,000 | 154 | 154 |
Adapté de Grocott; Mythen, mythen, mythen. GAN (2005)
D’autre part, de grandes quantités de solution saline conduisent à l’acidose hyperchloré[16]mique et l’état de l’hypercoagulorabi[17]lité encore plus démontré que celui normalement vu dans l’infusion d’autres crystalloide[18]s.
3.5 UTILISATION RATIONNELLE DE FLUIDES PENDANT LA PÉRIODE PÉRIOPÉRATOIRE
Plus que le type de liquide utilisé, il y a une préoccupation de plus en plus claire d’identifier les indications réelles de remplacement de fluide dans la période périopératoire.
L’une des stratégies les plus répandues est la thérapie pilotée par les objectifs (GOT), qui a été utilisée à plusieurs reprises pour améliorer considérablement les résultats de l’optimisation hémodynamique, à court et à long terme, l’ap[19]p[20]roche TGO est axée sur la maximisation (optimisation) de la production cardiaque (CO) par l’administration progressive des fluide[21]s.
Le consensus national mené en 2016 a conclu que le succès de la thérapie guidée par les objectifs (GOT) et d’autres stratégies restrictives en matière de fluides suggèrent que la planification du liquide périopératoire ne devrait mettre l’accent sur le fait que la thérapie fluide n’est administrée que lorsqu’il y a u[22]ne indication claire à l’aide des critères d’inclusion présentés au tableau 01.
En outre, en ce qui concerne la stratégie thérapeutique ciblée, il y a 9 études dans lesquelles une stratégie thérapeutique orientée vers un objectif a également été employée pour maximiser des variables hémodynamiques liées au flux des patients chirurgicaux, intra et postopératoire[23]s. Les études ont révélé que la stratégie de traitement réduisait les complications gastro-intestinales et la durée du séjour à l’hôpit[24]al, tant dans le service que dans les unités de soins intensif[25]s.
Concomitante avec l’initiation de la thérapie, il est important de souligner que, une fois initié, l’évaluation de la réactivité avant l’administration des fluides peut non seulement aider à la détection des patients ayant besoin de fluides, mais aussi éviter la surcharge inutile et nocive de fluide. Cette évaluation consiste, par exemple, à observer des paramètres dynamiques fonctionnels tels que les changements dans la sortie cardiaque lors de manœuvres pré-modifications, comme l’élévation passive des membres inférieur[20]s.
Dans les patients chirurgicaux à haut risque, l’utilisation d’un protocole hémodynamique pour maintenir la perfusion de tissu a diminué la mortalité et l’échec postopératoires d’organ[26]e. La surveillance de la production cardiaque en calculant le transport et la consommation d’oxygène a également aidé à guider la thérapi[18]e.
4. CONSIDÉRATIONS FINALES
Le régime de remplacement idéal serait celui qui a diminué la mortalité et amélioré la qualité de vie, a diminué l’échec multiple d’organe et l’utilisation de sang, et était peu-coût. Ce régime n’a évidemment pas encore été réalisé. Comme il n’y a pas de ligne directrice fondée sur des preuves, dans la pratique, une combinaison de cristalloïdes et de colloïdes est utilisée, et il est plus important de savoir comment remplacer que de savoir quoi remplacer.
En général, les liquides doivent être appliqués comme n’importe quel autre médicament, en respectant leurs indications et limitations individuelles. En faisant référence à cela, des aspects avantageux du remplacement du volume périopératoire par des solutions iso-oncotiques sont compréhensibles, bien que d’autres essais contrôlés randomisés soient nécessaires pour prouver sa pertinence pour le résultat. Résumant les arguments cités ci-dessus, une stratégie rationnelle d’administration fluide pourrait être de traiter les patients subissant la chirurgie à faible risque avec la perte de volume intravasculaire négligeable avec l’infusion cristalloïde et utiliser une combinaison de l’administration cristalloïde et colloïde, soigneusement titré basé sur des mesures hémodynamiques.
Enfin, nous concluons que la thérapie guidée par objectif dans la période périopératoire est associée à des réductions des complications et de la durée de l’hospitalisation. Les effets bénéfiques de l’OT peuvent être obtenus, évitant ainsi les difficultés d’admission aux unités de soins intensifs.
5. RÉFÉRENCES
BRANDSTRUP, B.; SVENDSEN, P. E.; RASMUSSEN, M.; et al. Which goal for fluid therapy during colorectal surgery is followed by the best outcome: near-maximal stroke volume or zero fluid balance? British Journal of Anaesthesia. United Kingdom, v. 109, n.2 , p. 191–199, 17 jun. 2012. Disponível em: <https://ac-els-cdn.ez3.periodicos.capes.gov.br/S000709121732888X/1-s2.0-S000709121732888X-main.pdf?_tid=bde7ae63-beb3-46c9-9adc-e0f04482d0cf&acdnat=1539636094_9a27cfa1829cc5679acd68973a0e7357>. Acesso em: 15 out. 2019.
BUNDGAARD-NIELSEN, M.; HOLTE, K.; SECHER, N. H.; KEHLET, H. Monitoring of peri-operative fluid administration by individualized goal-directed therapy. Acta Anaesthesiologica Scandinavica. USA v. 51, n. 3, p. 331–340, mar. 2007. Wiley/Blackwell (10.1111). Disponível em: <http://doi.wiley.com/10.1111/j.1399-6576.2006.01221.x>. Acesso em: 16 out. 2019.
GOW, K. W.; PHANG, P. T.; TEBBUTT-SPEIRS, S. M.; et al. Effect of crystalloid administration on oxygen extraction in endotoxemic pigs. Journal of Applied Physiology. USA, v. 85, n. 5, p. 1667–1675, nov. 1998. American Physiological SocietyBethesda, MD . Disponível em: <http://www.physiology.org/doi/10.1152/jappl.1998.85.5.1667>. Acesso em: 15 out. 2019.
GROCOTT, M. P. W.; MYTHEN, M. G.; GAN, T. J. Perioperative Fluid Management and Clinical Outcomes in Adults. Anesthesia & Analgesia. USA, v. 100, n. 4, p. 1093–1106, 2005. Disponível em: <https://insights.ovid.com/crossref?an=00000539-200504000-00032>. Acesso em: 15 out. 2019..
GURGEL, S. T.; DO NASCIMENTO, P. Maintaining Tissue Perfusion in High-Risk Surgical Patients. Anesthesia & Analgesia. USA, v. 112, n. 6, p. 1384–1391, 2011. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/21156979>. Acesso em: 16 out. 2019..
HAMILTON, M. A.; CECCONI, M.; RHODES, A. A Systematic Review and Meta-Analysis on the Use of Preemptive Hemodynamic Intervention to Improve Postoperative Outcomes in Moderate and High-Risk Surgical Patients. Anesthesia & Analgesia. USA, v. 112, n. 6, p. 1392–1402, 2011. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/20966436>. Acesso em: 16 out. 2019.
HOLTE, K.; SHARROCK, N. E.; KEHLET, H. Pathophysiology and clinical implications of perioperative fluid excess. British Journal of Anaesthesia. United Kingdom, v. 84, n. 4, p. 622-632, oct. 2002. Disponível em: <https://www.ncbi.nlm.nih.gov/pubmed/12393365>. Acesso em: 16 out. 2019.
KELLUM, J. A. Saline-induced hyperchloremic metabolic acidosis. Critical care medicine. New York, v. 30, n. 1, p. 259–61, 2002. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/11902280>. Acesso em: 15 out. 2019.
LEE, T. H.; MARCANTONIO, E. R.; MANGIONE, C. M.; et al. Derivation and Prospective Validation of a Simple Index for Prediction of Cardiac Risk of Major Noncardiac Surgery. Circulation. Dallas, v. 100, n. 10, sep. 1999. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/10477528>. Acesso em: 15 out. 2019.
LORENTZ, M. N. Reposição volêmica perioperatória. Rev Med Minas Gerais. Minas Gerais, v. 20, n. 4, p. 47–56, 2018. Disponível em: <http://rmmg.org/artigo/detalhes/1025>. Acesso em: 15 out. 2019.
MANGANO, D. T.; LAYUG, E. L.; WALLACE, A.; TATEO, I. Effect of Atenolol on Mortality and Cardiovascular Morbidity after Noncardiac Surgery. New England Journal of Medicine. Canada, v. 335, n. 23, p. 1713–1721, 1996. Massachusetts Medical Society . Disponível em: <http://www.nejm.org/doi/abs/10.1056/NEJM199612053352301>. Acesso em: 15 out. 2019.
MORETTI, E. W.; ROBERTSON, K. M.; EL-MOALEM, H.; GAN, T. J. Intraoperative Colloid Administration Reduces Postoperative Nausea and Vomiting and Improves Postoperative Outcomes Compared with Crystalloid Administration. Anesthesia & Analgesia. USA, v. 96, n. 2, p. 611–617, 2003. Disponível em: <https://insights.ovid.com/crossref?an=00000539-200302000-00056>. Acesso em: 15 out. 2019.
MYTHEN, M. G.; WEBB, A. R. Perioperative plasma volume expansion reduces the incidence of gut mucosal hypoperfusion during cardiac surgery. Archives of surgery. Chicago, v. 130, n. 4, p. 423–9, 1995. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/7535996>. Acesso em: 16 out. 2019.
ØSTGAARD, G.; REED, R. K. Interstitial fluid accumulation does not influence oxygen uptake in the rabbit small intestine. Acta Anaesthesiologica Scandinavica. USA, v. 39, n. 2, p. 167–173, 1995. Wiley/Blackwell (10.1111). Disponível em: <http://doi.wiley.com/10.1111/j.1399-6576.1995.tb04037.x>. Acesso em: 15 out. 2019.
PEARSE, R.; DAWSON, D.; FAWCETT, J.; et al. Early goal-directed therapy after major surgery reduces complications and duration of hospital stay. A randomised, controlled trial [ISRCTN38797445]. Critical Care. New York, v. 9, n. 6, p. R687, 2005. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/16356219>. Acesso em: 16 out. 2019.
PEREL, A.; HABICHER, M.; SANDER, M. Bench-to-bedside review: Functional hemodynamics during surgery – should it be used for all high-risk cases? Critical Care. New York, v. 17, n. 1, p. 203, 2013. BioMed Central. Disponível em: <http://ccforum.biomedcentral.com/articles/10.1186/cc11448>. Acesso em: 15 out. 2019.
POLDERMANS, D.; BOERSMA, E.; BAX, J. J.; et al. The Effect of Bisoprolol on Perioperative Mortality and Myocardial Infarction in High-Risk Patients Undergoing Vascular Surgery. New England Journal of Medicine. Canada, v. 341, n. 24, p. 1789–1794, 1999. Massachusetts Medical Society. Disponível em: <http://www.nejm.org/doi/abs/10.1056/NEJM199912093412402>. Acesso em: 15 out. 2019.
RAOBAIKADY, R.; DINESH, S.; HACKING, M.; WIGMORE, T. Cardiopulmonary exercise testing as a screening test for perioperative management of major cancer surgery: a pilot study. Critical Care. New York, v. 11, n. Suppl 2, p. 250, 2007. BioMed Central. Disponível em: <http://ccforum.biomedcentral.com/articles/10.1186/cc5410>. Acesso em: 15 out. 2019.
RIELLA MC, RIELLA CV, PACHALY MA, RIELLA LV. Metabolismo da água. In: Riella MC, org. Princípios de nefrologia e distúrbios hidroeletrolíticos. 5ª ed. Rio de Janeiro, Brasil: Guanabara Koogan; 2010. p. 105-38.
RUTTMANN, T. G.; JAMES, M. F.; VILJOEN, J. F. Haemodilution induces a hypercoagulable state. British Journal of Anaesthesia. United Kingdom, v. 76, n. 3, p. 412–414, 1996. Oxford University Press. Disponível em: <http://linkinghub.elsevier.com/retrieve/pii/S0007091217435483>. Acesso em: 16 out. 2019.
SHOEMAKER, W. C.; APPEL, P. L.; KRAM, H. B.; WAXMAN, K.; LEE, T. S. Prospective trial of supranormal values of survivors as therapeutic goals in high-risk surgical patients. Chest. Glenview, v. 94, n. 6, p. 1176–86, 1988. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/3191758>. Acesso em: 16 out. 2019.
SILVA, E. D.; PERRINO, A. C.; TERUYA, A.; et al. Brazilian Consensus on perioperative hemodynamic therapy goal guided in patients undergoing noncardiac surgery: fluid management strategy – produced by the São Paulo State Society of Anesthesiology (Sociedade de Anestesiologia do Estado de São Paulo – SAESP). Brazilian Journal of Anesthesiology (English Edition). São Paulo v. 66, n. 6, p. 557–571, 2016. Sociedade Brasileira de Anestesiologia. Disponível em: <https://linkinghub.elsevier.com/retrieve/pii/S0104001416301750>. Acesso em: 15 out. 2019.
SINCLAIR, S.; JAMES, S.; SINGER, M. Intraoperative intravascular volume optimisation and length of hospital stay after repair of proximal femoral fracture: randomised controlled trial. BMJ (Clinical research ed.). London, v. 315, n. 7113, p. 909–12, 1997. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/9361539>. Acesso em: 16 out. 2019.
SKYTTE LARSSON, J.; BRAGADOTTIR, G.; KRUMBHOLZ, V.; et al. Effects of acute plasma volume expansion on renal perfusion, filtration, and oxygenation after cardiac surgery: a randomized study on crystalloid vs colloid. British Journal of Anaesthesia. United Kingdom, v. 115, n. 5, p. 736–742, 2015. Oxford University Press. Disponível em: <https://linkinghub.elsevier.com/retrieve/pii/S0007091217310759>. Acesso em: 15 out. 2019.
SUBRAMANIAM, B.; SUBRAMANIAM, K.; PARK, K. W. Volume Replacement Strategies and Outcome. International Anesthesiology Clinics. USA, v. 48, n. 1, p. 115–125, 2010. Disponível em: <https://insights.ovid.com/crossref?an=00004311-201004810-00009>. Acesso em: 16 out. 2019.
TOCANTINS, L. M.; CARROLL, R. T.; HOLBURN, R. H. The Clot Accelerating Effect of Dilution on Blood and Plasma. Relation to the Mechanism of Coagulation of Normal and Hemophilic Blood. Blood. Washington, v. 6, n. 8, 1951. Disponível em: <http://www.bloodjournal.org/content/6/8/720.short?sso-checked=true>. Acesso em: 15 out. 2019.
TOTE, S. P.; GROUNDS, R. M. Performing perioperative optimization of the high-risk surgical patient. British Journal of Anaesthesia. United Kingdom, v. 97, n. 1, p. 4–11, 2006. Oxford University Press. Disponível em: <http://linkinghub.elsevier.com/retrieve/pii/S0007091217351772>. Acesso em: 15 out. 2019.
APPENDICE – RÉFÉRENCES DANS LA NOTE DE BAS DE PAGE
2. Hamilton, 2011.
3. Holte, 2002.
4. Grocott, 2005.
5. Brandstrup, 2012.
6. Lorentz, 2018.
7. Subramaniam, 2010.
8. Riella, 2010.
9. Lee, 1999.
10. Raobaikady, 2007.
11. Tote, 2006.
12. Skytte Larsson, 2015.
13. Moretti, 2003.
14. ØStgaard, 1995.
15. Gow, 1998.
16. Kellum, John.
17. Ruttmann, 1996.
18. Tocantins et al. 1951
19. Gurgel; Nascimento, 2011.
20. Hamilton, Cecconi, Rhodes, 2011.
21. Perel, Habicher, Sander, 2003.
22. Silva, Et al. 2016.
23. Bundgaard-Nielsen, 2007.
24. Mythen, 1995.
25. Sinclair, Stephen. James, Sally. Singer, Merrill, 1997.
26. Pearse, Ruppert, 2005.
[1] Médical. Troisième cycle en médecine des soins intensifs pour adultes.
Envoyé: Décembre, 2019.
Approuvé : janvier 2020.


