ARTICOLO ORIGINALE
OLIVEIRA, Leandro José Dias Gonçalves de [1]
OLIVEIRA, Leandro José Dias Gonçalves de. Sintesi di un glicinato di rame (II) complesso monoidrato. Revista Científica Multidisciplinar Núcleo do Conhecimento. anno 04, Ed. 07, Vol. 10, pp. 87-96. luglio 2019. ISSN: 2448-0959
RIEPILOGO
I composti di coordinamento sono fondamentalmente caratterizzati da uno ione di un metallo a blocchi D, chiamato acido di Lewis circondato da liganti chiamati basi Lewis, e di solito i loro sali hanno una colorazione intensa quando sono in soluzione. Il lecinato di rame (II) monoidrato è un solido di colore blu-verde, e ha forme isomeriche cis/trans. Il presente lavoro mira a segnalare il processo di sintesi e caratterizzazione a livello qualitativo di questo complesso nel laboratorio chimico della scuola comunale Governador Israel Pinheiro, Joo Monlevade, MG. I risultati dell’esperimento hanno rivelato cristalli di colore caratteristici del composto previsto e resa percentuale favorevole.
Parole chiave: sintesi chimica, glicinato di rame, complesso, composto di coordinamento.
1. INTRODUZIONE
La sintesi chimica ci permette di ottenere prodotti più complessi di interesse per la società partendo da sostanze più semplici. La maggior parte dei progressi tecnologici sono stati possibili grazie a questi studi. I processi di sintesi sono presenti, tra gli altri, nell’industria chimica e farmaceutica, nel campo della biologia e della biotecnologia. I processi di sintesi chimica mirano non solo a creare nuove sostanze, ma a sviluppare metodi reazionari di maggiore redditività economica.
Isenmann (2013) apud Oliveira et al (2018) afferma che prima di pensare alla pianificazione della sintesi, dovremmo cercare informazioni di base, come la comprensione dei meccanismi delle reazioni, la conoscenza delle reazioni classiche, le nozioni di stoichiometria, i metodi di Purificazione e quali composti sono prontamente disponibili.
Tra le migliaia di composti sintetizzati dall’uomo sono i complessi. Nella definizione di Russell (1994) un complesso è costituito da un atomo centrale o principale, circondato da e legato da uno o più ligando, che possono essere atomi, ioni o molecole. Atkins e Jones (2012) completano, affermando che i leganti sono orientati al metallo da legami coordinati.
È comune avere una formazione complessa con elementi di blocchi D e f con orbitali disponibili per nuovi elettroni. Il glicinate di rame (II) –[Cu(gly)2], è un sale che ha percorsi diversi da sintetizzare, e il metodo e i reagenti influenzano quando si vuole ottenere distintamente le forme CIS e trans del composto. Per Shriver e Atkins (2003), i complessi metallici hanno un ruolo importante nella chimica inorganica, specialmente quelli formati dai metalli D-Block.
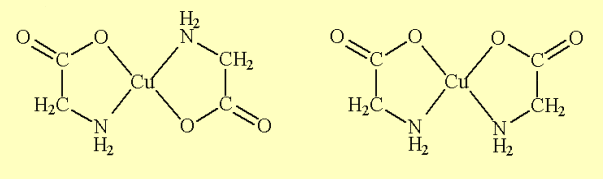
Figura 01 – Trans-bis-e cis-bi[Cu(gly)2]s-strutture[Cu(gly)2].
I complessi metallici sono composti interessanti, in quanto presentano molte proprietà peculiari in termini di: strutture, colori, proprietà ottiche e magnetiche, per esempio. Un’altra caratteristica che può essere menzionata si riferisce al fatto che formano sali che non rilasciano i loro ioni in mezzo acquoso, mantenendo la loro integrità chimica. I composti di coordinamento sono divisi in due gruppi: i doppi sali, quelli che perdono la loro identità, e i complessi, che sono quelli che mantengono l’identità. (Hoehne e Dall’Oglio, 2013).
Questo lavoro ha lo scopo di descrivere il metodo utilizzato per ottenere uno degli isomeri di glicinate di rame (II) a partire dall’acido aminoacetico e acetato di rame (II) monositaro, effettuato nel laboratorio di una scuola tecnica di Joo Monlevade, MG, e fare un Semplice analisi qualitativa del composto formato.
2. METODO
L’utilizzo di un bequer di 50 mL ha sciolto 2,0 g di acetato di rame (II) Monoidrata in 25 mL di acqua riscaldata deionizzata, procedendo al successivo riscaldamento progressivo utilizzando l’apparato montato su Bunsen. A questa soluzione è stato aggiunto un precedentemente riscaldato 25 mL di P.A. etanolo. Ha continuato a mantenere la miscela sotto riscaldamento. In un altro fardello, 1,5 g di acido aminoacetico è stato sciolto in 25 mL di acqua calda deionizzata. Entrambi i bambini sono stati tenuti sotto riscaldare fino a raggiungere i 70 gradi centigradi (è stato utilizzato un termometro per monitorare la temperatura). La soluzione dell’acido aminoacetico è stata aggiunta alla miscela di acetato di rame (II) monoidrato. La miscela è stata lasciata a riposo fino a raggiungere la temperatura ambiente. Poi il bequer è stato immerso nel bagno di ghiaccio. Dopo alcuni minuti, il contenuto del Bequer è stato filtrato utilizzando la carta da filtro di massa qualitativa precedentemente determinata. Il contenuto dell’imbuto è stato lavato con etanolo. Dopo la filtrazione completa, la carta da filtro è stata rimossa dall’imbuto, che è stato aperto sul piano di lavoro fino alla completa evaporazione dell’alcol. La massa del contenuto sulla carta da filtro è stata misurata e il rendimento della reazione è stato calcolato.
3. RISULTATI E DISCUSSIONI
Abbiamo misurato le masse di acido aminoacetico e acetato di rame (II) Monoidrato, i cui valori erano rispettivamente 1.5009 G e 2.0036 G. Dopo di che, è stata misurata la massa della carta filtrante qualitativa ed è stato trovato il valore di 1.1609 G. È stata osservata imprecisione della misurazione di massa nella quarta cifra decimale per l’acido aminoacetico e per la carta filtrante qualitativa e nella terza e quarta cifra decimale per l’acetato di rame (II) monoidratare.
L’acetato di rame è un sale di colore blu-verde, mentre l’acido aminoacetico è acido organico incolore. Durante la fase di riscaldamento non ci sono state notevoli alterazioni nel contenuto dei beduini, e hanno presentato chiaramente i colori dei rispettivi reagenti utilizzati.
Figura 02 – Fase di riscaldamento dei reagenti.

Il noto cambiamento si è verificato quando la soluzione dell’acido aminoacetico è stata posta nel bequer contenente la miscela di acetato di rame (II) monoidrato ed etanolo. Ha rivelato un colore blu. Il farquer è stato rimosso dall’apparecchio di riscaldamento e posto sul piano di lavoro fino a raggiungere la temperatura ambiente.
Figura 03 – Miscela risultante dalla miscela tra i reagenti.

La colorazione osservata è dovuta al metallo iosidratato di rame CU2, responsabile della formazione di diversi complessi di interesse scientifico, tra cui il glicinato di rame (II) monoidrato, che ha suscitato il maggiore interesse degli studenti rivelando il loro intenso Colorazione. Molti elementi del blocco D formano soluzioni con colori caratteristici in acqua (ATKINS e JONES, 2012). Altre caratteristiche, come la conduttività, il colore, i composti con la stessa composizione molecolare, ma diversi colori e momenti di dipolo sono stati osservati in questa nuova classe di composti (COELHO, 2010).
Il colore che una sostanza visualizza corrisponde, quindi, alla frazione della luce visibile che non assorbe. L’assorbimento delle radiazioni ultraviolette al di sotto di 400 non viene rilevato dall’occhio umano, e percepiamo la radiazione infrarossa come calore (SOU-A, S.D.).
In chimica la varietà di colori incanta tutti e, infatti, il cambiamento di colore è un’indicazione della reazione chimica. I colori sono importanti in quanto possono rivelare più dettagli su un composito nell’analisi. Basato su glicinato di rame (II) monoidrato, il sale ha rivelato una caratteristica colorazione dello ione complesso. Secondo Atkins e Jones (2012), se il complesso è blu è perché sta assorbendo la luce arancione (580-620 nm). Arancione e blu sono colori complementari.
Figure 04 – Cerchio cromatico.

Affinché un composto abbia colore, deve assorbire la luce visibile. Un composto assorbirà radiazioni visibili quando tale radiazione ha l’energia necessaria per spostare un elettrone dal suo stato energetico inferiore (fondamentale) a uno stato eccitato (BROWN, 2003).
Dopo che la miscela del becher ha raggiunto la temperatura ambiente, misurata con un termometro, il bequer è stato immerso nel bagno di ghiaccio. Cristalli troppo luminosi di una colorazione blu, leggermente meno intensi, hanno dimostrato di essere più grandi e più definiti. I cristalli di sale mostravano poca solubilità nel mezzo acquoso quando sottoposti a bassa temperatura.
Figure 05/06-copper cristalli di glicinata (II).

Figura 07 – Apparecchi di filtrazione.

Dopo alcuni minuti, l’apparato di filtrazione è stato assemblato al fine di trattenere la parte solida che si è formata come la temperatura stava diminuendo. Con l’aumentare del volume del filtrato nel calice, a causa del lavaggio continuo con etanolo, abbiamo potuto vedere i cristalli di Glycinus di rame (II), molto uniti, apparentemente macerati, di intensa colorazione blu. Il colore del complesso dipende dal metallo, ma anche dal ligando, il che significa che i cambiamenti nelle sostituzioni possono causare cambiamenti di colore. Dopo il filtraggio, la carta filtrante è stata rimossa e aperta sul piano di lavoro, in modo che passerebbe sopra un flusso d’aria.
La reazione che si è verificata per la formazione del composto di coordinamento è data dall’equazione
Cu (CH3COO)2 + 2 NH2CH2COOH + H2O [Cu (NH2CH2COO)2]. H2O + 2 CH3COOH
Dopo l’evaporazione completa dell’etanolo che smorzava la carta filtrante, rimanevano solo i cristalli. La massa dei cristalli con la carta da filtro era 2.9385 G. Pertanto, la massa dei cristalli isolati corrisponde a 1.7776 g.
Per calcolare la resa della reazione di sintesi della glicinate di rame è stato necessario determinare le masse molare dei reagenti coinvolti, essendo
Cu (CH3COO)2 = 181,62982 g.mol-1, NH2CH2COOH = 75,42662 g.mol-1 e
[Cu (NH2CH2COO)2]. H2O = 229,67450 g.mol-1. I calcoli eseguiti seguono di seguito, utilizzando tutte le posizioni decimali allo scopo di lasciare il risultato più preciso:
1 mol NH2CH2COOH __________ 75,42662 g
2 mol NH2CH2COOH __________ m1 = 150,85324 g
È stata effettuata una verifica per verificare se vi è stato un reagente in eccesso, il cui calcolo è il seguente:
1 mol Cu (CH3COO)2 __________ 2 mol NH2CH2COOH
181,62982 g __________ 150,85324 g
2,0036 g __________ m2 = 1,6640965215 g NH2CH2COOH
181,62982 g __________ 150,85324 g
m3 __________ 1,5009 g m3 = 1,8071086629 g Cu (CH3COO)2
È stato notato, attraverso i calcoli, che il reagente in eccesso è Cu (CH3COO) 2, presto si è allontanato dal reagente limitante, NH2CH2COOH, per eseguire il calcolo della resa.
2 mol NH2CH2COOH __________ 1 mol [Cu (NH2CH2COO)2]. H2O
150,85324 g __________ 229,6745 g
1,5009 g __________ m4 = 2,2851246486 g
2,2851246486 g __________ 100%
1,7776 g __________ R = 77,790067211%
I calcoli hanno mostrato che il rendimento della reazione era di circa il 77,8%. Possiamo considerare quanto sia favorevole il rendimento reazionario > 60%.
C’è grande interesse tra i professionisti nelle strutture, nelle proprietà e negli usi dei complessi, secondo Atkins e Jones (2012), in parte perché partecipano a molte reazioni biologiche.
I colori dei composti di coordinamento sono di solito determinati dagli atomi centrali, anche se possono anche essere dovuti ad altri cromofori (o pigmenti) che fanno parte della loro composizione. I complessi metallici di transizione sono affascinanti per le varietà di colori che esibiscono. Per un particolare metallo, questo cambiamento di colore può anche essere osservato in funzione del ligando (SO-A, S.D.).
I complessi metallici del gruppo D sono spesso magnetici e dai colori vivaci e vengono utilizzati in chimica per l’analisi, la dissoluzione degli ioni, l’elettrodeposizione metallica e la catalisi. Sono anche oggetto di ricerca nella conservazione dell’energia solare, nella fissazione dell’azoto atmosferico e dei nuovi farmaci (ATKINS e JONES, 2012).
Molti complessi sono importanti per la nostra vita, e la loro mancanza nel nostro organismo può causare gravi malattie. Secondo Brown (2003) elementi come V, Cr, Mn, Fe, Co, Ni, Cu, n, Mo e Cd formano complessi con una varietà di gruppi di donatori presenti nei sistemi biologici come gli enzimi. Il glicinate di rame (II) è anche ampiamente usato per il completamento parenterale negli animali, essendo una fonte di sostituzione del rame.
Ci sono anche complessi che vengono utilizzati in pigmenti di vernice, produzione di colori in vetro e pietre preziose. Esempi di altri complessi importanti per il mantenimento della vita sono l’emoglobina, responsabile del trasporto di ossigeno nel sangue, il cui atomo centrale è Il Fe2 e la clorofilla, responsabile della fotosintesi, il cui atomo centrale è Mg2.
Ci sono molti metalli che formano complessi indispensabili per diverse funzioni biologiche degli esseri viventi, contribuendo al mantenimento delle esigenze cellulari di base. Questi composti sono in grado di interagire con molti recettori siti, che rappresenta un potenziale guadagno nella formulazione di agenti terapeutici selettivi.
Le attività svolte dagli ioni metallici nei media biologici hanno stimolato la ricerca e lo sviluppo di composti inorganici come agenti terapeutici. Il coinvolgimento di questi composti in medicina, in particolare quelli contenenti metalli di transizione, è stato molto limitato fino al 1965, quando c’era una dimostrazione classica dell’attività antitumorale del complesso chiamato cisplat[PtCl2(NH3)2]in, (COHEN, 2007 apud GUERRA et al, 2011 ).
4. CONCLUSIONE
La sintesi proposta del composto previsto è stata soddisfatta con successo. L’uso di strategie come la sperimentazione contribuisce notevolmente alla formazione degli studenti, oltre ad essere in grado di essere utilizzato come prima pietra miliare per l’introduzione di un contenuto. Si ritiene che gli errori analitici e le attrezzature senza una corretta calibrazione possano aver contribuito alla perdita della resa reazionale. Non è possibile determinare solo qualitativamente quale forma isomerica è stata sintetizzata o se c’è la possibilità di una miscela racemica. Per questo, sarebbero necessari metodi analitici strumentali più selettivi, in grado di determinare la struttura dei composti. La formazione di cis-bis-è stata specu[Cu(gly)2]lata. H2O sulla base di informazioni provenienti da altri esperimenti, dicendo che attraverso la miscela di glicina al filtrato rimanente è possibile ottenere la forma trans del complesso di interesse. Lo studio della sintesi chimica è relativamente complesso, ma importante per lo sviluppo di nuovi prodotti e principi attivi di interesse non solo nell’ambiente accademico, ma in diverse aree di conoscenza, come i settori farmaceutico e agroveterinare, per esempio.
5. RIFERIMENTI
ATKINS, Peter; JONES, Loretta. Princípios de química: questionando a vida moderna e o meio ambiente, 5° ed. Bookman, 2012, 922 p.
BROWN, Theodore. Química: a ciência central, 9° ed. São Paulo, Pearson, 2003.
Círculo cromático. Disponível em < http://www.elgin.com.br/blog/2017/04/18/cores-voce-sabe-como-combina-las-na-hora-de-decorar/>; 2017. Acesso em 30/10/2018.
COELHO, Augusto Leite. Química Inorgânica, Ceará, Núcleo Gráfico da UECE, 2010, 132 p.
COTTON, Simon. Uppingham Scholl, Rutland, UK Molecule od the Month April, 2010. Disponível em <http://www.chm.bris.ac.uk/motm/glycine/Glycine%20-%20Molecule%20of%20the%20Month%20-%20April%202010.pdf>. Acesso em 30/10/2018.
GUERRA, Wendell; et al. Coordenação de metais a antibióticos como uma estratégia de combate à resistência bacteriana. Revista Química Nova, 34(1); 2011: 111-118.
HOEHNE, Lucélia; DALL’OGLIO, Camila. Compostos de coordenação e a química orgânica. Revista Destaques Acadêmicos, 5(4); 2013: 79-83.
ISENMANN, Armin Franz. Princípios da Síntese Orgânica. 2ª ed. Timóteo, 2013.
OLIVEIRA, Leandro José Dias Gonçalves de.; et al. Rotas de síntese do antibiótico Linezolida e correlação entre sua estrutura química e bioatividade. Revista Eletrônica Acervo em Saúde, Vol. Sup. 13, 2018; p. 1557-1566.
RUSSEL, John. Química Geral, 2ª ed. Pearson, 1994, vol.1, 662 p.
SHRIVER, Duward; ATKINS, Peter. Química Inorgânica, 3ª ed. Bookman, 2003, 816 p.
SOUZA, Anne. Compostos de coordenação: cor e propriedades magnéticas, s.d.; p. 152-160.
[1] Chimica (UNIUBE). Specialista in insegnamento di chimica (UCAM). Accademico del Corso di specializzazione in Educazione Scientifica (UFMG).
Inviato: Luglio, 2019.
Approvato: luglio 2019.