ARTÍCULO ORIGINAL
OLIVEIRA, Leandro José Dias Gonçalves de [1]
OLIVEIRA, Leandro José Dias Gonçalves de. Síntesis de un complejo de glicinato de cobre (II) monohidrato. Revista Científica Multidisciplinar Núcleo do Conhecimento. Año 04, Ed. 07, Vol. 10, págs. 87-96. Julio de 2019. ISSN: 2448-0959. Enlace de acceso: https://www.nucleodoconhecimento.com.br/quimica-es/complejo-de-glicinato, DOI: 10.32749/nucleodoconhecimento.com.br/quimica-es/complejo-de-glicinato
RESUMEN
Los compuestos de coordinación se caracterizan básicamente por un ion de un metal de bloque D, llamado ácido Lewis rodeado de ligantes llamados bases Lewis, y por lo general sus sales tienen una coloración intensa cuando están en solución. El glicinato de cobre (II) monohidrato es un sólido de color azul-verde, y tiene formas isoéricas cis/trans. El presente trabajo tiene como objetivo informar el proceso de síntesis y caracterización a nivel cualitativo de este complejo en el laboratorio químico del Colegio Municipal Governador Israel Pinheiro, João Monlevade, MG. Los resultados del experimento revelaron cristales de color característicos del compuesto previsto y rendimiento porcentual favorable.
Palabras clave: síntesis química, glicinato de cobre, complejo, compuesto de coordinación.
1. INTRODUCCIÓN
La síntesis química nos permite obtener productos más complejos de interés para la sociedad a partir de sustancias más simples. La mayoría de los avances tecnológicos fueron posibles gracias a estos estudios. Los procesos de síntesis están presentes en las industrias química y farmacéutica, en el campo de la biología y la biotecnología, entre otros. Los procesos de síntesis química tienen como objetivo no sólo crear nuevas sustancias, sino desarrollar métodos reaccionarios de mayor viabilidad económica.
Isenmann (2013) apud Oliveira et al (2018) dice que antes de pensar en la planificación de la síntesis, debemos buscar información básica, como la comprensión de los mecanismos de las reacciones, el conocimiento de las reacciones clásicas, las nociones de estequiometría, los métodos de Purificación y qué compuestos están fácilmente disponibles.
Entre los miles de compuestos sintetizados por el hombre están los complejos. En la definición de Russell (1994) un complejo está constituido por un átomo central o principal, rodeado y unido a uno o más ligandos, que pueden ser átomos, iones o moléculas. Atkins y Jones (2012) complementan, diciendo que los aglutinantes están orientados al metal mediante enlaces coordinados.
Es común tener una formación compleja con elementos de bloques D y f con orbitales disponibles para nuevos electrones. El glicinato de cobre (II) [Cu(gly)2]–, es una sal que tiene diferentes rutas a sintetizar, y el método y los reactivos influyen cuando se quiere obtener claramente las formas CIS y trans del compuesto. Para Shriver y Atkins (2003), los complejos metálicos tienen un papel importante en la química inorgánica, especialmente aquellos formados por metales D-Block.
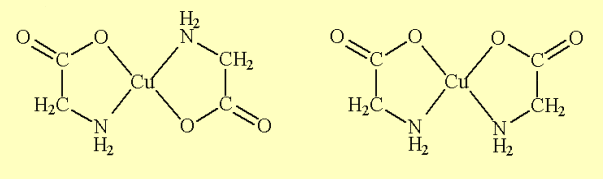
Figura 01 – Trans-bis-y cis-bis-[Cu(gly)2]estructuras[Cu(gly)2].
Los complejos metálicos son compuestos interesantes, ya que exhiben muchas propiedades peculiares en términos de: estructuras, colores, propiedades ópticas y magnéticas, por ejemplo. Otra característica que se puede mencionar se refiere al hecho de que forman sales que no liberan sus iones en medio acuoso, manteniendo su integridad química. Los compuestos coordinadores se dividen en dos grupos: las sales dobles, los que pierden su identidad, y los complejos, que son los que mantienen la identidad. (Hoehne e Dall’Oglio, 2013).
Este trabajo tiene como objetivo describir el método utilizado para obtener uno de los isómeros de glicinato de cobre (II) a partir del ácido aminoacético y acetato de cobre (II) monohidrato, llevado a cabo en el laboratorio de una escuela técnica de Joao Monlevade, MG, y hacer una Análisis cualitativo simple del compuesto formado.
2. MÉTODO
Utilizando un bequer de 50 ml disuelto 2,0 g de acetato de cobre (II) Monohidrato en 25 ml de agua desionizada calentada, procediendo al calentamiento progresivo posterior utilizando el aparato montado en Bunsen. A esta solución se añadió un P.A. de 25 ml de etanol previamente calentado. Continuó manteniendo la mezcla bajo calentamiento. En otro bequer, 1,5 g de ácido aminoacético se disolvió en 25 ml de agua desionizada caliente. Ambos bebés se mantuvieron bajo calentamiento hasta que alcanzaron los 70oC (se utilizó un termómetro para controlar la temperatura). La solución de ácido aminoacético se añadió a la mezcla de acetato de cobre (II) monohidrato. La mezcla se dejó en reposo hasta que alcanzó la temperatura ambiente. Entonces el querador se sumergió en el baño de hielo. Después de unos minutos, el contenido del Bequer se filtró utilizando el papel de filtro de masa cualitativo previamente determinado. El contenido del embudo se lavó con etanol. Después de la filtración completa, el papel del filtro se retiró del embudo, que se abrió en la encimera hasta la evaporación completa del alcohol. Se midió la masa del contenido en el papel del filtro y se calculó el rendimiento de reacción.
3. RESULTADOS Y DISCUSSIONS
Medimos las masas de ácido aminoacético y acetato de cobre (II) Monohidrato, cuyos valores fueron respectivamente 1.5009 G y 2.0036 G. Después de eso, se midió la masa del papel de filtro cualitativo y se encontró el valor de 1.1609 G. Se observó inexactitud de la medición de masa en el cuarto decimal para el ácido aminoacético y para el papel de filtro cualitativo y en el tercer y cuarto decimales para acetato de cobre (II) monohidrato.
El acetato de cobre es una sal de color azul-verde, mientras que el ácido aminoacético es ácido orgánico incoloro. Durante la fase de calentamiento no hubo alteraciones notables en el contenido de los beduinos, y presentaron claramente los colores de los reactivos respectivos utilizados.
Figura 02 – Fase de calentamiento de los reactivos.

El cambio notorio se produjo cuando la solución de ácido aminoacético se colocó en el quero contiene la mezcla de acetato de cobre (II) monohidrato y etanol. Reveló un color azul. El querador fue retirado del aparato de calefacción y colocado en la encimera hasta que alcanzó la temperatura ambiente.
Figura 03 – Mezcla resultante de la mezcla entre los reactivos.

La tinción observada se debe al ion de cobre CU2 + hidratado, metal responsable de la formación de varios complejos de interés científico, entre ellos, el glicinado de cobre (II) monohidrato, que despertó el mayor interés de los estudiantes al revelar su intenso Colorante. Muchos elementos del bloque D forman soluciones con colores característicos en el agua (ATKINS y JONES, 2012). Otras características, como conductividad, color, compuestos con la misma composición molecular, pero diferentes colores y momento de dipolo se observaron en esta nueva clase de compuestos (COELHO, 2010).
El color que muestra una sustancia corresponde, por lo tanto, a la fracción de la luz visible que no absorbe. La absorción de radiaciones ultravioletas por debajo de 400 no es detectada por el ojo humano, y percibimos la radiación infrarroja como calor (SOUZA, S.D.).
En química, la variedad de colores encanta a todos y, de hecho, el cambio de color es una indicación de reacción química. Los colores son importantes, ya que pueden revelar más detalles sobre un compuesto en el análisis. A base de glicinato de cobre (II) monohidrato, la sal reveló la tinción característica del ion complejo. Según Atkins y Jones (2012), si el complejo es azul es porque está absorbiendo la luz naranja (580-620 nm). El naranja y el azul son colores complementarios.
Figuras 04 – Círculo cromático.

Para que un compuesto tenga color, debe absorber la luz visible. Un compuesto absorberá la radiación visible cuando esa radiación tenga la energía necesaria para mover un electrón de su estado de energía inferior (fundamental) a un estado excitado (BROWN, 2003).
Después de que la mezcla de vaso de precipitados alcanzó la temperatura ambiente, medida con un termómetro, el bequer se sumergió en el baño de hielo. Se demostró que los cristales demasiado brillantes de una coloración azul, ligeramente menos intensa, eran más grandes y más definidos. Los cristales de sal mostraron poca solubilidad en medio acuoso cuando se someten a baja temperatura.
Figuras 05/06-cristales de glicinato de cobre (II).

Figura 07 – Aparato de filtración.

Después de unos minutos, el aparato de filtración se ensambló con el fin de retener la parte sólida que se formó a medida que la temperatura estaba disminuyendo. A medida que el volumen del filtrado aumentaba en el cáliz, debido al lavado continuo con etanol, pudimos ver los cristales de Glicina de cobre (II), muy unidos, aparentemente macerados, de intensa coloración azul. El color del complejo depende del metal, pero también del ligando, lo que significa que los cambios en las sustituciones pueden causar cambios de color. Después de filtrar, el papel filtrante se quitó y se abrió en la encimera, para que pasara sobre una corriente de aire.
La reacción que se produjo para la formación del compuesto de coordinación se da por la ecuación
Cu (CH3COO)2 + 2 NH2CH2COOH + H2O [Cu (NH2CH2COO)2]. H2O + 2 CH3COOH
Después de la evaporación completa del etanol que humedecía el papel del filtro, sólo quedaron los cristales. La masa de los cristales con el papel de filtro fue de 2.9385 G. Por lo tanto, la masa de los cristales aislados corresponde a 1.7776 g.
Para calcular el rendimiento de la reacción de síntesis de glicinato de cobre fue necesario determinar las masas molares de los reactivos implicados,
Cu (CH3COO)2 = 181,62982 g.mol-1, NH2CH2COOH = 75,42662 g.mol-1 e
[Cu (NH2CH2COO)2]. H2O = 229,67450 g.mol-1. Los cálculos realizados siguen a continuación, utilizando todos los decimales con el fin de dejar el resultado más preciso:
1 mol NH2CH2COOH __________ 75,42662 g
2 mol NH2CH2COOH __________ m1 = 150,85324 g
Se hizo una verificación para verificar si había exceso de reactivo, cuyo cálculo sigue:
1 mol Cu (CH3COO)2 __________ 2 mol NH2CH2COOH
181,62982 g __________ 150,85324 g
2,0036 g __________ m2 = 1,6640965215 g NH2CH2COOH
181,62982 g __________ 150,85324 g
m3 __________ 1,5009 g m3 = 1,8071086629 g Cu (CH3COO)2
Se notó, a través de los cálculos, que el exceso de reactivo es Cu (CH3COO) 2, pronto se apartó del reactivo limitante, NH2CH2COOH, para realizar el cálculo del rendimiento.
2 mol NH2CH2COOH __________ 1 mol [Cu (NH2CH2COO)2]. H2O
150,85324 g __________ 229,6745 g
1,5009 g __________ m4 = 2,2851246486 g
2,2851246486 g __________ 100%
1,7776 g __________ R = 77,790067211%
Los cálculos mostraron que el rendimiento de la reacción fue de aproximadamente 77,8%. Podemos considerar cuán favorables son los rendimientos reaccionarios > 60%.
Hay un gran interés entre los profesionales en las estructuras, propiedades y usos de los complejos, según Atkins y Jones (2012), en parte porque participan en muchas reacciones biológicas.
Los colores de los compuestos de coordinación generalmente están determinados por los átomos centrales, aunque también pueden deberse a otros cromóforos (o pigmentos) que forman parte de su composición. Los complejos metálicos de transición son fascinantes por las variedades de colores que exhiben. Para un metal en particular, este cambio de color también se puede observar en función del ligando (SOUZA, S.D.).
Los complejos de metales del grupo D son a menudo magnéticos y de colores brillantes y se utilizan en la química para el análisis, la disolución ióniforme, la electrodeposición metálica y la catálisis. También son objetos de investigación en la conservación de la energía solar, en la fijación de nitrógeno atmosférico y nuevos fármacos (ATKINS y JONES, 2012).
Muchos complejos son importantes para nuestras vidas, y su falta en nuestro organismo puede causar enfermedades graves. Según Brown (2003) elementos como V, Cr, Mn, Fe, Co, Ni, Cu, Zn, Mo y Cd forman complejos con una variedad de grupos de donantes presentes en sistemas biológicos como enzimas. Glicinato de cobre (II) también se utiliza ampliamente para la suplementación parenteral en animales, siendo una fuente de reemplazo de cobre.
También hay complejos que se utilizan en pigmentos de pintura, producción de color en vidrio y piedras preciosas. Ejemplos de otros complejos importantes para el mantenimiento de la vida son la hemoglobina, responsable del transporte de oxígeno en la sangre, cuyo átomo central es Fe2 + y clorofila, responsable de la fotosíntesis, cuyo átomo central es Mg2 +.
Hay muchos metales que forman complejos indispensables para varias funciones biológicas de los seres vivos, contribuyendo al mantenimiento de las necesidades celulares básicas. Estos compuestos son capaces de interactuar con muchos sitios receptores, que representa una ganancia potencial en la formulación de agentes terapéuticos selectivos.
Las actividades realizadas por los iones metálicos en medios biológicos han estimulado la investigación y el desarrollo de compuestos inorgánicos como agentes terapéuticos. La participación de estos compuestos en la medicina, especialmente aquellos que contenían metales de transición, fue muy limitada hasta 1965, cuando hubo una demostración clásica de la actividad antitumoral del complejo llamado cisplatin[PtCl2(NH3)2]o, (COHEN, 2007 apud GUERRA et al, 2011 ).
4. CONCLUSIÓN
La síntesis propuesta del compuesto previsto se cumplió con éxito. El uso de estrategias como la experimentación contribuye en gran medida a la formación de los estudiantes, además de poder ser utilizado como un hito inicial para la introducción de un contenido. Se cree que los errores analíticos y el equipo sin una calibración adecuada pueden haber contribuido a la pérdida del rendimiento reaccionarico. No es posible determinar cualitativamente qué forma isomérica fue sintetizada o si existe la posibilidad de una mezcla racmica. Para ello, seríanecesarion métodos analíticos instrumentales más selectivos, capaces de determinar la estructura de los compuestos. Se especuló la formación de cis-b[Cu(gly)2]is– . H2O basado en información de otros experimentos, diciendo que a través de la mezcla de glicina al filtrado restante es posible obtener la forma trans del complejo de interés. El estudio de la síntesis química es relativamente complejo, pero importante para el desarrollo de nuevos productos y principios activos de interés no sólo en el entorno académico, sino en diferentes áreas de conocimiento, como los sectores farmacéutico y agroveterinario, Ejemplo.
5. REFERENCIAS
ATKINS, Peter; JONES, Loretta. Princípios de química: questionando a vida moderna e o meio ambiente, 5° ed. Bookman, 2012, 922 p.
BROWN, Theodore. Química: a ciência central, 9° ed. São Paulo, Pearson, 2003.
Círculo cromático. Disponível em < http://www.elgin.com.br/blog/2017/04/18/cores-voce-sabe-como-combina-las-na-hora-de-decorar/>; 2017. Acesso em 30/10/2018.
COELHO, Augusto Leite. Química Inorgânica, Ceará, Núcleo Gráfico da UECE, 2010, 132 p.
COTTON, Simon. Uppingham Scholl, Rutland, UK Molecule od the Month April, 2010. Disponível em <http://www.chm.bris.ac.uk/motm/glycine/Glycine%20-%20Molecule%20of%20the%20Month%20-%20April%202010.pdf>. Acesso em 30/10/2018.
GUERRA, Wendell; et al. Coordenação de metais a antibióticos como uma estratégia de combate à resistência bacteriana. Revista Química Nova, 34(1); 2011: 111-118.
HOEHNE, Lucélia; DALL’OGLIO, Camila. Compostos de coordenação e a química orgânica. Revista Destaques Acadêmicos, 5(4); 2013: 79-83.
ISENMANN, Armin Franz. Princípios da Síntese Orgânica. 2ª ed. Timóteo, 2013.
OLIVEIRA, Leandro José Dias Gonçalves de.; et al. Rotas de síntese do antibiótico Linezolida e correlação entre sua estrutura química e bioatividade. Revista Eletrônica Acervo em Saúde, Vol. Sup. 13, 2018; p. 1557-1566.
RUSSEL, John. Química Geral, 2ª ed. Pearson, 1994, vol.1, 662 p.
SHRIVER, Duward; ATKINS, Peter. Química Inorgânica, 3ª ed. Bookman, 2003, 816 p.
SOUZA, Anne. Compostos de coordenação: cor e propriedades magnéticas, s.d.; p. 152-160.
[1] Química Química (UNIUBE). Especialista en Enseñanza Química (UCAM). Académico del Curso de especialización en Educación Científica (UFMG).
Enviado: Julio, 2019.
Aprobado: Julio de 2019.