ORIGINAL-ARTIKEL
OLIVEIRA, Leandro José Dias Gonçalves de [1]
OLIVEIRA, Leandro José Dias Gonçalves de. Synthese eines Kupferglycinats (II) komplexes Monohydrat. Revista Científica Multidisciplinar Núcleo do Conhecimento. 04-Jahr, Ed. 07, Vol. 10, S. 87-96. Juli 2019. ISSN: 2448-0959
ZUSAMMENFASSUNG
Die koordinierenden Verbindungen sind im Grunde durch ein Ion eines D-Block-Metalls gekennzeichnet, genannt Lewis-Säure, umgeben von Ligants, die Lewis-Basen genannt werden, und in der Regel haben ihre Salze eine intensive Färbung, wenn sie in Lösung sind. Kupferglycinat (II) Monohydrat ist ein blau-grün gefärbter Feststoff und hat cis/trans isomerische Formen. Die vorliegende Arbeit zielt darauf ab, den Prozess der Synthese und Charakterisierung auf der qualitativen Ebene dieses Komplexes im chemischen Labor der städtischen Schule Governador Israel Pinheiro, Joo Monlevade, MG zu berichten. Die Ergebnisse des Experiments ergaben charakteristische Farbkristalle der beabsichtigten Verbindung und einen günstigen prozentualen Ertrag.
Stichworte: chemische Synthese, Kupferglycinat, komplex, Koordinationsverbindung.
1. EINFÜHRUNG
Die chemische Synthese ermöglicht es uns, komplexere Produkte zu erhalten, die für die Gesellschaft von Interesse sind, ausgehend von einfacheren Substanzen. Die meisten technologischen Fortschritte waren dank dieser Studien möglich. Syntheseprozesse sind in der chemischen und pharmazeutischen Industrie, unter anderem im Bereich der Biologie und Biotechnologie, präsent. Die Prozesse der chemischen Synthese zielen nicht nur darauf ab, neue Substanzen zu schaffen, sondern auch reaktionäre Methoden zu einer größeren wirtschaftlichen Lebensfähigkeit zu entwickeln.
Isenmann (2013) apud Oliveira et al (2018) sagt, dass wir, bevor wir an die Syntheseplanung denken, nach grundlegenden Informationen suchen sollten, wie das Verständnis der Mechanismen von Reaktionen, das Wissen über klassische Reaktionen, Vorstellungen von Stoichiometrie, Methoden der Reinigung und welche Verbindungen sind leicht verfügbar.
Unter den Tausenden von Verbindungen, die vom Menschen synthetisiert werden, sind die Komplexe. Nach Russells Definition (1994) besteht ein Komplex aus einem Zentral- oder Hauptatom, das von einem oder mehreren Liganden umgeben und an einen oder mehrere Liganden gebunden ist, die Atome, Ionen oder Moleküle sein können. Atkins und Jones (2012) ergänzen sich und sagen, dass die Bindemittel durch koordinierte Bindungen auf das Metall ausgerichtet sind.
Es ist üblich, komplexe Formation mit Elementen von D- und f-Blöcken mit Orbitalen für neue Elektronen zur Verfügung zu haben. Kupferglycinat (II) – ist ein [Cu(gly)2]Salz, das verschiedene Wege hat, um synthetisiert zu werden, und die Methode und Reagenzien beeinflussen, wenn man deutlich die GUS und Transformen der Verbindung erhalten will. Für Shriver und Atkins (2003) spielen Metallkomplexe eine wichtige Rolle in der anorganischen Chemie, insbesondere solche, die aus D-Block-Metallen gebildet werden.
Abbildung 01 – Trans-bis- und cis-b[Cu(gly)2]is-Strukture[Cu(gly)2]n.
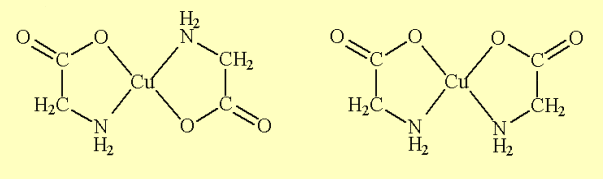
Die Metallkomplexe sind interessante Verbindungen, da sie viele besondere Eigenschaften in Bezug auf: Strukturen, Farben, optische und magnetische Eigenschaften, zum Beispiel. Ein weiteres Merkmal, das erwähnt werden kann, bezieht sich auf die Tatsache, dass sie Salze bilden, die ihre Ionen nicht in wässrigen Medien freisetzen, um ihre chemische Integrität zu erhalten. Die koordinierenden Verbindungen sind in zwei Gruppen unterteilt: die Doppelsalze, diejenigen, die ihre Identität verlieren, und die Komplexe, die diejenigen sind, die die Identität bewahren. (Hoehne e Dall’Oglio, 2013).
Diese Arbeit zielt darauf ab, das Verfahren zu beschreiben, das bei der Gewinnung eines der Kupferglycinat-Isomere (II) verwendet wird, ausgehend von dem Monohydrat von Aminoessigsäure und Kupferacetat (II), das im Labor einer technischen Schule von Joo Monlevade, MG, durchgeführt wird, und Einfache qualitative Analyse der gebildeten Verbindung.
2. SYSTEM
Mit einem 50 ml Bequer gelöst 2,0 g Kupferacetat (II) Monohydrat in 25 ml erhitztem entionisiertem Wasser, die anschließende progressive Erwärmung mit dem Bunsen-montierten Gerät. Dieser Lösung wurde eine zuvor erhitzte Ethanol-P.A. von 25 ml zugesetzt. Es fuhr fort, die Mischung unter Erhitzen zu halten. In einem anderen Bequer wurden 1,5 g Aminoessigsäure in 25 ml heißem entionisiertem Wasser gelöst. Beide Babys wurden unter Erhitzen gehalten, bis sie 70 ° C erreichten (ein Thermometer wurde verwendet, um die Temperatur zu überwachen). Die Lösung von Aminoessigsäure wurde der Mischung aus Kupferacetat (II) Monohydrat zugesetzt. Die Mischung wurde in Ruhe gelassen, bis sie Raumtemperatur erreichte. Dann wurde der Bequer in das Eisbad eingetaucht. Nach wenigen Minuten wurde der Inhalt des Bequer mit dem zuvor ermittelten qualitativen Massenfilterpapier gefiltert. Der Inhalt des Trichters wurde mit Ethanol gewaschen. Nach der vollständigen Filtration wurde das Filterpapier aus dem Trichter entfernt, der auf der Arbeitsplatte bis zur vollständigen Verdunstung des Alkohols geöffnet wurde. Die Masse des Inhalts auf dem Filterpapier wurde gemessen und die Reaktionsausbeute berechnet.
3. ERGEBNISSE UND DISKUSSIONEN
Wir maßen die Massen von Aminoessigsäure und Kupferacetat (II) Monohydrat, deren Werte 1,5009 G bzw. 2,0036 G betrugen. Danach wurde die Masse des qualitativen Filterpapiers gemessen und der Wert von 1,1609 G gefunden. Es wurde eine Ungenauigkeit der Massenmessung in der vierten Dezimalstelle für Aminoessigsäure und für das qualitative Filterpapier und in der dritten und vierten Dezimalstelle für Kupferacetat (II) Monohydrat beobachtet.
Kupferacetat ist ein blau-grün gefärbtes Salz, während Aminosäure farblose organische Säure ist. Während der Heizphase gab es keine nennenswerten Veränderungen im Inhalt der Beduinen, und sie zeigten deutlich die Farben der jeweiligen Reagenzien verwendet.
Abbildung 02 – Heizphase der Reagenzien.

Die berüchtigte Veränderung trat auf, als die Lösung von Aminoessigsäure in den Bequer gelegt wurde, der das Gemisch aus Kupferacetat (II) Monohydrat und Ethanol enthielt. Es zeigte eine blaue Farbe. Der Bequer wurde aus dem Heizgerät entfernt und auf die Arbeitsplatte gelegt, bis er Raumtemperatur erreichte.
Abbildung 03 – Mischung, die sich aus der Mischung zwischen den Reagenzien ergibt.

Die beobachtete Färbung ist auf das Kupferion CU2 + hydratisiert, Metall verantwortlich für die Bildung von mehreren Komplexen von wissenschaftlichem Interesse, darunter das Kupferglycinat (II) Monohydrat, das das größere Interesse der Studenten geweckt, indem sie ihre intensive Färbung. Viele Elemente des D-Blocks bilden Lösungen mit charakteristischen Farben in Wasser (ATKINS und JONES, 2012). Andere Eigenschaften, wie Leitfähigkeit, Farbe, Verbindungen mit der gleichen molekularen Zusammensetzung, aber unterschiedliche Farbe und Dipolmoment wurden in dieser neuen Klasse von Verbindungen beobachtet (COELHO, 2010).
Die Farbe, die eine Substanz entsprechend dem Bruchteil des sichtbaren Lichts anzeigt, den sie nicht absorbiert. Die Absorption von ultravioletten Strahlungen unter 400 wird vom menschlichen Auge nicht erkannt, und wir nehmen Infrarotstrahlung als Wärme wahr (SOUZA, S.D.).
In der Chemie verzaubert die Vielfalt der Farben jeden und in der Tat ist Farbwechsel ein Hinweis auf chemische Reaktion. Farben sind wichtig, da sie mehr Details zu einem Verbund in der Analyse offenbaren können. Basierend auf Kupferglycinat (II) Monohydrat zeigte Salz eine charakteristische Färbung des komplexen Ions. Laut Atkins und Jones (2012), wenn der Komplex blau ist, ist es, weil es das orange Licht absorbiert (580-620 nm). Orange und Blau sind komplementäre Farben.
Figuren 04 – Chromatischer Kreis.

Damit eine Verbindung Farbe hat, muss sie sichtbares Licht absorbieren. Eine Verbindung absorbiert sichtbare Strahlung, wenn diese Strahlung die Energie hat, die benötigt wird, um ein Elektron aus seinem niedrigeren (fundamentalen) Energiezustand in einen angeregten Zustand zu versetzen (BROWN, 2003).
Nachdem die Bechermischung die Raumtemperatur erreicht hatte, gemessen mit einem Thermometer, wurde der Bequer in das Eisbad getaucht. Kristalle, die zu hell von einer blauen Färbung, etwas weniger intensiv, wurden gezeigt, größer und definierter. Die Salzkristalle zeigten bei niedriger Temperatur wenig Löslichkeit im wässrigen Medium.
Abbildungen 05/06-Kupferglycinatkristalle (II).

Abbildung 07 – Filtrationsgerät.

Nach einigen Minuten wurde das Filtergerät montiert, um das feste Teil zu behalten, das bei abnehmender Temperatur gebildet wurde. Als das Volumen des Filtrats im Kelch zunahm, aufgrund des kontinuierlichen Waschens mit Ethanol, konnten wir die Kristalle von KupferGlycinus (II) sehen, sehr vereint, scheinbar mazeriert, von intensiver blauer Färbung. Die Farbe des Komplexes hängt vom Metall ab, aber auch vom Liganden, was bedeutet, dass Änderungen der Substitutionen zu Farbänderungen führen können. Nach dem Filtern wurde das Filterpapier entfernt und auf der Arbeitsplatte geöffnet, so dass es über einen Luftstrom geleitet wurde.
Die Reaktion, die zur Bildung der Koordinationsverbindung aufgetreten ist, wird durch die Gleichung
Cu (CH3COO)2 + 2 NH2CH2COOH + H2O [Cu (NH2CH2COO)2]. H2O + 2 CH3COOH
Nach der vollständigen Verdunstung des Ethanols, das das Filterpapier dämpfte, blieben nur noch die Kristalle übrig. Die Masse der Kristalle mit dem Filterpapier betrug 2.9385 G. Daher entspricht die Masse der isolierten Kristalle 1,7776 g.
Um die Ausbeute der Synthesereaktion von Kupferglycinat zu berechnen, war es notwendig, die Molmassen der beteiligten Reagenzien zu bestimmen,
Cu (CH3COO)2 = 181,62982 g.mol-1, NH2CH2COOH = 75,42662 g.mol-1 e
[Cu (NH2CH2COO)2]. H2O = 229,67450 g.mol-1. Die durchgeführten Berechnungen folgen unten, wobei alle Dezimalstellen verwendet werden, um das Ergebnis genauer zu machen:
1 mol NH2CH2COOH __________ 75,42662 g
2 mol NH2CH2COOH __________ m1 = 150,85324 g
Es wurde überprüft, ob ein überschüssiges Reagenz vorlag, dessen Berechnung wie folgt lautet:
1 mol Cu (CH3COO)2 __________ 2 mol NH2CH2COOH
181,62982 g __________ 150,85324 g
2,0036 g __________ m2 = 1,6640965215 g NH2CH2COOH
181,62982 g __________ 150,85324 g
m3 __________ 1,5009 g m3 = 1,8071086629 g Cu (CH3COO)2
Bei den Berechnungen wurde festgestellt, dass das überschüssige Reagenz Cu (CH3COO) 2 ist, das bald vom begrenzenden Reagenz NH2CH2COOH abgewichen ist, um die Berechnung des Ertrags durchzuführen.
2 mol NH2CH2COOH __________ 1 mol [Cu (NH2CH2COO)2]. H2O
150,85324 g __________ 229,6745 g
1,5009 g __________ m4 = 2,2851246486 g
2,2851246486 g __________ 100%
1,7776 g __________ R = 77,790067211%
Die Berechnungen zeigten, dass die Reaktionsausbeute bei etwa 77,8% lag. Wir können uns überlegen, wie günstig die reaktionären Erträge > 60% sind.
Laut Atkins und Jones (2012) besteht unter Fachleuten großes Interesse an den Strukturen, Eigenschaften und Nutzungen der Komplexe, auch weil sie an vielen biologischen Reaktionen teilnehmen.
Die Farben der koordinierenden Verbindungen werden in der Regel durch die zentralen Atome bestimmt, obwohl sie auch auf andere Chromophore (oder Pigmente) zurückzuführen sein können, die Teil ihrer Zusammensetzung sind. Übergangsmetallkomplexe faszinieren durch die Farbvielfalt, die sie aufweisen. Bei einem bestimmten Metall kann diese Farbveränderung auch als Funktion des Liganden (SOUZA, S.D.) beobachtet werden.
Metallkomplexe der Gruppe D sind oft magnetisch und hell gefärbt und werden in der Chemie zur Analyse, Ionenauflösung, Metallelektrodenposition und Katalyse eingesetzt. Sie sind auch Objekte der Forschung in der Erhaltung der Sonnenenergie, in der Fixierung von atmosphärischem Stickstoff und neuen Medikamenten (ATKINS und JONES, 2012).
Viele Komplexe sind wichtig für unser Leben, und ihr Mangel an unserem Organismus kann schwere Krankheiten verursachen. Nach Brown (2003) bilden Elemente wie V, Cr, Mn, Fe, Co, Ni, Cu, Zn, Mo und Cd Komplexe mit einer Vielzahl von Spendergruppen, die in biologischen Systemen wie Enzymen vorhanden sind. Kupferglycinat (II) ist auch weit verbreitet für parenterale Supplementierung bei Tieren verwendet, als eine Quelle für Kupferersatz.
Es gibt auch Komplexe, die in Farbpigmenten, Farbproduktion in Glas und Edelsteinen verwendet werden. Beispiele für andere wichtige Komplexe für die Aufrechterhaltung des Lebens sind Hämoglobin, verantwortlich für den Transport von Sauerstoff im Blut, dessen zentrales Atom Fe2 + ist, und Chlorophyll, verantwortlich für die Photosynthese, dessen zentrales Atom Mg2 + ist.
Es gibt viele Metalle, die Komplexe bilden, die für mehrere biologische Funktionen von Lebewesen unverzichtbar sind und zur Erhaltung der zellulären Grundbedürfnisse beitragen. Diese Verbindungen sind in der Lage, mit vielen Rezeptoren zu interagieren, Das stellt einen potenziellen Gewinn in der Formulierung von selektiven therapeutischen Mitteln.
Die Aktivitäten von Metallionen in biologischen Medien haben die Forschung und Entwicklung anorganischer Verbindungen als therapeutische Wirkstoffe angeregt. Die Einbeziehung dieser Verbindungen in die Medizin, insbesondere solche, die Übergangsmetalle enthielten, war bis 1965 sehr begrenzt, als es eine klassische Demonstration der Antitumoraktivität des Komplexes namens Cisplatin gab[PtCl2(NH3)2] (COHEN, 2007 apud GUERRA et al, 2011 ).
4. FAZIT
Die vorgeschlagene Synthese der beabsichtigten Verbindung wurde erfolgreich erfüllt. Der Einsatz von Strategien wie Experimentieren trägt wesentlich zur Bildung von Studierenden bei, neben der Möglichkeit, als erster Meilenstein für die Einführung eines Inhalts genutzt zu werden. Es wird angenommen, dass analytische Fehler und Geräte ohne ordnungsgemäße Kalibrierung zum Verlust der reaktionsrischen Ausbeute beigetragen haben können. Es ist nicht möglich, nur qualitativ zu bestimmen, welche isomerische Form synthetisiert wurde oder ob es die Möglichkeit einer racemischen Mischung gibt. Dazu wären selektivere instrumentelle Analysemethoden erforderlich, die in der Lage sind, die Struktur der Verbindungen zu bestimmen. Über die Bildung von cis-bis-wurde sp[Cu(gly)2]ekuliert. H2O basiert auf Informationen aus anderen Experimenten, die besagten, dass es durch das Glycingemisch zum verbleibenden Filtrat möglich ist, die Transform des Interessenkomplexes zu erhalten. Die Untersuchung der chemischen Synthese ist relativ komplex, aber wichtig für die Entwicklung neuer Produkte und Wirkstoffe, die nicht nur für das akademische Umfeld, sondern auch für verschiedene Wissensbereiche, wie z. B. die Pharma- und Agrarveterinärsektoren, von Interesse sind. beispiel.
5. REFERENZEN
ATKINS, Peter; JONES, Loretta. Princípios de química: questionando a vida moderna e o meio ambiente, 5° ed. Bookman, 2012, 922 p.
BROWN, Theodore. Química: a ciência central, 9° ed. São Paulo, Pearson, 2003.
Círculo cromático. Disponível em < http://www.elgin.com.br/blog/2017/04/18/cores-voce-sabe-como-combina-las-na-hora-de-decorar/>; 2017. Acesso em 30/10/2018.
COELHO, Augusto Leite. Química Inorgânica, Ceará, Núcleo Gráfico da UECE, 2010, 132 p.
COTTON, Simon. Uppingham Scholl, Rutland, UK Molecule od the Month April, 2010. Disponível em <http://www.chm.bris.ac.uk/motm/glycine/Glycine%20-%20Molecule%20of%20the%20Month%20-%20April%202010.pdf>. Acesso em 30/10/2018.
GUERRA, Wendell; et al. Coordenação de metais a antibióticos como uma estratégia de combate à resistência bacteriana. Revista Química Nova, 34(1); 2011: 111-118.
HOEHNE, Lucélia; DALL’OGLIO, Camila. Compostos de coordenação e a química orgânica. Revista Destaques Acadêmicos, 5(4); 2013: 79-83.
ISENMANN, Armin Franz. Princípios da Síntese Orgânica. 2ª ed. Timóteo, 2013.
OLIVEIRA, Leandro José Dias Gonçalves de.; et al. Rotas de síntese do antibiótico Linezolida e correlação entre sua estrutura química e bioatividade. Revista Eletrônica Acervo em Saúde, Vol. Sup. 13, 2018; p. 1557-1566.
RUSSEL, John. Química Geral, 2ª ed. Pearson, 1994, vol.1, 662 p.
SHRIVER, Duward; ATKINS, Peter. Química Inorgânica, 3ª ed. Bookman, 2003, 816 p.
SOUZA, Anne. Compostos de coordenação: cor e propriedades magnéticas, s.d.; p. 152-160.
[1] Chemisch (UNIUBE). Facharzt für Chemielehre (UCAM). Akademiker des Fachstudiengangs Naturwissenschaften (UFMG).
Eingereicht: Juli 2019.
Genehmigt: Juli 2019.


