ARTIGO ORIGINAL
SAVIATO, Mário Junior [1], GUIMARÃES JÚNIOR, José Carlos [2], LIMA, Jucivaldo Dias [3]
SAVIATO, Mário Junior. GUIMARÃES JÚNIOR, José Carlos. LIMA, Jucivaldo Dias. Poluição e suas relações com alterações histológicas em Salminus hilarii Valenciennes, 1850. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano. 07, Ed. 08, Vol. 02, pp. 157-195. Agosto de 2022. ISSN: 2448-0959, Link de acesso: https://www.nucleodoconhecimento.com.br/biologia/alteracoes-histologicas
RESUMO
O uso ambiental do Cerrado pela agricultura, pecuária e exploração mineral promove alterações que afetam os sistemas biológicos como um todo, principalmente os ecossistemas aquáticos. Sendo que, o nordeste goiano possui vocação à pecuária e recentemente vem sendo explorado para a extração mineral, devido a seu subsolo rico. Dentro deste contexto, existem interferências negativas na saúde dos organismos aquáticos, frente aos impactos decorrentes da exploração ambiental? Desta forma, o presente estudo teve como objetivo investigar determinar as condições histológicas em brânquias e fígado de Salminus hilarii em um trecho de rio nas cabeceiras do Araguaia, no Noroeste goiano, a fim de determinar a saúde destes organismos nos diferentes sítios amostrais, distribuídos ao longo do trecho estudado. Neste sentido, foram capturados espécimes de S. hilarii, com técnicas de pesca tais como rede de espera e tarrafa. Destes, extraiu-se os órgãos internos que foram tratados e laminados para posterior análise microscópica. Os exemplares analisados apresentaram desde nenhuma alteração na estrutura tecidual (fígado e brânquias), até alterações graves, com possível perda de funções dos órgãos analisados registradas em exemplares à jusante das áreas controle. Os mesmos, apresentavam modificações estruturais do tecido branquial, como fusão lamelar, proliferação do epitélio, proliferação do epitélio laminar, aneurismas, edema e necrose. Assim como, para fígado, apresentou danos, tais como, núcleo periférico, vacuolização nuclear, esteatose microvesicular, esteatose macrovesicular, hipertrofia nuclear, atrofia nuclear, fibrose e melanomacrófagos. Portanto, essas alterações branquiais e hepáticas indicam que os organismos inseridos no meio aquático podem sofrer disfunções histológicas proveniente do contato com metais dissolvidos no meio.
Palavras-chave: Histologia, rios do cerrado, metais pesados, saúde animal, noroeste do Goiás.
1. INTRODUÇÃO
Os rios do Cerrado sofrem impactos direta e indiretamente, devido a exploração de áreas utilizadas para a agricultura, pecuária e exploração minerais. Tais atividades causam alterações, principalmente das características físicas e químicas ambientais, resultando em mudanças dos parâmetros e da fisionomia destas áreas, afetando o sistema como um todo (BOAVENTURA et al., 2009).
Pois, a constante exploração do Cerrado desencadeia uma serie de impactos no meio, principalmente promovendo a contaminação dos recursos hídricos por subprodutos ocasionais provenientes da agricultura, pecuária e exploração mineral. Assim como, em regiões próximas a centros urbanos eventualmente pode se tornar um corpo receptor. O Brasil possui muitos recursos minerais a serem explorados, e o são, sobretudo por empresas internacionais ou efetivamente estrangeiras (SAVIATO et al., 2022).
Sendo que as evidentes alterações estão diretamente relacionadas à expansão dos centros urbanos. O aumento do uso de produtos químicos na agricultura e a significativa expansão da indústria, tem despejado quantidades crescentes de metais pesados em ecossistemas aquáticos, afetando direta e indiretamente toda a teia alimentar em ambientes de água doce (SOARES et al., 2018). Assim como, os organismos aquáticos estão relacionados intimamente ao meio, pois na maioria dos casos passam toda a sua vida ou parte dela submersos no meio (SAVIATO et al., 2021).
Peixes são bem estudados em todo o mundo demonstraram que esses poluentes podem causar alterações desde o nível molecular até o comportamental, em todas as fases da vida, inclusive nas gerações futuras (MORON et al., 2019). Contudo, na região Neotropical, poucos estudos abordam a influência de metais em espécies nativas in loco. Sendo assim, a aparente relação entre os níveis de metais, tais como, Alumínio, Cobre, Chumbo e Zinco apresentam relação direta entre a variação nas quantidades destes parâmetros, com a coleção de alterações histológicas encontradas (GOMES et al., 2018).
Da mesma forma, que órgãos metabolicamente podem apresentar maiores acúmulo destes metais, apresentam também reflexos morfológicos que podem levar o organismo ao óbito (SOARES et al., 2020). Sendo que, as atividades antrópicas de forma geral, geram resíduos que porventura podem conter contaminantes magnificadores e genotóxicos.
Porém, as atividades agrícolas e da exploração mineral estão mais intimamente ligadas à geração de subprodutos contendo metais dissolvidos. Destes metais destacam-se o alumínio, proveniente da lixiviação solo ou por meio de resíduos da exploração mineral, da mesma forma que zinco. Ambos promovem efeitos similares na biota, principalmente nos peixes (FONSECA et al., 2017).
Assim como, o cobre e o chumbo considerados metais pesados e tem evidente importância nas alterações histológicas que promovem deformidades graves nos órgãos internos e externos destes organismos (PASCHOALINI; BAZZOLI, 2021).
A intensidade destas explorações exerce condições negativas ao sistema e consequentemente aos organismos inseridos nestas regiões, principalmente os aquáticos. Pois estes ficam expostos constantemente às alterações paramétricas, provocadas por substâncias carreadas ou lançadas no meio (LATIF et al., 2022). Somando-se a isso, esses ecossistemas podem sofrer mudanças na fisionomia ambiental devido a alterações causadas pelo pisoteio do gado e modificação do microclima (LEITE et al., 2021).
Em organismos aquáticos, estas alterações ambientais podem alterar a qualidade de vida e o bem-estar destes animais, em especial o grupo dos peixes (VIANA et al., 2021). Tendo interferência direta em sua fisiologia e homeostase, causando alterações às condições de funcionamento e respostas imunológicas (PASCHOALINI; BAZZOLI, 2021). Desta forma, resultando em mudanças fisiológicas e morfológicas que em graus mais elevados como histopatologias deletérias (ALVES et al., 2020).
Esta intrínseca relação de causa e efeitos, faz com que os peixes sejam suscetíveis às ações das alterações ambientais que ocorram, seja no ambiente aquático, ou em ambiente terrestre (SOARES et al., 2018). Estando sujeito aos efeitos negativos desta relação que, tendo a possibilidade de ocasionar decréscimo das populações afetadas com deleções locais, e em casos mais graves extinções (GOMES; SATO, 2011).
Os organismos aquáticos estão entre os que sofrem maiores efeitos das alterações ambientais in loco, ou das pressões causadas em seu entorno (MELO et al., 2019). Apresentam configurações fisiológicas e morfológicas distintas da homeostase esperada, devido ao quadro ambiental, refletindo com especificidade cada grupo de condições de estresse, seja positiva ou negativa (SAVIATO et al., 2021).
As respostas fisiológicas e bioquímicas em peixes refletem as dinâmicas de alterações dos parâmetros no ambiente aquático, apresentando relevante desequilíbrio homeostático durante a exposição destes organismos aos parâmetros não ideais. Desta forma, promovendo reflexos mensuráveis na fisiologia e nas configurações histológicas (MARIANO et al., 2019).
Este reflexo imune em peixes ocorre em duas etapas bastante discrepantes: a primeira é o contato direto com os contaminantes responsáveis pelas alterações dos parâmetros ambientais e seus impactos nos órgãos externos; a segunda são as ações secundárias na fisiologia e nos órgãos internos podendo ocorrer independentemente uma da outra ou sinergicamente, em organismos mais sensíveis (RORIZ et al., 2015).
Os órgãos mais afetados pelos efeitos negativos das alterações paramétricas do ambiente aquático, são o fígado, rim, intestino e as brânquias (PASCHOALINI; BAZZOLI, 2021). Sendo que as principais causas destas mudanças morfológicas e fisiológicas estão diretamente ligadas aos efeitos do ambiente sobre os parâmetros hematológicos e bioquímica enzimática (MARIANO et al., 2021).
As brânquias são susceptíveis às alterações paramétricas ambientais, pois estão diretamente em contato com a água e podem ser analisadas a fim de identificar mudanças morfológicas e fisiológicas neste tecido, como indicadores de toxicidade (RIBEIRO et al., 2017).
Nos ambientes com contaminação por metais e surfactantes, as brânquias podem apresentar patologias, tais como, hipertrofia e descamação epitelial (GOMES; SATO, 2011). Assim como, podem proporcionar fusão lamelar, principalmente próximo às fontes contaminantes, tal como, efluentes industriais e domésticos (SAVASSI et al., 2020). Contudo, o descolamento de epitélio é observado em locais onde haja a contaminação por cobre e organofosforados, assim como, a vasodilatação é verificada em locais com maiores concentrações de alumínio e zinco (FONSECA, 2017).
É evidenciando que cada alteração morfológica possui relação direta com a especificidade à presença de determinada contaminação. Sendo, que estas modificações morfológicas causam prejuízos fisiológicos, como nas trocas gasosas, distúrbios osmorregulatórios, mecanismos efetivos à sobrevivência, provocando efeitos nocivos à saúde destes organismos (TEIXEIRA et al., 2018).
No entanto, tendo em vista a grande quantidade de espécies, construir uma descrição geral para fígados de peixes, de modo geral, dificilmente foi possível. Outras variáveis, tais como, as características fisiológicas de cada espécie ou grupo ecológico, contribuem ao polimorfismo hepático da ictiofauna. Contudo, considera-se como ponto de partida os estudos filogenéticos e comparativos entre os vertebrados (MELO et al., 2019).
O fígado está presente em todos os vertebrados, como importante controlador das funções vitais, tendo função fisiológica no anabolismo e no catabolismo, este último ligado à desintoxicação. Assim, tem grande importância nas análises dos parâmetros biológicos e ambientais que promovem alterações morfológicas e metabólicas deste órgão, a exemplo: ingestão de alimentos, ações parasitárias, efeitos de toxinas e de metais pesados (VIANA et al., 2021).
Estas modificações histopatológicas hepáticas podem variar de leve a graves, podendo ser qualificadas pela presença de hipertrofia, atrofia nuclear, vacuolização citoplasmática, centros melanomacrófagos e necrose. Sendo estas alterações, reflexos dos níveis de alteração dos parâmetros ambientais, promovidos ou não por ações antrópicas (MARIANO et al., 2021).
Contudo, mesmo sendo procedimentos invasivos, resultando na morte dos exemplares analisados, são importantes ferramentas na avaliação dos efeitos do ambiente sobre os organismos. E mais especificamente na análise temporal destas alterações paramétricas, tendo em vista que, estes danos histológicos não ocorrem instantaneamente e sim devido a exposição prolongada dos organismos sob as condições ambientais alteradas (LIMA et al., 2015).
Mesmo os peixes possuindo íntima relação com as alterações ambientais, o uso de peixes predadores para análises possibilita o entendimento das dinâmicas e sinergias entre os níveis tróficos, como um todo. Além de possibilitar o entendimento da movimentação de matéria e energia nos sistemas aquáticos (LINS et al., 2010). Desta forma, o uso da Tabarana (Salminus hilarii) um dos predadores mais importantes dos sistemas que habita, proporciona identificar as influências do ambiente sobre todos os níveis tróficos.
Mesmo a espécie S. hilarii sendo considerada um peixe de médio porte, o mesmo se alimenta de diversas espécies de peixes menores, com comportamento semiterritorialista, mantendo-se à espreita na foz de pequenos corpos d’água ou escoamento de lagos marginais em busca de alimento (HONJI et al., 2019). Ainda assim, possui ampla distribuição, estando presente em diversas bacias brasileiras.
Atualmente registrada por estudos filogenéticos sobre a distribuição do gênero Salminus Agassiz (1829) nas bacias brasileiras, indicando sua existência no Alto Paraná, Araguaia-Tocantins, São Francisco e Amazonas (MACHADO et al., 2016).
Da mesma forma, S. hilarii possui relevância na pesca por ribeirinhos ou pesca esportiva (SMITH et al., 2019), sendo uma espécie que prefere as drenagens formadas por pequenos corpos d’água, podendo ser considerado importante na cadeia alimentar, como um todo, incluindo as populações humanas das bacias que formam as cabeceiras do rio Araguaia (ARAÚJO et al., 2020).
Dentro deste contexto, existem interferências negativas na saúde dos organismos aquáticos, frente aos impactos decorrentes da exploração ambiental?
Este estudo objetivou determinar as condições histológicas em brânquias e fígado de Salminus hilarii em um trecho de rio nas cabeceiras do Araguaia, no Noroeste goiano que sofre as pressões da exploração antrópica na região. E assim determinar a saúde destes organismos nos diferentes sítios amostrais distribuídos ao longo do trecho estudado, podendo o mesmo ser utilizado como indicador de qualidade ambiental.
2. METODOLOGIA
2.1 DESCRIÇÃO DA ÁREA DE ESTUDO
A área de estudo está localizada na porção noroeste do estado de Goiás, em uma ampla região com domínio efetivo do Cerrado Stricto Sensu. Com localidades de altiplanos e serras, densamente ocupados por áreas florestais típicas desta fitofisionomia. Assim como, regiões mais baixas ocupadas principalmente por áreas agricultáveis e intensa atividade pecuária. E em uma porção mais restrita, áreas de exploração para a extração mineral de metais preciosos. Apresentando-se como uma região singular, por fazer parte do complexo ecossistema de ecótonos da Amazônia Oriental, composto por floresta de galeria, fitofisionomia presente no bioma Cerrado (AGUIAR et al., 2021).
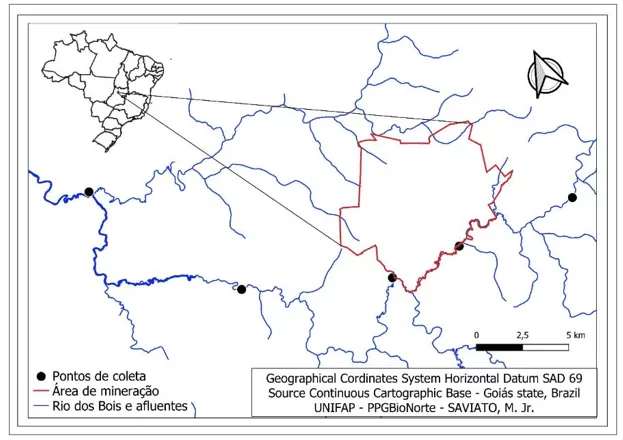
A área amostral inclui pontos inseridos na bacia hidrográfica nas cabeceiras da bacia do rio Araguaia inserida na zona rural, no noroeste do estado de Goiás, Brasil, entre as coordenadas UTM 22M 680205.00 m E; 8422958.00 m S e 656655.00 m E; 8434760.00 m S (Tabela 1 e Figura 1).
Tabela 1 – Coordenadas geográficas dos pontos amostrais alocados no trecho de rio estudado, GO.
| Pontos de Coleta | Longitude 22M | Latitude |
| 01 | 680205.00 m E | 8422958.00 m S |
| 02 | 673539.00 m E | 8423221.00 m S |
| 03 | 669530.00 m E | 8423224.00 m S |
| 04 | 661869.00 m E | 8426228.00 m S |
| 05 | 656655.00 m E | 8434760.00 m S |
Fonte: Saviato, M. Jr. (2022).
Figura 1 – Representação da região estudada, área de Cerrado (à esquerda), apresentando ocupação pecuária e (à direita), ao fundo exploração de metais preciosos.

Com o intuito de maximizar as comparações estatísticas resultantes das análises das fotomicrografias histopatológicas, as amostras foram agrupadas em duas seções amostrais. Estas áreas foram denominadas Seção Controle e Seção Interferência, assim designada em alusão ao ponto de descarga de efluentes entre estas. A seção controle é aquela formada pelos pontos amostrais 01 e 02, os quais estão à montante do referido ponto de desague de eluentes, tendo como corpo receptor o rio estudado. Já a seção interferência, é aquela formada pelos agrupamentos dos pontos à jusante deste lançamento de efluentes, os pontos 03, 04 e 05.
O presente rio, é um tributário da macrobacia do rio Crixás-Açu, a qual deságua na bacia do rio Araguaia. Apresenta-se como um rio típico do cerrado, com águas rápidas, poucos poções e remansos, tendo cobertura vegetal condizente a fitofisionomia das Matas de Galeria. E assim percorre uma extensão de aproximadamente 280km, inserido apenas em áreas rurais dos municípios que singra, no sentido de Sudeste para Noroeste, em direção ao rio Araguaia (BICHUETTE, 2021).
A ocupação da região se dá pela agricultura e pecuária, contando ainda com exploração para a mineração de metais como ouro e cobre. As áreas agricultáveis estão relacionadas principalmente, à agricultura familiar e por vezes forrageiras. Entretanto, a pecuária na maior parte da região é efetuada de forma extensiva, onde o pastoreio se dá em amplas regiões cercadas, sem o cercamento das APPs. Sendo que, a exploração mineral ocorre em poucos locais, porém, com jazidas em grande escala e a céu aberto (GONZAGA et al., 2019).
Para maximizar as comparações estatísticas, as amostras foram agrupadas em duas seções amostrais (Seção Controle e Seção Interferência), assim designada em alusão ao ponto de descarga de efluentes entre estas. A seção controle é aquela formada pelos pontos amostrais 01 e 02, os quais estão à montante do ponto de descarga de efluentes, tendo como corpo receptor o rio estudado. Já a seção interferência, é aquela formada pelos agrupamentos dos pontos à jusante deste lançamento de efluentes (pontos 03, 04 e 05 – Figura 2).
O rio estudado é um tributário da macrobacia do Rio Crixas-Açu, a qual desagua na bacia do rio Araguaia. Apresenta-se como um rio típico do Cerrado, com águas rápidas, poucos poções e remansos, tendo cobertura vegetal condizente a fitofisionomia das Matas de Galeria. E assim percorre uma extensão de aproximadamente 280km, inserido apenas em áreas rurais dos municípios que singram, no sentido de Sudeste para Noroeste, em direção ao rio Araguaia (BICHUETTE, 2021).
As principais atividades existentes na região são agricultura, pecuária, e exploração mineral como ouro e cobre. A agricultura local está relacionada principalmente, à agricultura familiar e por vezes forrageiras. Quanto à pecuária na maior parte da região é efetuada de forma extensiva. A exploração mineral ocorre em poucos locais, porém, com jazidas em grande escala e a céu aberto (GONZAGA et al., 2019).
Figura 2 – localização dos pontos de coleta dentro da calha principal do Rio dos Bois, Alto Horizonte, Goiás, Brasil.
2.2 PARÂMETROS FÍSICO-QUÍMICOS DE METAIS DISSOLVIDOS
Portanto, verificou-se uma possível relação entre o aparecimento das injúrias histológicas e o gradiente de alterações paramétricas da qualidade da água. Sendo possível verificar que alguns parâmetros possuíram maior destaque dentre os demais analisados, são estes o Alumínio Dissolvido, Cobre Dissolvido, Chumbo Total e o Zinco Total (SAVIATO et al., 2022). Estando dispostos de montante para jusante com valores crescentes, tanto para estação seca, quanto para a estação chuvosa.
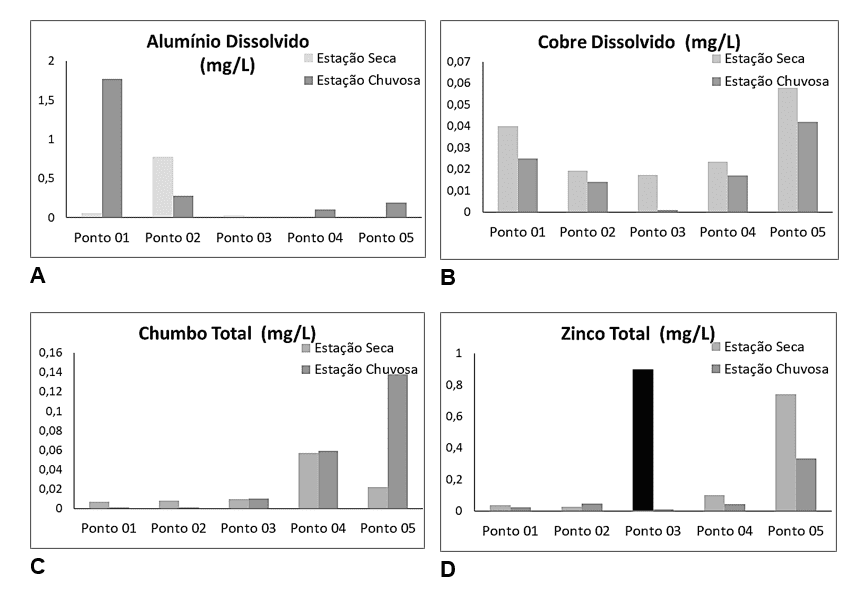
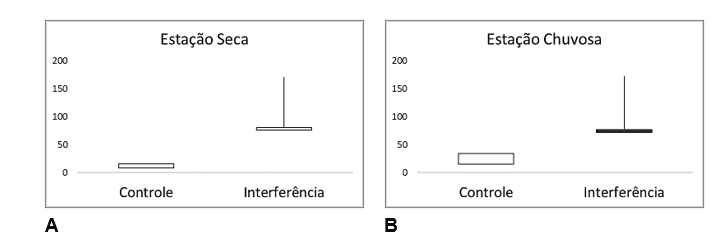
Os resultados das análises apontam que, Alumínio Dissolvido esteve presente com valores entre 0,0022 e 0,7770 mg/L, de jusante para montante, na estação seca (julho/2021), da mesma forma que apresentou valores 0,101 e 1,77 mg/L, de jusante para montante, para a estação chuvosa (novembro/2021). Estabelecendo um gradiente inverso à calha do rio. Os demais metais comportam-se de forma inversa. Sendo assim, Cobre dissolvidos apresentou valores entre 0,0179 e 0,0578 µg/L, de montante para jusante, na estação seca, assim como apresentou o mesmo gradiente, porém, explicitando notável diluição, com valores entre <0,001 e 0,042 µg/L, também, de montante para jusante, para a estação chuvosa. Da mesma forma, as mensurações para os níveis de Chumbo total, apresentaram-se de 0,0065 a 0,0568 µg/L, para a estação seca. E valores similares para a estação chuvosa, estando estes entre <0,001 e 0,059 µg/L. Da mesma forma, os valores para Zinco Total, estiveram entre 0,025 e 30,020 mg/L, no mesmo gradiente proposto, porém, com um pico discrepante no ponto 03, para a estação seca. Assim, os valores para zinco na estação chuvosa foram encontrados entre 0,010 e 0,331 mg/L, sem a presença de distúrbios como o anteriormente citado. Demonstrando que, estes metais estiveram presentes em um gradiente com valores em ordem crescente, nas seções estudadas, de montante para jusante, para ambas as estações (seca e chuvosa) (Figura 3).
Figura 3 – Resultados dos parâmetros de metais dissolvidos ao longo da seção estudada, nos pontos de 01 a 05, em ordem crescente de montante para jusante. Apresentando os metais Alumínio Dissolvido (A), Cobre Dissolvido (B), Chumbo Total (C) e Zinco Total, assim como, seu pico fora da curva (30,02mg/L), como uma barra preta (D).
Da mesma forma que estes metais, a distribuição de alterações histológicas, tanto hepáticas, quanto branquiais, respeitou o mesmo gradiente, com valores aparentemente convergentes. Sendo, o ponto 01, dentro da seção controle, foi o detentor dos menores índices de alterações, ao passo que o ponto 05, parte do agrupamento da seção interferência, apresentou os maiores índices de modificações negativas aos tecidos extraídos e analisados.
2.3 COLETA DE DADOS
Para as análises de material biológico foram coletados 50 exemplares de Salminus hilarii Valenciennes, 1850. Sendo coletados 10 exemplares por ponto amostral (5 na estação seca e 5 na estação chuvosa, julho de 2021 e novembro de 2021, respectivamente). Os exemplares de S. hilarii foram capturados com o auxílio de rede de pesca (10m x 1,5m e malha 6cm entre nós opostos). As mesmas ficaram armadas em cada ponto num total de 12 horas amostrais por ponto/campanha, com revisão das redes de hora em hora. A presente metodologia de captura, padroniza a seleção por tamanho dos animais, uma vez que são capturados os exemplares com diâmetro corporal próximo a malha utilizada. Corrigindo possíveis erros de capturas para animais de tamanhos discrepantes, consequentemente idades diferentes.
Os espécimes de S. hilarii (Figura 4) coletados foram eutanasiados para a coleta de fígado e brânquias, em seguida estes órgãos foram fixados em solução Bouin. Os órgãos coletados passaram pelo procedimento de desidratação em séries alcoólicas e diafanizadas para inclusão em parafina. Após a desidratação, as amostras foram embebidas em parafina e, em seguida, foram feitos cortes de 3 µm em micrótomo. Os cortes foram montados em lâminas histológicas e coradas com hematoxilina-eosina (HE), usando métodos de rotina.
Figura 4 – Espécime de Salminus hilarii coletado para o estudo.

As lâminas histológicas geradas neste tratamento do material coletado foram então analisadas em microscópio ótico, onde foram efetuadas cinco fotomicrográfias por tipo de tecido por lâmina analisadas. E nestas fotomicrográfias segregadas por órgão, foram então contabilizados os encontros das alterações histológicas tanto do tecido hepático, quanto do tecido branquial.
Desta forma, as análises das alterações histopatológicas foram classificadas em estágios progressivos quanto ao comprometimento das funções do órgão: Alterações de Estágio I (não comprometem o funcionamento do órgão), Estágio II (mais severas e que prejudicam o funcionamento normal do órgão) e Estágio III (muito severas e irreversíveis).
As alterações histopatológicas hepáticas foram categorizadas em 3 estágios (leve, moderada e severas), sendo o último estágio com o comprometimento do órgão. Já as alterações histopatológicas das branquiais, também foram classificadas em estágios I, II e III (leve, moderada e severas), onde estas modificações histológicas estão ligadas principalmente à hipertrofia (Hi), descamação epitelial (DE), fusão lamelar (FL), edemas (Ed), aneurismas (An), proliferação do epitélio filamentar (PEF), proliferação do epitélio lamelar (PEL) e necrose (Ne). Nas alterações mais graves, sugere-se o comprometimento das funções branquiais de troca gasosa e osmorregulação.
2.4 ANÁLISE DOS DADOS
Para o tratamento dos dados histopatológicos, numéricos, foram analisados de forma semiqualitativa, usando o valor médio de alteração (VMA) (SCHWAIGER et al., 1997) e índice de alteração histopatológica (IAH) (POLEKSIC; MITROVIC-TUTUNDZIC, 1994). Sendo utilizados os testes não paramétricos de distribuição normal e homoscedasticidade, pelos testes de Shapiro-Wilk e Bartlett, respectivamente. Assim como foram analisados pelo teste ANOVA-One Way e teste de Tukey, para permitir comparações entre as médias (MARIANO et al., 2021).
3. RESULTADOS
3.1. SAÚDE DOS EXEMPLARES DE SALMINUS HILARII NOS POSTOS AMOSTRAIS
Os exemplares de S. hilarii (n = 20) provenientes da área controle, apresentaram poucas/nenhumas alterações nos tecidos analisados. Entretanto, as análises histopatológicas dos exemplares dos sítios (P3, P4 e P5 – área afetada n = 30) mais à jusante da descarga oriunda da exploração mineral apresenta interferência negativa na formação tecidual, indicando que a exposição destes organismos, às variações paramétricas neste trecho de rio, indica possível relação do gradiente de mudanças paramétricas da água com a existência de anomalias histológicas no fígado e nas brânquias desses animais.
Desta forma, os espécimes de S. hilarii analisados dos pontos (P3, P4 e P5) apresentaram desde nenhuma alteração morfológica (n = 3), até alterações que comprometeriam a homeostase do organismo (n = 8). Algumas amostras (n = 14) no momento da extração do órgão, apresentaram características alteradas como cor e formato, sendo possível identificar que o órgão estava com aspecto amarelado e com hepatomegalia aparente.
Ainda foram observados nas brânquias, alterações histológicas em 43% dos exemplares (n = 23) analisados da maioria dos pontos. Entretanto, as amostras analisadas do ponto P1 não apresentaram modificações morfológicas nos tecidos estudados. Os demais sítios amostrais apresentaram algum tipo ou nível de alteração, seja hepática ou branquial (Tabela 2 a Tabela 5).
Tabela 2 – As alterações hepáticas registradas nas fotomicrografias das lâminas histológicas dos exemplares Salminus hilarii / ponto amostral (julho/2021), no rio estudado, nordeste do Goiás.
| Estação Seca | Pontos | ||||
| Alterações Hepática | 01 | 02 | 03 | 04 | 05 |
| Núcleo periférico | 1 | 1 | 4 | 1 | 10 |
| Vacuolização nuclear | 0 | 2 | 2 | 0 | 3 |
| Esteatose microvesicular | 1 | 0 | 3 | 6 | 6 |
| Esteatose macrovesicular | 0 | 1 | 4 | 2 | 7 |
| Hipertrofia nuclear | 0 | 0 | 3 | 1 | 5 |
| Atrofia nuclear | 0 | 1 | 3 | 0 | 6 |
| Melanomacrófagos | 0 | 1 | 3 | 1 | 0 |
| Fibrose | 0 | 0 | 3 | 2 | 1 |
Fonte: Saviato, M. Jr. (2022).
Tabela 3 – As alterações hepáticas registradas nas fotomicrografias das lâminas histológicas dos exemplares Salminus hilarii / ponto amostral (novembro/2021) no rio estudado, nordeste do Goiás.
| Estação Chuvosa | Pontos | ||||
| Alterações Hepáticas | 01 | 02 | 03 | 04 | 05 |
| Núcleo periférico | 0 | 0 | 3 | 2 | 1 |
| Vacuolização nuclear | 0 | 1 | 3 | 4 | 8 |
| Esteatose microvesicular | 1 | 2 | 5 | 0 | 9 |
| Esteatose macrovesicular | 0 | 2 | 5 | 1 | 8 |
| Hipertrofia nuclear | 0 | 2 | 0 | 4 | 5 |
| Atrofia nuclear | 1 | 6 | 5 | 6 | 1 |
| Melanomacrófagos | 0 | 0 | 3 | 1 | 1 |
| Fibrose | 0 | 0 | 1 | 0 | 1 |
Fonte: Saviato, M. Jr. (2022).
Tabela 4 – As alterações branquiais registradas nas fotomicrografias das lâminas histológicas dos exemplares Salminus hilarii / ponto amostral (julho/2021) no rio estudado, nordeste do Goiás.
| Estação Seca | Pontos | ||||
| Alterações Branquiais | 01 | 02 | 03 | 04 | 05 |
| Hipertrofia | 1 | 2 | 6 | 0 | 2 |
| Descamação epitelial | 2 | 5 | 8 | 0 | 1 |
| Fusão lamelar | 0 | 2 | 1 | 1 | 3 |
| Edema | 0 | 0 | 2 | 2 | 3 |
| Aneurisma | 0 | 1 | 0 | 1 | 5 |
| Proliferação do epitélio filamentar | 0 | 2 | 4 | 1 | 5 |
| Proliferação do epitélio lamelar | 0 | 2 | 1 | 1 | 4 |
| Necrose | 0 | 0 | 1 | 0 | 1 |
Fonte: Saviato, M. Jr. (2022).
Tabela 5 – As alterações branquiais registradas nas fotomicrografias das lâminas histológicas dos exemplares Salminus hilarii / ponto amostral (novembro/2021) no rio estudado, nordeste do Goiás.
| Estação Chuvosa | Pontos | ||||
| Alterações Branquiais | 01 | 02 | 03 | 04 | 05 |
| Hipertrofia | 0 | 1 | 3 | 2 | 1 |
| Descamação epitelial | 3 | 5 | 2 | 3 | 2 |
| Fusão lamelar | 0 | 0 | 1 | 0 | 3 |
| Edema | 0 | 0 | 2 | 5 | 5 |
| Aneurisma | 0 | 0 | 1 | 5 | 2 |
| Proliferação do epitélio filamentar | 0 | 5 | 2 | 0 | 5 |
| Proliferação do epitélio lamelar | 0 | 1 | 4 | 1 | 3 |
| Necrose | 0 | 0 | 1 | 3 | 0 |
Fonte: Saviato, M. Jr. (2022).
3.2 ANÁLISE HISTOPATOLÓGICA DE FÍGADO (SALMINUS HILARII)
As análises histológicas do tecido hepático indicam melhores condições para os exemplares coletados na estação chuvosa (P1), não sendo observadas alterações com as análises de microscopia. Sendo que para a estação seca (julho/2021) as alterações histológicas observadas foram classificadas como estágio I (leve), (ver Tabela 2; Tabela 3 e Figura 5).
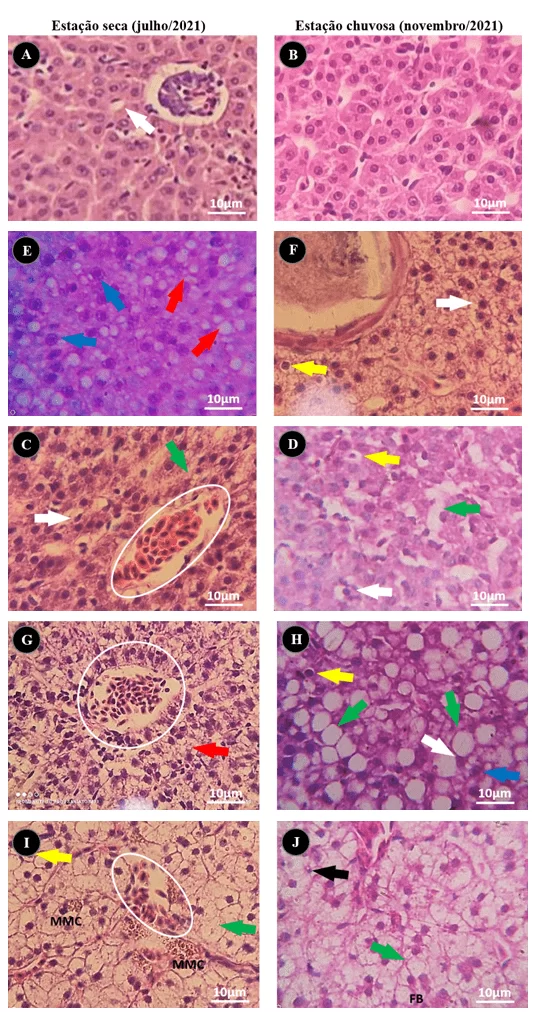
Figura 5 – Alterações histopatológicas em fígado de Salminus hilarii no gradiente das seções de coleta, do ponto 01 ao ponto 05. (A, B) ponto Controle, apresentando pouca ou nenhuma alteração visível, (C, D) Peixes expostos à água da seção denominada Ponto 02 (E, F) Peixes do Ponto 03, (G, H) Material histológico de peixes do Ponto 04, (I, J) Peixes coletados no Ponto 05. Onde podemos observar as estruturas histológicas analisadas: sinusóides hepáticos (área circular), núcleo periférico (setas brancas), vacuolização nuclear (setas amarelas), esteatose microvesicular (setas vermelhas), esteatose macrovesicular (setas verdes), hipertrofia nuclear (setas azuis), atrofia nuclear (setas pretas), fibrose (FB) e melanomacrófagos (MMC). Coloração: Hematoxilina e Eosina.
As análises de agrupamento dos pontos amostrais também indicaram que os exemplares registrados no P1 apresentam menor número de alterações teciduais. Ao passo que os exemplares da seção interferência (P3, P4 e P5), apresentaram maiores valores para quase todas as alterações hepáticas, evidenciando um gradiente de distribuição para tais eventos histopatológicos, como presença de fotomicrografias. Os fígados destes exemplares, mesmo antes das análises, apresentaram aparência amarelada (n = 14). Fato verificado através da distribuição dos valores médios e seus desvios obtidos a partir da análise combinada ANOVA-One Way e teste de Tukey para estas alterações (Figura 6). Padrão similar foi registrado na estação chuvosa (Figura 7).
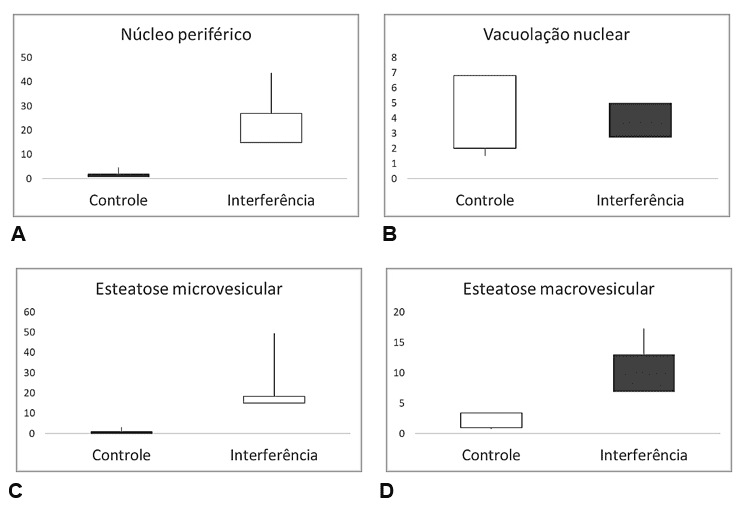
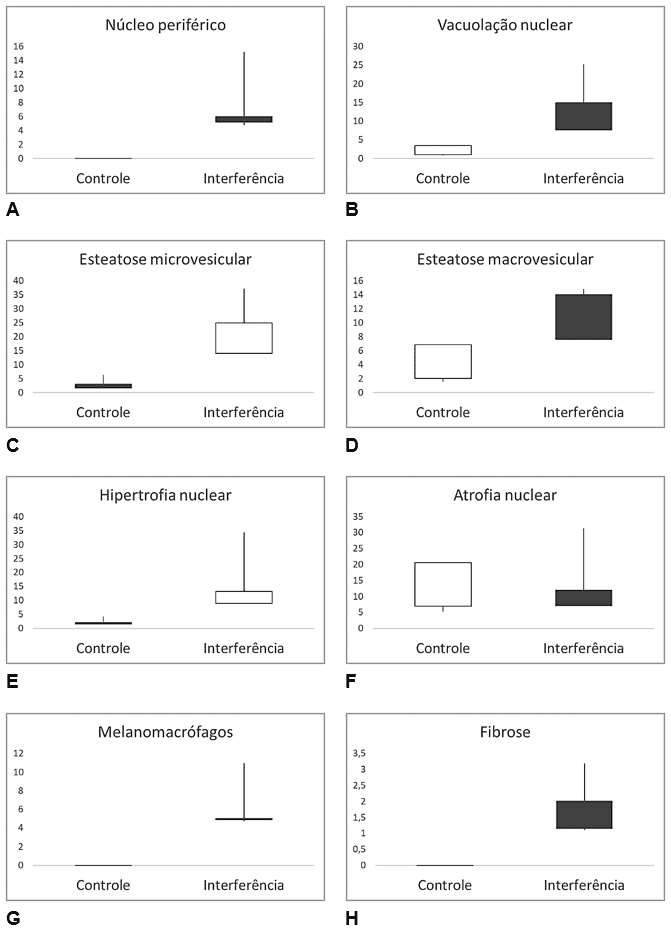
Figura 6 – Comparação de valores das alterações histopatológicas em fígado de Salminus hilarii durante a Estação Seca (Seção Controle (P1 e P2) e a Seção Interferida (P3, P4 e P5). A) Núcleo periférico (NP); B) Vacuolização nuclear (VN); C) Esteatose microvesicular (Em); D) Esteatose macrovesicular (EM); E) Hipertrofia nuclear (HN); F) Atrofia nuclear (AN); G) Melanomacrófagos (MMC) e H) Fibrose (FB).
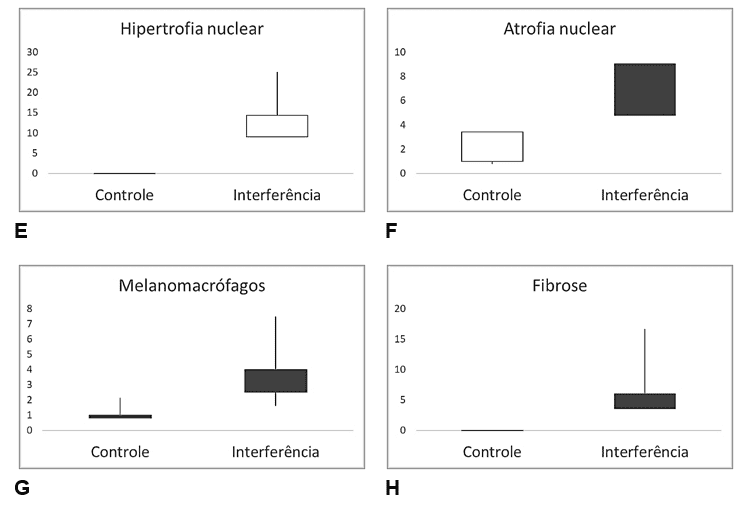
Figura 7 – Comparação de valores das alterações histopatológicas em fígado de Salminus hilarii, para a Estação Chuvosa (Seção Controle P1 e P2) e Seção Interferida (P3, P4 e P5). A) Núcleo periférico (NP); B) Vacuolização nuclear (VN); C) Esteatose microvesicular (Em); D) Esteatose macrovesicular (EM); E) Hipertrofia nuclear (HN); F) Atrofia nuclear (AN); G) Melanomacrófagos (MMC) e H) Fibrose (FB).
As análises para todas as alterações histopatológicas hepáticas entre as estações climáticas (Chuvosa e Seca), revelou diferenças, indicando que as amostras da seção interferida (P3, P4 e P5), apresentou maiores valores para as alterações negativa detectadas (Figura 8).
Figura 8 – Comparação do total de alterações histopatológicas hepáticas, nos peixes estudados, para as duas estações climáticas (Seca e Chuvosa), e entre as duas seções amostrais (Controle e Interferência).
3.3 ANÁLISES HISTOPATOLÓGICA EM BRÂNQUIAS (SALMINUS HILARII)
As análises da correlação entre as concentrações de metais e a gravidade das lesões branquiais por ponto amostral, indicou haver um gradiente estabelecido de pontos de montante para jusante, onde se identifica um crescente aparecimento de alterações histológicas ao longo da seção estudada de acordo com as alterações físico-químicas existentes (Figura 9).
Figura 9 – Correlação logarítmica entre as concentrações de metais dissolvidos e as quantidades de alterações histopatológicas registradas em Salminus hilarii (ж e ▲, alterações hepáticas; e ■ e ♦, alterações branquiais).
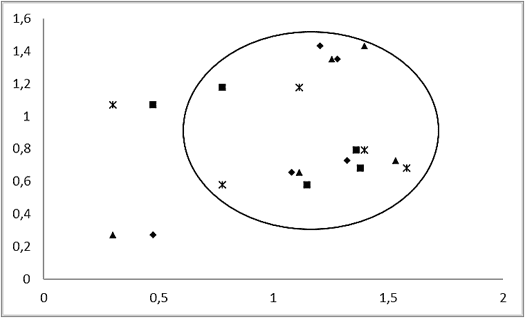
Nos tecidos analisados, observou-se que as microfotografias (Figura 10), seguem o gradiente, indicando menores números de alterações do P1 a P5, estando relacionado com o gradiente de alterações físico-químicas do local das amostras. As lesões LF, FEP e Ne correlacionaram-se positivamente (inserir resultado do teste estatístico da Correlação) com todos os metais (células sombreadas). Os maiores coeficientes foram obtidos para FEP.
Figura 10 – Microfotografias das alterações histopatológicas branquiais observadas nos exemplares de Salminus hilarii capturados nos pontos de coleta no rio estudado, GO. (A, B) ponto Controle, apresentando pouca ou nenhuma alteração visível; (C, D) exemplares coletados no P2; (E, F) exemplares coletados no P3; (G, H) exemplares coletados no P4; (I, J) exemplares coletados no P5. Legenda: Epitélio Filamentar (EF), Epitélio Lamelar (L), assim como, tecidos com hipertrofia (Hi), descamação epitelial (DE), fusão lamelar (FL), edemas (Ed), aneurismas (An), proliferação do epitélio filamentar (PEF), proliferação do epitélio lamelar (PEL) e necrose (Ne). Coloração: Hematoxilina e Eosina.
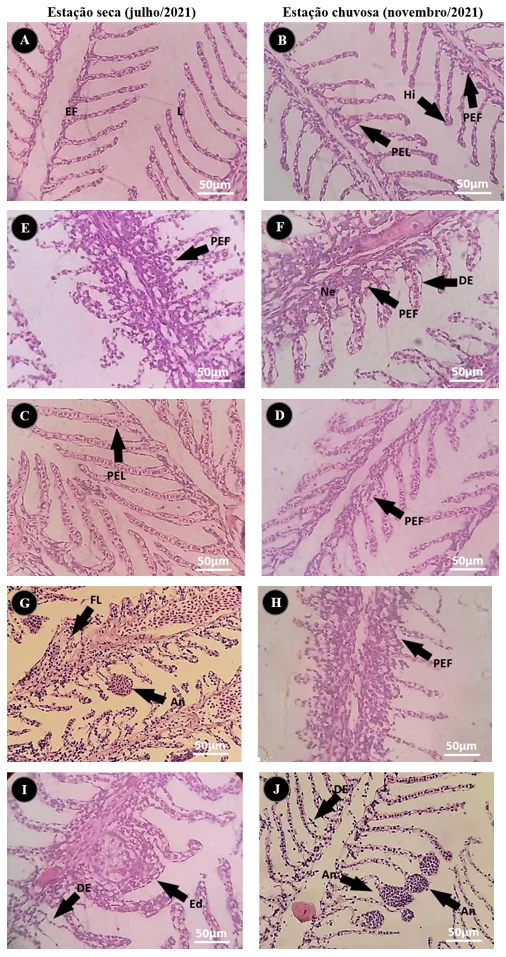
Muitas destas alterações teciduais têm relação com a história de vida do organismo e sua exposição a determinado grupo de parâmetros. Onde o chumbo e o cobre, promovem interferências diretas na formação histológica, desde o estágio embrionário. Provocando genotoxidade que proporcionam má formação celular e tecidual observadas geralmente, nas camadas de tecidos não superficiais, causando alterações morfológicas como edemas (Ed) e aneurismas (An), podendo evoluir para necrose (Ne).
Já o alumínio e o zinco são agentes que promovem a degradação tecidual, observadas como hipertrofia (Hi) e descamação (DE) dos tecidos mais superficiais como o epitélio lamelar (EL) e o epitélio filamentar (EF). Estes últimos, estão presentes muitas vezes de forma natural, em ambientes com dureza elevada.
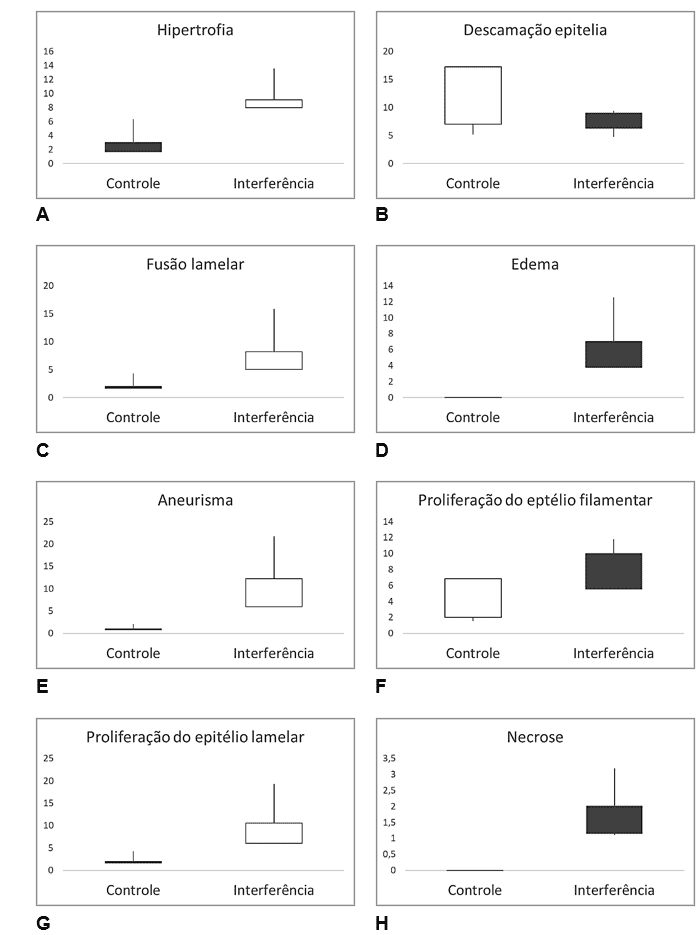
Estes padrões de distribuição das alterações analisadas, seguem um modelo similar aos metais dissolvidos, podemos constatar tal fato nas análises combinadas ANOVA-One Way e teste de Tukey que se seguem (Figura 11).
Figura 11 – Comparativo de dados histopatológicos de tecido branquial nos animais analisados, entre a Seção Controle e a Seção Interferência, na Estação Seca. A) Hipertrofia (Hi); B) Descamação epitelial (DE); C) Fusão lamelar (FL); D) Edemas (Ed); E) Aneurismas (An); F) Proliferação do epitélio filamentar (PEF); G) Proliferação do epitélio lamelar (PEL) e H) necrose (Ne).
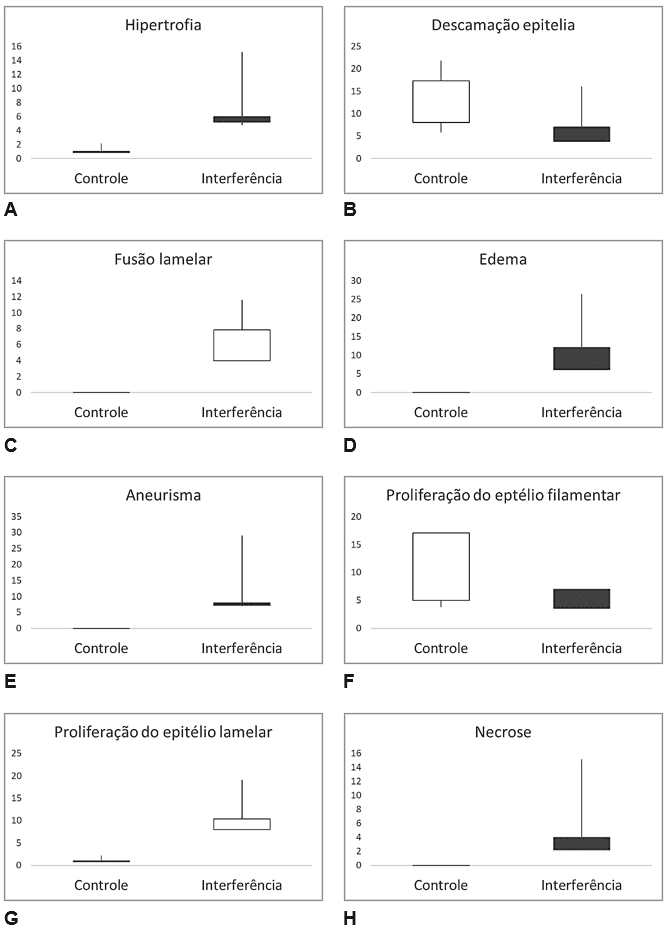
Na estação chuvosa se observou o mesmo modelo de distribuição, com sensível discrepância para a estação seca (Figura 12).
Figura 12 – Comparativo de dados histopatológicos de tecido branquial nos animais analisados, entre a Seção Controle e a Seção Interferida, na Estação Chuvosa. A) hipertrofia (Hi); B) Descamação epitelial (DE); C) Fusão lamelar (FL); D) Edemas (Ed); E) Aneurismas (An); F) Proliferação do epitélio filamentar (PEF); G) Proliferação do epitélio lamelar (PEL) e H) necrose (Ne).
De forma geral, a aglutinação de valores para as interferências negativas no tecido branquial, para as duas sessões experimentais (controle e interferida) e para as duas estações climáticas (Seca e Chuvosa), não apresentaram diferença significativa (Controle – 6,25 ± 4,41; 7,5 ± 5,85 e Interferida – 21,5 ± 8,18; 22,16 ± 8,94). Apenas estando em divergência, quando comparamos as seções amostrais que, com valores similares paras as duas estações climáticas, apresentaram elevação no encontro de alterações histopatológicas para a seção interferida, tal como o esperado devido ao seu histórico no despejo de efluentes (Figura 13).
Figura 13 – Comparação do total de alterações histopatológicas hepáticas, nos peixes estudados, para as duas estações climáticas (Seca e Chuvosa), e entre as duas seções amostrais (Controle e Interferência).
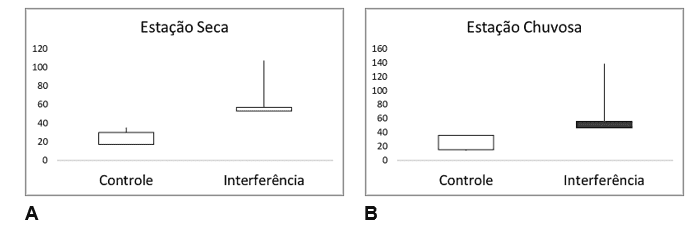
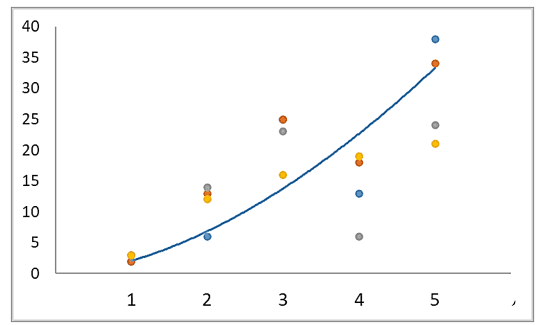
Desta forma, geral as alterações histopatológicas apresentaram padrão crescente ao longo do trecho estudado. Algumas apresentaram decréscimo na estação seca, como o caso das alterações no tecido branquial. Sendo que P4 apresentou redução, em ambas as estações. Estas alterações teciduais foram mais frequentes à jusante da seção controle (Figura 14).
Figura 14 – Distribuição dos valores para as alterações histopatológicas ao longo da seção amostra geral (pontos 01 a 05), para ambas as estações.
4. DISCUSSÃO
4.1 SAÚDE DOS EXEMPLARES DE SALMINUS HILARII NOS PONTOS AMOSTRAIS
O fato da maioria dos exemplares da área controle ter menor número de alterações no fígado e nas brânquias em relação aos exemplares coletados nas áreas interferidas, está relacionado com a maior quantidade de metais dissolvidos, presentes nestes locais (SULTANA et al., 2019). Resultados similares foram registrados por Ballotin (2019), na localidade de Mariana/MG, onde análise das qualidades da água indicaram grandes concentrações de metais dissolvidos, sendo que os peixes registrados para estes locais também apresentaram alterações no fígado, brânquias, com expressiva depreciação de suas funções (KAPEPA, 2020; LATIF et al., 2022a).
Tal como o apresentado por Ribeiro et al. (2020) indicou que peixes capturados em áreas mineradas apresentam contaminação por metais superiores ao encontrado em de áreas preservadas. Assim como é perceptível, por meio das análises físico-químicas da água, pelos parâmetros de metais dissolvidos, que apontaram incremento importante para estes contaminantes na seção denominada intervenção (pontos 03, 04 e 05). A mesma área apresentou maiores resultados para o encontro de injúrias tanto hepáticas, quanto branquiais, com relação similar ao encontrado por Latif et al. (2022b), ao estudar os efeitos da bioacumulação de metais em Carpa-capim (Ctenopharyngodon idella), e o Mahseer-fish (Tor putitora).
Nos exemplares que foram expostos a água contendo contaminantes apresentaram maior taxa de aparecimento de alterações histológicas, tanto hepáticas quanto branquiais, assim como o exibido pelo estudo em peixes costeiros (BARBIERI et al., 2020). No entanto, apenas os peixes coletados no P1, o qual compõe a seção controle, não apresentaram injúrias ou apenas penas modificações que não poderiam alterar ou danificar as funções dos órgãos afetados.
4.2 ANÁLISES HISTOPATOLÓGICAS DE FÍGADO (SALMINUS HILARII)
As análises efetuadas neste estudo apresentaram resultados que se assemelham às alterações histopatológicas observadas no fígado de Arapaima gigas (SCHINZ, 1822) exposto a concentrações subletais do pesticida a base de Bacillus thuringiensis (MARIANO et al., 2021), que mesmo não contendo metais em sua composição, apresentou lesões análogas. Também, foram verificados danos histopatológicos relacionados às concentrações de metais em Labeo catla (HAMILTON, 1822) (Catla catla) (LATIF et al., 2022a), assim como, em Sciades herzbergii (BLOCH, 1794), (SOARES et al., 2018; VIANA et al., 2021).
Estas lesões hepáticas, apresentaram relação com as concentrações de cobre e chumbo, tal como exibido neste estudo, igualmente aos resultados obtidos com a avaliação histopatológica de peixes na região de Mariana/MG (BALLOTIN, 2019).
Em suma, esta convergência de resultados, associa a presença de metais com alterações importantes no tecido de órgãos respiratórios e metabólicos, interferindo negativamente na homeostase do organismo (VIANA et al. 2021), provocando modificações morfológicas em células e tecidos (SAVASSI et al., 2020). Da mesma forma que, há relação direta com a concentração de metais no meio e a quantidade de lesões hepáticas, podendo culminar em perda das funções do órgão, tal como o apresentado por Liesner et al. (2020).
4.3 ANÁLISE HISTOPATOLÓGICA EM BRÂNQUIAS (SALMINUS HILARII)
Estes resultados evidenciaram que mais de 40% dos animais da seção intervenção apresentaram injúrias entre os níveis II e III, em contrapartida na seção controle, os peixes analisados apresentaram-se em até 10% dos capturados para este experimento. Evidências similares encontradas por Ribeiro et al. (2017), em estudo com tecido branquial de Bryconops caudomaculatus.
Reafirmando o proposto, de que as concentrações de metais no ambiente causam mudanças em múltiplas rotas e mecanismos relacionados ao estresse oxidativo causando, ao DNA alterações durante sua replicação (SULTANAS et al., 2019), o que leva má formação proteica e consequentemente provoca mudanças nas configurações estruturais das células (PASCHOALINI; BAZZOLI, 2021). Provocando danos fisiológicos graves que nos tecidos branquiais causam uma série de deformações (ALMEIDA et al., 2022).
Tais alterações histológicas em tecido branquial, são apresentados estudos com convergência de resultados que citam os metais alumínio e zinco, como protagonistas de deformações leves, porém abundante (FONSECA et al., 2017). Em contrapartida chumbo e cobre, provocam lesões agudas e mais persistentes, alterando e danificando o órgão. O mesmo descrito para Bryconops caudomaculatus (Günther 1864) (MELO et al., 2019), e para Oreochromis niloticus (Linnaeus 1758) (TEIXEIRA et al., 2018).
Assim como, o alumínio e o zinco provocam DE nas brânquias a partir de regiões hipertróficas, os Cobre e o Chumbo desencadeiam regiões tumorais (An e Ed) pelo acúmulo intracelular e desvirtuamento do processo oxidativo (LATIF et al., 2022a).
A exposição à água contendo metais dissolvidos em quantidades crescentes ao longo da seção estudada, também apresentaram em proporções similares, alterações morfológicas nos tecidos branquiais extraídos e analisados, análogo aos resultados de Pereira et al. (2019), estudando peixes na lagoa da Mangueira/RS.
Um dos parâmetros que apresentaram destaque, foi o alumínio dissolvido encontrado com valores mais elevados à montante que à jusante (0,7771 – 0,002 mg/L – estação seca; 1,770 – 0,101 mg/L – estação chuvosa) correlato aos dados do rio Formoso/TO (GUARDA et al., 2020a), estabelecendo um comportamento de distribuição inverso aos demais metais dissolvidos. Coincidindo com as alterações de DE, verificadas nas análises histopatológicas em brânquias, tal como o exibido por Barbieri et al. (2020), em bagres estuarinos. Sendo que, tais alterações presentaram valores mais elevados na seção controle que na seção interferência, diferindo dos estudos analisados. Assim, o mesmo comportamento de modificações histológicas foi verificado para PEF, também para a seção controle, que apenas apresentou esta discrepância para a estação chuvosa.
5. CONSIDERAÇÕES FINAIS
O presente estudo expõe uma série de alterações hepatologias e brânquias em S. hilarii com diferentes níveis de gravidade, leve, moderado e grave, onde observa-se relativa relação com as concentrações de metais dissolvidos nas seções estudadas. O local de estudo está localizado no Noroeste do estado brasileiro do Goiás, em um rio importante das cabeceiras do rio Araguaia – Tocantins. Estando a região sujeita às diversas formas de uso ambiental, seja pela expansão urbana, menor índice, seja pela agricultura, pecuária e exploração mineral.
A relação da interação entre as concentrações de metais e as lesões histológicas foram avaliadas a partir de análises combinadas ANOVA-One Way e teste de Tukey. Já os metais analisados foram alumínio, cobre, chumbo e zinco, que sabidamente possuem interrelação danosa aos tecidos em peixes. Desta forma, as análises indicaram que principalmente as alterações como descamação epitelial e hipertrofia, nas brânquias, possuíram maior relação com as concentrações de alumínio e zinco. Contudo, as demais lesões parecem estarem mais relacionadas ao cobre a chumbo, ressaltando que estas são as mais graves e mais comumente encontradas fora da seção controle.
Porém, as observações indicaram uma coleção de alterações nas brânquias, como, fusão lamelar, proliferação do epitélio, proliferação do epitélio laminar, aneurismas, edema e necrose. Assim como, para fígado, foram encontradas grande variação de danos, tais como, núcleo periférico, vacuolização nuclear, esteatose microvesicular, esteatose macrovesicular, hipertrofia nuclear, atrofia nuclear, fibrose e melanomacrófagos, sendo estes últimos relatados em órgãos muito danificados por outras comorbidades.
O dano nas brânquias pode implicar em um obstáculo às principais funções fisiológicas, tais como trocas gasosas e equilíbrio osmótico. Entretanto lesões hepáticas, podem impedir a homeostase como um todo, dado ao fato de o fígado ser um órgão metabólico que processa e neutraliza toxinas. O impacto do alumínio, cobre e zinco podem ser explicados pelas altas concentrações em água doce, devido a lixiviação do solo, que nas áreas de Cerrado, possuem muitos sais a base destes metais.
Os tecidos hepáticos analisados, nas seções em que chumbo e cobre estiveram com seus maiores valores, foram identificadas maiores concentrações de aparecimento de Ed e An nos tecidos branquiais. Da mesma forma, o tecido hepático estivera bastante comprometido, apresentando FB e MMC, evidenciando agravamento. Nestas mesmas amostras a frequência de EM, também foi menor, ao passo que, o tecido hepático aparentou elevado comprometimento, continha visivelmente maior frequência de EM, implicando em um quadro esteático grave.
Tais evidências corroboram a afirmação de que os resíduos provenientes da exploração mineral afetam diretamente a saúde dos animais avaliados. De forma, a apresentarem lesões hepáticas e branquiais, graves, que em locais onde há maior concentração de metais estes danos são mais severos a ponto de inibir as funções fisiológicas dos órgãos afetados.
Podendo interferir de forma direta, na saúde dos peixes, de forma geral, e consequentemente na saúde e bem-estar das populações humanas que deste pescado dependem, direta ou indiretamente.
O assunto aqui abordado é de interesse geral, principalmente das comunidades científicas e ambientais. De forma geral, conclui-se que os resultados obtidos, relativos às alterações histológicas, são correlatas às variações de concentração dos metais citados nas águas do trecho de estudado, GO. A contaminação de ambientes aquáticos por metais é cada emergente, e as restas aos danos ecológicos sobre as populações de peixes dos ecossistemas atingidos é emergencial, podendo assim estes estudo ser de suma importância e contribuir para a compreensão dos efeitos da exploração mineral sobre os organismos aquáticos e os danos causados em curto prazo.
Assim como, a espécie Salminus hilarii por ser um predador esta espécie apresenta maiores chances de sofrer com o acúmulo destes metais em seus tecidos e órgãos. E sendo uma espécie de ampla ocorrência, permite a comparação entre diferentes sistemas ecológicos. Por esta razão a referida espécie deve ser preferencialmente utilizada em programas de monitoramento de rios para a avaliação do seu real estado ecológico. Mesmo dependo de sua presença no ambiente monitorado, a alternativa de usar esta espécie auxiliaria na redução nos custos operacionais e tempo de execução destes estudos.
Por fim, frente aos dados analisados, existem reflexos negativos de depreciação das condições de saúde dos organismos aquáticos em decorrência das pressões exercidas pelas alterações ambientais causadas pela alteração da qualidade ambiental. sendo estas, promovidas pelo uso desordenado dos recursos e pelos despejos de efluentes no meio.
REFERÊNCIAS
AGUIAR, B. A. C.; SILVA, M. V. C.; FERREIRA, B. G.; VARAVALLO, M. A.; MOURA, T. M.; SANTOS, A. F.; RAMOS, Y. A.; SOUZA, P. B. Similaridade florística de remanescentes de Cerrado da região Norte, Amazônia Legal. PUBVET v.15, n.03, a771, p.1-8, 2021.
ALMEIDA, T. P.; MACENA, D. Â.; SIMÕES, J. S. T.; MARECO, E. A.; ROSSI, E. C.; FAVARETO, A. P. A.. Análise de parâmetros de qualidade da água e teste de genotoxicidade em peixes da bacia hidrográfica do rio Pirapozinho–SP, Brasil. Research, Society and Development, n.11, v.3, p01-15, 2022.
ALVES, G. B. M.; OLIVEIRA, S. M. L.; PESSI, D. D.; MARTARELLO, A. P.; VIEIRA, A.; MENDONÇA, V. M.. Análise ambiental do desmatamento em área de assentamento rural no Cerrado (Mato Grosso, Brasil). Terr@Plural, Ponta Grossa, v.14, p.1-13, 2020.
BALLOTIN, L. V.. Níveis de metais pesados e histopatologias nas brânquias de duas espécies de peixes da Bacia do rio Doce após rompimento da barragem em Mariana-MG. Dissertação de Mestrado (Programa de Pós-Graduação em Biologia Animal) Universidade Federal de Viçosa – UFV, Viçosa – MG, 2019. 78p.
BARBIERI, E.; MARINHO, D.; BRUSIUS, B. K.. Bagre estuarino Cathorops spixii como bioindicador de metais pesados: um estudo de caso. Engenharia de Pesca: aspectos teóricos e práticos – v.3. p.106-116, 2020.
BICHUETTE, M. E.. Ecologia de peixes de riachos de cavernas e outros horizontes subterrâneos. Oecologia Australis, v.25, n.2, p.622-643, 2021.
BOAVENTURA, K.J.; RISSATE, G.L.; OLIVEIRA, M.A.; COSTA, G.F.; SILVA, S.D.; FERREIRA, A.A.; MARTINS, P. T. A.. Alterações nas paisagens do Cerrado Brasileiro pela expansão da fronteira agrícola (1987–2017). Opción – Revista de Ciencias Humanas y Sociales, Año 35, Regular, n.89-2, p.43-68, 2019.
FONSECA, A. R.; FERNADES, L. F. S.; FERNANDES, A. F.; MONTEIRO, S. M.; PACHECO, F.A.L.. The impact of freshwater metal concentrations on the severity of histopathological changes in fish gills: A statistical perspective. Science of The Total Environment, v.599-600, p. 217-226, 2017.
GOMES, M. V. T.; SATO, Y.. Avaliação da contaminação por metais pesados em peixes do rio São Francisco à jusante da represa de Três Marias, Minas Gerais, Brasil. Saúde & Ambiente em Revista, Duque de Caxias, v.6, n.1, p.24-30, 2011.
GOMES, R. C. A.; MANETTA, G.I.; BENEDITO, E.. Concentração de mercúrio em diferentes guildas tróficas de peixes neotropicais. Oecologia Australis. v.22, n.3, p.325–333, 2018.
GUARDA, P. M.; GUALBERTO, L. da S.; MENDES, D. B.; GUARDA, E. A.; SILVA, J. E. C. da. Analysis of triazines, triazoles, and benzimidazoles used as pesticides in different environmental compartments of the Formoso River and their influence on biodiversity in Tocantins. TAYLOR & FRANCIS – Journal of Environmental Science Health, Part B. v.55, n.9, p.783–793. 2020.
KAPEPA, M.. Perfil de contaminação das águas e peixes por metais pesados e suas consequências para a saúde humana: uma revisão de literatura. Revista Brasileira de Ciências Biomédicas, v.1, n.1, p.16-16, 2020.
LATIF, F.; IQBAL, R.; AMBREEN, F.; KOUSAR, S.; AHMED, T.; AZIZ, S.. Studies on bioaccumulation patterns, biochemical and genotoxic effects of copper on freshwater fish, Catla catla: an in vivo analysis. Brazilian Journal of Biology, v.84, n e256905. p.1-11, 2022.
LATIF, M.; ZAHOOR, M.; MUHAMMAD, A.; NAZ, S.; KAMRAN, A. W.; ULLAH, R.; SHAHE, A. B.; ALMEERF, R.; SAYED, A.. Bioaccumulation of lead in different organs of Ctenopharyngodon Idella (grass fish) and Tor putitora (Mahseer) fish. Brazilian Journal of Biology, v.84, n. e260355, p.1-7. 2022.
LEITE, M. S.; MOURA, C. O.; SILVA, M. J. M.. Insetos bentônicos como bioindicadores de qualidade ambiental no Jardim Botânico de Brasília. Heringeriana – Revista do Jardim Botânico de Brasília, v.16, n. e917962, p.1-13, 2021.
LIESNER, C. O.; MARIN, J. F. V.; BINDACO, A. L. S.; BOELONI, J. N.; NUNES, L. C.. Importância da necropsia de peixes como indicadores da saúde ambiental. Tópicos Especiais em Ciência Animal IX, v.1, n.1, p.354-372, 2020.
LIMA, D. P.; SANTOS, C.; SILVA, R. S.; YOSHIOKA, E. T. O.; BEZERRA, R. M.. Contaminação por metais pesados em peixes e água da bacia do rio Cassiporé, Estado do Amapá, Brasil. ACTA AMAZONICA. v.45, n.4, p.405-414, 2015.
MARIANO, W. S.; AZEVEDO, S. B.; GOMES, F. L.; LIMA, L. B. D.; MORON, S. E.; TAVARES-DIAS, M. 2019. Physiological parameters of Piaractus mesopotamicus (Osteichthyes: Characidae) exposed to a biopesticide based on Bacillus thuringiensis. ANAIS DA ACADEMIA BRASILEIRA DE CIÊNCIAS (ONLINE), v. 91, n.2, p.1-9, 2019.
MARIANO, W. S.; OLIVEIRA-LIMA, J.; SANTUCI, M. A.; LIMA, L. B. D.; MORON, S. E.; TAVARES-DIAS, M.. 2021. Can a biopesticide based on Bacillus thuringiensis affect the physiology and histomorphology of Arapaima gigas? ANAIS DA ACADEMIA BRASILEIRA DE CIÊNCIAS, v. 93, n.04, p.1-15, 2021.
MELO, L. F.; CABRERA, M. L.; RODRIGUES, A. C. B.; TURQUETTI, A. O. M.; RUIVO, L. P.; BRUNO, C. E. M.; RICI, R. E. G.. Morphological Description of Blue Shark Liver, Prionace glauca (Linnaeus, 1758), Elasmobranchii, Carcharhiniformes. INTERNATIONAL JOURNAL OF ADVANCED ENGINEERING RESEARCH AND SCIENCE, v.6, n.5, p.286-290, 2019.
MORON, S. E.; LIMA, L. B. D.; VIEIRA, L. P. L.; MORAIS, P. B.; ANDRADE, R. L. T.. Monitoramento e caracterização da qualidade da água do rio Javaés. p.31-43. In: PINHEIRO, R. T.. Biodiversidade na região da ilha do Bananal/Cantão, Tocantins. EDUFT. 2019. 150p.
PASCHOALINI, A. L.; BAZZOLI, N.. Heavy metals affecting Neotropical freshwater fish: A review of the last 10 years of research. Aquatic Toxicology v.237, n.2021, p.1-11, 2021.
PEREIRA, F. O. P.; SANTOS, L.; SANCHES FILHO, P. J.. Avaliação da contaminação ambiental por metais pesados, através da análise de peixes coletados da Lagoa Mangueira–RS. Revista Ibero-Americana de Ciências Ambientais, v.10, n.1, p.180-194, 2019.
RIBEIRO, E. S.; NOGUEIRA, W. V.; PONTUSCHKA, R. B.. Metal pesado em pescado: a presença do mercúrio como agente contaminante. p.85-102, In: NOGUEIRA, W. V.. Realidades e perspectivas em Ciência dos Alimentos – Nova Xavantina, MT: Pantanal, 2020. 103p.
RIBEIRO, M. C.; MORON, S. E.; LOPES, J. M.. Histological analysis of Bryconops caudomaculatus grills and liver under different concentrations of ammonia. Boletim do Instituto de Pesca, São Paulo-SP, v.43, n.1, p.35-43, 2017.
RORIZ, B. C.; MARIANO, W. S.; TAKAKO, A. K.; CASTRO, F. J.; GARCIA, R. G.. Efeitos do estresse de exposição ao ar sobre parâmetros sanguíneos de juvenis de caranha, Piaractus brachypomus. Enciclopédia Biosfera, v. 11, n.1. p.2231-2242, 2015.
SAVASSI, L. A.; PASCHOALINI, A. L.; ARANTES, F. P.; RIZZO, E.; BAZZOLI, N.. Heavy metal contamination in a highly consumed Brazilian fish: immunohistochemical and histopathological assessments. Springer – Environmental Monitoring & Assessment, v.2020, n.192:542, p.01-14. 2020.
SAVIATO, M. Jr.; SASSI, V. B.; CUNHA, M. M.; SASSI, E. A. B.; GUIMARÃES JUNIOR, J. C.; LIMA, J. D. Hematology of Astyanax novae Eigenmann, 1911 (Characidae: Stethaprioninae) in Neblina stream, eastern Amazon, Brazil. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano. 06, Ed. 11, v.15, p.198-215, 2021.
SAVIATO, M. J.; MARIANO, W. S.; SAVIATO, P. L. C.; SASSI, V. B.. Ictiofauna do ribeirão Jacubinha, bacia do rio Lontra na cidade de Araguaína-TO. Enciclopédia Biosfera, Centro Científico Conhecer – Goiânia, v.14, n.25, p.1362-1374, 2017.
SAVIATO, M. J.; MARIANO, W. S.; SAVIATO, P. L. C.; SASSI, V. B.; MARTINS, P. H. O.; PAULINO, M. G.; ALMEIDA, S. S. M. S.. Fishes diversity in a reservoir of small hydroelectric power that suffers influence of urban evictions, in the city of Araguaína, Tocantins State, Brazil. FACIT Business and Technology Journal, v.13, n.1, p.100-112, 2020.
SMITH, W. S.; SILVA, F. L. D.; BIAGIONI, R. C.. River dredging: when the public power ignors the causes, biodiversity and science. Ambiente & Sociedade, v.22, n.e00571, p.1-20. 2019.
SOARES, D. B.; ALMEIDA, M. W.; SANTOS, E. L. R.; MORON, S. E.; ROCHA, A. S.. Detecção de cobre empregando métodos voltamétricos e eletrodos de baixo custo. 70ª Reunião Anual da SBPC – 22 a 28 de julho de 2018 – UFAL – Maceió / AL. 2018.
SOARES, H. C.; SOUSA, D. B. P.; JESUS, W. B.; CARVALHO-NETA, R. N. F.. Biomarcadores histológicos em Sciades herzbergii (Pisces, Ariidae) para avaliação de impactos em ambientes estuarinos da Baía de São Marcos, Maranhão. Arquivos Brasileiros de Medicina Veterinária e Zootecnia., v.72, n.4, p.1403-1412, 2020
SULTANA, S.; JABEEN, F.; SULTANA, T.; AL-GHANIM, K. A.; AL-MISNED, F.; MAHBOOB, S.. Assessment of heavy metals and its impact on DNA fragmentation in different fish species. Brazilian Journal of Biology, v.80, p.823-828. 2019.
TEIXEIRA, R. J.; EIRAS, J. C.; SPADACCINI-MORENA, D. D.; XAVIER, J. G.; LALLO, M. A.. Infecção das brânquias de tilápia do Nilo (Oreochromis niloticus) por Myxosporea. Pesquisa Veterinária Brasileira. v.38, n.6, p.1085-1090, 2018.
TRINDADE, R. R.; SIEBEN, A.. Impactos socioambientais na área urbana de Araguaína-TO: o rio Lontra no Bairro JK. Nemad. webnode. com – Interface, v.4, n.5, p.39-52, 2012.
VIANA, T. M. A.; OLIVEIRA, S. R. S.; TORRES, H. S.; JESUS, W. B.; TEIXEIRA, A. F.; CARVALHO NETA, R. N. F.. 2021. Biomarcadores histológicos em brânquias e fígados de Sciades herzbergii (Bloch, 1794) em uma área portuária e em uma de proteção ambiental – MA, Brasil. Brazilian Journal of Development, Curitiba, v.7, n.4, p.41047-41065, 2021.
[1] Doutorando em Biotecnologia e Biodiversidade, Mestre em Engenharia Ambiental, Graduação em Ciências Biológicas. ORCID: 0000-0002-8757-7915.
[2] Doutor em Biodiversidade e Biotecnologia -Universidade do Estado do Amazonas- UEA-Rede BioNorte Mestre em Planejamento e Gestão Ambiental pela Universidade Católica de Brasília. ORCID: 0000-0002-8233-2628.
[3] Orientador. Doutor em Biodiversidade e Biotecnologia. Biólogo, Mestre em Zoologia pela Universidade Federal do Pará / Museu Paraense Emílio Goeldi. ORCID: 0000-0002-2592-7430.
Enviado: Julho, 2022.
Aprovado: Agosto, 2022.