SANTOS, Enrico Jardim Clemente [1]
SANTOS, Enrico Jardim Clemente. Avaliação de Diferentes Vias de Administração de Células Progenitoras Adultas Multipotentes Visando sua Utilização Terapêutica no Tratamento da Diabete. Revista Científica Multidisciplinar Núcleo do Conhecimento. Edição 05. Ano 02, Vol. 01. pp 1066-1075, Julho de 2017. ISSN:2448-0959
RESUMO
Durante décadas, pesquisadores em todo mundo vêm procurado maneiras de substituir as células produtoras de insulina do pâncreas que em quadro diabético, são destruídas pelo próprio sistema imunológico do paciente. Sendo uma doença grave e crônica, a diabete mellitus (DM) é caracterizada por um conjunto de alterações metabólicas provocadas por uma ação deficiente da insulina, resultando em um quadro de hiperglicemia. Recentemente uma nova opção terapêutica extremamente promissora conhecida como terapia com células tronco vem sendo estudada e aplicada com resultados consistentes, devido a sua capacidade de adquirir aspectos morfológicos e fisiológicos das células lesionadas, elas atuam nos processos de reparação e manutenção tecidual. Apesar do seu elevado potencial, um fator de extrema importância para a eficácia terapêutica é a via de infusão utilizada. Aqui iremos abordar as principais vias de administração utilizadas no tratamento de organismos injuriados.
INTRODUÇÃO
A diabetes é uma doença grave, caracterizada por um conjunto de alterações metabólicas, provocadas por uma ação deficiente da insulina. O quadro resultante é de hiperglicemia em razão da destruição auto-imune das células-β no pâncreas (tipo 1) ou de diferentes graus de resistência à insulina com a redução parcial ou total da produção deste hormônio por parte das células-β (tipo 2).
Os distúrbios metabólicos associados à diabetes resultam em um extenso quadro de complicações sistêmicas devido à disfunção ou falência dos órgãos, dentre os quais estão a nefropatia culminando com insuficiência renal, neuropatia com risco de amputação de membros, sintomas cardiovasculares, gastrointestinais, geniturinários, disfunção sexual, retinopatia com potencial perda da visão e o déficit no processo de cicatrização de feridas. Estas alterações no quadro clínico diminuem a qualidade de vida, podendo levar à morte do paciente (Meire 2013; National Institute of Health. Stem Cell Information 2017; Khamaisi 2017).
As terapias atuais vêm revolucionando os procedimentos clínicos relacionados ao quadro de diabetes. Entretanto, a única terapia disponível realmente curativa é a substituição de células de ilhotas pancreáticas. Tal procedimento envolve a seleção de doadores que são raros, com a terapia imunossupressora, a qual visa reduzir o processo de rejeição por parte do organismo receptor (Khamaisi 2017). Desta forma, novas opções terapêuticas vêm sendo alvo de pesquisa, tanto em universidades como centros de pesquisa, sendo as células progenitoras adultas multipotentes (CPAMs), também conhecidas como células tronco mesenquimais multipotentes (CPAMs), uma das alternativas mais promissoras uma vez que possuem a capacidade de se diferenciar em células de origem mesodermal, endodermal e ectodermal (Figura 1)(LU 2015).
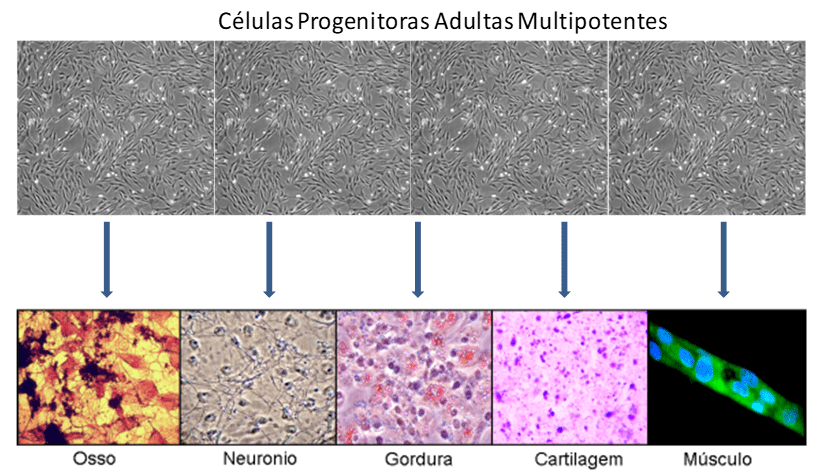
As CPAMs tem por características próprias serem células multipotentes capazes de adquirirem aspectos morfológicos e fisiológicos pertinentes a sua localização tecidual no organismo sendo as principais responsáveis, mediante estímulos específicos, pelos processos de reparação e manutenção tecidual durante o transcorrer da vida do indivíduo (Ferraro 2010; Parekkadan 2010; Shin 2013; Ito 2014).
Além do potencial de se diferenciar nos diversos tipos celulares que constituem o organismo, as CPAMs apresentam propriedades imunomodulatórias, atuando sobre as respostas imunológicas tanto ináta com adquirida e atenuando os processos inflamatórios, anti-apoptóticos, antifibroticos e angiogênicos. Todas estas propriedades são predominantemente mediadas por fatores parácrinos secretados pelas CPAMs como hormônios, citocinas, fatores de crescimento, mediadores lipídicos, vesículas extracelulares, RNA mensageiros e microRNAs, dentre outros (Spees 2016; Cruz 2016; Abreu 2016).
Alterações patológicas nos quadros microvasculares, macrovasculares e inflamatórios nos tecidos de pacientes com diabetes tendem a ser um obstáculo ao tratamento adequado das complicações tardias da doença. As CPAMs oferecem uma abordagem promissora no que tange a estas complicações por meio da libertação de fatores de crescimento e citocinas, de forma a estimular a formação de novos vasos e modular o processo inflamatório. Embora a abordagem terapêutica autóloga minimize a probabilidade da ocorrência de um processo de rejeição por parte do receptor, sua eficácia pode ser afetada em função da obtenção a partir de um indivíduo diabético ou potencialmente diabético. Por este prisma, a terapia alogênica se apresenta como uma alternativa consistente, uma vez que as CPAMs não são reconhecidas pelo sistema imunológico do organismo receptor.
Dentro deste contexto as CPAMs demonstram possuir um considerável potencial terapêutico por possuírem alta capacidade de proliferação e de diferenciação em diferentes tipos celulares maduros, inibirem o processo de rejeição de enxerto por parte do receptor e induzem, por meio da secreção de fatores tróficos, por exemplo, a angiogênese e ação anti-inflamatória. Contudo, persistem obstáculos significativos quanto à otimização do processo de seleção e direcionamento das CPAMs.
VIAS DE ADMINISTRAÇÃO
Para a obtenção de um resultado terapêutico satisfatório, por meio da terapia com células tronco, as vias de aplicação no processo de infusão das CPAMs são de suma importância, considera-se que essas devem ser de fácil realização, pouco invasiva e traumática, causando mínimos efeitos colaterais. Além disso, o procedimento deve apresentar a maior taxa possível de sobrevivência, retenção e enxertia das células infundidas (Dimmeler 2005).
Uma vez que a rota utilizada pode influenciar o processo de migração e destino das células transplantadas, é de fundamental importância o estabelecimento da via adequada. É importante ressaltar que alguns fatores adicionais devem ser considerados como o diagnóstico e prognóstico da doença, localização da região injuriada, extensão da lesão e tipo celular utilizado no tratamento (Wechsler 2009).
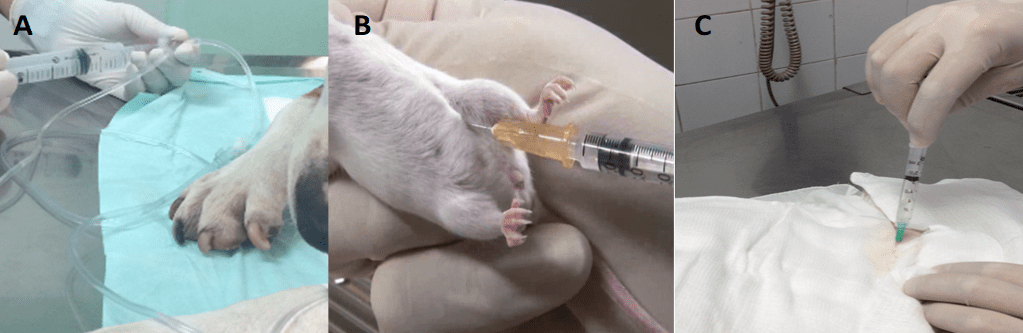
A via de administração mais utilizada é a endovenosa devido ao seu posicionamento anatômico de fácil e rápido acesso ao sistema venoso, além de pouco invasiva e de fácil difusão pelo organismo, proporciona a possibilidade de múltiplas aplicações, com o mínimo de efeitos colaterais (Xu 2008). Embora seja considerada uma via invasiva é pouco traumática não requerendo suporte médico avançado para sua utilização. Durante o processo de infusão, tanto a velocidade como a concentração celular devem ser levadas em consideração de forma a evitar a formação de aglomerados celulares e consequentemente geração de trombos (Figura 2A) (Dib 2010).
A cavidade peritoneal vem sendo utilizada por se tratar de uma via que propicia a infusão de um elevado concentrado celular com baixa probabilidade de gerar êmbolos. Quando comparada a infusão endovenosa, apresenta menores riscos de efeitos colaterais. Em ratos, têm-se preconizado a infusão na porção no quarto inferior esquerdo, para preservar o ceco, que se encontra à direita (Figura 2B)(Hao 2013; Wakabayashi 2014).
A via de administração local propicia a direta liberação das CPAMs na área lesionada resultando em uma maior retenção celular no local injuriado, embora necessite de conhecimento anatômico e perícia cirúrgica uma vez que é uma via altamente invasiva e potencialmente traumática (50,51). O sucesso da ação terapêutica das CPAMs está diretamente relacionada a manutenção das mesmas nas regiões lesionadas de forma que possam atuar tanto por meio de seu efeito parácrino como por diferenciação celular (Figura 2C)(41).
ANALISE DA SEGURANÇA E EFICÁCIA TERAPÊUTICA DAS CPAMs
O método de administração apropriado das CPAMs é crucial para a sobrevivência celular, indução da diferenciação celular e restauração funcional das ilhotas pancreáticas. Estudos analisaram diferentes vias de administração quanto a sua eficácia e segurança terapêuticas no tratamento de ratos diabéticos. Foram analisadas de três vias distintas e independentes: a endovenosa, intraperitoneal ou intra-pancreática de forma a determinar qual forneceria os melhores resultados terapêuticos.
A análise comparativa da eficiência terapêutica das vias de infusão intra-peritonial e endovenosa, foi realizada em em ratos diabéticos. A infusão pelas vias endovenosa e intra-peritonial facilitam a ampla distribuição das CPAMs no organismo propiciando a atuação das mesmas, por meio de diferentes mecanismos celulares, em uma grande variedade de tecidos (Devine et al., 2003). Dezoito animais diabéticos foram selecionados e divididos aleatoriamente em três grupos: o grupo controle constituído de oito animais; o grupo submetido a infusões das CPAMs pela veia caudal composto por cinco animais e o grupo infundido com as CPAMs pela via intra-peritonial formado por cinco animais. Todos os grupos tiveram os índices de glicose no sangue e peso corpóreo monitorados semanalmente durante o período oito semanas após a infusão das CPAMs. Os ratos submetidos a administração intra-peritonial apresentaram uma redução dos índices de glicose no sangue atingindo o seu níveis mais baixo no trigésimo quinto dia, embora os valores após este ponto tenham aumentado, atingindo valores equivalentes ao controle no quadragesimo segundo dia. A análise dos valores dos animais submetidos a infusão endovenosa das CPAMs apresentaram uma redução dos índices de glicose no sangue a partir do sétimo dia sendo os valores mantidos até o quinquagêsimo sexto dia. Os dados referentes ao peso corpóreo dos ratos demonstrou que os animais submetidos a administração endovenosa apresentaram um gradual aumento dos valores o qual foi mantido até o final do estudo. Os animais submetidos a infusão intra-peritonial apresentaram índices equivalentes ao grupo controle. Todos os animais foram sacrificados sendo amostras do tecido pancreático, coletadas e analisadas por meio do estudo histomorfométrico. Os animais diabéticos apresentaram ilhotas Langerhans com forma atrófica, redução significativa da densidade numérica (número de ilhotas /pâncreas), área e diâmetro. Os ratos infundidos pela via endovenosa apresentaram melhora dos parâmetros histomorfométricos, número, área e diâmetro das ilhotas Langerhans ao passo que os animais submetidos a administração intra-peritonial não apresentaram melhorias na estrutura das ilhotas pancreáticas. Os resultados demonstraram que ambas as vias se mostraram seguras e eficazes sendo que a administração intravenosa de CPAMs exibiu um melhor potencial para manter o controle da hiperglicemia de ratos diabéticos, quando comparado aos dados dos animais submetidos a infusão intraperitoneal (El-Hossary 2016). Dados recentes demonstram que o efeito anti-diabético exercido pelas CPAMs devem estar associados à sua capacidade de restaurar o equilíbrio Th1/Th2 e modificar o perfil de citoquinas no microambiente pancreático (Ezquer et al., 2012).
A análise da segurança e eficiência terapêutica das CPAMs infundidas pela via intra-pancreática foi realizada em 40 ratos diabéticos divididos em quatro grupos aleatoriamente de dez animais. O primeiro grupo estabelecido foi o de ratos sadios; o segundo de animais diabéticos; o terceiro grupo recebeu as CPAMs por meio da via endovenosa e o quarto grupo pela via intra-pancreática, mais precisamente sob a cápsula pancreática. Os animais foram analisados quanto ao índice de glicose no sangue, insulina presente no sangue e C-peptídeo apresentando resultados, referentes a hiperinsulinemia e hiperglicemia, mais relevantes após a infusão das CPAMs pela via intra-pancreática. Tal fato pode ser atribuído a diferença na concentração de CPAMs que atingem o pâncreas ser superior pela via intra-peritonial quando comparada a via endovenosa. Após atingirem o pâncreas as CPAMs se distribuem, com frequência e localização variável, nos vasos e dutcots, dentre outras estruturas de forma a otimizar, por meio do processo de diferenciação e liberação de fatores de crescimento e citocinas, o microambiente pancreático. Desta forma, o mecanismo de ação das CPAMs contribui para o restabelecimento da estrutura e função do tecido pancreático (Li 2016.
CONCLUSÃO
Apesar das múltiplas barreiras à implementação clínica, as células-tronco têm demonstrado suficiência para garantir um lugar no campo da medicina reparativa. A medida que nossa compreensão da biologia das células tronco e sua heterogeneidade aumenta, os benefícios tendem a crescer de forma considerável. Técnicas emergentes oferecem estratégias particularmente atraentes para tornar o uso terapêutico das células tronco cada vez mais seguros e eficazes, sendo o estabelecimento das vias de aplicação uma questão de extrema importância para a efetividade da terapia com células tronco.
REFERÊNCIAS
Lu L1, Li Y2, Du MJ3, Zhang C4, Zhang XY5, Tong HZ5, Liu L5, Han TL5, Li WD5, Yan L1, Yin NB5, Li HD5, Zhao ZM6. Characterization of a Self-renewing and Multi-potent Cell Population Isolated from Human Minor Salivary Glands. Sci Rep. 2015 Jun 9;5:10106.
Friedenstein A.J., Piatetzky-Shapiro I.I. & Petrakova K.V. 1966. Osteogenesis in transplants of bone marrow cells. J Embryol Exp Morphol. Dec;16(3):381-90.
Zuk PA, Zhu M, Mizuno H, Huang J, Futrell JW, Katz AJ, Benhaim P, Lorenz HP, Hedrick MH. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Engineering 7, 211–28, 2001
Park KS, Lee YS, Kang KS. In vitro neuronal and osteogenic differentiation of mesenchymal stem cells from human umbilical cord blood. J Vet Sci. 2006 Dec;7(4):343-8.
Lu LL, Liu YJ, Yang SG, Zhao QJ, Wang X, Gong W, Han ZB, Xu ZS, Lu YX, Liu D, Chen ZZ, Han ZC. Isolation and characterization of human umbilical cord mesenchymal stem cells with hematopoiesis-supportive function and other potentials. Haematologica. 2006 Aug;91(8):1017-26.
Bortolotti F, Ukovich L1, Razban V2, Martinelli V1, Ruozi G1, Pelos B3, Dore F3, Giacca M1, Zacchigna S4. In vivo therapeutic potential of mesenchymal stromal cells depends on the source and the isolation procedure. Stem Cell Reports. 2015 Mar 10;4(3):332-9.
See comment in PubMed Commons belowJeon YJ, Kim J2, Cho JH1, Chung HM3, Chae JI1. Comparative Analysis of Human Mesenchymal Stem Cells Derived From Bone Marrow, Placenta, and Adipose Tissue as Sources of Cell Therapy. J Cell Biochem. 2016 May;117(5):1112-25.
Jin HJ, Bae YK, Kim M, Kwon SJ, Jeon HB, Choi SJ, Kim SW, Yang YS, Oh W, Chang JW. Comparative analysis of human mesenchymal stem cells from bone marrow, adipose tissue, and umbilical cord blood as sources of cell therapy. Int J Mol Sci. 2013 Sep 3;14(9):17986-8001.
Ferraro F., C. L. Celso, and D. Scadden, “Adult stem cels and their niches,” in The Cell Biology of Stem Cells, E. Meshorer and K. Plath, Eds., vol. 695 of Advances in Experimental Medicine and Biology, pp. 155–168, 2010.
Parekkadan B. and J. M. Milwid, “Mesenchymal stem cells as therapeutics,” Annual Review of Biomedical Engineering, vol. 12, pp. 87–117, 2010.
Shin L. and D. A. Peterson, “Human mesenchymal stem cell grafts enhance normal and impaired wound healing by recruiting existing endogenous tissue stem/progenitor cells,” Stem Cells Translational Medicine, vol. 2, no. 1, pp. 33–42, 2013.
Ito K. and T. Suda, “Metabolic requirements for the maintenance of self-renewing stem cells,” Nature Reviews Molecular Cell Biology, vol. 15, no. 4, pp. 243–256, 2014.
Spees JL, Lee RH, Gregory CA. Mechanisms of mesenchymal stem/stromal cell function. Stem Cell Res Ther. 2016;7:125.
Cruz FF, Weiss DJ, Rocco PRM. Prospects and progress in cell therapy for acute respiratory distress syndrome. Expert Opin Biol Ther. 2016;16:1353–60.
Abreu SC, Weiss DJ, Rocco PRM. Extracellular vesicles derived from mesenchymal stromal cells: a therapeutic option in respiratory diseases? Stem Cell Res Ther. 2016;7:53.
Lin P, Chen L, Yang N, Sun Y, Xu YX. Evaluation of stem cell differentiation in diabetic rats transplanted with bone marrow mesenchymal stem cells. Transplant Proc. 2009 Jun;41(5):1891-3.
Devine SM, Cobbs C, Jennings M, Bartholomew A, Hoffman R (2003)
Mesenchymal stem cells distribute to a wide range of tissues following systemic infusion into nonhuman primates. Blood 101:2999–3001
El-Hossary N, Hassanein H2, El-Ghareeb AW3, Issa H4. Intravenous vs intraperitoneal transplantation of umbilical cord mesenchymal stem cells from Wharton’s jelly in the treatment of streptozotocin-induced diabetic rats. Diabetes Res Clin Pract. 2016 Nov;121:102-111.
Ezquer F, Ezquer M, Contador D, Ricca M, Simon V, Conget P (2012)
The antidiabetic effect of mesenchymal stem cells is unrelated to their transdifferentiation potential but to their capability to restore Th1/Th2 balance and to modify the pancreatic microenvironment. Stem Cells 30:1664–1674
Hao H, Liu J, Shen J, Zhao Y, Liu H, Hou Q, Tong C, Ti D, Dong L, Cheng Y, Mu Y, Liu J, Fu X, Han W. Multiple intravenous infusions of bone marrow mesenchymal stem cells reverse hyperglycemia in experimental type 2 diabetes rats. Biochem Biophys Res Commun. 2013 Jul 5;436(3):418-23.
Dimmeler S1, Zeiher AM, Schneider MD. Unchain my heart: the scientific foundations of cardiac repair. J Clin Invest. 2005 Mar;115(3):572-83.
Wechsler L, Steindler D, Borlongan C, Chopp M, Savitz S, Deans R, Caplan L, Hess D, Mays RW, Boltze J, Boncoraglio G, Borlongan CV, Caplan LR, Carmichael ST, Chopp M, Davidoff AW, Deans RJ, Fisher M, Hess DC, Kondziolka D, Mays RW, Norrving B, Parati E, Parent J, Reynolds BA, Gonzalez-Rothi LJ, Savitz S, Sanberg P, Schneider D, Sinden JD, Snyder E, Steinberg GK, Steindler D, Wechsler L, Weiss MD, Weiss S, Victor S, Zheng T.Stem Cell Therapies as an Emerging Paradigm in Stroke (STEPS): bridging basic and clinical science for cellular and neurogenic factor therapy in treating stroke. Stroke. 2009 Feb;40(2):510-5.
Dib N1, Menasche P, Bartunek JJ, Zeiher AM, Terzic A, Chronos NA, Henry TD, Peters NS, Fernández-Avilés F, Yacoub M, Sanborn TA, Demaria A, Schatz RA, Taylor DA, Fuchs S, Itescu S, Miller LW, Dinsmore JH, Dangas GD, Popma JJ, Hall JL, Holmes DR Jr; International Society for Cardiovascular Translational Research. Recommendations for successful training on methods of delivery of biologics for cardiac regeneration: a report of the International Society for Cardiovascular Translational Research. JACC Cardiovasc Interv. 2010 Mar;3(3):265-75.
Xu YQ, Liu ZC. Therapeutic potential of adult bone marrow stem cells in liver disease and delivery approaches. Stem Cell Rev. 2008 Summer;4(2):101-12
Wakabayashi K1, Hamada C, Kanda R, Nakano T, Io H, Horikoshi S, Tomino Y. Adipose-derived mesenchymal stem cells transplantation facilitate experimental peritoneal fibrosis repair by suppressing epithelial-mesenchymal transition. J Nephrol. 2014 Oct;27(5):507-14.
Meier JJ, Bonadonna RC. Role of reduced β-cell mass versus impaired β-cell function in the pathogenesis of type 2 diabetes. Diabetes Care 2013;36(Suppl 2): S113–19.
National Institute of Health. Stem Cell Information. Chapter 7: Stem Cells and Diabetes. Available at: http://bit.ly/2j4iIUV (accessed January 17, 2017).
Khamaisi M, Balanson SE. Stem Cells for Diabetes Complications: A Future Potential Cure. Rambam Maimonides Med J 2017;8 (1):e0008. doi:10.5041/RMMJ.10283 Review
Lisha Li & Furong Li2 & Feng Gao3 & Yali Yang2 & Yuanyuan Liu1 & Pingping Guo1 & Yulin Li1. Transplantation of mesenchymal stem cells improves type 1 diabetes mellitus. Cell Tissue Res (2016) 364:345–355
[1] Biocientista. Mestre, Doutor, Pós-Doutor

