ОБЗОР СТАТЬИ
NOVAES, Michele Franciene Baú [1]
NOVAES, Michele Franciene Baú. Оценка нормативных стандартов по маркировке и упаковке фармацевтической продукции. Revista Científica Multidisciplinar Núcleo do Conhecimento. 05-й год, Эд. 06, г. 01, стр. 44-64. Июнь 2020 года. ISSN: 2448-0959, ссылка на доступ: https://www.nucleodoconhecimento.com.br/здравоохранение/нормативных-стандартов
РЕЗЮМЕ
Национальное агентство по надзору за состоянием здоровья (АНВИСА) стремится содействовать охране здоровья населения путем регулирования производства и сбыта продуктов и услуг, подлежащих санитарному надзору, включая фармацевтическую продукцию. Регулирующие стандарты определяют параметры качества, которые должны соблюдаться в производственной цепочке в фармацевтической фармацевтической промышленности. Это исследование было направлено на сбор библиографических данных для уточнения и обнародования информации для медицинских работников, фармацевтического промышленного сектора, представительных органов, связанных с Министерством здравоохранения, ANVISA и бразильским населением, в целом, о важности обсуждения и обновления бразильского законодательства о маркировке и упаковке фармацевтической продукции, выявлении и демонстрации данных, указывающих на возможные эквивалентности между ними, которые могут привести к ошибкам в лечении , что может произойти в обмен. Он также предназначен для проверки с учетом существующих санитарных норм, что обязательная информация, которая будет вставлена в этикетки, имеющие отношение к безопасности пользователей, и обсудить возможные побочные реакции, связанные с лактозы excipient, широко используется фармацевтической промышленности. Для выбора теоретической основы мы использовали базы данных сайтов Scielo.br, VHL (Виртуальная библиотека здоровья), поиск на веб-сайтах, научных журналах и статьях в журналах здоровья, где мы использовали поисковые слова в одиночку: маркировка, упаковка, законодательство, лактозы, и комбинированный поиск двух или трех слов: фармацевтические этикетки-лекарства ошибки, фармаковигация-лекарства ошибки, маркировка-упаковка-законодательство, этикетки-упаковка- Были исключены работы, не сочетающие ни в одном из трех слов, а также те, которые не вписывались в заранее отобранные годы с 2000 по 2019 год. Критерий исключения также применяется к статьям, которые после прочтения не относятся к основной цели исследования. Отсутствовали конкретные стандарты для обеспечения дифференциации аналогичных упаковок во избежание ошибок в лекарствах, а также было отмечено отсутствие правил, дискриминационных по присутствию лактозы на этикетках лекарственных средств. Публикация законодательства, направленного на поощрение дифференциации упаковки и стандартизации конкретной информации на этикетках, имеет основополагающее значение для поощрения рационального использования лекарственных средств.
Ключевые слова: маркировка лекарств, упаковка, ошибки в лекарствах. Законодательство, лактоза.
1. ВВЕДЕНИЕ
Национальное агентство по надзору за состоянием здоровья (АНВИСА) стремится содействовать укреплению здоровья населения путем контроля за производством и сбытом продуктов и услуг, представляемых санитарному надзору, включая фармацевтическую продукцию, путем инспекции, стандартизации процедур и процессов, которым следует следить в целях обеспечения качества и безопасности при использовании этих продуктов (BRASIL, 1999).
Цепочка промышленного производства фармацевтической продукции включает в себя ряд последовательных процедур, направленных на обеспечение качества, от предкостанционных исследований до разработки маркировки и подходящего упаковочного материала.
Качество фармацевтической продукции должно соблюдаться от процессов производства активов до этикетки и упаковки, которые должны соответствовать всем требованиям законодательства.
ANVISA RESOLUTION RDC No 71/2009 устанавливает спецификации, аспект и содержание, которые должны быть разработаны в Бразилии, в целях облегчения доступа к необходимой информации об этих продуктах и обеспечения рационального использования лекарственных средств (BRASIL, 2009).
Цель упаковки заключается в упаковке, упаковке, упаковке, защите и поддержании безопасности, а также обеспечении надлежащего сохранения фармацевтического продукта, что является важным элементом эффективности и безопасности, в дополнение к передаче важной информации о администрации. На этикетках должно быть указано торговое наименование продукта, если есть название активного ингредиента, фармацевтическая форма, маршрут администрирования, дозировка и количество, упакованное в упаковочный материал (BRASIL, 2009).
Федеральная конституция в одной из своих статей предусматривает, что здоровье гарантировано всем, и государство обязано обеспечивать его с помощью социально-экономической политики, которая, как правило, снижает вероятность развития у граждан заболеваний или других травм, а также доступа к действиям и услугам по поощрению и защите здоровья всех бразильских граждан (BRASIL, 1988).
Кодекс о защите прав потребителей предусматривает право потребителя гарантировать защиту жизни и адекватную и четкую информацию о товарах и услугах. Разработанная продукция не может нести риски для здоровья или безопасности потребителей, а в конкретном случае продукции, производимой в промышленной среде, производитель должен предоставить всю необходимую информацию, и они должны сопровождаться продуктом, особенно информацией, касающейся безопасности использования (BRASIL, 1990).
В 1998 году Всемирная организация здравоохранения опубликовала документ “Роль фармацевта в самообслуживании и самолечении”, доклад 4-й Консультативной группы ВОЗ о роли фармацевта, документ, в котором также сообщается о важности доступа к беспристрастной и качественной информации для руководства самообслуживанием и самолечением (ВОЗ, 1998).
Ошибки в дозации и приеме лекарств вытекают из многофакторных последствий, имеющих различное происхождение и причины, от ошибок, вызванных дозированием и/или неправильным введением, до ошибок, полученных в результате бессознательного самолечения продуктов, содержащих вещества, которые могут создавать проблемы или проблемы со здоровьем пациентов (ВОЗ, 1998).
Научные данные свидетельствуют о том, что маркировка и аналогичная упаковка фармацевтической продукции могут быть одной из причин, причинивших ошибки в распределении и администрировании лекарственных средств в больницах и медицинских учреждениях (ANACLETO et al., 2005).
Другие исследования показывают, что использование некоторых эксципиентов в фармацевтических препаратах, широко используемых отраслями в производстве лекарственных средств, таких как лактозу, может вызвать развитие желудочно-кишечных дискомфортов у людей с непереносимостью этого типа углеводов, как у младенцев, так и у взрослых при приеме лекарств, содержащих этот препарат (SENA, 2012; СИЛЬВА, 2008).
Подобные ситуации могут привести к госпитализации или увеличению продолжительности пребывания госпитализированных пациентов, что приведет к последствиям для здоровья людей и увеличению расходов, расходуемых как на государственные, так и на частные системы здравоохранения.
Мы можем рассмотреть такие случаи, как упомянутые выше, как проблемы общественного здравоохранения, которые должны быть проанализированы, и мы должны обсудить законы, связанные с процессом маркировки и упаковки фармацевтической продукции, с тем чтобы гарантировать право на полное здоровье и информацию, доступную и понятную пользователю.
Основываясь на этих случаях, данное исследование намерено оценить действующие в Бразилии нормативные стандарты по маркировке и упаковке фармацевтической продукции, проанализировать эпидемиологические данные об ошибках в лекарствах, полученных из аналогичной упаковки, сообщить о возникновении побочных реакций, полученных в результате использования лекарств, содержащих лактозу, с тем чтобы проверить необходимость обсуждения и обновления бразильского законодательства по данному вопросу , для облегчения и обеспечения доступа населения к основной информации о лекарственных средствах.
2. АТРИБУЦИИ ANVISA И БРАЗИЛЬСКИЕ НОРМАТИВНЫЕ СТАНДАРТЫ ПО МАРКИРОВКЕ И УПАКОВКЕ ЛЕКАРСТВ
Национальное агентство по эпиднадзору за состоянием здоровья, учреждение, связанное с министерством здравоохранения и характеризующееся административной независимостью, в качестве одной из своих общих атрибутов несет ответственность за стандартизацию, контроль и надзор за продуктами, веществами и услугами, связанными со здоровьем, действовать в области укрепления здоровья и развивать работу в особых ситуациях, которые ставят под угрозу здоровье бразильского населения (BRASIL, 1999).
В качестве конкретных атрибуций этого субъекта можно упомянуть установление стандартов регулирования лекарственного сектора, таких, как стандартизация параметров качества для производства; разрешить и отменить регистрацию входных и фармацевтических продуктов; разработать дискуссии и общественные консультации по вопросам, касающимся здоровья, с тем чтобы изменить или создать новые правила в качестве основы для деятельности в области производства и сбыта лекарственных средств; и проанализировать запросы фармацевтической промышленности об изменениях в этикетках и упаковках (BRASIL, 1999).
Развитие цивилизации в глобализованном мире, появление новых патологий, которые должны быть исследованы медициной, и с улучшениями, достигнутыми в последние десятилетия в связи с легкостью доступа бразильского населения к лекарствам, по сравнению с предыдущими десятилетиями, наблюдается увеличение использования лекарственных средств и поиск более эффективных методов лечения для ухода за новыми болезнями современности.
В результате спроса на новые, более эффективные и современные терапевтические альтернативы была воспринята необходимость разработки новых фармацевтических ресурсов, разработки фармацевтических формул и систем доставки лекарств. В результате увеличилось число инвестиций отраслей в научные исследования и разработку новых молекул, и в результате этого и экономических интересов сектора значительно возросло количество лекарств.
Лекарственные этикетки и упаковка стали не только неотъемлемой частью упаковки готового продукта, но и для фармацевтического маркетинга важной возможностью для изучения и развития коммерчески привлекательной упаковки, которая помогла бы продвинуть продукт и увеличить продажи. Затем возникает необходимость установления санитарных норм для маркировки этих продуктов.
Учитывая критерии надлежащей производственной практики, применимые ко всем этапам исследований, производства и логистики продукта, и Национальную наркополитику, учрежденную Министерством здравоохранения в 1998 году, которая в качестве одного из своих принципов является стимулом для производства лекарственных средств и их санитарного регулирования, Национальное агентство по надзору за состоянием здоровья опубликовало постановление РДК No 333/2003 (БРАЗИЛИЯ, 2003; БРАЗИЛИЯ, 2019).
Постановление Коллегиального совета АНВИСА РДК No 333/2003 было первым разработанным законодательством, касающимся маркировки лекарственных средств, устанавливающим, что все упаковки лекарственных средств, разработанные с начала года после публикации, должны адаптироваться к стандартам, установленным этой резолюцией (BRASIL, 2003). Впоследствии это правило было отменено публикацией Резолюции РДК No 71/2009.
Резолюция RDC No 71/2009 является нынешней нормой в Бразилии, которая регулирует характеристики, которые должны соблюдаться для разработки маркировки лекарственных средств в Бразилии, в целях облегчения доступа к информации и стандартизации обязательной информации, которая будет введена (BRASIL, 2009).
Компании должны уведомить об адекватности маркировки, соблюдая требования, изложенные в постановлении, и сделать новые этикетки доступными на упаковке лекарственных средств, произведенных или импортируемых для продажи на рынке в течение 540 дней с даты публикации (BRASIL, 2009).
Некоторые определения представлены в этом стандарте для видов маркировки и назначения их использования и могут иметь дифференцированную маркировку и характеристики, которые позволяют быть идентифицированы как маркировка разработки для использования в продуктах, отпускаемых в государственных учреждениях, связанных с министерством здравоохранения; коммерческая, с маркировкой, разработанной для продукции с продажей в аптеках и аптеках; и больницы, с материалами, предназначенными для упаковки продуктов ограниченного использования для клиник и больниц. Также характерны концепции маркировки и дифференциации типов упаковки (BRASIL, 2009).
Этикетка все виды идентификации печатных или выгравированы на маркировке материала, который направлен на выявление важной информации в контейнерах, контейнерах, обертках, обертках или на продукте, в котором желательно быть идентифицированы (BRASIL, 2009).
Упаковка является все виды формы для упаковки, с основной целью агрегирования единиц продукта, с целью создания лучших условий для поддержания качества и логистики распределения же (BRASIL, 2009).
Когда дело доходит до лекарств, у нас все еще есть концепции первичной и вторичной упаковки. Согласно RDC No 71/2009, первичная упаковка поддерживает прямой контакт с фармацевтическим продуктом, в то время как вторичная упаковка является внешней упаковкой продукта, которая находится в контакте с первичной упаковкой и может содержать один или несколько первичных пакетов (BRASIL, 2009).
Согласно вышеупомянутому законодательству, имеется информация, включение которой становится обязательным в процессе маркировки для уточнения характеристик препарата.
На вторичной упаковке этикетки они должны содержать: торговое наименование лекарственного средства и его родовое наименование каждого активного ингредиента, содержащегося в рецептуре, с концентрацией каждого из них; маршрут администрирования, фармацевтическая форма, с указанием ограничения использования по возрастным группам, с указанием того, предназначен ли продукт для взрослого или педиатрического использования; общее количество упакованных в упаковочный материал с указанием температуры и условий хранения; и информацию о данных о производителе и регистрации продукции (BRASIL, 2009).
Предупреждающие фразы также должны быть вставлены пользователю в связи с противопоказаний, мер предосторожности и предупреждения для использования активных ингредиентов, терапевтического класса и excipients, когда это применимо, во вторичной упаковке. Однако RDC No 71/2009 конкретно не указывает, какие предупреждающие фразы в отношении активных и инклифентных ингредиентов должны быть включены на этикетках и упаковках (BRASIL, 2009).
Что касается этикетки первичной упаковки, то было установлено, что та же обязательная информация для вторичной упаковки должна быть вставлена в первичную упаковку, и в тех случае, когда невозможно содержать всю эту информацию в первичном упаковочном материале, отрасли промышленности должны информировать причины через электронное обращение (BRASIL, 2009).
Маркировка лекарственных средств является средством передачи информации о продукте пользователю. В этом смысле бразильское регулирующее учреждение играет важную роль в анализе и установлении критериев путем опубликования новых нормативных актов по разработке этикеток и упаковки, соответствующих потребностям населения, и более эффективной с информационной точки зрения.
3. ЭТИКЕТКИ И УПАКОВКА АНАЛОГИЧНЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ И ОШИБОК В ЛЕКАРСТВАХ
Вопросы, связанные с безопасностью пациентов, включают в себя действия по предотвращению и устранению ошибок, связанных с процессами здоровья. По данным Национального координационного совета СОЕДИНЕННЫх Штатов по отчетности и профилактике ошибок в лекарствах (NCCMERP), ошибка в лечении может быть определена как:
любое предотвратимое событие, которое может привести или привести к неправильному использованию лекарств или вреду для пациента, в то время как препарат находится под контролем медицинского работника, пациента или потребителя. Такие мероприятия могут быть связаны с профессиональной практикой, продуктами здравоохранения, процедурами и системами, включая рецепт, связь, этикетку, упаковку, номенклатуру, состав, диспансеризацию, дистрибуцию, администрирование, образование, мониторинг и использование (NCCMERP, 2015).
По данным Всемирной организации здравоохранения, ошибки в лекарствах являются одной из основных причин травм и предотвратимого повреждения в системах здравоохранения и могут происходить на разных стадиях процесса применения лекарств. Во всем мире стоимость ошибок, связанных с наркотиками, оценивается в 42 миллиарда долларов США в год (ВОЗ, 2017 г.).
Кульминацией публикации закона No 13.236/2015 стала поправка и включение в некоторые статьи Закона No 6360/1976, в целях усиления необходимости разграничения этикеток и упаковки лекарственных средств в целях минимизации возникновения ошибок в лекарствах, в том числе ошибок, возникающих при распределении лекарств, администрировании лекарственных средств или ошибочного обмена на представление аналогичной упаковки (BRASIL, 2015).
Этикетки и упаковка лекарственных средств, в дополнение к передаче характеристик для признания и использования этих, имеет цель быть важным средством, чтобы избежать ошибок. Однако данные указывают на ошибки в лекарствах, в которых этикетки и упаковка лекарств могут быть причиной путаницы со стороны медицинских работников в процедурах, выполняемых в рабочей среде, и, следовательно, наносят вред здоровью пациентов (ANACLETO et al., 2005).
Ошибки в лечении являются серьезной проблемой общественного здравоохранения и являются причиной возникновения заболеваемости, госпитализации, смертности и увеличения расходов на здравоохранение. По данным публикации Института безопасной практики использования лекарственных средств в 2018 году, среди ошибок, связанных с лекарствами, 33% вызваны этикетками и упаковкой, а 31% из них переросло в связанные со смертельным исходом (ISMP, 2018).
Эпидемиологическое исследование наблюдательного и поперечного типа было проведено в 2010 году в различных секторах больничной аптеки университетской больницы в Форталезе, Сеара, с целью проверки этикеток и упаковки лекарственных средств, выявления сходства в них, которые могут вызвать ошибки в лекарствах, которые могут возникнуть в процессах хранения, дозирования и администрирования (LOPES et al., 2012).
Мы изучили 300 фармацевтических презентаций, сфотографированных (150 пар) и представленных наблюдателям в разные дни, а наблюдателями, участвующими в исследовании, были две медсестры и фармацевт (LOPES et al., 2012).
Фармацевтические презентации исследуемой выборки включали эталонные препараты, дженерики, аналогичные препараты и лекарства с упаковкой от Министерства здравоохранения. Были проанализированы фармацевтические формы и презентации, типы упаковки, название, цвет, дизайн, фармакологический класс, поставщики и потенциал риска; потенциально опасных лекарственных средств и контролируемых лекарственных средств (LOPES et al., 2012).
Для отбора образцов были рассмотрены эталонные препараты, дженерики, аналогичные препараты и препараты с упаковкой от Министерства здравоохранения. При возникновении сходства данные были внесены в базу данных и охарактеризованы по международным ссылкам, таким как Национальный координационный совет по отчетности и профилактике ошибок в лекарствах (NCCMERP, 2017).
После представления фотографий наблюдателям, сбора полученных ими ответов и анализа данных с использованием статистических методов, исследователи обнаружили следующие результаты: в отношении типа лекарств 43% аналогичных упаковок были аналогичных препаратов, 21,33% эталонных препаратов и 18% непатентованных препаратов; и среди 24 фармакологических классов 28% были противомикробными препаратами, 10,67% анестетиками и 6,67% антигипертензивными (LOPES et al., 2012).
Сходства были также найдены в отношении печатных данных, дизайнер, цвет этикетки, упаковка с тем же цветом. Исследователи определили, что; среди анализируемой выборки 50% первичных пакетов и 44% вторичных пакетов имели одинаковый цвет (LOPES et al., 2012).
Исследование фармацевтических презентаций, изученных в этом исследовании, также показало, что в общей сложности, возможно, аналогичные препараты, 51,33% были малообъемными парентеральными решениями, включая ампулы, флаконы и мешки с закрытой системой, демонстрируя влияние, которое тема маркировки и упаковки лекарств оказывает на способность включить ошибки в лечении (LOPES et al., 2012).
В качестве представления о проблеме наблюдения, представленной в этом исследовании, мы попытались определить, например, некоторые этикетки и аналогичную упаковку лекарственных средств. Некоторые изображения были найдены при поиске на веб-сайтах.
Министерство здравоохранения в 2016 году обновило Руководство по визуальной идентификации упаковки лекарственных средств, в котором установлены критерии разработки и идентификации маркировки лекарственных средств, распространяемых Единой системой здравоохранения.
На рисунке 1 показаны инъекционные препараты, производимые и распространяемые Министерством здравоохранения для использования в UNIFIED HEALTH SYSTEM (SUS) и представляет собой сходство в маркировке двух различных типов инсулинов, возможный обмен которых может поставить пациента под угрозу, если есть ошибочное введение регулярного человеческого инсулина (упаковка, представленная на левой стороне изображения) вместо человеческого инсулина NPH (представленный на правой стороне изображения).
На рисунке 2 представлены аналогичные пакеты препаратов с контролируемыми веществами, которые классифицируются как противосудорожные препараты, обычно используемые для предотвращения срабатывания судорог у пациентов с эпилепсией. Имя производителя, выгравированное на нижней части упаковки, было намеренно покрыто черным помеченным, чтобы не выставлять отметку и избегать возможных вопросов, касающихся интересов данного исследования.
Рисунок 1. Аналогичная упаковка инсулина и потенциал для лекарства ошибки.

Рисунок 2. Аналогичные пакеты противосудорожных препаратов производятся в Бразилии.

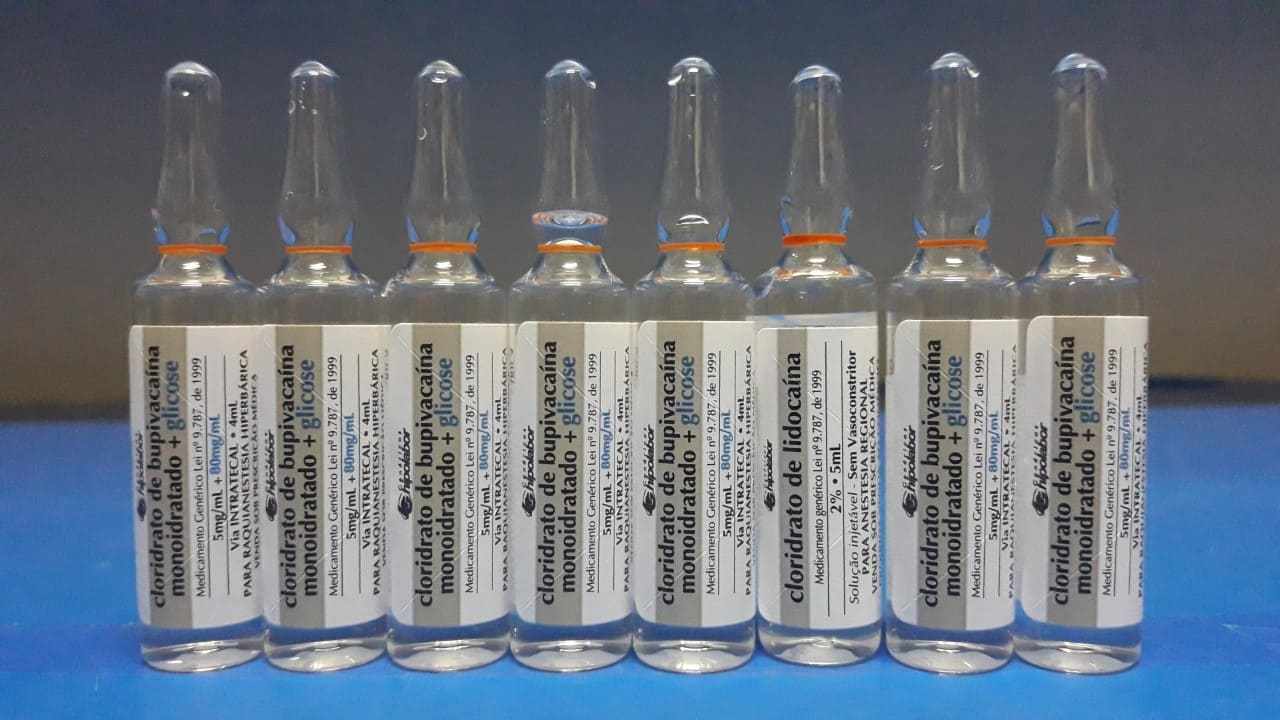
Еще одно сходство в маркировке лекарств было выявлено автором этого исследования, когда он отвечал за оказание фармацевтической помощи в больнице в городе Воторантим, в штате Сан-Паулу, Бразилия, от наблюдения аптечного запаса операционной, в коробках (так называемый “психобокс”), предназначенных для использования анестезиологами в операционных, где команда сообщила о возникновении административной ошибки между лидоканом.
Ампулы инъекционных препаратов лидокаина и бупивакаина, найденные в коробках, были проанализированы и представлены сходные возможности, чтобы вызвать ошибку лекарства, как для дозирования и введения у пациентов в хирургических процедурах.
Примечательно, что ампулы этих двух веществ имеют ту же компанию, что и производитель, и для наблюдения за сходством были помещены, эмпирически, некоторые из этих ампул бок о бок с введением ампулы различных веществ среди других для анализа потенциала сходства. Цифры 3 и 4 ниже представляют описанную ситуацию.
Рисунок 3. Инъекционные препараты, используемые в хирургических процедурах и аспектах маркировки.

Рисунок 4. Увеличенное фото. Инъекционные препараты, используемые в хирургических процедурах и аспектах маркировки.
Другое исследование, опубликованное в журнале Израильского института преподавания и исследований Альберта Эйнштейна, стремилось продемонстрировать, что цвета помогают в процессе визуальной идентификации глазных капель, уменьшая неправильное введение глазных капель. Этикетки упаковки проверенных продуктов были удалены, а идентификация глазных капель поощрялась пациентами с характерным цветом каждой презентации. Исследователи пришли к выводу, что окрашивание лекарственного вещества может помочь в процессе визуализации и идентификации лекарств (COSTA et al., 2019).
Из этого исследования и данных, представленных ранее, эмпирически, мы можем понять, что цвета вмешиваются в идентификацию лекарственных средств, как в активном веществе настоящее время, а также может положительно повлиять на маркировку и процесс упаковки фармацевтической продукции.
Различные цвета, используемые в процессах разработки упаковочного материала для улучшения различия маркировки, такие как ампулы, флаконы, мешки с парентеральными растворами, стеклянная посуда, волдыри, среди прочих, уменьшили вероятность ошибок на бирже.
4. ИСПОЛЬЗОВАНИЕ ЛАКТОЗЫ В КАЧЕСТВЕ ФАРМАЦЕВТИЧЕСКОГО ЭКСЦИПЕНТА
В исследованиях для разработки новых фармацевтических формул анализируются биофармацевтические и физикохимические характеристики активных и эксципациных ингредиентов. Фармацевтические формы требуют адъювантов для оказания помощи в таких процессах, как растворимость, сжатие, сохранение, придать объем, форму препарату и придать приятный вкус рецепту для улучшения приема потребителей (AULTON, 2016).
Лактоза является дисахаридным углеводом, являясь одним из видов эксципации, обычно используемых промышленностью, и который представляет себя как размяждение и подсластитель, особенно в твердых фармацевтических формах, а также может вмешиваться в фармакокинетические характеристики. Противопоказанием использования этого эксципента в фармацевтических препаратах будет тот факт, что некоторые люди имеют непереносимость лактозы (AULTON, 2016; 1475).
Непереносимость лактозы является состоянием организма, где есть неспособность пищеварения этого углевода из-за дефицита пищеварительного фермента лактазы, который превращает лактозу в глюкозу и галактозу, являясь условием, которое вызывает жизненные проблемы людей во всем мире (PEREIRA; ФЕРРЕЙРА; МАРКЕС, 2019).
Люди, которые присутствуют с этим условием, страдают от желудочно-кишечных неудобств, таких как развитие длительной тяжелой диареи, метеоризм, судороги, отек живота и обезвоживание, что приводит их к не потреблять молоко и другие молочные продукты (PERREIRA; ФЕРРЕЙРА; МАСКА, 2019).
Пациенты с непереносимостью лактозы подвержены побочным реакциям в результате использования лекарств, содержащих этот эксципиент, и могут развиться симптомы, аналогичные тем, которые возникают при употреблении продуктов, содержащих этот сахар, так как потребление количества, равного или менее 3 граммов, уже может спровоцировать описанные симптомы (SENA et al., 2014).
Исследование, проведенное в Фармаковигате Центр Сеара, направленных на выявление существования возможных эксциентов, которые вызывают побочные реакции, содержащиеся в 12 продуктов (35 фармацевтических презентаций) с самой высокой продажи в Бразилии, и образец был собран с августа по сентябрь 2004 года (SILVA и др., 2008).
Лактоза присутствовала среди фармацевтических адъювантов, содержащихся в исследуемых продуктах, например, в формуле, содержащей бромазепам (контролируемое вещество, приобретение которого требует конкретного рецепта) и дипилшополамина (SILVA et al., 2008).
В другом описательном исследовании с библиографическим исследованием состава лекарственных средств, с помощью брошюры и технической информации, записанной в ANVISA, был оценен риск возможных экскрициентов, вызывающих побочные реакции в противозачаточных препаратах. Для образца было представлено 6 презентаций по контрацепции, 3 из которых были эталонными препаратами, а 3 были схожими, и во всех из них было обнаружено наличие лактозы в составе (DE CASTRO et al., 2010).
Исследования, проведенные с препаратами, часто предписанные педиатрических пациентов также проанализировали наличие лактозы в 181 различных презентаций 42 препаратов. Обнаружены фармакологические группы: анальгетики/жареретики, нестероидные противовоспалительные препараты, антибиотики, антигистаминные препараты, антиэметики, оральные кортикостероиды, ингаляционные кортикостероиды, долгодействующие бронхолитики, ингаляционные кортикостероиды, связанные с бронходилоидами, противолодными препаратами. Что касается присутствия лактозы, 28% презентаций содержали этот excipient (GERMANA, и др. 2009).
Проверенные исследования показывают данные, которые определяют наличие лактозы в значительном проценте среди анализируемых продуктов. В настоящее время в Бразилии нет законодательства, которое регулирует производителей лекарств, чтобы добавить на внешней стороне пакета информацию о том, что препарат представляет excipient лактозы.
Вторичная упаковка препарата находится в непосредственном контакте с продуктом и обычно определяется непрофессиональным населением в фармацевтическом законодательстве как внешняя и впервые визуально идентифицированная: “аптечку”. Учитывая, что другая предупреждающая информация о красителях уже была включена в маркировку лекарственных средств через законодательство, например, тартазин, было бы интересно рассмотреть вопрос о введении предупреждения также на лактозе снаружи, облегчая идентификацию.
Маркировка может помочь людям с непереносимостью лактозы принимать более обоснованные решения о выборе и покупке их лекарств. Законопроект, внесенный в Палату представителей в 2009 году, предусматривает требование к фармацевтическим лабораториям вставлять на этикетках лекарственных средств предупреждение о наличии лактозы в составе их продукции. Хотя тема законопроекта актуальна для безопасного и рационального использования лекарственных средств, предложение было проанализировано и подано в 2013 году.
5. ПРАВО НА ДОСТУП К МЕДИЦИНСКОЙ ИНФОРМАЦИИ И МАРКИРОВКЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Здоровье является правом всех и обязанностью государства, гарантированным посредством социально-экономической политики, направленной на снижение риска заболеваний и других травм, а также всеобщего и равного доступа к действиям и услугам для его поощрения, защиты и восстановления (BRASIL, 1988).
Право на здоровье включено в сферу гарантированных Конституцией социальных прав (BRASIL, 1988). На основе Федеральной конституции в качестве принципа, подчеркивающий право на здоровье и информацию, полученную от этого права, ответственность за принятие инициатив лежит на бразильском регулирующий органе как неотъемлемой и представительной части министерства здравоохранения, которая будет развивать и обеспечивать доступ к населению по вопросам здравоохранения, имеющим к ним отношение.
Закон об органическом здравоохранении No. 8080/1990, которая создает Единую систему здравоохранения, возобновляет это заявление, содержащееся в федеральной конституции Бразилии, подтверждая, что здоровье является одним из основных прав человека и обязанность государства обеспечивать основные обстоятельства для его полного осуществления, и государство должно также гарантировать здоровье путем создания условий, обеспечивающих доступ, но ясно дает понять, что обязанность государства не освобождает от ответственности людей, семьи, компаний и общества в вопросах, связанных со здоровьем. (БРАЗИЛИЯ, 1990 ГОД).
В больничной среде, лекарства обычно хранятся в аптеке и дозирования осуществляется профессионалами, работающими в этом секторе, с фармацевтом является членом команды, ответственной за все виды деятельности, разработанные в аптеке больницы. Визуально четкая маркировка других продуктов позволяет правильно идентифицировать препарат во время диспансеризации и предотвращает ошибки в администрировании лекарственных средств медицинскими работниками.
В аптеках и аптеках лекарства могут быть приобретены самим пользователем или другим лицом, запрашиваемым пользователем, и могут быть приобретены лекарства, доступные в самообслуживании и известные как МИП (безрецептурные препараты), препараты, которые должны быть предписаны медицинским работником, квалифицированным для этой цели, включая контролируемые препараты, рецепт которых будет сохранен в учреждении, распределяющее продукт.
Например, в случае побочных реакций, вызванных непереносимостью лактозы, право на доступ к медицинской информации становится необходимым. Учитывая, что многие лекарства содержат лактозу в качестве excipient, в том числе контролируемых лекарств, если пользователь приходит к разработке неблагоприятной реакции на препарат, поскольку он содержит лактозу, этот продукт, вероятно, будет непригодным для использования и пациент должен будет попросить предписывающим для другого рецепта, чтобы сделать новую покупку. Таких случаев можно было бы избежать с помощью предупреждающих фраз на упаковке, так как информация о эксциентах вставляется только в булии.
Лекарства доступны в различных средах, но используются с той же целью профилактики, лечения, снятия симптомов или оказания помощи в диагностике заболеваний. Понимая эти предпосылки, мы можем понимать, что информация об этих продуктах должна доходить до пользователей эффективно, для того, чтобы обеспечить безопасное использование и без дополнительных рисков, в дополнение к тем, которые известны и уже проявляются в пакетной брошюре.
Информация о продуктах, особенно связанных со здоровьем, должна быть адекватной и ясной, с тем чтобы точно представить все доказательства, гарантирующие безопасность в отношении использования, как это предусмотрено в статье 6 Кодекса о защите прав потребителей (БРАЗИЛИЯ, 1990 год).
Санитарные нормы являются способом установления и гарантирования этого права потребителям фармацевтической продукции. Кроме того, фармацевтическая промышленность получит много пользы от предоставления более эффективной информации о маркировке в дополнение к тем, которые требуются действующим законодательством, поскольку продукты, которые повышают ценность безопасности потребителей и безопасности рецептурных препаратов, практикующих медицинские работники, выписывающие лекарства, будут иметь больше возможностей для выписки рецептов и продажи.
Необходимо взаимосвязано промышленное развитие упаковочного материала и право на медико-санитарные данные. Учитывая, что медицинские работники часто работают долгие рабочие часы в день, аналогичная упаковка создает риск ошибочного введения и не сотрудничает в выполнении критериев безопасности при использовании лекарств.
Изменения в маркировке и упаковке лекарств могут свести к минимуму возникновение ошибок в лекарствах, предупредить людей с проблемами, связанными с лактозы, о побочных реакциях и способствовать рациональному использованию лекарств, обеспечивая прямую информацию о здоровье и здоровье.
6. ЗАКЛЮЧИТЕЛЬНЫЕ СООБРАЖЕНИЯ
Проанализировав санитарные нормы по маркировке и упаковке фармацевтической продукции, удалось найти общие концепции и рекомендации по разработке маркировки, а также отсутствие конкретных правил для подавления возможных ошибок в лекарствах, полученных из этикеток и аналогичной упаковки.
В то же время ни один санитарный стандарт не нашел определения бразильским регулирующим органом об обязанности для фармацевтических отраслей вставлять информацию: “CONTAINS LACTOSE”, в упаковку и этикетки лекарственных средств, указывая медицинским работникам и пациентам о составе фармацевтической формулы непосредственно во вторичной упаковке: “вне коробки”.
Издержки, связанные с системами здравоохранения во всем мире, порождаемые ошибками в отношении лекарств и побочными реакциями, высоки, а последствия сходства и отсутствия информации об эксциентах на этикетках и упаковках способствуют увеличению расходов и повышают возможность риска для здоровья всех.
Ошибки в лечении и неблагоприятные явления, вытекающие из маркировки и упаковки фармацевтической продукции, должны быть исследованы органами общественного здравоохранения и ANVISA, агентством, связанным с министерством здравоохранения, в целях поиска решений проблемы, выделенной в этом исследовании, и попытаться найти пути в пользу рационального использования лекарственных средств в соответствие с развитием фармацевтической промышленности этикеток и упаковки более информативным, чем коммерческие.
Возникновение такой ситуации, видимо, не сдвинуто фармацевтической промышленности с целью разработки проектов по созданию новых решений, обеспечивающих стандартизацию упаковки и маркировки лекарственных средств, забывая о том, что параметры качества для удовлетворения надлежащей производственной практики должны соблюдаться на основе исследований разработки и производства фармацевтических форм до контроля качества и безопасности при постмаркетинговом использовании.
Простые действия наркоиндустрии могут улучшить жизнь пациентов и медицинских работников в области управления наркотиками. Использование различных цветов для дифференцирования маркировки наркотиков, особенно с умеренной до тяжелой потенциал взаимодействия наркотиков, и вставка конкретной предупреждающей фразы для лактозы продуктов непосредственно на улице в упаковке наркотиков, может избежать ошибок и облегчить доступ к соответствующей информации.
Это исследование надеется внести свой вклад в дальнейшие исследования, и по этому вопросу принимаются меры, как государственными учреждениями, так и фармацевтическим промышленным сектором, с тем чтобы обеспечить, чтобы дискуссии имели место и решения могут быть найдены.
В первую очередь Национальное агентство по надзору за состоянием здоровья, как орган, отвечающий за развитие укрепления здоровья, роль повторного анализова действующего законодательства о маркировке и упаковке лекарственных средств и публикации новых нормативных актов, которые решают вопросы, изложенные в этом исследовании.
Этикетки и упаковка были причиной ошибок лекарств и связанных с ними побочных реакций. Регулирование здравоохранения является способом обеспечения профилактики и минимизации проблем, связанных с наркотиками.
7. ССЫЛКИ
ANACLETO, Tânia Azevedo et al. Erros de medicação e sistemas de dispensação de medicamentos em farmácia hospitalar. Clinics. São Paulo, v. 60, n. 4, p. 325-332, ago. 2005. Disponível em: <http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1807-59322005000400011&lng=pt&nrm=iso>. Acesso em: 29 nov. 2019. http://dx.doi.org/10.1590/S1807-59322005000400011.
ANVISA, 2019. Registro de medicamentos cresce 100%. Disponível em: <http://portal.anvisa.gov.br/noticias/-/asset_publisher/FXrpx9qY7FbU/content/registro-de-medicamentos-cresce-100-em-2019/219201?p_p_auth=fJVL8wqt&inheritRedirect=false>. Acesso em: 06 jan. 2020.
ARAUJO, Ana Carolina; BORIN, Maria de Fátima. Influência de excipientes farmacêuticos em reações adversas a medicamentos. Brasília Med. 2012;49(4):267-278. Disponível em: <https://pdfs.semanticscholar.org/e5a3/9e36b11ae4dc9336d3bd033fe80cd45f2df1.pdf>. Acesso em: 15 jan. 2020.
AULTON, Michael E. Aulton delineamento de formas farmacêuticas. Michael E. Aulton, Kevin M. G. Taylor; [tradução Francisco Sandro Menezes]. Versão digital – 4 ed. – Rio de Janeiro: Elsevier, 2016.
BRASIL, 1988. Constituição da República Federativa do Brasil. Disponível em: <http://www.planalto.gov.br/ccivil_03/constituicao/constituicao.htm>. Acesso em: 20 nov. 2019
BRASIL, 1990. Lei nº 8.078, de 11 de setembro de 1990. Dispõe sobre o Código de Defesa do Consumidor. Disponível em: <http://www.planalto.gov.br/ccivil_03/leis/l8078.htm>. Acesso em 17 dez. 2019.
BRASIL, 1999. Lei nº 9.782, de 26 de janeiro de 1999. Disponível em: <http://bvsms.saude.gov.br/bvs/saudelegis/anvisa/2006/prt0354_11_08_2006.html>. Acesso em: 15 de jan. de 2020.
BRASIL, 2016. Manual de Identidade Visual de Medicamentos do Ministério da Saúde. Disponível em: < https://www.saude.gov.br/artigos/672-assuntos/assistencia-farmaceutica/42827-arquivos-do-manual-de-identidade-visual-de-medicamentos>. Acesso em: 22 jan 2020.
BRASIL, 2003. Resolução RDC nº 333, de 19 de novembro de 2003. Disponível em: <http://bvsms.saude.gov.br/bvs/saudelegis/anvisa/2003/rdc0333_19_11_2003.html>. Acesso em: 27 out. 2019.
BRASIL, 2019. Resolução RDC nº 71, de 22 de dezembro de 2009. Disponível em: <http://bvsms.saude.gov.br/bvs/saudelegis/anvisa/2009/res0071_22_12_2009.html>. Acesso em: 23 nov. 2019.
BRASIL, 2015. Lei nº 13.236, de 29 de dezembro de 2015. Disponível em: <https://www2.camara.leg.br/legin/fed/lei/2015/lei-13236-29-dezembro-2015-782195-publicacaooriginal-149108-pl.html>. Acesso em: 27 out. 2019.
BRASIL, 2019. Resolução RDC nº 301, de 21 de agosto de 2019. Disponível em: <http://www.in.gov.br/web/dou/-/resolucao-rdc-n-301-de-21-de-agosto-de-2019-211914064>. Acesso em 14 dez. 2020.
COSTA, Ana Luiza Fontes de Azevedo et al. Quando a cor ajuda. Einstein (São Paulo), São Paulo, v. 17, n. 1, eAO4410, 2019. Disponível em <http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1679-45082019000100200&lng=en&nrm=iso>. Acesso em 29 nov. 2019. Epub Dez 17, 2018. http://dx.doi.org/10.31744/einstein_journal/2019ao4410.
DE CASTRO, Ana Luiza Ferreira Meinen; AHLERT, Elias Ricardo; COLET, Christiane de Fátima. Avaliação do risco de reações adversas causadas por excipientes em formulações de anticoncepcionais. Revista Contexto & Saúde, v. 10, n. 19, p. 146-149, 14 jun. 2013. Disponível em: <https://www.revistas.unijui.edu.br/index.php/contextoesaude/article/view/1496>. Acesso em: 15 nov. 2019.
GERMANA, Stefani P. et al. Presença de corantes e lactose em medicamentos: avaliação e 181 produtos. Rev. bras. alergia imunopatol; v. 32, v.1, p. 18-26, jan.-fev. 2009. Disponível em: < http://www.sbai.org.br/revistas/Vol321/ART%201-09%20-%20Presen%C3%A7a%20de%20corantes%20e%20lactose.pdf>. Acesso em: 15 jan. 2020.
ISMP, 2018. Estratégias de segurança do paciente no Brasil – O que já foi feito e o que ainda está por vir?. Disponível em: <https://www.ismp-brasil.org/site/wp-content/uploads/2019/05/A—-es-da-Anvisa-com-foco-seguran–a.pdf>. Acesso em: 22 jan. 2020.
LOPES, Diana Maria de Almeida et al. Análise da rotulagem de medicamentos semelhantes: potenciais erros de medicação. Rev. Assoc. Med. Bras., São Paulo, v. 58, n. 1, p. 95-103, fev. 2012. Disponível em <http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0104-42302012000100021&lng=en&nrm=iso>. Acesso em: 29 nov. 2019. http://dx.doi.org/10.1590/S0104-42302012000100021.
National Coordinating Council for Medication Error Reporting and Prevention. What is a medication error? Nova York: National Coordinating Council for Medication Error Reporting and Prevention; 2015. Disponível em <http://www.nccmerp.org/aboutmedication-errors>. Acesso em 20 de jan. 2020.
PEREIRA, Leandra Gonçalves; FERREIRA, Michelle Silva; MARQUES, Fabíola Pedrosa Peixoto, 2019. Intolerância à lactose e os aspectos legais da rotulagem. Disponível em: <http://anais.unievangelica.edu.br/index.php/latosensu/article/view/4526>. Acesso em 15 jan. 2020
PESSANHA, Ana Flávia de Vasconcelos et al. Influência dos excipientes multifuncionais no desempenho dos fármacos em formas farmacêuticas. Rev. Bras. Farm. 93(2): 136-145, 2012. Disponível em: <http://www.rbfarma.org.br/files/rbf-2012-93-2-2.pdf>. Acesso em: 15 jan. 2020
SENA, Cristina Santana et al. Excipientes farmacêuticos e seus riscos à saúde: uma revisão da literatura. Rev. Bras. Farm. 93(2): 136-145, 2014. Disponível em: <http://www.sbrafh.org.br/v1/public/artigos/2014050405000621BR.pdf>. Acesso em: 15 jan. 2020
SILVA, Antonio Vinicios Alves da et al. Presença de excipientes com potencial para indução de reações adversas em medicamentos comercializados no Brasil. Rev. Bras. Cienc. Farm., São Paulo, v. 44, n. 3, p. 397-405, set. 2008. Available from <http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1516-93322008000300009&lng=en&nrm=iso>. Acesso em: 29 nov. 2019
WHO, 1998. Portal de informações sobre medicamentos essenciais e produtos de saúde. Relatório do 4º Grupo Consultivo da OMS sobre o papel do farmacêutico. Disponível em: <https://apps.who.int/medicinedocs/en/d/Jwhozip32e/>. Acesso em: 15 jan. 2020.
WHO, 2017. O terceiro desafio global da segurança do paciente da OMS: medicação sem danos. Disponível em: <https://www.who.int/patientsafety/medication-safety/campaign/en/>. Acesso em 06 jan. 2020.
[1] Аспирант по фармацевтическому промышленному менеджменту Университета Эстесио де Са, окончил фармацевтический факультет в области фармации и биохимии Университета Паулиста – UNIP.
Отправлено: март 2020 года.
Утверждено: июнь 2020 года.