ИНТЕГРАТИВНЫЙ ОБЗОР
SILVA, Poliane Cardoso da [1], MORAIS, Lauandecy Maria Domingas Costa de [2], LEAL, Kamila Soares [3]
SILVA, Poliane Cardoso da. MORAIS, Lauandecy Maria Domingas Costa de. LEAL, Kamila Soares. Последствия генетического редактирования у людей с использованием техника «CRISPR-CAS9». Revista Científica Multidisciplinar Núcleo do Conhecimento. Год 06, эд. 09, Vol. 05, с. 85-107. Сентябрь 2021 года. ISSN: 2448-0959, Ссылка доступа: https://www.nucleodoconhecimento.com.br/закон/техника-crispr-cas9
СВОДКА
Генетическое редактирование через систему CRISPR-Cas9 позволило достижить большие успехи в области генной инженерии, включая возможность генетической модификации человеческих эмбрионов с репродуктивным потенциалом, что недавно произошло в Китае. Таким образом, возникает много споров по теме, которая поднимает научные, этические и правовые дилеммы, проблема, которая привела к настоящему исследованию со следующим вопросом: Каковы основные научные, этические и правовые последствия, возникающие в результате генетического редактирования у людей посредством применения метода CRISPR-Cas9? Таким образом, цель состояла в том, чтобы исследовать такие воздействия, чтобы сплести соответствующие размышления по этому вопросу в текущем сценарии, рассматривая защиту генетического наследия в соответствии с принципом достоинства человеческой личности. Мы также стремились подойти к этим аспектам междисциплинарным образом, чтобы поднять закон в соответствии с антропоцентрическими перспективами. Для проведения исследования мы использовали интегративные и документальные теоретико-библиографические исследования, осуществляемые путем поиска научных работ в национальных и международных индексаторах, официальных сайтах консультаций по законодательству, а также обновленных книг, доступных в физической и цифровой среде. Было получено, что система CRISPR-Cas9 чрезвычайно перспективна, учитывая ее применение для генной терапии, однако применение редактирования генов в репродуктивных клетках человека находится в разгаре научной неопределенности с неожиданными результатами, такими как мозаицизм и случайные мутации; что касается нормативных вопросов, то существует национальная и международная охрана генетического наследия в отношении эмбриональных клеток человека, поскольку ДНК человека рассматривается как неотъемлемое благо человечества, и никакие изменения не передаются будущим поколениям; Что касается этических последствий, то изменение естественного состава человека означает нарушение предела, который вредит принципу самоопределения индивида, позволяя при этом увидеть евгеническуюпрактику и усилить социальную сегрегацию. Делается вывод о том, что возможности, предоставляемые генетическим редактированием с помощью исследуемой методики, неизбежны и, следовательно, правовая система должна стремиться обновить свой прогноз, такие обновления должны, прежде всего, учитывать этические принципы, которыми руководствуются биоэтика и биоправо. Подчеркивается, что такие мероприятия должны проводиться более убедительными исследованиями.
Ключевые слова: генетическое редактирование, последствия, достоинство человеческой личности.
1. ВСТУПЛЕНИЕ
Открытие более практических средств генетического редактирования у людей вызвало большую помпу в научной среде, главным образом из-за объявления о рождении первых генетически модифицированных людей, факт, который произошел в Китае, благодаря использованию техники «CRISPR-Cas9» – Clustered Regulary Interepaced Short Palindro Repeatmics, термин относится к фрагментам цепи ДНК.
Генетическое редактирование из метода CRISPR-Cas9 происходит от применения функций, выполняемых истинным наблюдаемым механизмом на молекулярном уровне, где сегменты ДНК модифицируются, согласно Aмабис и Марто (2010) ДНК – это структура, которая несет всю наследственную информацию одиночных или многоклеточных живых организмов, ее структура двойной спирали состоит из тысяч нуклеотидов, соединенных последовательно, чьи последующие действия образуют гены, места, которые указывают на выражение характеристик каждой особи, например, цвет глаз, форму лица, даже могут иметь аномалии, которые выражаются в наследственных заболеваниях.
Таким образом, овладение генетическими манипуляциями означает контроль экспрессии генотипа и фенотипа организмов, то есть их генетического состава и его экстернализации. Важно сообщить, что первые результаты с CRISPR-Cas9 показывают многообещающие перспективы с учетом возможностей, предоставляемых генной терапией (ORMON et al., 2017).
Тем не менее, необходимо подчеркнуть расхождения, присутствующие в научной среде, потому что нет единого мнения относительно таких манипуляций, поскольку некоторые исследования указали на побочные эффекты, способные привести к потерям, таким как вредные мутации в других генах, появление раковых заболеваний и другие неизмеримые изменения, добавив к этому тот факт, что окончательные изменения в ДНК влияют на будущие поколения в их биологических и социальных измерениях (CLEMENTE, 2020).
В нынешней конъюнктуре научные неопределенности приводят к этическим и правовым дилеммам, касающимся этой темы, с учетом принципов, которыми руководствуются биоэтика и биоправо. Что касается национального законодательства, то в Законе о биобезопасности (No 11.105/2005) регулируется деятельность в области генной инженерии, и это устройство закрепляет практику генетических вмешательств с участием половых клеток и эмбрионов человека (BRASIL, 2005). Аналогичным образом, существует международная охрана генетического наследия с помощью устройств, направленных на универсальную охрану генетического материала как фундаментальной единицы, принадлежащей человеку (UNESCO, 1997 год).
В этом контексте настоящее исследование было направлено на то, чтобы таким образом исследовать основные научные, этические и правовые последствия генетического редактирования у людей с помощью метода CRISPR-Cas9, чтобы сплести должные размышления по этому вопросу в текущем сценарии, рассматривая защиту генетического наследия в соответствии с принципом достоинства человеческой личности. Мы также стремились подойти к этим аспектам междисциплинарным образом, чтобы поднять закон в соответствии с антропоцентрическими перспективами.
Настоящее исследование имеет большое значение для академической и социальной среды, поскольку оно направлено на получение более широких знаний о нюансах, связанных со спорной темой, которая в настоящее время имеет большое значение для биоправа и смежных областей, как и положено для междисциплинарной темы. Это тема, затрагивающая права человека и основные права, такие как достоинство человеческой личности перед лицом технологических инноваций, характеризующихся механизмами, все более присутствующими в постмодернистском мире и которые, следовательно, составляют порождающие факты нынешнего и будущего права, динамизм которого требует максимального внимания и постоянного обсуждения.
Для проведения исследования мы использовали интегративные и документальные теоретико-библиографические исследования, осуществляемые путем поиска научных работ в национальных и международных индексаторах, официальных сайтах консультаций по законодательству, а также обновленных книг, доступных в физической и цифровой среде.
Эта работа следует за организацией, представляющей в качестве результатов и обсуждений следующие тематические оси: генетическое редактирование; техника CRISPR-Cas9; охрана генетического наследия человека; Научные ограничения техники CRISPR-Cas9 у людей и этические последствия, связанные с указанной техникой, наконец, последний раздел приводит общие соображения как продукт проведенных исследований.
2. РАЗРАБОТКА
2.1 ГЕНЕТИЧЕСКОЕ ИЗДАНИЕ
Генная инженерия позволяет редактировать генетический материал человека путем передачи генетических последовательностей, которые будут рекомбинированы с другими сегментами ДНК, деятельность, которая требует надлежащего контроля и регулирования, чтобы избежать рисков для человеческой жизни, поскольку соблюдается принцип человеческого достоинства (MALUF, 2020, стр. 59).
Практика модификации организма посредством геномного редактирования подразумевает его улучшение, придавая ему желаемые характеристики, как утверждает Скарманха; Сильва и Гаре:
A engenharia genética realiza processos de manipulações genéticas, objetivando que elementos sejam duplicados, transferidos ou mesmo isolados dos genes originais. Assim, com estes procedimentos, é possível obter seres com genética melhorada com qualidade e aprimoramento de funções (SCARMANHÃ; SILVA; GARÉ, 2019, p. 05).
В этом измерении приложения генной инженерии могут быть осуществлены в любом животном или человеческом организме, что Клементе (2020) обеспечивает, поскольку приложения генетического редактирования первоначально ограничены соматическими клетками, то есть незародными клетками, которые присутствуют в большей части человеческого тела и отличаются и специализируются на различных тканях и органах, в то время как гаметические клетки необходимы для размножения нового существа. Таким образом, изменения в половых клетках могут передаваться будущим поколениям, напротив, изменения в соматических клетках остаются только у особей, которые имеют их в своем составе.
Учитывая эти возможности, динамический характер наук, которые всегда стремятся к прогрессу, при этом генная инженерия не происходила иначе, говорит Бериам (2017), который еще в 2015 году начал усиливать споры о генетическом изменении половых клеток человека или генетическом редактировании яйцеклеток, сперматозоидов и эмбрионов (оплодотворенных яйцеклеток), таким образом, появилась возможность манипулирования генетическим материалом человеческих эмбрионов.
Что касается генетического редактирования у людей, то законодательство родины, как правило, запрещает соответствующую практику через Закон о биобезопасности, который устанавливает стандарты использования методов генной инженерии и высвобождения генетически модифицированных организмов – ГМО в окружающую среду (BRASIL, 2005).
Существует запрет на генетическое изменение эмбриональных или половых клеток человека, читая статью 8 вышеупомянутого устройства, отмечаются другие запреты, касающиеся манипуляций с зародышевыми клетками:
Art. 6º Fica proibido:
I – Implementação de projeto relativo a OGM sem a manutenção de registro de seu acompanhamento individual;
II – Engenharia genética em organismo vivo ou o manejo in vitro de ADN/ARN natural ou recombinante, realizado em desacordo com as normas previstas nesta Lei;
III – engenharia genética em célula germinal humana, zigoto humano e embrião humano;
IV – Clonagem humana; (…) (BRASIL, 2005).
Следует отметить, что вышеупомянутый закон кочтет применение генной инженерии при редактировании половых клеток человека преступлением, предусматривая в статье 24, что такое поведение, а также любой акт нарушения генетического материала человека in vivo, который не направлен на устранение генетических дефектов и выходит за рамки правовых норм, приведет к наказанию в виде лишения свободы на срок от 1 (одного) до 3 (три) лет и штрафа. Клонирование человека и использование человеческих эмбрионов также наказываются в несогласии с юридическими прогнозами:
Art. 24. Utilizar embrião humano em desacordo com o que dispõe o art. 5º desta Lei:
Pena – detenção, de 1 (um) a 3 (três) anos, e multa.
Art. 25. Praticar engenharia genética em célula germinal humana, zigoto humano ou embrião humano:
Pena – reclusão, de 1 (um) a 4 (quatro) anos, e multa.
Art. 26. Realizar clonagem humana:
Pena – reclusão, de 2 (dois) a 5 (cinco) anos, e multa.
Art. 27. Liberar ou descartar OGM no meio ambiente, em desacordo com as normas estabelecidas pela CTNBio e pelos órgãos e entidades de registro e fiscalização:
Pena – reclusão, de 1 (um) a 4 (quatro) anos, e multa. (BRASIL, 2005).
Остается уточненным положение закона, регулирующего деятельность, связанную с генетическим изменением организмов, это допускается как у других нечеловеческих живых существ, так и у неимбриональных или репродуктивных клеток человека. С другой стороны, современная биотехнология развивает более противоречивые и революционные процедуры генетических манипуляций (REIS; OLIVEIRA, 2019).
Также по мнению авторов, среди революционных методик, полученных в результате биотехнологических инноваций, более конкретно в области генной инженерии выделяется методика редактирования генов под названием CRISPR-Cas9, которая позволяет заменять сегменты внутри ленты ДНК, исправляя возможные ошибки или генетические дефекты путем вставки желаемых или более полезных характеристик. Эта возможность пробуждается к размышлению о рисках, возникающих в результате манипулирования человеком, следуя его интересам, таких как возможность евгенических практик (REIS; OLIVEIRA, 2019).
2.2 ТЕХНИКА CRISPR-CAS-9
Согласно Caндер и Чжон (2014), система CRISPR-Cas9 возникла из молекулярной инженерии иммунной системы бактерий, это позволяет редактировать любой ген посредством фрагментации ДНК ферментом рестрикции под названием «Cas9», который направляется РНК-транспортером и обладает способностью сочетаться с последовательностями специфических азотных оснований.
Подтверждая то же понимание, что и выше, болт et al. (2016) сравнивают эту технику с текстовым редактором, начиная с того момента, когда ДНК представляет собой письменный код, и, как и любой другой, он может содержать ошибки в своей структуре, а также Как письменные инструменты идентификации ошибок, метод распознает определенные нуклеотидные последовательности в целевой ДНК, а также использует средства отсечения для их выбора. На рисунке 3 показан механизм генетического редактирования с помощью системы CRISPR-Cas9.
Рисунок 3 – Система CRISPR – Cas9
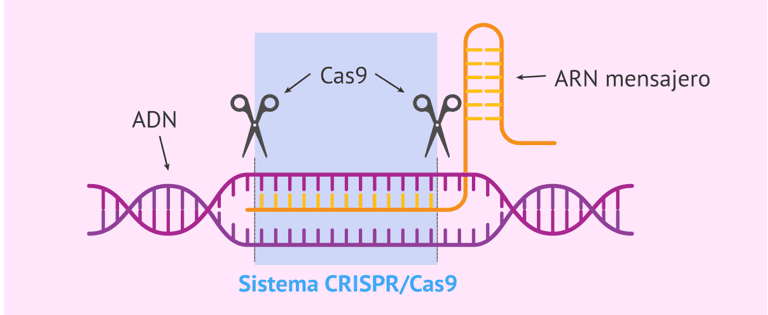
В этом контексте Клементе ссылается на два основных момента в механизме редактирования, упомянутых здесь, а именно на стадию распознавания и расщепления, когда молекула ДНК разрезается, а также фаза репарации ДНК:
O processo de edição divide-se em duas etapas, sendo a primeira relacionada ao reconhecimento e clivagem da molécula de DNA e, a segunda, destinada ao reparo da mesma. Uma vez seccionados, os nucleotídeos são acionados mecanismo celulares endógenos, naturais de reparação do DNA. O processo de edição utiliza-se então, desses recursos, para promover modificações pretendidas. Assim, o reparo pode ocorrer por ligação das extremidades não homólogas (mecanismo útil quando se pretende silenciar a ação dos genes) ou também, por reparo dirigido por moldes. Nessa situação, é possível inserir, nas moléculas, juntamente com a ferramenta de edição, moldes de DNA externo. Assim, pode-se fornecer moldes externos contendo genes selecionados, ao novo seguimento de DNA a ser formado no local da clivagem (CLEMENTE, 2020, p. 15).
Понятно, что клетка имеет внутренние механизмы репарации, которые активируются через действие системы CRISPR-Cas9, где она использует такие средства для провоцирования изменений интереса, эти изменения могут происходить от плесени, вставленной в процесс, или от использования концов, уже присутствующих в ленте ДНК.
Обсуждаемая здесь методика была многообещающей из-за ее простоты, скорости и эффективности в генетических манипуляциях, как утверждает Клементе (2020), преимущества этой техники представляют собой настоящую революцию в лечении здоровья, особенно в отношении серьезных заболеваний наследственного происхождения, которые часто неизлечимы. Таким образом, создается положительное ожидание по отношению к новым терапевтическим альтернативам.
Применение редактирования генов у людей предлагает много преимуществ от более фундаментальных до более продвинутых исследований, позволяющих несколько улучшений для людей, среди инноваций можно привести: понимание дифференцировки клеток в процессе развития человеческого организма, функционирование определенных генов еще в эмбриональной фазе организма, понимание заболеваний генетического происхождения, обеспечение производства специфических препаратов таких патологий, достижения в генной терапии (лечение рака), среди других механизмов, которые все еще находятся в стадии исследования (CLEMENTE 2020).
Тем не менее, что касается приложений, стоит подчеркнуть генетическое редактирование новорожденных детей, состояния наследственных врожденных пороков развития, по крайней мере, 6% новорожденных детей имеют серьезные генетические проблемы, с помощью механизма CRISPR-Cas9 идентифицируются сегменты в ДНК, которые несут ответственность за возникновение таких патологий, поэтому можно обратиться за профилактическим лечением (CLEMENTE, 2020).
Преимущества по-прежнему относятся к физиологии иммунной системы. Многие гены напрямую связаны с устойчивостью некоторых особей к инфекционным возбудителям, идентификация этих участков в геноме означает распространение их преимуществ на другие организмы и содействие эффективной иммунизации. Подчеркивается, что такие процедуры уже являются реальностью (ORMOND et al., 2017).
2.3 ЗАЩИТА ГЕНЕТИЧЕСКОГО НАСЛЕДИЯ
Биотехнологические достижения растут и занимают все больше и больше места, что обучает необходимость содействия эффективной защите генома человека, направленной на сохранение будущих поколений (NAVES; GOIATÁ, 2017).
Такая защита подпадает под сложные темы, поскольку возникает много конфликтов, от экономических интересов до философских и религиозно-этических дискуссий, но широкий человеческий потенциал для применения технологических средств для модификации биологических систем требует надлежащего контроля, основанного на «регулировании и установлении конкретных мер по сохранению посредством надлежащего и сознательного использования биологических ресурсов» (NASCIMENTO; BRITO, 2021, с. 5).
Генетическому наследию соответствует любая «информация генетического происхождения растений, животных, микробов или других видов, включая вещества, полученные из метаболизма этих живых существ» (BRASIL, 2015), эта концепция была принята законом 13 123 от мая 2015 года, который регулирует конституционное положение о сохранении целостности генетического наследия, а также меры по охране генетического наследия и доступу к нему, установленные в Конвенции о биологическом разнообразии, которую было в одностороннем порядке предложено государствам подписать в ходе Конференции Организации Объединенных Наций по окружающей среде и развитию в 1992 году.
Таким образом, генетическое наследие – это любая наследственная единица, присутствующая в одиночных или многоклеточных организмах, а также вещества, возникающие в результате их метаболической деятельности. Поэтому их защита падает на гены животных, растения микроорганизмов и человека. Однако права и обязанности, предусмотренные в Законе о доступе к генетическому наследию, не распространяются на материалы человека, как описано в статье 4.
Таким образом, это правило не включает в себя правила, касающиеся доступа к генетическому наследию человека. Это оправдано руководящими принципами и запретами, предусмотренными Законом о биобезопасности, запреты которого сосредоточены на поведении, связанном с изменением эмбриональных клеток, клонированием и любой модификацией генетического материала in vivo в нарушение действующих норм (BRASIL, 2005).
Стоит подчеркнуть запреты делать акцент на модификации или манипуляции эмбриональными клетками, то есть репродуктивными клетками, однако существует пробел в отношении применения методов генетической модификации в соматических клетках, которые через процесс митоза отличаются формой тканей и других органов человека. Это тонко в рамках стандартов и нормативных стандартов, они могут быть подвергнуты процессам изменения генов.
Фактически, до нескольких лет не существовало никаких нормативных стандартов в отношении таких механизмов, однако Национальное агентство по надзору за здоровьем — Anvisa, регулируемое в 2018 году, через RDC No 260, правила клинического испытания продуктов передовых исследуемых методов лечения, включая генную терапию, согласно Anvisa (2018), это имеет в качестве биопродукта ДНК или рекомбинантную РНК, направленную на модификацию генетической экспрессии с этой целью. лечение, профилактическое или диагностическое лечение».
Таким образом, генная терапия, выполняемая в нерепродуктивных клетках человека, стала манипулируемой, но цель исключительно медицинская, терапия, которая подразумевает лечение или профилактику.
В этом контексте подчеркивается, что стандарт регулировал такие процедуры на экспериментальных уровнях «исследуемыми», по словам самой Anvisa (2018), «с целью доказательства безопасности и эффективности». Однако в 2020 году это же агентство зарегистрировало первую генную терапию в Бразилия для лечения спинальной мышечной атрофии — AME (NOVARTIS, 2020).
Учитывая, что биотехнологические приложения пронизывают все группы и царства живых организмов, субъект направлен на защиту генетического материала человека, который является объектом национальной защиты посредством вышеупомянутой безопасности и международных стандартов через систему защиты прав человека.
Права человека рассматриваются в соответствии с их аспектами защиты, простым образом мы говорим о правах первого измерения, которые защищают индивидуальные свободы, правах второго измерения, защита которых зависит от социальных прав, и третьем измерении, касающемся прав трансгендеров, однако четвертое измерение предусматривает права, связанные с вопросами биотехнологии, генная инженерия и ее этико-правовые последствия, несмотря на сохранение человеческой жизни (GORCZEVSKI, 2009).
Права человека четвертого поколения и их регулирование возникли в связи с новыми проблемами, возникающими в связи с технологическими и научными достижениями, с которыми до тех пор не сталкивались, однако они были совершенно предсказуемы, особенно те, которые имеют отношение к исследованиям генома человека и манипулированию им (NETO, 1998).
Так, предвидя последствия научно-технического прогресса в вопросах, касающихся генетических манипуляций, в 1997 году 29-я Генеральная конференция UNESCO приняла документ, предложенный Международным комитетом по биоэтике, который был задуман как «Всеобщая декларация генома человека и прав человека».
Всеобщая декларация генома человека и прав человека направлена на то, чтобы подчеркнуть достоинство человеческой личности перед лицом исследований, связанных с генетическим вмешательством, права лиц, проходящих лечение или диагностику, которые влияют на их геном, и установить пределы, которые должны соблюдаться странами, которые проводят такие исследования. В этом контексте в письме говорится, что «геном человека лежит в основе фундаментального единства всех членов человеческой семьи, а также признания присущего ей достоинства и разнообразия» (UNESCO, 1997 год).
Таким образом, охрана генетического наследия, предложенная ЮНЕСКО, предусматривает защиту человеческой индивидуальности, что соответствует научным аспектам ДНК, поскольку генетический материал универсально состоит из одной молекулярной структуры и выполняет одни и те же физиологические функции, однако является уникальным и исключительным кодом для каждого индивидуума. Даже если он несет информацию от своих асцендентов, он функционирует как текст, описывающий физические характеристики каждого человека. Это то, что связывает всю человеческую семью, при этом привнося оригинальность каждому человеку, как отпечаток пальца.
Таким образом, устройство признает генетическое содержание каждого человека достоянием, принадлежащим всему человечеству, разнообразие которого должно уважаться и признаваться, иначе оно нарушает принцип достоинства человеческой личности, который управляет каждым народом, основанным на демократическом режиме. В этом смысле Навес и Гойата (2017, стр. 03) согласны с тем, что «защита генетических данных человека — это защита самого генетического наследия и преемственность вида в достойных условиях».
Подтверждая вышеупомянутое правовое положение, оно избегает любой дискриминации по признаку генетического состава данного лица, так что такое нарушение наносит ущерб правам человека и другим основным свободам (UNESCO, 1997 год).
В этом аспекте Бразилия в соответствии с положениями о международной защите генома, большое письмо CF / 88, в статье 225 § 1, пункт II, возложила на государственные органы обязанность «сохранять разнообразие и целостность генетического наследия. страны и осуществляют надзор за организациями, занимающимися исследованиями генетического материала и манипулированием им » (BRASIL, 1988), однако вышеупомянутое правовое положение стало регулироваться с принятием закона о биобезопасности, который регулирует стандарты безопасности и действия с инструментами инспекции, включая генетически модифицированные организмы – OGM и их производные, и создает Национальный совет по биобезопасности – CNBS, а также реструктуризация Национальной технической комиссии по биобезопасности – CTNBio, предусматривает Национальную политику биобезопасности – PNB (BRASIL, 2005).
2.4 ОГРАНИЧЕНИЯ ГЕНЕТИЧЕСКОГО РЕДАКТИРОВАНИЯ У ЛЮДЕЙ ИЗ МЕТОДА CRISPR-CAS9
Охрана генетического наследия очень актуальна для того, чтобы делать правильные прогнозы через перспективы биотехнологии и генной инженерии, от самых архаичных механизмов геномного редактирования до самых современных и эффективных, открывших окно в будущее великих открытий и способности улучшать жизнь на Земле.
Однако следует отразить, что такое окно является обоюдоострым мечом, так как человек может использовать научные ресурсы на благо окружающей среды и здоровья человека, он также по его плану является альтернативой применения их только в экономических интересах, без измерения воздействий.
По-прежнему необходимо проверить тот факт, что по-прежнему существует полный контроль за операционализацией и результатами некоторых методов, как это наблюдается в случае использования механизма CRISPR-Cas9.
В этом смысле возможности, вытекающие из биотехнологических достижений, произвели революцию в способе рассмотрения генов, особенно в отношении научных и экономических аспектов, учитывая расширение исследований и валоризацию генетического содержания, которое в настоящее время признается в качестве фундаментальной части биотехнологических достижений (NASCIMENTO; BRITO, 2021).
Хотя метод генетического редактирования из механизма CRISPR-Cas9 оказался быстрым, эффективным и экономичным, в литературе сообщается о некоторых ограничениях, что, естественно, подразумевает риски или побочные эффекты.
Поэтому в научном контексте, из которого вытекают эксперименты и исследования, происходит представление противоречивых результатов в отношении вмешательств в отношении генетического материала.
Подчеркивается, что в научной сфере существуют два типа противоречий, которые являются внутренними, возникающими из-за неубедительных, неполных или слишком сложных вопросов; внешние, связанные с проблемами, оценочными суждениями, убеждениями, религиозными, философскими, культурными или этическими концепциями (HODSON, 2018). В этом измерении обсуждаются неубедительные или ошибочные результаты, которые связаны с неопределенностью научных экспериментов, а также их воздействием, особенно в отношении генетического редактирования у людей.
Согласно Томпсон et al., (2019) В некоторых экспериментах с эмбрионами, представленными на генетическое редактирование, произошло то, что можно назвать мозаицизмом, который является результатом ошибки в вырезании последующего интереса, такая ошибка может быть результатом двух возможностей, неудачного разрезания нуклеазой (Cas9, который выполняет расщепление) или из-за неправильного восстановления этого. Результатом является появление как минимум трех типов клеток, которые с генетическим материалом происхождения являются модифицированными мутациями и теми, которые были правильно изменены, то есть организм начинает иметь генетический состав, содержащий различные наборы ДНК.
В этом контексте этот эффект связан с лоскутным одеялом или мозаикой, намекая на «геномную фрагментацию» организма. Важно подчеркнуть наличие мутации в клетках, где не произошло восстановления, важно, чтобы большинство мутаций были удалены, то есть приводят к врожденным недостаткам генетического происхождения, таким как несколько синдромов.
Подчеркивается, что если мозаицизм может или не может произойти, экспрессия нежелательных генов, однако, оказавшись в составе индивида, существует вероятность его передачи будущим поколениям (CLEMENTE, 2020).
Еще один фактор, требующий осторожности и особой осторожности, – это возможность случайных модификаций «off-tarfegt», которые представляют собой случайные мутации, при которых фермент не попадает в разрезанную мишень, происходящую из-за неопределенного события в Cas9, что приводит к атипичным и непреднамеренным действиям (MARTI -GUITIERREZ et al., 2017).
Перед разоблаченным Ормонд et al. (2017) утверждают, что такие неудачи невелики ввиду способности техники вылечить множество заболеваний, негативные последствия которых являются определенными и разрушительными. И все же, появление непредвиденных результатов не является правилом, так как сама ДНК способна выдержать определенный уровень мутаций.
Из этого следует, что генетические манипуляции в ДНК человека не дали результатов со стопроцентной уверенностью о применении метода CRISPR-Cas9, что может привести к повреждению, такому как вредные мутации в других генах и другие неизмеримые изменения, поскольку сама наука не знает всей совокупности эффектов экспрессии генов.
Однако Ормон et al. (2017) утверждают, что в отношении in vitro редактирование генов не должно быть объектом препятствий, при условии, что оно находится под этическими юридическими протоколами и протоколами безопасности, такими как разрешение донора и соответствующий надзор. Вполне уместно еще, государственное финансирование таких исследований.
Что касается продолжения технических применений в зародышевых линиях человека с репродуктивным потенциалом, то следует рассмотреть по крайней мере четыре момента, а именно: «(a) убедительное медицинское обоснование, (b) доказательная база, подтверждающая его клиническое использование, (c) этическое обоснование и (d) прозрачный публичный процесс запроса и включения вклада заинтересованных сторон» (ORMON et al., 2017, с. 01).
Автор приходит к выводу, что ввиду научных вопросов, на которые до сих пор не получено ответов, редактирование генов в эмбриональной линии человека с репродуктивной способностью осуществляться не следует, такие практики совершенно неадекватны (ORMON et al., 2017).
Противоположная ситуация произошла в Китае в 2015 году, где группа исследователей под руководством ученого Цзюньцзю Хуан из Университета Сунь Ятсена провела исследования на человеческих эмбрионах с использованием метода CRISPR-Cas9 с целью исправления мутации, присутствующей в ген HBB, функция которого заключается в кодировании белка бета-глобина (LIANG et al., 2015).
Наиболее противоречивые события произошли в 2018 году, когда было объявлено о рождении близнецов Лулу и Наны, первых генетически модифицированных людей, где ученый Цзянкуй Хе использовал механизм CRISPR-Cas9 для изменения генов CCR5, сделав детей невосприимчивыми к вирусу ВИЧ (CÁRDENAS-KRENZ, 2018).
Согласно сообщениям новостей, ученый был осужден китайским правосудием, когда он предположил генетическое программирование другого ребенка, таким образом, даже без запретительных правил в отношении генетического редактирования человека, но с учетом общественного неодобрения, исследователь был приговорен к 3 года тюрьмы (JUNQUEIRA, 2019).
О таких спорах больше информации нет, Китай является крайне закрытой нацией. Поэтому нет никаких исследований или новостей о том, как такие дети, или как третий ребенок, выжил ли он или представил какую-либо аномалию.
2.5 ЭТИЧЕСКИЕ ПОСЛЕДСТВИЯ ГЕНЕТИЧЕСКОГО РЕДАКТИРОВАНИЯ У ЛЮДЕЙ
Что касается этических последствий, то неудача/ограничения/неудачи или даже успешное применение геномного редактирования из CRISPR-Cas9 порождают последствия (ORMON et al., 2017). В этом сценарии Сандель (2013, с. 84) предупреждает о неизбежном существовании дилемм и противоречий, поскольку есть технологические и научные достижения, но эволюция общества не происходит такими же темпами.
Что касается негативных аспектов, то они рассматриваются между воздействием на отдельных лиц вмешательств с вредным потенциалом в условиях неопределенности таких рисков преодоления преимуществ, как это происходит в случае редактирования человеческих эмбрионов, последствия которых все же будут определены (ORMON et al., 2017).
Решающий момент в этических дебатах относится к автономии людей, даже перед лицом успеха техники, согласно Ормон et al., (2017) такая технология оказывает серьезное влияние, создавая генетически модифицированное существо без их согласия.
На этом этапе необходимо учитывать, что родители являются наиболее подходящими людьми для принятия решения о жизни своих детей, однако это спорная тема, потому что она относится к генетическому составу кого-то, индивидуального существа, которое будет выражать свои генотипические характеристики и жить с ними вечно.
В этом измерении Хайден (2016) утверждает, что родители, в том числе, уже осуществляют огромный контроль над своими детьми, например, возможность генетического скрининга во время дородового ухода, где можно проверить возникновение аномалий в ДНК, как в случае трисомии 21 – синдрома Дауна, а также в отношении выбора принятия или немерсти беременности до конца, как и в некоторых странах.
В этом контексте выросло число движений, выступающих против этого контроля, как и тех, кто считает само зачатие аморальным актом, для того, чтобы вызвать к жизни кого-то, кто никогда не просил родиться, по словам бенате (2015, с. 60), главного защитника идеи, деторождение может показаться чем-то невинным, но на самом деле это очень вредно, потому что рожденный ребенок является мишенью всех бед и ужасных вещей, которые могут произойти, Хотя не каждый будет страдать от больших ужасов, никто не свободен от серьезного вреда, лучший способ защитить ребенка от ужасных вещей жизни – не иметь их.
К этому добавляется тот факт, что есть сообщения о людях, которые, несмотря на то, что у них есть редкие и «невыгодные» генетические состояния, такие как альбинизм и ннизм, заявляют, что они не хотели бы, чтобы их генетическое содержание было изменено, чтобы стать нормальными людьми (HAYDEN, 2016).
Существует также возможность вмешательства путем выбора генов, экспрессивляющих патологические состояния, как утверждает Сандель (2013, с. 86), автор сообщает случай пары глухих женщин, которые через вспомогательную репродукцию позволили зачать ребенка также глухим, такой интерес заключался в защите того, что глухота не была бы профилактивным состоянием жизни, как любая другая. На самом деле ребенок родился с глухотой.
По-прежнему остается большая дилемма относительно ограничений генетического редактирования для лечения состояний, считающихся ненормальными по здравому смыслу, согласно Хайден (2016), многие глухие люди не считают свое состояние болезнью или инвалидностью, даже отрицая такие вмешательства, как кохлеарные имплантаты, а также избегая лечения своих глухих детей.
Подтверждая, Lamphier et al. (2015) указывает, что помимо рисков, связанных с евгеникой, существуют проблемы, связанные с возможным повреждением самой родословной человека, поскольку изменение генетического материала подразумевает наследственный перенос признаков, то есть необратимую модификацию человека и его потомков.
Кроме того, Хабермас (2016) добавляет беспокойства к этическому самопониманием вида, то есть субъективным и экзистенциальным аспектам человека, который был генетически отредактирован по суждению других.
Вышеупомянутый автор посвятил себя постановке вопроса и окружению нарушения самоопределения индивидов, несмотря на явную уверенность в том, что эмбрион не имеет волевого характера, он находится в полном развитии и станет существом, наделенным ценностями, тоской и наоборот, говоря тем же, это евгеническое вмешательство «ограничивает автономную конфигурацию жизни индивида и подрывает принципиально симметричные отношения между свободными и равными людьми» (HABERMAS, 2016, с. 15).
Существует явный и примечательный конфликт в этом биотехнологическом процессе с благоприятностью биоэтики, среди которых можно упомянуть принцип автономии, согласно Mалуф (2020, стр. 155), связан со способностью самоуправления индивидов. Вмешательство в гены эмбрионов, пригодных для размножения, означало бы, в пределах бразильских этических и правовых ограничений, нарушение этого принципа.
Еще одним принципом «под прицелом» генетического редактирования является само достоинство человеческой личности, для Mалуф (2020, с.155) это в гармонии с принципом святости, они предвидят защиту человеческой жизни во всем ее измерении.
В этой точке настройки важно обсудить полемику вокруг возникновения личности, которая, согласно Bенозный (2007, стр. 230), в бразильской правовой системе полезна для поднятия прав каждого индивида, на эту тему излучают расхождения вокруг будущего ребенка.
Это противоречие сохраняется из-за прочтения статьи 2 Гражданского кодекса 2002 года, где говорится, что личность человека начинается через рождение с жизнью, однако закон поддерживает права нерожденного ребенка (BRASIL, 2002). По этим пунктам подчеркивается, что это права в гражданской сфере, в то время как закон сохраняет любое право будущего ребенка.
Однако определение будущего ребенка не укладывается в то, что пока является только эмбрионом, ведь зачатый и не родившийся соответствует эмбриону после нидации, то есть после фиксации во внутренней стенке матки. Таким образом, о правах эмбрионов не идет речь, однако Тартус (2015) указывает на важность законодательства, скрывающего прогноз о таких технологиях.
В этом пути настройки Cervi задает вопросы,
(…) diante das inovações biotecnológicas de edição genética embrionária, seria possível promover uma interpretação acerca de intimidade e identidade e dos direitos da personalidade em um momento até mesmo anterior ao nascimento com vida, ou antes, à própria consideração de ser o embrião nascituro? (CERVI, 2019, p. 13).
В условиях такого пробела автор выступает за переформулирование правовых норм в соответствии с неизбежными современными требованиями с целью защиты закрепленного принципа человеческого достоинства (CERVI, 2019).
Делается вывод, что этические и культурные ценности связаны с каждым народом и нацией, в то время как человеческая сущность и состав человека объединены, в этом смысле Родота (2010) индуцирует о возможности редактирования человеческих эмбрионов, которые получают физическое тело, спроектированное в соответствии с определением кого-то, унижает права человека.
2.5.1 ВОПРОСЫ, СВЯЗАННЫЕ С ЕВГЕНИЕЙ
Взгляд и очарование перспектив исцеления от генетического редактирования вызывают беспокойство даже перед лицом возможных вмешательств, направленных на скрытые интересы, основанные на культурных аспектах, учитывая, что контроль техники используется при выборе физических характеристик, таких как как рост, цвет глаз, волосы, форма лица и т. д. (CERVI, 2019).
Таким образом, опасения обращаются к рискам евгенических практик, учитывая интерес человека здесь, который прекрасен и далек от ненормального или уродливого, для Cervi (2019) стремление к красоте и молодости всегда сопровождало человека, являясь доказательством этого, его потребность выражать совершенство в произведениях искусства, а также проверяется в литературных повествованиях при описании характеристик молодых и привлекательных персонажей.
Проще говоря, евгеника заключается в отборе особей по их генетическим характеристикам с целью улучшения потомков, которые родятся. Относительно генетического редактирования Ормон et al. (2017) предупреждает о возможности его использования для выбора характеристик, выходящих за рамки терапевтических интересов.
Для Боббио (2016) концепция, разработанная в Англии в девятнадцатом веке, объединяет теории наследственности расовых биологических веществ и подрывную интерпретацию естественного отбора, предложенную Чарльзом Дарвином, согласно которой выживет наиболее приспособленный, то есть тот, у кого лучшие генетические характеристики выживут. По словам индоктринатора, такие теории породили практики, ошибочно применяемые в расистских политических контекстах: там, где проповедовалось расовое очищение.
В зависимости от этого наблюдения, Ормон et al., (2017) в любом отношении евгеника является опасной практикой, усиливающей предрассудки, вытекающие из определения того, что было бы нормальным или приемлемым в обществе, как это исторически происходило, улучшением ДНК человека, без терапевтической цели, связанной с генетической детерминицией, которая, поддерживаемая государством, порождала катастрофические последствия.
Поэтому генетическое улучшение никогда не должно использоваться для усиления предрассудков стереотипов, особенно зная, к чему может привести вера в превосходство расы, как это произошло в нацистской Германии, где считалось, что арийская раса за превосходство над другими должна доминировать, в этом отношении Cervi (2019, стр. 05) заявляет «претензии на этнические чистки и поощрение чистой расы и арийской красоты, это породило к его неудаче много печали, отчуждения, страданий и смерти, а также чувство стыда».
Таким образом, возможность евгенических практик порождает опасения по поводу возможного отбора индивидов и их характеристик в качестве определяющего паттерна, который приведет к потере человеческого разнообразия.
2.5.2 СОЦИАЛЬНЫЕ ПОСЛЕДСТВИЯ
В этических тупиках генетического редактирования человека стоит кратко обсудить социальные последствия в возможном сценарии индивидов, характеристики которых были ранее выбраны и искусственно определены.
Уведомимо, что метод ограничен протоколами, которые препятствуют его применению, но в возможной реальности, в которой его реализация регулируется, Ормон et al. (2017) предупреждают, что социальные последствия являются одним из наиболее важных моментов, учитывая успех, потому что он, вероятно, еще больше устратит социальное неравенство, с которым уже сталкивается сегодня.
Подчеркивается, что даже немного более сложные медицинские процедуры часто ограничиваются теми, кто может иметь хорошие количества, такие как вспомогательная репродукция, согласно Cervi (2019) биотехнологические процедуры применения в области здравоохранения возможны для небольшой группы людей, и нет никаких перспектив вокруг широкого доступа к лучшим лечебным методам лечения.
Поэтому возникает вопрос Зингера (2017, с.135) «что будет с теми, у кого нет денег, чтобы пойти в генетический супермаркет? Будут ли твои дети предопределены к посредственности?»
Конечно, каждый человек ищет лучшее для себя и своего, известно, что человек не измеряет усилия, чтобы искать то, что дает ему качество жизни и безопасность. То, что когда-то казалось утопическим, сегодня не так далеко, но что касается и без того маргинализированных, то будущее остается чреватым неопределенностью.
Согласно Зингера (2017) в этой логике, рынок генов может благоприятствовать тем, кто обладает большей покупательной способностью, чтобы вставить в генетическую родословную своих потомков гены, кодирующие характеристики, которые могут способствовать интеллекту, способности к практике определенных видов спорта, среди прочих (SINGER, 2017). Автор также ссылается на исключение «генетической лотереи» для обозначения возможных воздействий, вызванных искусственным выбором желаемых качеств.
3. ОКОНЧАТЕЛЬНЫЕ СООБРАЖЕНИЯ
Настоящее исследование было направлено на то, чтобы привнести междисциплинарный подход, оценивающий основные научные, этико-философские и правовые последствия, вызванные генетическим редактированием у людей от метода Crispr-Cas9, такой биотехнологический механизм генной инженерии открыл новые прецеденты в отношении лечения и борьбы с патологиями человека, которые до сих пор считались непреодолимыми. Таким образом, он рассматривает его как неизбежную технологию в постмодерне.
Тем не менее, вселенная возможностей проистекает из применения генетических манипуляций через систему CRISPR-Cas9, которая насторожила научное сообщество, поскольку она оказывается эффективной, доступной и быстрой, но эксперименты все же приносят другие неубедительные результаты перед лицом возможных ошибок в работе инструмента, которые могут привести к непредсказуемым и вредным последствиям для организма.
Он также связан с использованием теневых целей, таких как генетическое улучшение человека, практика, яростно опровергнутая для пробуждать евгенические идеалы, которые в прошлом приводили к реальным катастрофам под оправданием веры в высшие расы.
Учитывая очевидную трудность человека в соблюдении пределов, необходимых для сбалансированного использования экологических ресурсов, направленных на экологически сбалансированную окружающую среду. Были опасения по поводу социального неравенства, которое может вызвать техника такого масштаба, поскольку такие процедуры, безусловно, будут полностью дорогостоящими, что приведет к большей сегрегации среди людей, чьи родители смогли заплатить за желательные генетические характеристики и предрасположенность, по сравнению с людьми, зачатыми в рамках генетической лотереи.
Среди вопросов, связанных с правовой охраной, которые вращаются вокруг этой темы, установлено, что генетический состав каждого индивидуума является достоянием всей человеческой семьи, как это предусмотрено организациями международной защиты, которые считают его неприкосновенным достоянием, необходимым для поддержания принципа достоинства человеческой личности, и никогда не может быть использовано в целях сегрегации.
Охрана генетического наследия также прогнозируется на национальном уровне, с тем чтобы запретить любые манипуляции с генетическим материалом человека, такие как процедуры, связанные с клонированием и человеческими эмбрионами. Интерпретируется, что запрет распространяется на методы редактирования, связанные с системой CRISPR-Cas9. Стоит упомянуть о недавнем регулировании генной терапии на экспериментальном уровне, регулирующая ответственность которого лежит на Национальном агентстве по надзору за здоровьем – Anvisa.
Перед лицом будущего с неизбежным совершенствованием и совершенствованием биотехнологических механизмов сохраняется нормативно-правовая необходимость в отношении такой практики, уделяя особое внимание соображениям биоэтики как вопросу, который направлен на установление правильных средств применения процедур, связанных с окружающей средой и здоровьем человека, все больше укрепляя биоправние и принципы, которые его регулируют.
ИСПОЛЬЗОВАННАЯ ЛИТЕРАТУРА
AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA – ANVISA. Resolução da Diretoria Colegiada – RDC Nº 260, de 21 de Dezembro de 2018. Dispõe sobre as regras para a realização de ensaios clínicos com produto de terapia avançada investigacional no Brasil, e dá outras providências. Disponível em:< https://www.in.gov.br/materia/-/asset_publisher/Kujrw0TZC2Mb/content/id/57218930/do1-2018-12-28-resolucao-da-diretoria-colegiada-rdc-n-260-de-21-de-dezembro-de-2018-57218634> Acesso em 17 jun 2021.
AMABIS, J. M.; MARTHO, G. R. Biologia das células. v. 1. São Paulo: Moderna, 2010.
BOBBIO, N. Dicionário de Política. Brasília: Universidade de Brasília, 2016.
BRASIL. Constituição da República Federativa do Brasil de 1988. Disponível em: < http://www.planalto.gov.br/ccivil_03/Constituicao/Constituicao.htm>. Acesso em 28 jan 2021.
BRASIL. Lei Nº 11.105, de 24 de Março de 2005. Disponível em:< http://www.planalto.gov.br/ccivil_03/_Ato2004-2006/2005/Lei/L11105.htm>. Acesso em 28 jan 2021.
BRASIL. Lei nº 13.123, de 20 de maio de 2015. Regulamenta o inciso II do § 1º e o § 4º do art. 225 da Constituição Federal, o Artigo 1, a alínea j do Artigo 8, a alínea c do Artigo 10, o Artigo 15 e os §§ 3º e 4º do Artigo 16 da Convenção sobre Diversidade Biológica, promulgada pelo Decreto nº 2.519, de 16 de março de 1998; dispõe sobre o acesso ao patrimônio genético, sobre a proteção e o acesso ao conhecimento tradicional associado e sobre a repartição de benefícios para conservação e uso sustentável da biodiversidade; revoga a Medida Provisória nº 2.186-16, de 23 de agosto de 2001; e dá outras providências. Brasília, 20 de maio de 2015. Disponível em:< http://www.planalto.gov.br/ccivil_03/_ato2015-2018/2015/lei/l13123.htm> Acesso em 16 jun 2021.
BRITO, N. B. V., Nascimento, S. M. C. Herança da vida: reflexões ético-jurídicas acerca do Patrimônio Genético. Brasil, Editora Dialética, 2021.
BOEL, Annekatrien et al. BATCH-GE: Batch analysis of Next-Generation Sequencing data for genome editing assessment. Scientific reports, v. 6, n. 1, p. 1-10, 2016. Disponível em:< https://www.nature.com/articles/srep30330>. Acesso em 01 jun 2021.
CERVI, T. M. D. Dorian Gray Na Moldura Do Século Xxi: Reflexões Jurídicas Em Edição Genética Embrionária. RJLB, Ano 5 (2019), nº 3. Disponível em:< http://www.cidp.pt/revistas/rjlb/2019/3/2019_03_1703_1721.pdf> Acesso em 19 jun 2021.
CLEMENTE, G. T. Avanços e desafios na edição gênica em seres humanos. In NICOLETI, C. E. et al. Biodireito, Bioética e Filosofia em Debate. Almedina, São Paulo. 2020.
Conferência Geral da Organização das Nações Unidas para a Educação, Ciência e Cultura (UNESCO) 29.ª sessão. Declaração Universal do Genoma Humano e dos Direitos Humanos. 11 de novembro de 1997.
GORCZEVSKI, C. Direitos humanos, educação e cidadania: conhecer, educar, praticar. Santa Cruz do Sul: Edunisc, p. 16, 2009.
HABERMAS, J. O futuro da natureza humana. Tradução de Karina Jannini. 2ª ed. São Paulo: WMF Martins Fontes, 2016.
HAYDEN, C. E. Should you edit your children’s genes?. Nature News, v. 530, n. 7591, p. 402, 2016.
HODSON, D. Realçando p papel da ética e da política educação científica. In: Dália Melissa Conrado, Nei Nunes-Neto. Questões sociocientíficas: fundamentos, propostas de ensino e perspectivas para ações sociopolíticas. Brasil, Editora da Universidade Federal da Bahia, 2018.
JUNQUEIRA, D. China confirma o nascimento de terceiro bebê geneticamente modificado. Olhar Digital. Disponível em:< https://olhardigital.com.br/2019/12/31/ciencia-e-espaco/china-confirma-nascimento-de-terceiro-bebe-geneticamente-modificado/> Acesso em 19 jun 2021.
LAMPHIER, E. et al. Don’t edit the human germ line. Nature, v. 519, p. 410-411, mar. 2015. Disponível em:< https://www.nature.com/news/don-t-edit-the-human-germ-line-1.17111> Acesso em: 03 de mai 2021.
MALUF, A. C. R. F.D. Curso de bioética e biodireito. 3ª ed. Atlas. São Paulo. 2015.
NAVES, B. T. O.; GOIATÁ, S. R. Direitos Humanos, patrimônio genético e dados genéticos humanos: crítica à doutrina dos dados genéticos como interesse difuso. Revista de bioética y derecho, n. 40, p. 63-81, 2017.
NETO, F. V. L. Direitos humanos de 4ª Geração. DHNET, 1998. Disponível em < http://www.dhnet.org.br/direitos/textos/geracaodh/4_geracao.html> Acesso em 22 de mai de 2021.
NOVARTIS. Aprovado o registro da primeira terapia gênica para AME no Brasil. 18 Agosto 2020. Disponível em:< https://www.novartis.com.br/news/aprovado-o-registro-da-primeira-terapia-genica-para-ame-no-brasil> acesso em 17 jun 2021.
ORMOND, K. E. et al. Human germline genome editing. The American Journal of Human Genetics, v. 101, n. 2, p. 167-176, 2017.
REIS, É. V. B.; OLIVEIRA, B. T. Crispr-Cas9, Biossegurança E Bioética Uma Análise Jusfilosófica-Ambiental da Engenharia Genética. Veredas do Direito: Direito Ambiental e Desenvolvimento Sustentável, v. 16, n. 34, p. 123-152, 2019.
RODOTÁ, Stefano. La vida y las reglas: entre el derecho y el no derecho. Traduzido por Andrea Greppi. Madrid: Edi-torial Trotta, 2010.
SCARMANHÃ, B. O. S. G. SILVA, M. F. GARÉ, C. C. T. Os avanços biotecnológicos e da engenharia genética: sob a perspectiva da reprodução humana assistida e seus reflexos no direito de família. RJLB, Ano 5 (2019). Disponível em:< http://www.cidp.pt/revistas/rjlb/2019/3/2019_03_0259_0279.pdf> Acesso em 11 jun 2021.
SANDEL, M. Contra a perfeição: ética na era da engenharia genética. Rio de Janeiro: Civilização Brasileira, 2013.
SANDER, J. D.; JOUNG, J. Keith. CRISPR-Cas systems for editing, regulating and targeting genomes. Nature biotechnology, v. 32, n. 4, p. 347, 2014.
SINGER, P. Ética no mundo real: 82 breves ensaios sobre coisas realmente importantes. Traduzido por Desidério Murcho. Lisboa: Edições 70, 2017.
TARTUCE, F. Manual de Direito Civil. Vol. Único. 5ª Edição. Editora Método. São Paulo. 2015.
THOMPSON, Deborah J. et al. Genetic predisposition to mosaic Y chromosome loss in blood. Nature, v. 575, n. 7784, p. 652-657, 2019. Disponível em:< https://www.nature.com/articles/s41586-019-1765-3> Acesso em: 18 jun 2021.
VENOSA, S. S. Direito Civil-Parte Geral. 7 ed. São Paulo (SP): Atlas, 2007.
VILLAR, L. P. Empieza el primer proyecto de modificación genética de embriones humanos. Reproducción Asistida ORG. 2020. Disponível em: <https://www.reproduccionasistida.org/autorizacion-de-modificacion-de-embriones/> Acesso em: Acesso em 11 jun 2021.
[1] Академик курса бакалавриата права. ORCID: https://orcid.org/0000-0002-0096-7153
[2] Бакалавр права. ORCID: https://orcid.org/0000-0001-7902-079X
[3] Консультант по ориентации.
Представлено: Cентябрь 2021 года.
Утвержден: Cентябрь 2021 года.