RODRIGUES, Camila Cristine Torres dos Reis [1], ARAÚJO, Graziela [2]
RODRIGUES, Camila Cristine Torres dos Reis; ARAÚJO, Graziela. Alterações Sistêmicas Associadas à Circulação Extracorpórea (CEC). Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano 03, Ed. 05, Vol. 02, pp. 36-54, Maio de 2018. ISSN:2448-0959
Resumo
Introdução: A circulação extracorpórea (CEC) possibilitou novas curas em doenças cardíacas, contudo existem complicações que podem ser desencadeadas durante ou após a cirurgia. Objetivo: Relacionar as principais desordens sistêmicas associadas à circulação extracorpórea; identificando os principais distúrbios hematológicos; definindo as alterações imunológicas do paciente e correlacionando as implicações renais e pulmonares. Materiais e Métodos: Trata-se de uma revisão da literatura utilizando bases de dados científicos da SciELO, LILACS e PUBMED abrangendo publicações nacionais e internacionais no período de 1993 à 2014. Resultados e discussão: Apesar de toda modernidade o organismo reconhece o sistema da CEC como estanho, gerando uma resposta imunológica que pode evoluir rapidamente para uma Síndrome da Resposta Inflamatória Sistêmica (SIRS) e também uma resposta hematológica através da coagulação sanguínea, sendo essencial anticoagular o paciente para evitar trombose durante a cirurgia com CEC, ao tempo, que no pós-operatório, o paciente fica suscetível à hemorragia por diversos fatores. Problemas renais e pulmonares são comumente observados após a CEC devido uma multiplicidade de fatores, sendo que alguns casos evoluem rapidamente para Insuficiência Renal Aguda (IRA), enquanto a disfunção pulmonar continua sendo a maior causa de morbidade pós-operatória. Considerações finais: A CEC deve ser usada quando for a única forma de recurso operatório para pacientes cardíacos, pois existem severas complicações associadas a esta técnica que aumentam as taxas de morbidade e mortalidade. Entretanto, há uma complexa inter-relação do procedimento cirúrgico, da anestesia e da CEC que dificulta atribuir todas as complicações ao uso exclusivo da CEC.
Palavras-Chaves: Perfusão Extracorpórea, Coração-Pulmão, Complicações Sistêmicas.
Introdução
A cirurgia cardíaca juntamente com a circulação extracorpórea desde o século XX foi umas das maiores conquistas na área da saúde, pois trouxe um grande avanço na medicina, diminuindo significativamente o número de óbitos e trazendo a possibilidade para novas curas em doenças cardíacas 16.
Em 1953, John H. Gibbon realizou a primeira cirurgia cardíaca com sucesso utilizando a técnica de circulação extracorpórea (CEC). Esse procedimento tem por finalidade assumir a função temporária do coração e pulmão quando o paciente passa por um processo cirúrgico cardíaco. Assim, um conjunto de máquinas, aparelhos e circuitos mantém a circulação do sangue ativo, enquanto esses órgãos ficam excluídos da circulação43.
De acordo com Lima23 (1997), nem todos os pacientes submetidos à cirurgia cardíaca utilizam a técnica da circulação extracorpórea, pois embora seja um método que melhorou bastante nos resultados, sabe-se que certos inconvenientes ainda existem, como: reação inflamatória, hemodiluição, acidente vascular cerebral, morbidade diversa, além do aumento dos custos. Portanto, quando possível, utilizam-se outras técnicas sem o auxílio da CEC para menor agressão ao paciente.
Com o surgimento da CEC, apareceram novos estudos ligados a uma fisiologia diferenciada. Entretanto, estes conhecimentos beneficiaram não só as cirurgias cardiovasculares, mas também todas as especialidades, obtendo conceitos para os cuidados dos pacientes durante a realização cirúrgica e incluindo o subsequente período pós-operatório17.
Infelizmente, uma das principais características dos pacientes submetidos à cirurgia cardíaca com CEC é a facilidade dos sistemas orgânicos serem afetados por alterações da função do sistema cardiovascular. Uma variedade de complicações pode ocorrer após a cirurgia do coração, em frequência são encontradas: hemorragias, disfunção respiratória, baixo debito cardíaco, disfunção renal, alterações neurológicas e infecções43.
Dessa forma, o objetivo deste trabalho foi relacionar as principais desordens sistêmicas associadas ao uso da circulação extracorpórea; identificando os principais distúrbios hematológicos; definindo as alterações imunológicas do paciente e correlacionando as implicações renais e pulmonares do paciente à circulação extracorpórea.
Materiais e Métodos
Trata-se de uma revisão da literatura com levantamento bibliográfico utilizando bases de dados científicos da SciELO, LILACS e PUBMED. Os artigos encontrados foram lidos e selecionados, abrangendo publicações nacionais e internacionais no período de 1993 à 2014.
Os descritores usados para a busca foram: perfusão extracorpórea, coração/pulmão, alterações sistêmicas.
REFERENCIAL TEÓRICO
Circulação Extracorpórea (CEC)
Durante a CEC, as funções de bombeamento do coração são desempenhadas por uma bomba mecânica e as funções dos pulmões são substituídas por um aparelho capaz de realizar as trocas gasosas com o sangue20.
Neste contexto, para entendimento das complicações sistêmicas relacionadas a este procedimento faz-se necessário a compreensão básica sobre o circuito do sangue durante a circulação extracorpórea.
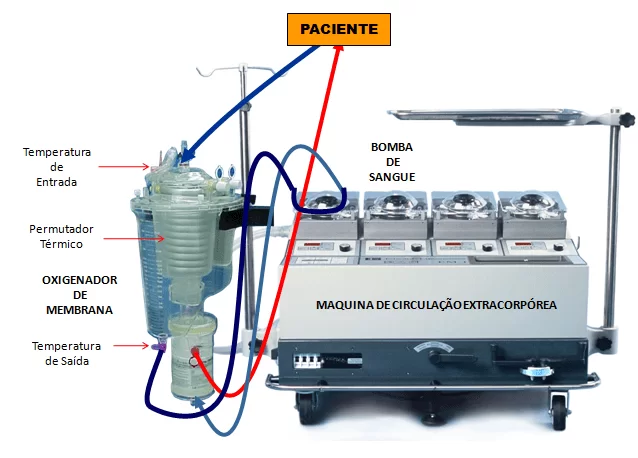
Assim, na CEC, o sangue venoso é desviado do coração e dos pulmões ao chegar ao átrio direito do paciente, através de cânulas colocadas nas veias cavas superior e inferior. Por uma linha comum, o sangue venoso é levado ao oxigenador, reservatório feito de membranas semipermeáveis para separação do sangue do oxigênio e realização das trocas gasosas8.
Do oxigenador, o sangue é bombeado para um ponto do sistema arterial do paciente, geralmente a aorta ascendente, de onde percorre o sistema arterial e é distribuído a todos os órgãos, cedendo oxigênio aos tecidos para a realização dos processos vitais, e recolhendo o dióxido de carbono neles produzido. Após circular pelo sistema capilar dos tecidos, o sangue volta ao sistema das veias cavas superior e inferior, onde será continuamente reconduzido à máquina de CEC até o fim da cirurgia14.
Para a realização de cirurgias cardíacas com CEC alguns procedimentos foram adotados ao longo da história para obtenção de melhores, como a hipotermia, o uso de soluções cardioplégicas e a hemodiluição.
A hipotermia foi associada à circulação extracorpórea com o objetivo de reduzir as necessidades metabólicas dos pacientes e, portanto, o seu consumo de oxigênio, oferecendo proteção adicional ao organismo, especialmente aos órgãos vitais, evitando lesões por anóxia7. Atualmente, é empregada a hipotermia central que é induzida pelo resfriamento do sangue com água gelada no permutador térmico do oxigenador, assim através da circulação do sangue frio nos órgãos ocorre o resfriamento dos mesmos. A reversão da hipotermia, ou seja, o reaquecimento do paciente se obtém circulando água morna no permutador de calor43.
As soluções cardioplégicas, ricas em potássio, são usadas para impedir lesões do miocárdio, levando à parada quase instantânea do coração, sem consumo de energia. Alia-se, portanto, para proteção do miocárdio o uso criterioso de soluções cardioplégicas e a hipotermia, para que, após o processo cirúrgico, ocorra à volta ao estado normal da homeostase metabólica7.
Antes do início da CEC, para preencher o reservatório do oxigenador e os demais componentes do circuito, processo conhecido como desareação, usam-se soluções não celulares, de solutos cristalóides ou colóides (chamado de perfusato ou prime), dessa forma, ocorre uma diluição do sangue. Estudos mostraram que esta hemodiluição melhora a oxigenação obtida durante a perfusão, reduzindo a quantidade total de sangue necessária a cada paciente, durante e após a operação, preservando um maior número de plaquetas, além de reduzir as perdas sanguíneas pós-operatórias3.
Complicações Sistêmicas Pós CEC
A circulação extracorpórea devido à multiplicidade de componentes mecânicos e interações com o sangue produz várias alterações no organismo humano que geram grandes desvios da fisiologia, seja logo após a saída da perfusão ou no início do pós-operatório 31, 50.
Apesar de toda modernidade da aparelhagem em uso, quanto maior o tempo de CEC, maiores serão as chances de ocorrerem complicações. Além disso, as condições intrínsecas como idade, peso, uso de medicações, doenças de base, entre outros, podem comprometer o estado de saúde final do paciente. Sabe-se, por exemplo, que pacientes idosos e crianças com idade inferior a três meses tem piores prognóstico, já que estão em maior risco para a hipotermia, pois crianças pequenas são mais propensas à dispersão do calor e nos idosos anestesiados o limite para vasoconstrição está no nível de temperatura mais baixa que em adultos mais jovens24.
Cleveland13 et al., (2001) relataram uma mortalidade de 2,9% em cirurgias com CEC e 2,3% sem CEC, além disso, pacientes operados sem CEC apresentaram 10,6% de complicações, comparado com 14% dos operados com CEC.
Uma variedade de complicações pode ocorrer, após a cirurgia do coração e dos grandes vasos, algumas relacionadas ao manuseio anestésico, outras relacionadas à cirurgia e outras relacionadas à circulação extracorpórea. Com frequência, é difícil atribuir uma determinada complicação a um procedimento específico, em função da inter-relação dos procedimentos na sala de operações. Salienta-se, portanto, que as complicações mais frequentemente encontradas são as complicações imunológicas, hematológica, pulmonares, e renais16.
Distúrbios Hematológicos
As disfunções hemorrágicas relacionadas à CEC invariavelmente esbarram-se nas alterações da coagulação sanguínea, uma vez que o sangue circula através de tubos e aparelhos que são superfícies não endotelizadas. E, apesar de serem utilizados materiais compatíveis, ainda assim constituem superfícies estranhas, capazes de estimular simultaneamente, em maior ou em menor grau, os sistemas de coagulação e imunológico36.
Ocorre, portanto, um desequilíbrio da hemostasia sanguínea, sendo que durante a CEC o mais comum é a ocorrência de eventos trombóticos, enquanto que após a CEC geralmente são relatados quadros de sangramento.
Assim, durante a CEC, as vias extrínseca e intrínseca da cascata da coagulação serão ativadas, a primeira através do contato do fator XII à superfície artificial e a segunda pela liberação do fator tecidual (FT), ambas culminando na formação de coágulo.
Além disso, quando o sangue é aspirado do campo cirúrgico e retornado ao circuito extracorpóreo, ocorre uma série de outros elementos, tais como: fragmentos de coágulos e/ou gordura, tromboplastina tissular, e resíduos de materiais, aumentando o risco para trombose29.
A CEC induz ainda a alteração da fibrinólise com diminuição na formação da plasmina, o que favorece ainda mais o surgimento de trombos36. Dessa forma, a associação destes fatores indicam a importância da heparinização do paciente logo no início da perfusão, a fim de evitar a coagulação sanguínea, impedindo-se os eventos trombóticos9,36.
O anticoagulante heparina é o mais utilizado para essa finalidade, porque tem poucos efeitos colaterais, sem inconvenientes e existe um antídoto específico, a protamina, que é usado ao final da perfusão para neutralizar o efeito anticoagulante da heparina, pois o sangramento pós-cirúrgico pode ocorrer devido o efeito hemorrágico da heparina. É válido mencionar que a simples neutralização da heparina circulante mediante a administração de doses adequadas de protamina restaura a atividade hemostática apenas de forma parcial, não sendo capaz de recuperar imediatamente as funções hemostáticas dos pacientes submetidos à CEC45.
Por outro lado, há várias causas para o sangramento pós CEC, tais como: hemodiluição, consumo dos fatores de coagulação, alteração quantitativa e qualitativa das plaquetas, hipotermia, resposta imune do hospedeiro na formação do complexo heparina-protamina e hemostasia cirúrgica inadequada. Alguns pacientes necessitam, portanto, de re-intervenção devido o sangramento no início do pós-operatório e muitas vezes não pode ser identificada a causa do sangramento na cirurgia 1, 28.
O paciente durante e após a CEC pode desenvolver trombocitopenia devido diversos fatores, tai como: deposição de plaquetas nas superfícies internas dos tubos, oxigenadores e filtros; resultado da ação da heparina utilizada para a anticoagulação; redução da capacidade de agregação devido o contato com as superfícies não endoteliais dos circuitos e aparelhos; efeito dilucional sobre as plaquetas devido à hemodiluição; além do sequestro de numerosas plaquetas pelo baço e fígado27.
Segundo Ascione2 et al. (2001), em estudos prospectivos com grupos aleatórios de baixo risco pré-operatório, foi encontrado quadro de sangramento 1,6 vezes maior no grupo com circulação extracorpórea do que no sem circulação extracorpórea. Ainda foi indicado que menos de 20% dos pacientes sem CEC necessitaram de transfusão sanguínea, comparado a mais da metade do grupo com CEC.
Outros estudos mostraram que a revascularização do miocárdio (RM) sem circulação extracorpórea apresenta vantagens em relação à RM com circulação extracorpórea, em relação ao menor sangramento no pós-operatório e menor necessidade de transfusão de concentrado de hemácias, minimizando os fatores mórbidos e custos hospitalares1,2. Por isso, atualmente, nas cirurgias de RM estão sendo feitas sem CEC.
Sabe-se que aproximadamente cerca 10 a 20% dos pacientes que se submetem a CEC apresentam sangramento excessivo logo após a cirurgia, ou seja, cerca de 5 a 10% necessitam nas primeiras horas logo após a cirurgia de reposição sanguínea6.
De acordo com Souza43 et al. (2006) a complexa interação de diversos fatores (hemodiluição, hipotermia, trauma da perfusão, interação das plaquetas com as superfícies não endoteliais, deposição do fibrinogênio nas cânulas, redução do número e da atividade das plaquetas circulantes e liberação de um número de substâncias ativadoras das plaquetas) favorecem a ocorrência dos distúrbios da hemostasia e da coagulação.
Além das próprias alterações hemorrágicas citadas, a CEC promove também hemólise das hemácias devido principalmente o desvio da circulação normal pelo uso de cânulas quem formam centros de turbulência e também pela calibragem inadequada das bombas de roletes do sistema. Contudo, para equipes cirúrgicas que utilizam o reservatório de cardiotomia ou sistema de sucção cardiotômica, responsável por aspirar o sangue extravasado no campo operatório, esta prática constitui a maior causa de hemólise, pois quando o ar é aspirado com sangue através do aspirador ocorrem danos às células vermelhas11,51.
A hemólise acentuada culmina em quadros de hemoglobinemia e hemoglobinúria, que pode influenciar a filtração glomerular por obstrução dos glomérulos glomerular, gerando um quadro de insuficiência renal34.
Alterações Imunológicas
Quando o coração permanece sem sangue durante a CEC, ou seja, parado instantaneamente, associado à interação com materiais estranhos ao organismo ocorre consequentemente a ativação da resposta imunológica com possível repercussão para complicações futuras9.
O sangue ao entrar em contato com as superfícies artificiais do circuito da perfusão ativa o sistema complemento, bem como a resposta inflamatória. Com o sistema complemento ativado são liberadas as anafilatoxinas C3a e C5a que estimulam a produção de citocinas e vários mediadores do processo inflamatório. Além disso, os leucócitos serão também ativados pelo grande poder quimiotático dessas anafilatoxinas, com consequente vasocontrição e aumento da permeabilidade vascular, gerando acúmulo de água no interstício29, 38, 49.
Nesse processo também é ativado a coagulação sanguínea e aumento da adesão dos neutrófilos às células endoteliais, sendo este um pré-requisito essencial a todos os processos que conduzem à injúria tecidual10.
Assim, os neutrófilos são ativados e liberam substâncias que contribuem para a formação da reação inflamatória generalizada. Durante a perfusão, os neutrófilos tendem a se acumular nos pulmões, onde seus produtos tóxicos produzem aumento da permeabilidade vascular e edema intersticial. Além disso, os demais leucócitos ativados liberam radicais livres de oxigênio que em determinadas circunstâncias podem produzir oclusão microvascular30.
Essa cascata de reações inflamatórias constituem a Síndrome de Resposta Inflamatória Sistêmica (SIRS) podendo ser manifestada em menor ou maior grau, sendo mais evidentes e deletérias em idosos e neonatos17.
A SIRS também denominada de síndrome pós-perfusão, apresenta características clínicas muito semelhantes ao choque séptico. Clinicamente a SIRS pós-CEC se caracteriza pelo comprometimento das funções pulmonares, renais, cerebrais, cardíacas, presença de febre, taquicardia, hipotensão arterial, leucocitose, coagulopatias, suscetibilidade às infecções, alteração da permeabilidade vascular levando ao acúmulo de líquido intersticial, vasoconstricção e hemólise35.
A frequência das manifestações clínicas de SRIS após a CEC varia entre 22% e 27,5%, ainda que tenha sido avaliada por diferentes métodos15. Em um estudo de 1993 foi relatado a incidência de 27,5% de SRIS em crianças no qual o critério diagnóstico utilizado foi adaptado da definição de SRIS em pacientes clínicos41.
Em cirurgias de RM foi observado a SIRS como uma resposta protetora do organismo em torno de 11%, com uma alta taxa de mortalidade de 41%25.
Outro dado relevante, é que a CEC é seguida da Síndrome de Desconforto Respiratório Agudo (SARA) com frequência de 0,4% em população adulta, sendo que há uma alta mortalidade associada15, 28.
Segundo Torrati47 et al. (2012) a CEC produz uma resposta inflamatória sistêmica em razão das alterações na permeabilidade vascular e à diminuição na pressão oncótica, com liberação de substâncias que prejudicam a coagulação e a resposta imunológica, acarretando algumas complicações no período pós-operatório imediato.
Em alguns pacientes, a resposta exacerbada do sistema de defesa do organismo ocorre devido à liberação de substâncias com efeito vasodilatador, como a bradicinina, sendo que sua ação paraliza a vasculatura arteriolar, complicando a saída da perfusão29. Devido seu mecanismo vasoativo ocorre aumento da permeabilidade vascular e vasodilatação arteriolar, favorecendo o extravasamento de líquidos para o interstício, sendo que a bradicinina permanecerá elevada durante a CEC, pois seu sítio pulmonar de metabolização está excluído do processo38.
Alguns pacientes podem desenvolver resistência à heparina ou ainda reações de hipersensibilidade desencadeadas pelo complexo heparina-protamina, agravando as respostas protetoras do sistema imunológico22.
Um estudo comparativo sobre a RM com e sem a CEC identificou uma resposta inflamatória, através do aumento das concentrações da Proteína C Reativa (PCR) e fibrinogênio 24h após o procedimento. Sendo que a RM com CEC apresentou evidências bioquímicas de um estado pró-trombótico precoce após a cirurgia, porém, sem evidências do aumento do número de eventos trombóticos. Este estado pró-trombótico pode ser consequência do circuito extracorpóreo, resposta compensatória ao sangramento ou a ambos32.
Vale ressaltar que a resposta inflamatória desencadeada pela CEC é significativamente menor quando o tempo de perfusão é inferior a 70 minutos52.
Alterações Renais
A insuficiência renal no período pós CEC é um evento grave que está relacionado à elevada taxa de mortalidade e morbidade. Apesar de toda evolução da tecnologia na circulação extracorpórea, a insuficiência renal continua apresentando alta na incidência, sendo o desenvolvimento dessa complicação complexo e multifatorial44.
Nos primeiros instantes da CEC é comum o quadro de hipotensão devido uma multiplicidade de fatores como: a redução do fluxo de perfusão, a hemodiluição com redução da viscosidade do sangue, e o aumento do vasodilatador bradicinina. Após este período, o organismo começa uma resposta compensatória que, com frequência, resulta em hipertensão. Assim, a vasoconstrição produzida pela hipotermia, a elevação da resistência vascular sistêmica e a ausência de pulsatilidade na circulação contribuem para esta resposta hipertensiva43.
Contudo, como consequência da vasoconstrição renal, ocorre uma redução do fluxo sanguíneo renal, predispondo os rins à isquemia e injúria. Dessa forma, a energia disponível para os mecanismos da atividade renal normal fica reduzida, inviabilizando as funções reabsortivas e secretórias renais48.
Além disso, a hemodiluição com soluções cristalóides, quando em excesso, predispõe o paciente a formação de edema, devido a redução da pressão coloido-osmótica do plasma, diminuindo a reabsorção nos capilares peritubulares, o que resulta em uma diurese aquosa e rica em eletrólitos, podendo culminar num desequilíbrio hidroeletrolítico39.
A hemólise ocasionada na CEC produz vasoconstrição pela liberação de produtos vasoativos do interior das células e por ser uma molécula grande, a hemoglobina é filtrada com dificuldade e pode se cristalizar nos túbulos renais, causando obstrução e necrose tubular34, 37.
Alguns outros fatores também são responsáveis pela produção de disfunção renal, como doença renal pré-operatória, incluindo o emprego de agentes nefrotóxicos, isquemia renal, vasoconstrição severa, hemodiluição extrema e hipotermia profunda44.
Em pacientes idosos o risco de desenvolver distúrbios de insuficiência renal aguda é mais frequente, pois esse grupo de pacientes na maioria das vezes vem acompanhado de outras doenças como: diabetes, reserva renal marginal, doença vascular periférica, e febre reumática. Então, para uma medida preventiva é importante adicionar manitol ao perfusato, com o objetivo de proteger contra a injúria isquêmica do tecido renal47.
Contudo, há várias evidências de que os efeitos deletérios da circulação extracorpórea sobre os rins, incluindo a produção de insuficiência renal aguda, estão relacionados ao tempo de duração da perfusão. Isso foi comprovado no estudo de Taniguchi44 et al., (2007) que identificou a influência negativa do tempo de CEC na função renal pelo aumento da creatinina sérica, da variação da creatinina sérica e maior incidência de diálise em pacientes com tempo de CEC maior que 90 minutos.
A insuficiência renal em cirurgia cardíaca tem uma incidência variando de 3,5% a 31,0%, com elevação da taxa de mortalidade de 0,4% a 4,4% para 1,3% a 22,3%; sendo que a necessidade de terapia dialítica acha-se presente em 0,3% a 15,0% dos casos, e nestes, a taxa de mortalidade atinge 25,0% a 88,9%26.
As cirurgias cardíacas com o auxílio da CEC apresentam algumas implicações típicas, sendo algumas maiores e mais prevalentes do que outras. Dentre elas está incluída a insuficiência renal com o processo de evolução para a insuficiência renal aguda (IRA) que ocorre em média de 7% a 30%. Acredita-se que fatores genéticos como aterosclerose, diabetes e até mesmo hipertensão arterial sistêmica possam contribuir na disfunção renal logo no pós-operatório46.
Alterações Pulmonares
Nos últimos anos, devido o avanço e a sofisticação dos equipamentos e das técnicas de perfusão, houve uma redução das complicações pulmonares. Entretanto, ainda constituem a causa mais significativa de morbidade no pós-operatório com evolução tão rápida que resiste a todas as medidas terapêuticas39.
O paciente submetido a uma cirurgia do coração com CEC normalmente apresentará um grau de disfunção pulmonar com diminuição da capacidade residual funcional dos pulmões. Ocorre nos pulmões um aumento no extravasamento de água para o interstício causado pelas células inflamatórias, com preenchimento alveolar, levando à inativação do surfactante e ao colapso de algumas regiões, e redução na capacidade pulmonar. Além disso, a exposição à hipotermia durante a CEC também afeta a função pulmonar negativamente, causando prejuízo para o endotélio pulmonar12.
Outro fator que contribui para a disfunção pulmonar pós CEC são as doses de anestésicos e sedativos que comumente deprimem a ventilação pulmonar, reduzindo a capacidade residual funcionar em torno de 20%5,40.
Assim, a fisiopatologia da disfunção pulmonar é multifatorial, ocorrendo a combinação referente aos efeitos gerados pela anestesia, incisão cirúrgica, tempo de isquemia, trauma cirúrgico na circulação extracorpórea, e ativação do sistema imunológico. Estes fatores apresentam grande relevância sobre o aparecimento de complicações respiratórias no pós-operatório de cirurgia cardíaca 4,21,33.
Várias complicações pulmonares surgem no pós-operatório de uma cirurgia cardíaca, dentre elas destaca-se a atelectasia com média de incidência entre 60% a 90% dos casos, sendo um número 6 vezes superior às cirurgias cardíacas sem CEC18, 33.
A atelectasia pulmonar é uma das principais causas de hipoxemia que ocorre no pós-operatório com CEC, causando uma redução nas trocas gasosas e acarretando problemas pulmonares como: compressão do parênquima pulmonar, a absorção do ar alveolar e comprometimento da função surfactante5,42.
Dentre todos os órgãos afetados pelo o ato cirúrgico pós CEC, o pulmão tende a ser o mais comprometido. Embora ocorram vários fatores associados ao aumento de água intersticial, o mais importante é a deposição de neutrófilos na microcirculação pulmonar, principal local de sequestração dos neutrófilos ativados. Essas células liberam enzimas lisossômicas e radicais livres de oxigênio, ocasionando lesão endotelial direta e alterando a permeabilidade vascular, com consequente acúmulo de água no interstício pulmonar38.
Estudos mostram a CEC como uma das principais causas para o prejuízo pulmonar devido ao aumento da resistência da via aérea e possível aumento da disfunção diafragmática, sendo que toda cirurgia cardíaca gera danos pulmonares, contudo na CEC é maior21.
Contudo, o estudo de Montes34 et al. (2004) relata que não houve diferença significativa da função pulmonar, 72 horas após a cirurgia, de pacientes operados com e sem CEC, sendo que em ambos teve uma redução.
Muitos estudos revelam que o tempo de permanência em sala cirúrgica é maior nos pacientes que utilizaram a CEC 22,28,43,53.. Sendo que alguns autores ainda afirmam que os pacientes que utilizam a CEC criam maior dependência de ventilação mecânica no pós-cirúrgico1,38. Entretanto, este assunto ainda é controverso, pois existem dados que mostram não haver diferença significativa quando comparados grupos com e sem CEC. Da mesma forma, alguns dados indicam não haver diferença na média de tempo para extubação entre pacientes operados com e sem CEC 11,29.
Considerações Finais
Mesmo com a grande evolução da CEC ao longo de seus mais de 50 anos de história no Brasil, ainda existem muitas implicações observadas ao uso desta técnica, que apesar de ser a única forma de recurso operatório para muitos procedimentos cardíacos, pode repercutir em severas complicações, sendo estas responsáveis pelo prolongamento do tempo de internação com aumento dos custos hospitalares, além de importante causa de morbidade e mortalidade.
Em cirurgias de grande porte como as cardíacas existe uma complexa inter-relação do procedimento cirúrgico em si, da anestesia e da CEC (principalmente em relação ao tempo de cirurgia), além de fatores relacionados ao paciente, sendo, portanto, questionável a etiologia das alterações sistêmicas.
Referências
1. ATIK, Fernando Antibas; MIANA, Leonardo Augusto; JATENE, Fábio B.; JÚNIOR, José Otávio C. Auler; OLIVEIRA, Sérgio Almeida de. A cirurgia de revascularização do miocárdio sem circulação extracorpórea minimiza o sangramento pós-operatório e a necessidade transfusional. Arq. Bras. Cardiol. vol.83 no.4 São Paulo Oct. 2004.
2. ASCIONE R, WILLIAMS S, LLOYD CT, SUNDARAMOORTHI T, PITSIS AA, ANGELINI G D. Reduced prostoperative blood loss and transfusion requirement after beating-heart coronary operations: a prospective randomized study. J Thorac Cardiovasc Surg 2001; 121: 689-96.
3. ALVES, Priscila Dias. Imediato de cirurgia cardíaca. Brasília, 2013.
4. AMBROZIN ARP, CATANEO AJM. Aspectos da função pulmonar após revascularização do miocárdio relacionados com risco pré-operatório. Rev Bras Cir Cardiovasc. 2005;20(4):408-15.
5. AULER JUNIOR, José Otávio Costa; GALAS, Filomena Regina Barbosa Gomes; HAJJAR, Ludhmila Abrahão; FRANCA, Suelene Aires. Ventilação mecânica no intra-operatório. São Paulo, 2007.
6. BARROSO, Roberto Cardoso; MENDONDÇA, José Teles de; CARVALHO, Marcos Ramos; COSTA, Rika Kakuda; SANTOS, José Edivaldo dos. Avaliação da protamina na neutralização da heparina após circulação extracorpórea. Rev Bras Cir Cardiovasc vol.17 no.1 São Paulo Jan./Mar. 2002.
7. BIAZZOTTO, Camila B.; BRUDNIEWSKI, Márcio; SCHMIDT, André P.; JUNIOR, José Otávio Costa Auler. Hipotermia no Período Peri-Operatório. Rev Bras Anestesiol 2006; 56: 1: 89 – 106.
8. BISCEGLI, J. F; ANDRADE, A. J. P; PAULISTA, P. P; . OLIVEIRA, S. A ; SOUZA, L. C. B; LEME, J. ; TOFFANO, R. M.; PICCINI, B. Avaliação clínica de um oxigenador de membrana de baixo volume de enchimento (“PRIMING”). São Paulo, 1999.
9. BRASIL L A; GOMES W J; SALOMÃO R; FONSECA J H P; BRANCO J N R, BUFFOLO E. Uso de corticóide como inibidor da resposta inflamatória sistêmica induzida pela circulação extracorpórea. Rev Bras Cir Cardiovasc 1999; 14 (3): 254-68.
10. BORIWIEC JW, HAGMAN TH, PEKNA M, VENGE P, THELIN S. Circulating cytokines and granulocyte-derived enzymes during complex heart surgery: a clinical study with special reference to heparin-coating of cardiopulmonary bypass circuits. Scand J Thorac Cardiovasc Surg 1995;29(4):167-74.)
11. CASTRO, Reginaldo Pereira de; CROTI, Ulisses Alexandre; MACHADO, Maurício de Nassau; MUTILLO, Harold Gonzalez; RINCON Omar Yesid Prieto; POLICARPO, Sebastião Rodrigues; FINOTI, Renata Geron; BRAILE, Domingo Marcolino. Ultrafiltração convencional com modificação técnica no tratamento cirúrgico dos defeitos cardíacos congênitos. Rev Bras Cir Cardiovasc vol.21 no.1 São José do Rio Preto Jan./Mar. 2006
12. CLARK SC. Lung injury after cardiopulmonary bypass. Perfusion. 2006;21(4):225-8.
13. CLEVELAND JC, SHROYER LW, CHEN AY, PETERSON E, GROVER, FL. Off-pump coronary artery bypass grafting decreases risk-adjusted mortality and morbidity. Ann Thorac Surg 2001;72:1282-9
14. COLAFRANCESCHI, Alexandre Siciliano; MONTEIRO, Andrey José de Oliveira; CANALE, Leonardo Secchin; CAMPOS, Luiz Antonio de Almeida; MONTERA, Marcelo Westerlund; SILVA, Paulo Roberto Dutra da; FERNANDES, Marcelo Ramalho; PINTO, Alexandre de Araújo; MOLAS, Stelmar Moura; MESQUITA, Evandro Tinoco. Assistência circulatória com oxigenação por membrana extracorpórea (ECMO) no adulto: um conceito falido ou esquecido?. Arq. Bras. Cardiol. vol.91 no.1 São Paulo July 2008.
15. COSTA SOARES, Leonardo Cavadas da; RIBAS, Denise; SPRING, Regine; SILVA, Jean Marcelo Ferreira da; MIYAGUE, Nelson Itiro. Perfil Clínico da Resposta Inflamatória Sistêmica após Cirurgia Cardíaca Pediátrica com Circulação Extracorpórea. Arq Bras Cardiol 2010;94 (1):127-133.
16. DIENSTMANN, Caroline; CAREGNATO, Rita Catalina Aquino. Cirulação extracorpórea em cirurgia cardíaca: um campo de trabalho para o enfermeiro. Rev. SOBECC, São Paulo. jan./mar. 2013; 18(1): 35-43.
17. DOMINGO, M Braile. Circulação Extracorpórea. Rev Bras Cir Cardiovasc vol.25 no.4 São José do Rio Preto Oct./Dec. 2010.
18. FIGUEIREDO LC, ARAÚJO S, ABDALA RCS, ABDALA A, GUEDES CAV. CPAP de 10 cmH2O durante a circulação extracorpórea não melhora a troca gasosa pós-operatória. Rev Bras Cir Cardiovasc. 2008;23(2):209-15.
19. FONSECA, J.W.G; BISCEGLI, J.F; LEME, J.; POLANSKY, M.R; AKIKUBO, R. Projeto e desenvolvimento de um termômetro para circulação. II mostra SES, São Paulo 2008.
20. GOMES, Walter J.; SABA, João C.;BUFFOLO, Enio. 50 anos de circulação extracorpórea no Brasil: Hugo J. Felipozzi, o pioneiro da circulação extracorpórea no Brasil. Rev Bras Cir Cardiovasc vol.20 no.4 São José do Rio Preto Oct./Dec. 2005.
21. GUIZILINI S, GOMES WJ, FARESIN SM, BOLZAN DW, ALVES FA,CATANI R, et al. Avaliação da função pulmonar em pacientes submetidos à cirurgia de revascularização do miocárdio com e sem circulação extracorpórea. Rev Bras Cir Cardiovasc. 2005; 20(3):310-6.
22. JOÃO, Paulo Ramos David; JUNIOR, Fernando Faria. Cuidados imediatos no pós-operatório de cirurgia cardíaca. Rio de Janeiro (RJ) 2003.
23. LIMA, Leonardo Esteves. Cirurgia Cardíaca Menos Invasiva. Um Fenômeno de Moda ou um Método do Futuro? Comentário Editorial. Hospital La Pitiè – Paris, França, 1997.
24. LOBO FILHO, José Glauco; LEITÃO, Maria Cláudia de Azevedo; LOBO FILHO, Heraldo Guedis; SOARES, João Paulo Holanda; MAGALHÃES, George Araújo; LEÃO FILHO, Carmelo Silveira Carneiro; FEITOSA, José Acácio Francisco; OLIVEIRA, Martins de; LAVOR, Arnóbio; SOARES FILHO, Odair; BORGES, Elita; ABREU, José Sebastião de; DIÓGENES, Tereza Cristina Pinheiro; BARRETO, José Erirtônio Façanha; PAES JÚNIOR, José Nogueira. Cirurgia de revascularização coronariana esquerda sem CEC e sem manuseio da aorta em pacientes acima de 75 anos. Rev Bras Cir Cardiovasc 2002; 17(3): 208-214.
25. MACHADO, Luciano Brandão; NEGRI, Elnara Marcia; BONAFÉ, Wanderley Wesley; SANTOS, Luciana Moraes; MALBOUISSON, Luís Marcelo Sá; CARMONA, Maria José Carvalho. Avaliação dos Níveis de Citocinas e da Função Pulmonar de Pacientes Submetidos à Cirurgia Cardíaca com Circulação Extracorpórea. Rev Bras Anestesiol ARTIGO CIENTÍFICO 2011; 61: 3: 275-285.
26. MANGOS GJ, BROWN MA, CHAN WY, HORTON D, TREW P, WHITWORTH JA. Acute renal failure following cardiac surgery: incidence, outcomes and risk factors. Aust N Z JMed 1995; 25: 284-9.
27. MIANA, Leonardo Augusto; ATIK, Fernando Antibas; MOREIRA, Luiz Felipe; HUEB, Alexandre Ciappina; JATENE, Fabio Biscegli; AULER JUNIOR, José Otávio; OLIVEIRA, Sérgio Almeida de. Fatores de risco de sangramento no pós-operatório de cirurgia cardíaca em pacientes adulto. Rev Bras Cir Cardiovasc 2004; 19(3): 280-286.
28. MILOT J, PERRON J, LACASSE Y, LETOURNEAU L, CARTIER PC, MALTAIS F. Incidence and predictors of ARDS after cardiac surgery. 2001; 119 (3): 884-8.
29. MOTA, André Lupp; RODRIGUES, Alfredo José; ÉRVORA, Paulo Roberto Barbosa. Circulação extracorpórea em adultos no século XXI. Ciência, arte ou empirismo? Rev Bras Cir Cardiovasc 2008; 23(1): 78-92.
30. MOURA, Hemilton Vieira; POMERANTZEFF, Pablo M.; GOMES, Walter José. Síndrome da resposta inflamatória sistêmica na circulação extracorpórea: papel das interleucinas. Rev Bras Cir Cardiovasc 2001; 16(4): 376-87.
31. NOGUEIRA, Celia R. S. R.; HUEB, Whady; TAKIUTI, Myrthes E.; GIRARDI, Priscyla B. M. A.; NAKANO, Teryo; FERNANDES, Fábio; Felipe da S., PAULITSCH, Aécio F. T. GÓIS; LOPES, Neuza H. M.; STOLF, Noedir A.. Qualidade de Vida após Revascularização Cirúrgica do Miocárdio com e sem Circulação Extracorpórea. Artigo Original. São Paulo, SP – Brasil, 2008.
32. PAULITSCH, Felipe da Silva. Alterações hemostáticas e clínicas em cirurgias de revascularização miocárdica com e sem circulação extracorpórea: estudo prospectivo randomizado. São Paulo, 2009.
33. PADOVANI, Cauê; CAVENAGHI, Odete Mauad. Recrutamento alveolar em pacientes no pós-operatório imediato de cirurgia cardíaca. Rev Bras Cir Cardiovasc vol.26 no.1 São José do Rio Preto Jan./Mar. 2011.
34. PONTES, José Carlos Dorsa Vieira; SILVA, Guilherme Viotto Rodrigues da; BENFATTI, Ricardo Adala; MACHADO, Natália Pereira; PONTELLI, Renato; PONTES, Elenir Rose Jardim Cury. Fatores de risco no desenvolvimento de insuficiência renal aguda após cirurgia de revascularização miocárdica com CEC. Rev Bras Cir Cardiovasc 2007; 22(4): 484-490.
35. SALLES, M.J.C; SPROVIERI, S.R.S; BEDRIKOW, R; PEREIRA, A.C; CARDENUTO, S.L; AZEVEDO, P.R.C; SILVA, T.M; GOLIN, V. Síndrome da resposta inflamatória sistêmica/sepse ¾ revisão e estudo da terminologia e fisiopatologia. São Paulo, 1999.
36. SANTOS, Ari-Tadeu Lírio dos; SPLETTSTOSSER, João Carlos; WARPECHOWSHI, Paulo; GAIDZINSKI, Mariana Mariz Pinto. Antifibrinolíticos e cirurgia cardíaca com circulação extracorpórea. Rev. Bras. Anestesiol. vol.57 no.5 Campinas Sept./Oct. 2007.
37. SANTOS, Fernando Oliveira; SILVEIRA, Marco Antonio; MAIA, Roberto Barreto; MONTEIRO, Marcelo Dantas Cerqueira; MARTINELLI, Reinaldo. Insuficiência Renal Aguda após Cirurgia de Revascularização Miocárdica com Circulação Extracorpórea – Incidência, Fatores de Risco e Mortalidade. Salvador, BA. 2003.
38. SAVARIS, Neverton. Resposta Imunoinflamatória À Circulação Extracorpórea: Estado Atual. Rev. Bras. Anestesiol 1998; 48: 2: 126-136 artigo de revisão.
39. SOARES, Gustavo Mattos Teixeira; FERREIRA, Diego Costa de Souza; GONÇALVES, Mariana Paula Cunha; ALVES, Thales Gontijo de Siqueira; DAVID, Flégon Lopes; HENRIQUES, Karina Magalhães de Castro; RIANI, Larissa Rodrigues. Prevalência das Principais Complicações Pós-Operatórias em Cirurgias Cardíacas. Rev Bras Cardiol. 2011; 24(3):139-146.
40. SENRA, Dante Fanganiello; IASBECH, José Alberto; OLIVEIRA, Sérgio Almeida de. Pós-operatório em cirurgia cardíaca de adultos. São Paulo, 1998.
41. SEGHAYE MC, DUCHATEAU J, GRABITZ RG, FAYMONVILLE ML, MESSMER BJ, BURO-RATHSMANN K, et al. Complement activation during cardiopulmonary bypass in infants and children: relation to postoperative multiple system organ failure. Thorac Cardiovasc Surg. 1993; 106 (6): 978-87
42. SILVA, Naila Luisa Saiki da; PIOTTO, Raquel Ferrari; BARBOZA, Marcelo Adriano Ingraci; CROTI, Ulisses Alexandre; BRAILE, Domingo M. Inalação de solução salina hipertônica como coadjuvante da fisioterapia respiratória para reversão de atelectasia no pós-operatório de cirurgia cardíaca pediátrica. Rev Bras Cir Cardiovasc v.21 n.4 São José do Rio Preto out./dez. 2006.
43. SOUZA, Maria Helena; ELIAS, Decio. Fundamentos da Circulação Extracorpórea. Segunda edição, Rio de Janeiro- Brasil, 2006.
44. TANIGUCHI, Fábio Papa; SOUZA, Ademar Rosa de; MARTINS, Antonio Sérgio. Tempo de circulação extracorpórea como fator risco para insuficiência renal aguda. Braz J Cardiovasc Surg 2007; 22(2): 201-205.
45. TANAKA KA , THOURANI VH , WILLIAMS WH , DUKE PG , LEVY JH , GUYTON RA , PUSKAS JD – Anticoagulante heparina em pacientes submetidos a CEC e com CEC cirurgia de revascularização, 2007.
46. TEIXEIRA SOARES, Gustavo Mattos; FERREIRA, Diego Costa de Souza; GONÇALVES, Mariana Paula Cunha; ALVES, Thales Gontijo de Siqueira; DAVID, Flégon Lopes; HENRIQUES, Karina Magalhães de Castro; RIANI, Larissa Rodrigues. Prevalência das Principais Complicações Pós-Operatórias em Cirurgias Cardíacas. Rio de Janeiro, 2011.
47. TORRATI, Fernanda Gaspar; DANTAS, Rosana Ap. Spadoti. Circulação extracorpórea e complicações no período pós-operatório imediato de cirurgias cardíacas. Acta paul. enferm. vol.25 no.3 São Paulo, 2012.
48. UTLEY, J.R. – RENAL EFFECTS OF CARDIOPULMONARY BYPASS. IN GRAVLEE, G.P.; DAVIS, R.F.; UTLEY, J.R. Cardiopulmonary Bypass. Principles and Practice.Williams & Wilkins, Baltimore, 1993.
49. UVA, Joaquim Miguel Sennfelt de Sousa. Estudo Prospectivo Aleatorizado Da Cirurgia Coronária Com E Sem Circulação Extracorporal. PORTO, 2009.
50. VEGNI, Ronaldo; BRAGA, Gustavo Ferreira de Fabricio; FREITAS, Marcia; DRUMOND, Luis Eduardo; PENNA, Guilherme; KEZEN, José; NOBRE, Gustavo Freitas; KALICHSZTEIN, Marcelo; JAPIASSÚ, André Miguel. Complicações após cirurgia de revascularização miocárdica em pacientes idosos. Rio de Janeiro(RJ) Brasil, 2008.
51. VIEIRA JUNIOR , Francisco Ubaldo; VIEIRA, Reinaldo Wilson; COSTA, Eduardo Tavares; ANTUNES, Nilson; PETRUCCI JUNIOR, Orlando; Pedro OLIVEIRA, Paulo Martins de; SILVEIRA FILHO, Lindemberg da Mota; VILARINHO, Karlos Alexandre de Sousa; SEVERINO, Elaine Soraya Barbosa de Oliveira. Visualização de refluxo em aspirador de sangue e reservatório de cardiotomia usados em circulação extracorpórea. Rev Bras Cir Cardiovasc vol.24 no.4 São José do Rio Preto Oct./Dec. 2009.
52. WHITTEN CW, HILL GE, IVY R, GREILICH PE, LIPTON JM. Does the duration of cardiopulmonary bypass or aortic cross-clamp, in the absence of blood and/or blood product administration, influence the IL-6 response to cardiac surgery? Anesth Analg. 1998;86(1):28-33
[1] Aluna do Curso de Biomedicina
[2] Professora Mestre do Curso de Biomedicina

