ОРИГИНАЛ СТАТЬИ
OLIVEIRA, Leandro José Dias Gonçalves de [1]
OLIVEIRA, Leandro José Dias Gonçalves de. Синтез медного глицината (II) комплексного моногидрата. Revista Científica Multidisciplinar Núcleo do Conhecimento. 04 год, Эд. 07, Vol. 10, стр. 87-96. Июль 2019 года. ISSN: 2448-0959
РЕЗЮМЕ
Координационные соединения в основном характеризуются ионом металла D-блока, называемого кислотой Льюиса, окруженной лигантами, называемыми базами Льюиса, и обычно их соли имеют интенсивную окраску, когда в растворе. Медный глицинат (II) моногидрат является сине-зеленого цвета твердых, и имеет cis /trans изомерических форм. Нынешняя работа направлена на отчет о процессе синтеза и характеристики на качественном уровне этого комплекса в химической лаборатории муниципальной школы Governador Израиль Пинейро, Jo’o Monlevade, MG. Результаты эксперимента выявили характерные цветовые кристаллы предполагаемого соединения и благоприятную процентную доходность.
Ключевые слова: химический синтез, медный глицинат, сложный, координационный комплекс.
1. ВВЕДЕНИЕ
Химический синтез позволяет нам получать более сложные продукты, представляющие интерес для общества, начиная с более простых веществ. Благодаря этим исследованиям удалось выйти на большую часть технологических достижений. Процессы синтеза присутствуют в химической и фармацевтической промышленности, в области биологии и биотехнологии, среди других. Процессы химического синтеза направлены не только на создание новых веществ, но и на разработку реакционных методов большей экономической жизнеспособности.
Isenmann (2013) apud Oliveira et al (2018) говорит, что прежде чем думать о планировании синтеза, мы должны искать основную информацию, такую как понимание механизмов реакций, знание классических реакций, понятий стойхиометрии, методы Очищение и какие соединения легко доступны.
Среди тысяч соединений, синтезированных человеком, есть комплексы. По определению Рассела (1994) комплекс состоит из центрального или основного атома, окруженного и связанного с одним или нескольколиганами, которые могут быть атомами, ионами или молекулами. Atkins и Jones (2012) дополняют, говоря, что связующие ориентированы на металл скоординированными облигациями.
Она является общей для комплексного формирования с элементами D и f блоков с орбиталами доступны для новых электронов. Медный глицинат (II) – эт[Cu(gly)2]о соль, которая имеет различные маршруты для синтеза, и метод и реагенты влияют, когда кто-то хочет получить отчетливо СНГ и транс-формы соединения. Для Шрайвера и Аткинса (2003) металлические комплексы играют важную роль в неорганической химии, особенно в тех, которые образуются металлами D-Block.
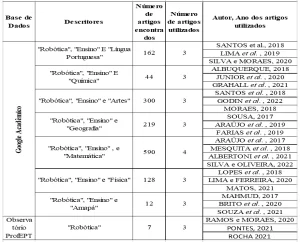
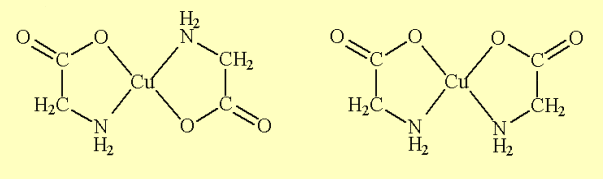
Рисунок 01 – Транс-бис-и цис-би[Cu(gly)2]с-структуры[Cu(gly)2].
Металлические комплексы представляют собой интересные соединения, так как они обладают многими специфическими свойствами с точки зрения: структуры, цвета, оптические и магнитные свойства, например. Еще одна особенность, которая может быть упомянута относится к тому, что они образуют соли, которые не высвобождают их ионы в водной среде, сохраняя их химической целостности. Координационные соединения делятся на две группы: двойные соли, те, которые теряют свою идентичность, и комплексы, которые являются те, которые поддерживают идентичность. (Hoehne e Dall’Oglio, 2013).
Эта работа направлена на описание метода, используемого в получении одного из медного глицинат изомеров (II), начиная с аминоацетической кислоты и медного ацетата (II) моногидрата, проведенного в лаборатории технической школы Jo’o Monlevade, MG, и сделать Простой качественный анализ соединения формируется.
2. МЕТОД
Используя 50 мл бенкера растворяется 2,0 г медного ацетата (II) Моногидрат в 25 мл нагретой деионизированной воды, переходя к последующему постепенному потеплению с помощью бунсена установленного аппарата. Ранее нагретые 25 мл этанола P.A. был добавлен к этому решению. Он продолжал держать смесь под отоплением. В другом беккере 1,5 г аминоатической кислоты растворялось в 25 мл горячей деионизированной воды. Оба младенца содержались под отоплением до тех пор, пока они не достигли 70 градусов по Цельсию (термометр использовался для контроля температуры). Раствор аминоатической кислоты был добавлен в смесь медного ацетата (II) моногидрата. Смесь оставляли в покое, пока не достигла комнатной температуры. Затем беккер был погружен в ледяную ванну. Через несколько минут содержимое Бекера было отфильтровано с помощью ранее определяемой качественной массовой фильтровальной бумаги. Содержимое воронки промывали этанолом. После полной фильтрации фильтровальная бумага была удалена из воронки, которая открывалась на столешнеке до полного испарения спирта. Измерялась масса содержимого фильтровальной бумаги и рассчитана доходность реакции.
3. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
Мы измерили массы аминоатической кислоты и медного ацетата (II) Моногидрат, значения которого составляли соответственно 1,5009 G и 2,0036 G. После этого была измерена масса качественной фильтровальной бумаги и обнаружено значение 1,1609 Г. Наблюдалась неточность измерения массы в четвертом десятичном месте аминоатической кислоты и для качественной фильтровальной бумаги, а также в третьем и четвертом десятичных местах для моногидрата медного ацетата (II).
Медный ацетат является солью синего-зеленого цвета, в то время как аминоацетическая кислота является бесцветной органической кислотой. Во время фазы нагрева не было никаких заметных изменений в содержании бедуинов, и они четко представили цвета соответствующих реагентов, используемых.
Рисунок 02 – Нагрев реагентов.

Пресловутое изменение произошло, когда раствор аминоатической кислоты был помещен в кваситель, содержащий смесь медного ацетата (II) моногидрата и этанола. Он показал синий цвет. Факел был снят с отопительного аппарата и помещен на столешнюю столешнюю столешнюю, пока не достигнет комнатной температуры.
Рисунок 03 – Смесь в результате смеси между реагентами.

Наблюдаемое окрашивание связано с медным ионом CU2 и гидратированным, металлом, ответственным за формирование нескольких комплексов научного интереса, среди них, медный глицинат (II) моногидрат, который вызвал больший интерес студентов, показывая их интенсивный Раскраска. Многие элементы блока D образуют решения с характерными цветами воды (ATKINS и JONES, 2012). Другие характеристики, такие как проводимость, цвет, соединения с тем же молекулярным составом, но другой цвет и дипольный момент наблюдались в этом новом классе соединений (COELHO, 2010).
Цвет, который вещество отображает соответствующие, следовательно, к фракции видимого света, что он не поглощает. Поглощение ультрафиолетовых излучений ниже 400 не обнаруживается человеческим глазом, и мы воспринимаем инфракрасное излучение как тепло (SOUzA, S.D.).
В химии разнообразие цветов очаровывает всех и, по сути, изменение цвета является признаком химической реакции. Цвета имеют важное значение, поскольку они могут выявить более подробную информацию о композитных в анализе. На основе моногидрата медного глицината (II) соль выявила характерное окрашивание комплекса ионов. По словам Аткинса и Джонса (2012), если комплекс синий это потому, что он поглощает оранжевый свет (580-620 нм). Оранжевый и синий являются дополнительными цветами.
Рисунки 04 – Хроматический круг.

Для соединения, чтобы иметь цвет, он должен поглощать видимый свет. Соединение будет поглощать видимое излучение, когда это излучение имеет энергию, необходимую для перемещения электрона из его нижнего (фундаментального) энергетического состояния в возбужденное состояние (BROWN, 2003).
После того, как стаканная смесь достигла комнатной температуры, измеряемой термометром, беккер был погружен в ледяную ванну. Кристаллы слишком яркие синие окраски, чуть менее интенсивные, были показаны, чтобы быть больше и более определенным. Кристаллы соли показали небольшую растворимость в вавочной среде при воздействии низкой температуры.
Цифры 05/06-медные глицинатные кристаллы (II).

Рисунок 07 – Фильтрационный аппарат.

Через несколько минут фильтрационный аппарат был собран для того, чтобы сохранить твердую часть, которая формировалась при понижении температуры. По мере того как том фильтрата увеличил в чаше, из-за непрерывного мытья с этанолом, мы смогли увидеть кристаллы меди Glycinus (II), очень соединенные, явно macerated, интенсивного голубого окраски. Цвет комплекса зависит не только от металла, но и от лиганда, а это значит, что изменения в заменах могут вызвать изменения в цвете. После фильтрации фильтровальная бумага была удалена и открыта на столешне, чтобы она проходила по воздушному потоку.
Реакция, которая произошла для формирования координационного соединения дается уравнение
Cu (CH3COO)2 + 2 NH2CH2COOH + H2O [Cu (NH2CH2COO)2]. H2O + 2 CH3COOH
После полного испарения этанола, который смочил фильтровальную бумагу, остались только кристаллы. Масса кристаллов с фильтровальной бумагой составила 2,9385 Г. Таким образом, масса изолированных кристаллов соответствует 1,7776 г.
Для расчета выхода синтезной реакции медного глицината необходимо было определить моляровые массы задействованных реагентов, будучи
Cu (CH3COO)2 = 181,62982 g.mol-1, NH2CH2COOH = 75,42662 g.mol-1 e
[Cu (NH2CH2COO)2]. H2O = 229,67450 g.mol-1. Расчеты, выполненные следовать ниже, используя все десятичные места для того, чтобы оставить результат более точным:
1 mol NH2CH2COOH __________ 75,42662 g
2 mol NH2CH2COOH __________ m1 = 150,85324 g
Проверка была проведена для проверки наличия избыточного реагента, расчет которого следует:
1 mol Cu (CH3COO)2 __________ 2 mol NH2CH2COOH
181,62982 g __________ 150,85324 g
2,0036 g __________ m2 = 1,6640965215 g NH2CH2COOH
181,62982 g __________ 150,85324 g
m3 __________ 1,5009 g m3 = 1,8071086629 g Cu (CH3COO)2
По расчетам было замечено, что избыточный реагент Cu (CH3COO) 2, вскоре отошло от ограничительного реагента NH2CH2COOH для выполнения расчета урожайности.
2 mol NH2CH2COOH __________ 1 mol [Cu (NH2CH2COO)2]. H2O
150,85324 g __________ 229,6745 g
1,5009 g __________ m4 = 2,2851246486 g
2,2851246486 g __________ 100%
1,7776 g __________ R = 77,790067211%
Расчеты показали, что доходность реакции составила около 77,8%. Мы можем рассмотреть, насколько благоприятны реакционные урожаи 60%.
Существует большой интерес среди профессионалов в структурах, свойстваи и использовании комплексов, в соответствии с Аткинсом и Джонс (2012), отчасти потому, что они участвуют во многих биологических реакций.
Цвета координационных соединений, как правило, определяются центральными атомами, хотя они также могут быть вызваны другими хромофорами (или пигментами), которые являются частью их состава. Переходные металлические комплексы завораживают разновидностями цветов, которые они выставляют. Для конкретного металла, это изменение цвета можно также наблюдать как функция лиганда (SOUzA, S.D.).
Металлические комплексы группы D часто являются магнитными и ярко окрашенными и используются в химии для анализа, растворения ионов, электродепозиции металла и катализа. Они также являются объектами исследований в области сохранения солнечной энергии, в фиксации атмосферного азота и новых препаратов (ATKINS и JONES, 2012).
Многие комплексы важны для нашей жизни, и их отсутствие в нашем организме может вызвать серьезные заболевания. Согласно элементам Brown (2003), таким как V, Cr, Mn, Fe, Co, Ni, Cu, N, Mo и Cd образуют комплексы с различными группами доноров, присутствующими в биологических системах, таких как ферменты. Медный глицинат (II) также широко используется для парентеральных добавок у животных, являясь источником замены меди.
Есть также комплексы, которые используются в краской пигментов, цветоводческих в стекле и драгоценных камнях. Примерами других важных комплексов для поддержания жизни являются гемоглобин, отвечающий за транспортировку кислорода в крови, центральным атомом которого является Fe2 и хлорофилл, отвечающий за фотосинтез, центральным атомом которого является Mg2.
Есть много металлов, которые образуют комплексы, необходимые для нескольких биологических функций живых существ, способствуя поддержанию основных клеточных потребностей. Эти соединения способны взаимодействовать со многими рецепторами сайтов, что представляет собой потенциальный выигрыш в разработке селективных терапевтических агентов.
Деятельность, выполняемая ионами металла в биологических носителях, стимулировала исследования и разработку неорганических соединений в качестве терапевтических агентов. Участие этих соединений в медицине, особенно содержащие переходные металлы, было очень ограничено до 1965 года, когда была классическая демонстрация противоопухолевой активности комплекса под названием цисплатин, ([PtCl2(NH3)2]COHEN, 2007 apud GUERRA et al, 2011 ).
4. ЗАКЛЮЧЕНИЕ
Предложенный синтез предполагаемого соединения был успешно выполнен. Использование таких стратегий, как эксперименты, в значительной степени способствует формированию студентов, помимо того, что они могут быть использованы в качестве первоначальной вехи для внедрения контента. Считается, что аналитические ошибки и оборудование без надлежащей калибровки, возможно, способствовали потере реакционной урожайности. Невозможно только качественно определить, какая изомера была синтезирована или есть возможность рацемической смеси. Для этого потребуются более селективные инструментальные аналитические методы, способные определять структуру соединений. Формирование цис-бис-было спек[Cu(gly)2]улировано. H2O на основе информации из других экспериментов, заявив, что через смесь глицина в оставшийся фильтррат можно получить транс-форму комплекса интересов. Изучение химического синтеза является относительно сложным, но важным для разработки новых продуктов и активных принципов интереса не только в академической среде, но и в различных областях знаний, таких как фармацевтическая и агроветеринарная отрасли, для Примере.
5. ССЫЛКИ
ATKINS, Peter; JONES, Loretta. Princípios de química: questionando a vida moderna e o meio ambiente, 5° ed. Bookman, 2012, 922 p.
BROWN, Theodore. Química: a ciência central, 9° ed. São Paulo, Pearson, 2003.
Círculo cromático. Disponível em < http://www.elgin.com.br/blog/2017/04/18/cores-voce-sabe-como-combina-las-na-hora-de-decorar/>; 2017. Acesso em 30/10/2018.
COELHO, Augusto Leite. Química Inorgânica, Ceará, Núcleo Gráfico da UECE, 2010, 132 p.
COTTON, Simon. Uppingham Scholl, Rutland, UK Molecule od the Month April, 2010. Disponível em <http://www.chm.bris.ac.uk/motm/glycine/Glycine%20-%20Molecule%20of%20the%20Month%20-%20April%202010.pdf>. Acesso em 30/10/2018.
GUERRA, Wendell; et al. Coordenação de metais a antibióticos como uma estratégia de combate à resistência bacteriana. Revista Química Nova, 34(1); 2011: 111-118.
HOEHNE, Lucélia; DALL’OGLIO, Camila. Compostos de coordenação e a química orgânica. Revista Destaques Acadêmicos, 5(4); 2013: 79-83.
ISENMANN, Armin Franz. Princípios da Síntese Orgânica. 2ª ed. Timóteo, 2013.
OLIVEIRA, Leandro José Dias Gonçalves de.; et al. Rotas de síntese do antibiótico Linezolida e correlação entre sua estrutura química e bioatividade. Revista Eletrônica Acervo em Saúde, Vol. Sup. 13, 2018; p. 1557-1566.
RUSSEL, John. Química Geral, 2ª ed. Pearson, 1994, vol.1, 662 p.
SHRIVER, Duward; ATKINS, Peter. Química Inorgânica, 3ª ed. Bookman, 2003, 816 p.
SOUZA, Anne. Compostos de coordenação: cor e propriedades magnéticas, s.d.; p. 152-160.
[1] Химический (UNIUBE). Специалист по химии (UCAM). Академик специализированного курса по научному образованию (UFMG).
Представлено: Июль, 2019.
Утверждено: июль 2019 года.