ARTICLE ORIGINAL
ROCHA, Ana Paula Coelho [1], ZÁU, Aline Sales Mendes [2], SANTOS, Luciana Mendes dos [3]
ROCHA, Ana Paula Coelho. ZÁU, Aline Sales Mendes. SANTOS, Luciana Mendes dos. Naevus mélanocytaire congénital géant avec neurotisation : à propos d’un cas. Revista Científica Multidisciplinar Núcleo do Conhecimento. An. 07, éd. 01, Vol. 06, p. 123-132. Janvier 2022. ISSN : 2448-0959, Lien d’accès : https://www.nucleodoconhecimento.com.br/sante/congenital-geant
RÉSUMÉ
Les naevus mélanocytaires congénitaux (NMC) sont des hamartomes rares qui se caractérisent par des proliférations clonales de mélanocytes dérivés de la crête neurale, nichant dans l’épiderme/derme après leur migration au cours de l’embryogenèse. Cliniquement, ce sont des lésions pigmentées, aux limites bien définies, de taille et d’aspect variables. Le naevus mélanocytaire congénital géant (NMCG) est un naevus de vingt centimètres ou plus de diamètre estimé à l’âge adulte. La présence d’un NMCG est associée à un risque plus élevé de comorbidités sévères telles que la mélanocytose neurocutanée et le mélanome, et il est également nécessaire d’exclure le mélanome malin congénital, principal diagnostic différentiel. Dans ce scénario, la présence de nodules prolifératifs serait-elle un pire facteur pronostique ? Ce rapport vise à présenter un cas clinique difficile de NMCG avec des nodules prolifératifs à croissance rapide chez un nouveau-né de 18 jours. Une brève revue de la littérature et la compilation des données cliniques et histopathologiques du patient en question, qui a été traité dans une clinique externe de dermatologie, ont été réalisées. Il est conclu que bien qu’il existe des caractéristiques cliniques qui indiquent un pronostic plus mauvais ou une éventuelle malignité, une interprétation histologique approfondie et une corrélation clinico-pathologique correcte sont essentielles pour un diagnostic et une prise en charge thérapeutique adéquats.
Mots clés : mélanome congénital, naevus congénital géant, naevus mélanocytaire, neurotisation, nodules prolifératifs.
INTRODUCTION
Les naevus mélanocytaires congénitaux (NMC) sont caractérisés par des proliférations clonales bénignes de mélanocytes, issus de la crête neurale, qui subissent des modifications de maturation et de différenciation au cours de la phase de migration de la période d’embryogenèse. Les cellules de naevus forment des nids ou sont dispersées dans l’épiderme et le derme profond, dans n’importe quelle zone du tégument. Environ 1 à 2 % de la population présente ces changements à la naissance (SCALVENZI, 2012).
Pour la différenciation initiale entre NMC et Naevus mélanocytaire acquis (NMA), la taille, la précocité de la lésion et les caractéristiques histologiques des deux sont prises en compte. Les NMC ont tendance à être plus gros et sont présents dès la naissance ou, en général, jusqu’aux 6 premiers mois de la vie (VIANA, 2013). En histopathologie, il existe des controverses sur les véritables indicateurs de différenciation entre naevus congénitaux et acquis, et il est souvent impossible de les distinguer. Cependant, contrairement aux NMA, les NMC ne se limitent pas à la jonction dermo-épidermique, elles présentent une plus grande cellularité et affectent des plans plus profonds (ZAAL, 2004).
Selon Simons (2017), dans l’histopathologie du NMC, les nids de mélanocytes et les cellules de naevus se retrouvent dispersés à différentes profondeurs du derme, entre les faisceaux de collagène, autour des annexes, des nerfs et des vaisseaux sanguins, et peuvent infiltrer les tissus sous-cutanés, les muscles et les fascias. Il existe souvent une cellularité élevée, divers degrés de désorganisation architecturale et d’atypie, ainsi qu’une propagation pathétique. De tels résultats se retrouvent couramment dans le mélanome, ce qui augmente la difficulté de différencier les deux et peut conduire à un diagnostic erroné.
Cliniquement, elles se présentent sous la forme de plaques brun-brun, fortement pigmentées, aux contours bien définis, à la surface homogène et souvent en forme de mamelon, avec des zones d’hypertrichose (MADRIGAL DÍEZ, 2015). Cependant, les naevus plus gros peuvent être asymétriques, avec des bords irréguliers et une surface hétérogène, rugueuse ou nodulaire en raison d’un excès de mélanocytes et d’une neurotisation. Ce terme fait référence au processus de maturation des cellules du naevus, qui se produit de la surface à la profondeur du tissu, où elles deviennent plus fusiformes. Celles-ci ressemblent aux cellules de Schwann qui composent le neurofibrome, une tumeur papulo-nodulaire de consistance ferme, dont l’origine embryologique se situe également dans la crête neurale (SINGH, 2015).
Selon Kopf (1979), le NMC peut être classé par taille, étant considéré comme petit lorsqu’il est inférieur à 1,5 cm, moyen s’il est compris entre 1,5 et 19,9 cm et géant lorsqu’il est supérieur ou égal à 20 cm, estimé à l’âge adulte. Plus récemment, Krengel (2012) a proposé une nouvelle classification incluant, en plus de la taille, des facteurs cliniques avec l’intention de rendre les descriptions plus standardisées et plus affirmées concernant le risque de mélanome. Dans ce contexte, les NMCG qui présentent une plus grande rugosité, une pigmentation plus foncée, une hypertrichose, des nodules sous-cutanés et la présence de naevus satellites sont considérés comme ayant un plus mauvais pronostic, avec un risque plus élevé de malignité.
Dans ce scénario, la présence de nodules prolifératifs serait-elle un pire facteur pronostique ? Ce rapport vise à présenter un cas clinique rare et difficile de NMCG avec des nodules prolifératifs à croissance rapide chez un nouveau-né de 18 jours, à travers l’exposition des données cliniques et histologiques du patient en question et une brève revue de la littérature afin de clarifier la relation entre les nodules prolifératifs/neurotisation et le pronostic.
RAPPORT DE CAS
Femelle NB, âgée de 18 jours, née à Amazonas, née à terme, pesant 4,415 kg. La mère signale une césarienne en raison d’une grossesse à haut risque, compliquée de pré-éclampsie, de diabète gestationnel et d’infections urinaires répétées, avec plusieurs régimes antibiotiques.
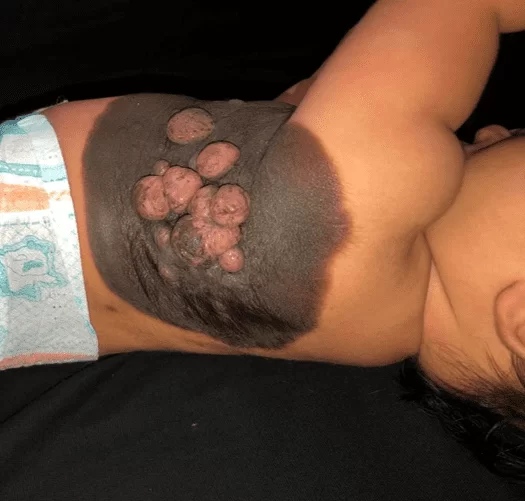
Il présente une plaque veloutée noircie dès la naissance sur l’hémithorax gauche, s’étendant de la ligne médio-claviculaire à la région dorsale interscapulaire homolatérale, mesurant 23 cm de plus grand diamètre, aux limites bien définies, présence de poils en périphérie, associés à des poils centraux et coalescents, noirâtre à rose, allant de 0,5 cm à 1,5 cm et de consistance ramollie (Figure 1). Il existe également une lésion satellite mesurant environ 0,7 cm au niveau de la cuisse gauche (Figure 2). Après 30 jours de traitement initial, il y a eu une augmentation significative des nodules mentionnés (Figure 3). Le reste de l’examen physique n’a montré aucune altération et le développement neuropsychomoteur était adéquat pour son âge. Il n’y avait pas de blessures maternelles suspectes.
Après un traitement dermatologique initial, nous avons opté pour une biopsie incisionnelle d’une lésion nodulaire centrale, en raison de l’aspect clinique évocateur d’un moins bon pronostic. Cependant, le rapport anatomopathologique n’a montré que des caractéristiques bénignes telles que la parakératose, des nids de cellules de naevus recouvrant le composant dermique de cellules de naevus soigneusement disposées, un pigment mélanique au derme profond et des zones de différenciation neurale, sans atypie. Ainsi, le diagnostic de NMC avec neurotisation a été confirmé et une éventuelle tumeur maligne a été exclue. Ainsi, en collaboration avec le secteur de la chirurgie pédiatrique, nous avons opté pour l’ablation en série des nodules et un suivi clinique pour l’évaluation périodique du naevus.
Figure 1. Naevus mélanocytaire congénital géant : plaque noircie, à surface veloutée, bien délimitée, poilue, à tumeurs centrales, mesurant plus de 20 cm.
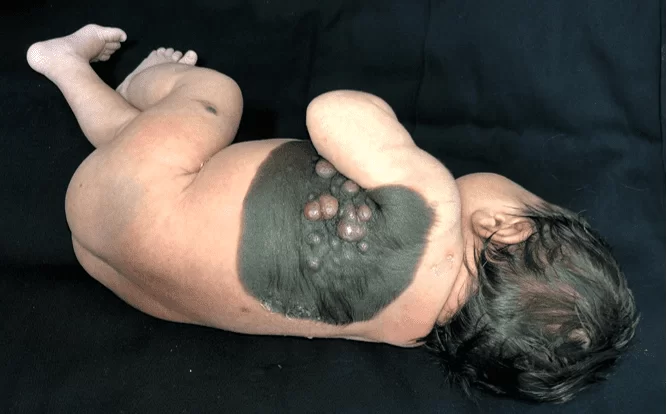
Figure 2. Lésion satellite unique de la cuisse gauche.
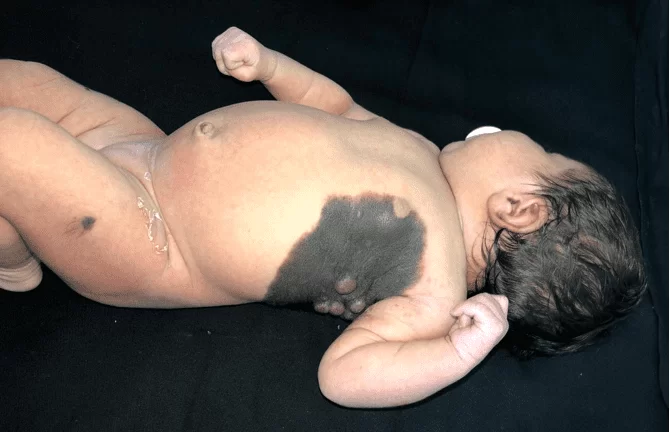
Figure 3. Croissance rapide des lésions 30 jours après le traitement initial, formant des tumeurs confluentes de consistance ramollie et de couleur rosâtre, maintenant des zones noircies en surface.
DISCUSSION
Le naevus mélanocytaire congénital géant (NMCG) est une entité rare et son taux d’incidence moyen est de 1 sur 20 000 naissances (ESCADÓN-PÉREZ, 2019). Cependant, il est d’une grande importance clinique car il est associé à un risque plus élevé de comorbidités graves telles que la mélanocytose neurocutanée (NCM) et le mélanome (RUGGIERI, 2020). Le premier est un syndrome qui affecte le système nerveux central et peut entraîner une hypertension intracrânienne et des convulsions, en particulier lorsque le NMCG présente des nodules, de multiples lésions satellites et se produit à des endroits tels que le cou, le cuir chevelu et la ligne médiane dorsale. Selon Alikhan (2012), le taux d’incidence des MNC varie entre 2,5 % et 45 %. On sait que les mélanomes proviennent principalement des mélanocytes normaux du JDE, cependant, Zaal (2003) souligne que jusqu’à 11 % des NMCG peuvent évoluer avec une dégénérescence maligne, qui survient dans la première décennie de la vie dans jusqu’à 60 % des cas.
La similitude clinique et dermoscopique entre le NMCG avec nodules prolifératifs et le mélanome malin congénital (MMC), une entité rare mais potentiellement mortelle, nécessite une interprétation prudente des résultats histopathologiques (SCALVENZI, 2012).
Ce rapport met en évidence la présence d’un NMCG sans lésions satellites significatives et avec une présence marquée de nodules, qui n’est généralement présent que dans 3 % des cas cités dans la littérature (SCALVENZI, 2012). Les résultats anatomopathologiques corroborent le fait que les nodules dermiques prolifératifs ne sont pas indépendamment indicatifs de malignité (SIMONS, 2017). Elle retrouve tout de même des couples en ce qui concerne la localisation la plus fréquente dans le tronc, l’absence d’antécédents familiaux et histopathologiques favorables au suivi clinique, observés dans 75 % des cas (VIANA, 2017).
De cette façon, il y a de grandes questions sur l’incidence réelle du mélanome des cas de NMCG, ainsi que sur la nécessité d’une intervention chirurgicale dans les cas les plus difficiles sur le plan clinique, soit en raison de la taille de la lésion, soit de la présence de plusieurs naevus satellites (VIANA, 2017). Il n’y a toujours aucune preuve qui prouve l’avantage de cette pratique en tant que prophylaxie contre le développement de la malignité, et, selon la profondeur des cellules du naevus, il n’y a aucune possibilité d’excision totale et, par conséquent, de guérison complète.
Malgré le défi thérapeutique, le NMCG reste un défi diagnostique en raison de sa capacité à imiter cliniquement et histologiquement la MMC (ESCADÓN-PÉREZ, 2019).
Il est à noter que la présence concomitante de plusieurs naevus satellites devrait alerter sur la possibilité d’une atteinte méningée et de tumeurs malignes ou bénignes du système nerveux central. Dans ce scénario, il est nécessaire de demander des tests supplémentaires, tels que l’imagerie par résonance magnétique ou l’évaluation du LCR, pour une meilleure évaluation et un meilleur suivi de la maladie, compte tenu de son pronostic plus défavorable et de son association avec des troubles neurologiques potentiellement mortels (RUGGIERI, 2020).
Enfin, le NMCG est responsable de dommages esthétiques et sociaux, générant un grand impact émotionnel sur les personnes impliquées (ZAAL, 2012).
CONSIDÉRATIONS FINALES
Compte tenu des résultats de la littérature et de la réponse à la question directrice, il est conclu que les nodules prolifératifs/neurotisés sont importants dans l’évaluation clinique du pronostic du NMCG, cependant, ils ne sont pas capables de déterminer un résultat pire isolément. Les NMCG présentent les phénotypes les plus variés, qui varient en termes de risque de développer un mélanome ou MNC, de difficulté chirurgicale et de faisabilité d’un suivi clinique exclusif. Ainsi, une analyse minutieuse de l’ensemble des informations cliniques combinées aux résultats histopathologiques est essentielle.
Ces faits illustrent l’importance d’approfondir l’étude de la NMCG, un événement rare, cependant, avec le potentiel d’ajouter une grande morbidité au patient, ainsi que d’imposer des obstacles au diagnostic et au traitement, qui doit donner la priorité à l’individualité du cas et être préparé de manière pluridisciplinaire.
RÉFÉRENCES
ALIKHAN, Ali; IBRAHIMI, Omar A.; EISEN, Daniel B. Congenital melanocytic nevi: where are we now?: part I. Clinical presentation, epidemiology, pathogenesis, histology, malignant transformation, and neurocutaneous melanosis. Journal of the American Academy of Dermatology, v. 67, n. 4, p. 495. e1-495. e17, 2012.
COTTON, Colleen H.; GOLDBERG, Gerald N. Evolution of congenital melanocytic nevi toward benignity: a case series. Pediatric dermatology, v. 36, n. 2, p. 227-231, 2019.
ESCANDÓN-PÉREZ, Sabrina et al. Nevo melanocítico congénito gigante. Boletín médico del Hospital Infantil de México, v. 76, n. 6, p. 251-258, 2019.
KRENGEL, Sven et al. New recommendations for the categorization of cutaneous features of congenital melanocytic nevi. Journal of the American Academy of Dermatology, v. 68, n. 3, p. 441-451, 2013.
KOPF, Alfred W.; BART, Robert S.; HENNESSEY, Patrick. Congenital nevocytic nevi and malignant melanomas. Journal of the American Academy of Dermatology, v. 1, n. 2, p. 123-130, 1979.
MADRIGAL DÍEZ, C. et al. Nevo melanocítico congénito gigante. Pediatría Atención Primaria, v. 17, n. 68, p. 351-355, 2015.
RUGGIERI, Martino et al. Neurocutaneous melanocytosis (melanosis). Child’s Nervous System, v. 36, n. 10, p. 2571-2596, 2020.
SCALVENZI, Massimiliano et al. Giant congenital melanocytic naevus with proliferative nodules mimicking congenital malignant melanoma: a case report and review of the literature of congenital melanoma. Case reports in dermatological medicine, v. 2013, 2013.
SIMONS, Emily A.; HUANG, Jennifer T.; SCHMIDT, Birgitta. Congenital melanocytic nevi in young children: Histopathologic features and clinical outcomes. Journal of the American Academy of Dermatology, v. 76, n. 5, p. 941-947, 2017.
SINGH, Nidhi et al. Neurotized congenital melanocytic nevus resembling a pigmented neurofibroma. Indian journal of dermatology, v. 60, n. 1, p. 46, 2015.
VIANA, Ana Carolina Leite; GONTIJO, Bernardo; BITTENCOURT, Flávia Vasques. Giant congenital melanocytic nevus. Anais brasileiros de dermatologia, v. 88, p. 863-878, 2013.
VIANA, Ana Carolina Leite et al. A prospective study of patients with large congenital melanocytic nevi and the risk of melanoma. Anais brasileiros de dermatologia, v. 92, p. 200-205, 2017.
ZAAL, L. H. et al. Classification of congenital melanocytic naevi and malignant transformation: a review of the literature. British journal of plastic surgery, v. 57, n. 8, p. 707-719, 2004.
[1] Résident de troisième année en dermatologie, baccalauréat en médecine. ORCID : 0000-0001-9895-706X.
[2] Résident de troisième année en dermatologie, baccalauréat en médecine. ORCID : 0000-0002-6561-376X.
[3] Conseiller. Docteur en Maladies Tropicales et Infectieuses de l’Université d’Etat d’Amazonas en partenariat avec la Fondation de Médecine Tropicale-FMT-HVD, Spécialiste en Dermatologie, Licence en Médecine. ORCID : 0000-0002-3991-6732.
Soumis : Janvier 2022.
Approuvé : Janvier 2022.