ARTIGO ORIGINAL
MELO, Fernando Henrique Boaventura de [1], TEIXEIRA, Valéria Wanderley [2], CAMARA, Claudio Augusto Gomes da [3], SOUZA, Catiane Oliveira [4], CRUZ, Glaucilane dos Santos [5], MONTEIRO, Vaneska Barbosa [6], MORAES, Marcilio Martins [7], VIEIRA FILHO, Leucio Duarte [8], MALERBO-SOUZA, Darclet Teresinha [9], SOARES, Anísio Francisco [10], TEIXEIRA, Álvaro Aguiar Coelho [11]
MELO, Fernando Henrique Boaventura de et al. Imunotoxicidade comparativa de abelhas, Apis mellifera (Hymenoptera: Apidae), expostas a xenobióticos naturais e sintéticos. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano 09, Ed. 02, Vol. 02, pp. 43-65. Fevereiro de 2024. ISSN: 2448-0959. Link de acesso: https://www.nucleodoconhecimento.com.br/biologia/imunotoxicidade-comparativa, DOI: 10.32749/nucleodoconhecimento.com.br/biologia/imunotoxicidade-comparativa
RESUMO
O objetivo deste estudo foi comparar os efeitos de pesticidas químicos naturais e sintéticos, examinando assim a suposta seletividade desses compostos naturais sobre as abelhas Apis mellifera. Os valores de CL50 usados nos bioensaios foram obtidos na pesquisa de Souza et al. (2023) e são os seguintes: Karate® (13,4 µL/100 mL), composto de Limoneno (1.440 µL/100 mL) e Roundup® (712.290 µL/100 mL). No entanto, conforme relatado por esses autores, uma concentração de 250 µL/100 ml foi utilizada para Azamax®. Esses valores de CL50, juntamente com uma concentração de 250 µL/100 mL de Azamax®, foram empregados em análises imunohistoquímicas utilizando o método TUNEL e PCNA no intestino médio das abelhas. Avaliações imunológicas (óxido nítrico, fenoloxidase e marcadores de estresse oxidativo TBARS e GSH) também foram realizadas em abelhas operárias adultas. Os tratamentos xenobióticos não revelaram apoptose ou proliferação celular. No entanto, observamos degeneração epitelial, marcada pela presença de células vacuoladas, sugerindo um processo necrótico. Exceto pelo composto de Limoneno, todas as substâncias induziram estresse oxidativo, levando a níveis aumentados de TBARS. Embora não tenham ocorrido diferenças nos níveis de GSH, observamos alterações no sistema imunológico desses insetos, caracterizadas pelo aumento da atividade da fenoloxidase e dos níveis de NO2. Com base nos resultados obtidos, é possível concluir que deve-se ter cautela ao utilizar pesticidas químicos na agricultura, quer sejam de origem sintética ou natural, pois têm o potencial de causar danos histopatológicos e imunológicos irreversíveis. Este estudo também destaca a importância de realizar investigações mais abrangentes sobre o impacto dos produtos naturais na fisiologia dos insetos polinizadores.
Palavras-chave: Apis mellifera, Xenobióticos, Imunohistoquímica, Estresse oxidativo, Fenoloxidase.
1. INTRODUÇÃO
As abelhas melíferas, Apis mellifera Linnaeus (Hymenoptera: Apidae), desempenham um papel proeminente nos ecossistemas devido ao seu envolvimento na polinização, um papel que desempenham tanto espontaneamente em ambientes naturais quanto em ambientes antropomorfizados. Elas facilitam a transferência de partículas de células reprodutivas, contribuindo assim para a diversidade genética de espécies vegetais selvagens e cultivadas (Klein et al., 2007; Michener, 2007; Potts et al., 2016; Eardley et al., 2016). Como artrópodes de grande importância, as abelhas melíferas contribuem intrinsecamente para a sobrevivência de inúmeros organismos na Terra (Potts et al., 2016; Eardley et al., 2016). Apesar de sua importância ambiental e econômica (Giannini et al., 2015), os últimos anos têm visto um declínio nas populações de abelhas e uma redução na diversidade de espécies em todos os continentes (Zattara & Aizen, 2021).
Os pesticidas agrícolas impactam as populações de abelhas melíferas de várias maneiras e são identificados como uma das causas multifatoriais que contribuem para o fenômeno conhecido como Transtorno do Colapso das Colônias (TCC), que afeta as abelhas sociais do gênero Apis e as espécies nativas (Graystock et al., 2013; Goulson et al., 2015). Inseticidas neurotóxicos, como neonicotinoides e piretroides, por exemplo, não apenas são letais, mas também capazes de induzir alterações comportamentais em abelhas operárias (Decourtye et al., 2005; Gill & Raine, 2014). Além disso, o herbicida amplamente utilizado glifosato foi encontrado para reduzir as habilidades de aprendizagem das abelhas (Herbert et al., 2014).
Do ponto de vista imunológico, Gregorc & Ellis (2011) conduziram testes em larvas de A. mellifera usando pesticidas químicos—organofosfato, neonicotinoide e o herbicida glifosato. Eles observaram um aumento na apoptose no intestino médio, com percentagens respectivas de 61%, 65% e 69% de morte celular nas larvas tratadas em comparação com 10% no grupo controle. Isso demonstra que os pesticidas exercem um efeito no nível celular. A apoptose é o processo de morte celular programada que ocorre naturalmente nos organismos para manter a homeostase celular e servir como um mecanismo de defesa (Ashe & Berry, 2003). No entanto, dependendo da capacidade de um indivíduo, ele pode se recuperar por meio do processo de proliferação celular (Caccia et al., 2019).
O estresse oxidativo tem o potencial de iniciar o processo de morte celular e ocorre devido ao equilíbrio entre espécies reativas de oxigênio ou nitrogênio (ROS e RNS) e compostos antioxidantes (Maulik et al., 1998; Barbosa et al., 2010). ROS e RNS são radicais livres que, quando em equilíbrio, desempenham papéis importantes no sistema imunológico dos insetos. Um exemplo disso é o óxido nítrico, que participa de processos sinalizando a presença de entomopatógenos e xenobióticos, e faz parte dos mecanismos de defesa humoral desses artrópodes (Bartling et al., 2021). A fenoloxidase é outro componente dessa defesa, pois essa enzima participa da formação da melanina, que está envolvida na esclerotização da cutícula, cicatrização de feridas e reconhecimento de agentes estrangeiros (Negreiro et al., 2004).
Neste contexto, ao longo das últimas duas décadas, a pesquisa sobre biopesticidas botânicos aumentou significativamente devido a várias vantagens que oferecem, incluindo maior seletividade para organismos não alvo (Isman, 2006; Isman, 2020). No entanto, apesar do extenso corpo de pesquisa, pouca atenção tem sido dada aos efeitos desses inseticidas naturais na fisiologia dos insetos (Isman, 2020; Giannini et al., 2015). Isso é motivo de preocupação, pois estudos têm revelado que óleos essenciais e seus compostos isolados têm o potencial de impactar a história de vida dos insetos, afetando pragas, bem como inimigos naturais e levando a mudanças histopatológicas (Almehmadi, 2011; Oliveira et al., 2021), nutricionais (Cruz et al., 2017; Oliveira et al., 2021) e imunológicas (Silva et al., 2020).
Assim, testes fisiológicos são necessários para garantir a segurança dessas substâncias nas abelhas em campos agrícolas. As operárias das abelhas podem potencialmente se contaminar, e consequentemente toda a colônia, tanto durante a coleta de alimentos quanto através de resíduos na água no caso de pesticidas químicos sintéticos (Mullin et al., 2010; Potts et al., 2010; Ruiz-Toledo & Sánchez-Guillén, 2014).
Diante do contexto apresentado, esta pesquisa teve como objetivo comparar as respostas imunológicas das abelhas A. mellifera quando expostas a xenobióticos sintéticos (inseticida piretroide – Karate® e herbicida glifosato – Roundup®) e xenobióticos naturais (biopesticida – Azamax® e composto de Limoneno) comumente usados na agricultura.
2. MATERIAL E MÉTODOS
2.1 OBTENÇÃO DE INSETOS
As abelhas utilizadas nesta pesquisa foram obtidas do apiário experimental do Departamento de Zootecnia da Universidade Federal Rural de Pernambuco (UFRPE). Abelhas operárias foram coletadas utilizando recipientes plásticos com tampas perfuradas colocados nas entradas das colmeias. Posteriormente, os insetos foram transportados para o Laboratório de Fisiologia de Insetos (LAFI) e para o Laboratório de Estudos Morfológicos em Vertebrados e Invertebrados (LABEMOVI), ambos na UFRPE, onde foram utilizados nos bioensaios.
2.2 CONCENTRAÇÕES UTILIZADAS NOS BIOENSÁIOS
As Concentrações Letais 50 (LC50) utilizadas para as avaliações imunohistoquímicas e imunológicas da população de abelhas A. mellifera do apiário da UFRPE foram obtidas de Souza et al. (2023). Eles relataram os valores de LC50 da seguinte forma: 13,4 µL/100 mL para o inseticida Karate® (solução de pesticida + mel 1:1 + 1% de dimetilsulfóxido (DMSO)), 1.440 µL/100 mL para o composto de Limoneno (solução de mel + DMSO) e 712.290 µL/100 mL para o herbicida Roundup® (mel + água + DMSO). Em relação ao inseticida botânico Azamax®, foi utilizada uma concentração de 250 µL/100 mL da solução (mel + DMSO). Conforme demonstrado por Souza et al. (2023), essa concentração representou o nível mais alto do produto que resultou em mortalidade sem repelir insetos; concentrações mais altas repeliram 100% dos indivíduos amostrados, tornando impossível determinar a LC50 para o Azamax®. O grupo de controle foi tratado apenas com a solução de mel (1:1) + 1% de DMSO. Após 24 horas de exposição aos tratamentos, as abelhas sobreviventes foram utilizadas nos testes subsequentes.
2.3 APOPTOSE NO INTESTINO MÉDIO DE APIS MELLIFERA
Para análise imunohistoquímica, incluindo apoptose e proliferação celular, os intestinos médios foram incluídos em parafina, e cortes de 5 µm de espessura foram obtidos usando um micrótomo Minot (Leica, 2035). Esses cortes foram então colocados em um banho-maria e coletados em lâminas silanizadas. As imagens foram capturadas e digitalizadas usando o software Leica LAS Image (Junqueira & Junqueira, 1983; Solomon, 2009). Para detectar apoptose via fragmentação do DNA, as lâminas silanizadas contendo seções de intestino médio foram submetidas ao teste TUNEL (Terminal Deoxynucleotidyl Transferase Uracil Nick End Labeling) (Costa, 2022; Gavrieli, 1992), seguindo o protocolo do kit Apoptag Plus (Merck®). Os cortes foram inicialmente desparafinizados e hidratados, seguidos por uma incubação de 5 minutos em PBS (solução salina tamponada com fosfato) à temperatura ambiente. A proteína quinase K foi então aplicada nas lâminas por 15 minutos. Após lavagem em água destilada, as lâminas foram incubadas em peróxido de hidrogênio por 5 minutos à temperatura ambiente. As seções foram lavadas em PBS e incubadas em um tampão de equilíbrio por 60 minutos a 4°C. Posteriormente, as seções foram incubadas em TdT a 37°C por 1 hora em uma câmara úmida. A solução de parada foi aplicada por 10 minutos à temperatura ambiente, seguida por lavagem em PBS e incubação em anti-digoxigenina. As lâminas foram enxaguadas em PBS, e as seções foram desenvolvidas com substrato cromogênico diaminobenzidina (DAB, DakoCytomationTM) por aproximadamente 20 minutos. Em seguida, foram coradas com hematoxilina por 20 a 30 segundos. Após isso, as lâminas foram lavadas em água corrente, desidratadas em concentrações crescentes de álcool e colocadas em xilol para montagem e observação ao microscópio óptico.
2.4 PROLIFERAÇÃO CELULAR DO INTESTINO MÉDIO
Para avaliar a proliferação celular, a parafina foi removida das seções, que foram então hidratadas e submetidas à recuperação antigênica usando tampão citrato (pH=6) em banho-maria por 20 minutos a 100°C. Após repouso por 20 minutos à temperatura ambiente, uma solução de peróxido de hidrogênio a 3% foi aplicada por 30 minutos. Em seguida, as seções foram enxaguadas em tampão Tris (Tris-(hidroximetil)-aminometano) e expostas ao anticorpo PCNA (antígeno nuclear de proliferação celular) (Spring) em diluição de 1:100 por 1 hora à temperatura ambiente. As seções foram novamente lavadas em tampão Tris e incubadas com histofine por 30 minutos. Posteriormente, foram submetidas ao cromógeno diaminobenzidina (DAB, DakoCytomation™) e coradas com hematoxilina. O índice apoptótico e a proliferação celular foram determinados com base na porcentagem de células positivas, calculada a partir da contagem de pelo menos 500 núcleos por tratamento, subdivididos em 10 campos aleatórios selecionados usando o objetivo 40x (Losa et al., 2000; Wu et al., 2013).
2.5 PREPARAÇÃO DO MACERADO
Uma abelha adulta foi macerada em 500µL de tampão fosfato (0,1 mM, pH 7,4) dentro de um almofariz usando um pilão de porcelana. O macerado resultante foi então transferido para um tubo de centrífuga de 2 mL e centrifugado por 1 minuto a 1000 rpm para remover quaisquer fragmentos do exoesqueleto dos insetos. O sobrenadante foi posteriormente transferido para outro tubo de 2 mL e mantido refrigerado a -20°C até a análise. Cada abelha individual foi tratada como uma repetição, e cada tratamento consistiu em 10 repetições realizadas dentro de 24 horas após a aplicação.
2.6 MEDIDA DE ÓXIDO NÍTRICO
O reagente de Griess Green et al. (1981) foi empregado para avaliar a concentração do íon nitrito (NO2). Em uma alíquota de 50 μL do macerado, foram adicionados 70 μL de sulfanilamida a 1% em ácido fosfórico a 5% (H3PO4). Após incubação, mais 50 μL de NEED a 0,1% foram adicionados aos 50 μL da amostra (macerado/sulfanilamida) em uma placa de microtitulação (Faraldo et al. 2005). A leitura da absorbância foi realizada a 562 nm utilizando o leitor de microplacas Biochrom Anthos 2010 (São Paulo, Brasil), com o programa ADAP operando no modo de ponto final. Os dados foram submetidos à ANOVA, e as médias foram comparadas usando o teste de Tukey HSD, com análise realizada utilizando o software SAS Institute.
2.7 ATIVIDADE DA FENOLOXIDASE
A análise para cada tratamento foi conduzida utilizando 10 µL do macerado, com cada tratamento consistindo em dez réplicas. Duplicatas de 50 µL dessa mistura foram transferidas para a placa de microtitulação. Posteriormente, 50 microlitros de L-DOPA (L-dihidroxifenilalanina) a uma concentração de 4 g/L (Sigma-Aldrich, St. Louis, MO, EUA) foram adicionados a cada poço para ativar a enzima. As leituras de absorbância foram realizadas utilizando um leitor de microplacas Biochrom Anthos 2010 (São Paulo, Brasil) a 492 nm, com o programa ADAP configurado no modo de fotometria cinética. A atividade enzimática foi medida durante a fase linear da reação em intervalos de 60 segundos por 20 minutos, seguindo o método descrito por (Faraldo et al., 2006). Os dados foram submetidos ao teste não paramétrico de Kruskal-Wallis a um nível de significância de 5%, utilizando o software SAS Institute.
2.8 ESTRESSE OXIDATIVO
Para avaliar o estresse oxidativo, a peroxidação lipídica foi avaliada pela medição de substâncias reativas ao ácido tiobarbitúrico (TBARS) seguindo o método de (Ohkawa et al., 1979). Dez insetos adultos de cada tratamento foram homogeneizados em um banho de gelo usando 1,15% de KCl + 3 mM de EDTA. Posteriormente, o meio reacional foi preparado adicionando 0,3% de ácido tiobarbitúrico, 0,4% de dodecilsulfato de sódio (SDS) e 7,5% de ácido acético (pH 3,5). A mistura foi então aquecida a 95°C por uma hora. Após centrifugação, a absorbância do sobrenadante foi medida em um comprimento de onda de 535 nm. Os dados obtidos foram normalizados pela concentração de proteína do homogeneizado, medida de acordo com (Lowry et al., 1951). Esses dados foram analisados usando o teste não paramétrico de Kruskal-Wallis com um nível de significância de 5%, utilizando o software SAS Institute. Os níveis de Glutationa Reduzida (GSH) foram determinados pela medição de grupos sulfidrilas não proteicos, seguindo a metodologia de (Sedlak & Lindsay, 1968). A partir do homogeneizado obtido para a avaliação da peroxidação lipídica, 80 a 160 mg de tecido foram precipitados em uma solução de 5% de TCA. Em seguida, um volume do sobrenadante foi misturado com um meio reacional contendo TRIS 4 mM, EDTA 4 mM e DTNB 4 mM a pH 8,9. A reação foi incubada à temperatura ambiente por 5 minutos, e a absorbância foi medida a 412 nm. O resultado foi ajustado para a concentração de proteína do homogeneizado. Os dados relativos aos níveis de GSH assumiram normalidade e homogeneidade e foram analisados utilizando ANOVA, com médias comparadas usando o teste de Tukey a um nível de significância de 5%, conforme determinado pelo SAS Institute.
3. RESULTADOS
3.1 APOPTOSE NO INTESTINO MÉDIO DE APIS MELLIFERA
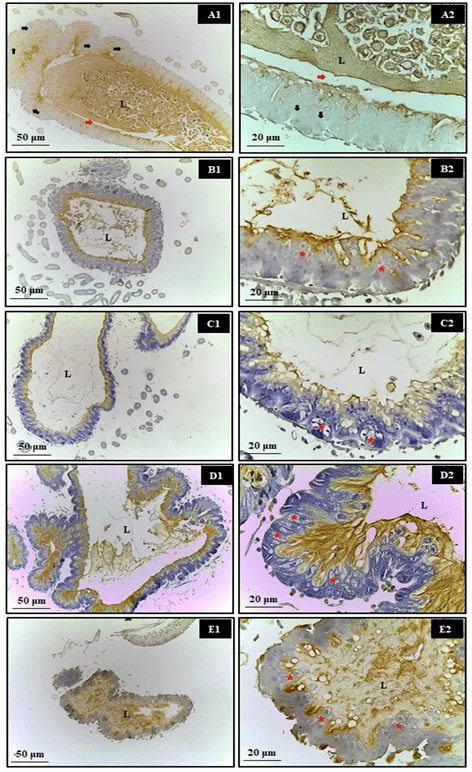
Em relação à avaliação imunohistoquímica do intestino médio das abelhas, não foram observados núcleos apoptóticos após a exposição a xenobióticos sintéticos (Roundup® e Karate®) e naturais (Azamax® e composto de Limoneno) após 24 horas. No entanto, o tecido epitelial apresentou degeneração celular caracterizada pela presença de vacúolos citoplasmáticos, sugerindo um processo necrótico. Acredita-se que esse dano celular possa ter sido um fator significativo que impediu essas células de secretar a matriz peritrófica, levando-as a entrar em contato com o conteúdo do lúmen e, consequentemente, com as enzimas digestivas (Figura 1).
Figura 1. Avaliação da apoptose no intestino médio de adultos de Apis mellifera, utilizando o teste Tunel. Em que, A1 e A2 – Controle, B1 e B2 – Azamax®, C1 e C2 – Limoneno, D1 e D2 – Roundup®, E1 e E2 – Karate®, L – Lúmen, Setas pretas – núcleos apoptóticos, Setas vermelhas – matriz peritrófica, Asterisco – Células vacuoladas
3.2 PROLIFERAÇÃO CELULAR DO INTESTINO MÉDIO
As células epiteliais não demonstraram ativação de mecanismos de regeneração pelo processo de proliferação celular em abelhas expostas a xenobióticos (Figura 2), sendo que a PCNA positiva foi identificada apenas no grupo controle (Figura 2A). As células epiteliais não apresentaram sinais de ativação de mecanismos de regeneração por meio do processo de proliferação celular em abelhas expostas a xenobióticos (Figura 2). A coloração positiva para PCNA foi observada apenas no grupo controle (Figura 2A).
Figura 2. Análise da proliferação celular (PCNA). Corte transversal do intestino médio de abelhas adultas, Apis mellifera. A- Controle, B- Azamax®, C- Limoneno, D- Roundup®, E- Karate®, L- Lúmen, asterisco- células regenerativas

3.3 A MEDIÇÃO DO ÓXIDO NÍTRICO
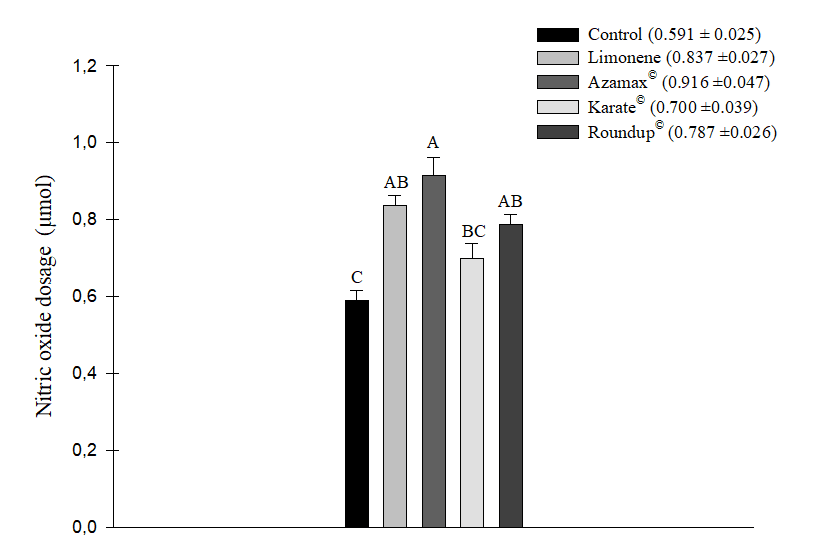
Após análise estatística, observou-se que todos os produtos químicos utilizados, nomeadamente Karate® (0,700 ± 0,039 µM de NO2), Limoneno (0,837 ± 0,027 µM de NO2), Azamax® (0,916 ± 0,047 µM de NO2) e Roundup® (0,787 ± 0,026 µM de NO2), aumentaram os níveis de óxido nítrico nas abelhas. No entanto, o aumento mais significativo foi observado no tratamento com Azamax®. O Limoneno não apresentou diferença estatisticamente significativa em comparação com ambos Azamax® e Roundup®. Embora as abelhas alimentadas com a solução mel+Karate® tenham apresentado uma resposta semelhante ao controle (0,591 ± 0,025 µM de NO2), ela não diferiu significativamente dos tratamentos com Roundup® e Limoneno, resultando em um aumento nos níveis de NO2 nas amostras (Figura 3).
Figura 3. Média (+SE) da dosagem de níveis de óxido nítrico (μM de NO2) em abelhas Apis mellifera submetidas à LC50 do composto Limoneno, ao inseticida Karate®, ao herbicida Roundup®, e à concentração de 250 µL/100 mL de Azamax®. Colunas com a mesma letra não diferem pelo teste Tukey HSD com 5% de probabilidade
3.4 ATIVIDADE DA FENOLOXIDASE
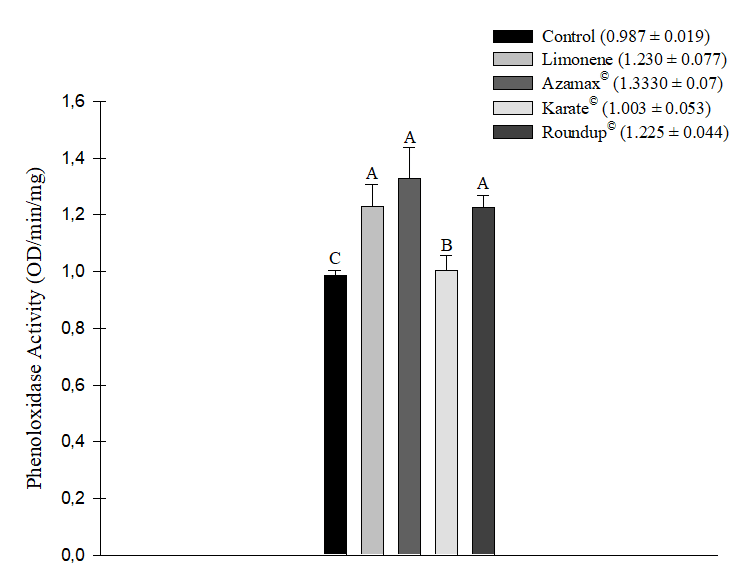
Todos os xenobióticos avaliados resultaram em aumento da atividade enzimática da fenoloxidase após 24 horas de exposição. Os aumentos mais significativos foram observados nos tratamentos com o biopesticida Azamax® (1,333 ± 0,107 OD/min/mg), seguido pelo composto Limoneno (1,230 ± 0,077 OD/min/mg) e pelo herbicida Roundup® (1,225 ± 0,044 OD/min/mg), que não diferiram significativamente entre si. Mais uma vez, o inseticida Karate® (1,003 ± 0,053 OD/min/mg) não apresentou diferença estatisticamente significativa em relação ao grupo controle (0,987 ± 0,019 OD/min/mg) (Figura 4).
Figura 4. Atividade enzimática da fenoloxidase (OD/min/mg) em abelhas Apis mellifera submetidas à CL50 do composto Limoneno, ao inseticida Karate®, ao herbicida Roundup® e à concentração de 250 µL/100 mL de Azamax®. Colunas com a mesma letra não diferem pelo teste não paramétrico de Kruskal-Wallis a 5% de probabilidade
3.5 ESTRESSE OXIDATIVO
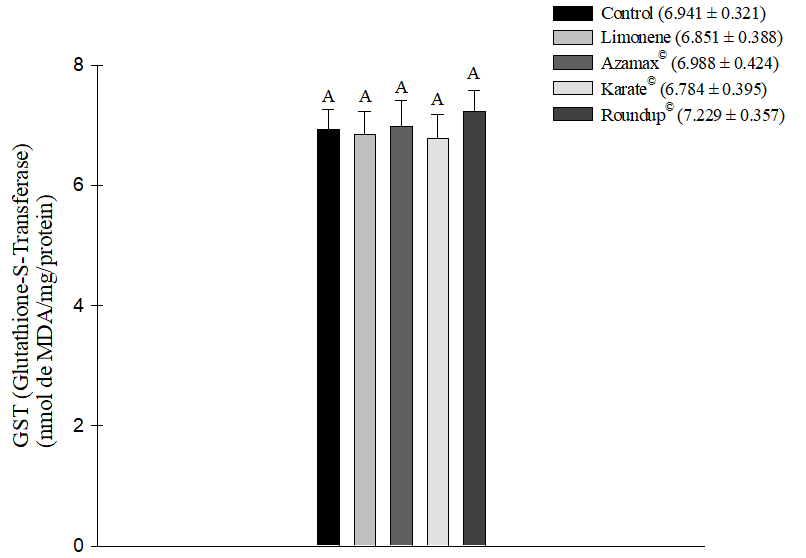
Todos os agentes químicos testados, exceto o Limoneno, demonstraram a capacidade de induzir um aumento no estresse oxidativo medido por TBARS, indicando peroxidação lipídica celular nas amostras de abelhas avaliadas. O herbicida Roundup® (1,838 ± 0,205 nmol de MDA/mg de proteína) foi particularmente notável, sendo o produto que induziu o estresse oxidativo mais significativo nas células, seguido pelo Azamax® (1,280 ± 0,070 nmol de MDA/mg de proteína) e pelo Karate® (1,214 ± 0,055 nmol de MDA/mg de proteína). Em contraste, o composto Limoneno (0,914 ± 0,096 nmol de MDA/mg de proteína) não mostrou diferença estatisticamente significativa em comparação com o grupo controle (0,782 ± 0,109 nmol de MDA/mg de proteína). Consequentemente, essa substância não promoveu esse tipo de estresse após 24 horas de exposição (Figura 5). Além disso, durante esse mesmo período de avaliação, não houve diferenças nos níveis de medição da Glutationa-S-Transferase (GSH) (Figura 6).
Figura 5. Estresse oxidativo a partir da medição do ácido tiobarbitúrico (TBARS) como indicador de peroxidação lipídica (nmol de MDA/mg de proteína) em Apis mellifera submetida à CL50 do composto Limoneno, ao inseticida Karate®, ao herbicida Roundup® e à concentração de 250 µL/100 mL de Azamax®. Colunas com a mesma letra não diferem pelo teste não paramétrico de Kruskal-Wallis a 5% de probabilidade
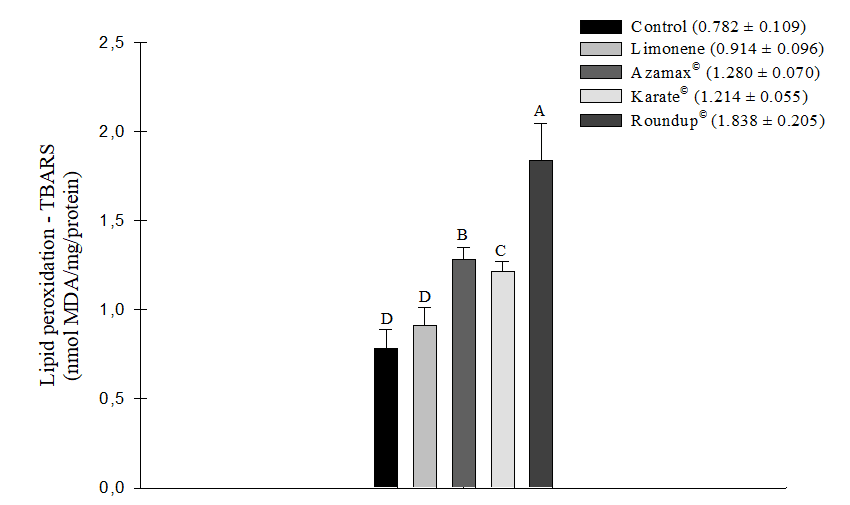
Figura 6. Estresse oxidativo a partir da medição da Glutationa-S-Transferase (GSH) em Apis mellifera submetida à CL50 do composto Limoneno, ao inseticida Karate®, ao herbicida Roundup® e à concentração de 250 µL/100 mL de Azamax®. Colunas com a mesma letra não diferem pelo teste de Tukey a 5% de probabilidade, para dados de GSH
4. DISCUSSÃO
As mudanças histopatológicas e imunológicas observadas nas abelhas tratadas sugerem que as substâncias testadas foram altamente prejudiciais a esses organismos e não permitiram tempo suficiente para ativar os mecanismos de regeneração (Illa-Bochaca & Montuenga, 2006; Caccia et al., 2019). Considerando que, em geral, os produtos naturais são considerados seletivos, esse achado é significativo. Os compostos naturais são principalmente avaliados por sua toxicidade aguda para insetos benéficos (Sabahi et al., 2022; Cappa et al., 2022). No entanto, há informações limitadas sobre como esses compostos afetam as abelhas em nível celular, o que tem graves implicações para sua fisiologia e saúde.
Braga et al. (2020) também identificaram a ausência de apoptose no intestino médio de ninfas de 5º instar do percevejo predador Podisus nigrispinus (Dallas), que haviam sido alimentadas com lagartas de Alabama argillacea (Hübner) tratadas com uma Dose Letal (DL50) de 2,50 e 2,82 mg/g de inseto, respectivamente, dos óleos de Mentha spicata L. e Melaleuca alternifolia Cheel. No entanto, em ninfas tratadas com M. alternifolia, foram observadas mudanças histopatológicas, como alongamento das células colunares e lise celular, sintomas semelhantes aos da necrose. A necrose é caracterizada pela dilatação do citoplasma, das mitocôndrias e do retículo endoplasmático, levando à ruptura celular e, consequentemente, à extravasação do conteúdo celular (Sun et al., 2021). Ambos os óleos consistem exclusivamente de terpenos, uma classe química à qual pertencem o Limoneno e a azadiractina. Portanto, a necrose do tecido epitelial pode ser um mecanismo de ação desses compostos em insetos.
Ao contrário das outras substâncias analisadas, o Limoneno não possui a molécula de oxigênio em sua composição, que é capaz de desencadear radicais livres prejudiciais ao corpo, tornando o indivíduo suscetível ao estresse oxidativo (Kumar et al., 2022). Além disso, há um relato de que monoterpenos podem ter propriedades antioxidantes (Yu et al., 2017). Portanto, não se esperava que o estresse oxidativo fosse uma das formas pelas quais o Limoneno age na fisiologia das abelhas.
O modo de ação do Limoneno está associado à inibição neuromuscular da acetilcolinesterase (AChE), levando ao acúmulo de AChE, que gera excitação neuronal e morte do inseto (García et al., 2005; Zarrad et al., 2017; Gadelhaq et al., 2023). Além disso, em A. mellifera, foram observados efeitos nas células intestinais, resultantes das lesões necróticas observadas no epitélio.
O estresse oxidativo observado nos outros tratamentos indica a ocorrência de peroxidação lipídica em abelhas, que, como consequência, leva a alterações nas funções fundamentais da membrana celular (Barbosa et al., 2010). Estudos relacionaram o processo apoptótico como uma das respostas celulares a esse estresse (Li & Wogan, 2005; Kim & Lee, 2020). No entanto, também pode ser a causa da ativação da necrose epitelial na população de A. mellifera testada, sendo esse efeito mais pronunciado em amostras tratadas com glifosato.
De fato, estudos sobre este herbicida mostraram seu impacto na sobrevivência e saúde de várias espécies de abelhas, sejam larvas ou adultos, seja expostos de forma aguda ou crônica. Essa exposição leva a alterações nos sistemas moleculares, celulares, histológicos e biológicos (Battisti et al., 2023). Um aspecto importante relatado por Liao et al. (2017) é que uma solução contendo água, açúcar e glifosato (10 ppb) foi considerada mais atraente para as abelhas quando comparada a uma solução sem o herbicida. Isso levanta preocupações sobre a contaminação potencial desses organismos através do néctar em seu ambiente natural.
O intestino médio constitui uma das primeiras barreiras de defesa dos insetos contra organismos patogênicos e xenobióticos (Schmid-Hempel, 2005). O comprometimento dessa função é confirmado pela ativação da cascata de fenoloxidase e alterações nos níveis de NO2, indicando o envolvimento de mecanismos de defesa humoral nas células das abelhas quando expostas a pesticidas sintéticos e naturais.
A baixa atividade da enzima fenoloxidase e o nível reduzido de NO2 nos testes com Karate® também foram observados por Silva et al. (2020) em percevejos da espécie Podisus nigrispinus (Dallas), submetidos a outro piretroide, deltametrina, ambos sob o tempo de avaliação de 24 horas. No entanto, após 72 horas de exposição, esses autores encontraram um aumento na atividade da fenoloxidase, simultaneamente com um aumento nos níveis de proteína total em P. nigrispinus. Mesmo assim, a análise da apoptose pelo teste de Tunel, no caso da população de abelhas amostrada nesta pesquisa, mostra necrose celular. Além disso, o inseticida Karate® e os outros compostos estudados causaram danos irreversíveis, pois não puderam ser acompanhados por reparo celular, levando consequentemente à morte do organismo (Miller & Zachary, 2017).
Estudos anteriores também demonstraram a repelência da azadiractina, o ingrediente ativo no Azamax®, para outras espécies de abelhas (Zhao et al., 2022) e vários insetos (Ikeura et al., 2013; Andrade et al., 2013). No caso de A. mellifera, foi observado o efeito repelente do Azamax® em concentrações acima de 250 µL/100 mL. Portanto, há potencial para este inseticida ser usado em programas de Manejo Integrado de Pragas (MIP) para preservar a abundância desses polinizadores em agroecossistemas. Isso porque o modo de ação da azadiractina está associado ao aumento da contaminação por ingestão (Martinez & Van Emden, 2001), e no campo, a probabilidade de contato com essa substância diminui. No entanto, devido aos fortes efeitos deletérios do Azamax® nos sistemas digestivo e imunológico das abelhas, é crucial ter cuidado para garantir que sua pulverização não coincida com o horário de forrageamento de A. mellifera.
A exposição desta população de A. mellifera ao inseticida natural Azamax® e ao Limoneno resultou em respostas análogas às induzidas pelos pesticidas sintéticos Karate® e Roundup®. Essas respostas incluíram a necrose do tecido epitelial e o comprometimento das funções da membrana. Apesar da suposta segurança do Limoneno e do Azamax® para organismos não-alvo, foram as substâncias que mais aumentaram significativamente os níveis de óxido nítrico e a atividade da enzima fenoloxidase em abelhas. No entanto, o Roundup® foi o tratamento que causou o estresse oxidativo mais significativo, e assim como o Karate®, possui o agravante de deixar resíduos nos substratos das colmeias. Como resultado, as abelhas também são afetadas pela exposição crônica a produtos químicos sintéticos.
5. CONCLUSÃO
Embora os inseticidas naturais testados aqui sejam considerados seguros para organismos não-alvo, esta pesquisa mostrou que é necessário cautela quanto ao seu uso em agroecossistemas. Eles foram capazes de causar efeitos prejudiciais no sistema imunológico das abelhas comparáveis aos pesticidas sintéticos. Portanto, mais pesquisas são necessárias para entender como os produtos naturais interferem na fisiologia das abelhas, a fim de garantir que os inseticidas botânicos usados na agricultura sejam realmente seletivos e uma alternativa segura aos pesticidas sintéticos.
AGRADECIMENTOS
Este trabalho foi apoiado em parte pela FACEPE (Fundação de Amparo à Ciência e Tecnologia do Estado de Pernambuco) sob o auxílio de R$ 36.000.
CONFLITO DE INTERESSE
Não há conflito de interesse por parte dos autores.
REFERÊNCIAS
ALMEHMADI, Roqaiah Mohammad. Larvicidal Histopathological and Ultra-structure Studies of Matrichiaria chamomella Extracts Against the Rift Valley Fever Mosquito Culex quinquefascia tus (Culicidaee: Diptera). Journal of Entomology-Academic Journals Inc., v. 8, n. 1, 2011.
ANDRADE, Lígia Helena de et al. Repellent effect of azadirachtin and essential oils on Aphis gossypii Glover (Hemiptera: Aphididae) in cotton plants. Revista Ciência Agronômica, v. 44, p. 628-634, 2013.
ASHE, Paula C.; BERRY, Mark D. Apoptotic signaling cascades. Progress in Neuro-Psychopharmacology and Biological Psychiatry, v. 27, n. 2, p. 199-214, 2003.
BARBOSA, Kiriaque Barra Ferreira et al. Oxidative stress: concept, implications and modulating factors. Rev Nutr, v. 23, n. 4, p. 629-43, 2010.
BARTLING, Merle T. et al. Exposure to low doses of pesticides induces an immune response and the production of nitric oxide in honeybees. Scientific Reports, v. 11, n. 1, p. 6819, 2021.
BATTISTI, Lucas et al. Review on the sublethal effects of pure and formulated glyphosate on bees: Emphasis on social bees. Journal of Applied Entomology, v. 147, n. 1, p. 1-18, 2023.
BRAGA, Valeska Andrea Ático et al. Effect of essential oils of Mentha spicata L. and Melaleuca alternifolia Cheel on the midgut of Podisus nigrispinus (Dallas)(Hemiptera: Pentatomidae). Acta Histochemica, v. 122, n. 3, p. 151529, 2020.
CACCIA, Silvia; CASARTELLI, Morena; TETTAMANTI, Gianluca. The amazing complexity of insect midgut cells: types, peculiarities, and functions. Cell and Tissue research, v. 377, p. 505-525, 2019.
CAPPA, Federico; BARACCHI, David; CERVO, Rita. Biopesticides and insect pollinators: Detrimental effects, outdated guidelines, and future directions. Science of the Total Environment, v. 837, p. 155714, 2022.
COSTA, Hilton Nobre et al. LAMBDA-CYHALOTHRIN PROMOTES OXIDATIVE STRESS AND PATHOLOGICAL CHANGES IN THE MIDGUT AND GONADS OF COTTON BOLL WEEVIL. International Journal of Biological and Natural Sciences, ISSN 2764-1813 v. 2, n. 2, 2022.
CRUZ, Glaucilane S. et al. Effect of trans-anethole, limonene and your combination in nutritional components and their reflection on reproductive parameters and testicular apoptosis in Spodoptera frugiperda (Lepidoptera: Noctuidae). Chemico-Biological Interactions, v. 263, p. 74-80, 2017.
DECOURTYE, A. et al. Comparative sublethal toxicity of nine pesticides on olfactory learning performances of the honeybee Apis mellifera. Archives of environmental contamination and toxicology, v. 48, p. 242-250, 2005.
EARDLEY, C. et al. Background to pollinators, pollination and food production. The Assessment Report on Pollinators, Pollination and Food Production; Ngo, HT, Eds, p. 1-25, 2016.
FARALDO, Ana Carolina et al. Nitric oxide production in blowfly hemolymph after yeast inoculation. Nitric Oxide, v. 13, n. 4, p. 240-246, 2005.
FARALDO, Ana Carolina et al. Prophenoloxidase activity in blowfly hemolymph after yeast inoculation. Resumos, 2006.
GADELHAQ, Sahar M. et al. D‐limonene nanoemulsion: lousicidal activity, stability, and effect on the cuticle of Columbicola columbae. Medical and Veterinary Entomology, v. 37, n. 1, p. 63-75, 2023.
GARCÍA, Matías et al. Toxic and repellent effects of Baccharis salicifolia essential oil on Tribolium castaneum. Pest Management Science: formerly Pesticide Science, v. 61, n. 6, p. 612-618, 2005.
GAVRIELI, Yael; SHERMAN, Yoav; BEN-SASSON, Shmuel A. Identification of programmed cell death in situ via specific labeling of nuclear DNA fragmentation. The Journal of cell biology, v. 119, n. 3, p. 493-501, 1992.
GIANNINI, Tereza C. et al. The dependence of crops for pollinators and the economic value of pollination in Brazil. Journal of economic entomology, v. 108, n. 3, p. 849-857, 2015.
GILL, Richard J.; RAINE, Nigel E. Chronic impairment of bumblebee natural foraging behaviour induced by sublethal pesticide exposure. Functional Ecology, v. 28, n. 6, p. 1459-1471, 2014.
GOULSON, Dave et al. Bee declines driven by combined stress from parasites, pesticides, and lack of flowers. Science, v. 347, n. 6229, p. 1255957, 2015.
GRAYSTOCK, Peter et al. The T rojan hives: pollinator pathogens, imported and distributed in bumblebee colonies. Journal of Applied Ecology, v. 50, n. 5, p. 1207-1215, 2013.
GREEN, Laura C. et al. Nitrate biosynthesis in man. Proceedings of the National Academy of Sciences, v. 78, n. 12, p. 7764-7768, 1981.
GREGORC, Ales; ELLIS, James D. Cell death localization in situ in laboratory reared honey bee (Apis mellifera L.) larvae treated with pesticides. Pesticide biochemistry and physiology, v. 99, n. 2, p. 200-207, 2011.
HERBERT, Lucila T. et al. Effects of field-realistic doses of glyphosate on honeybee appetitive behaviour. Journal of experimental biology, v. 217, n. 19, p. 3457-3464, 2014.
IKEURA, Hiromi; SAKURA, Akio; TAMAKI, Masahiko. Repellent effect of neem against the cabbage armyworm on leaf vegetables. Journal of Agriculture and Sustainability, v. 4, n. 1, 2013.
ILLA-BOCHACA, Irineu; MONTUENGA, Luis M. The regenerative nidi of the locust midgut as a model to study epithelial cell differentiation from stem cells. Journal of experimental biology, v. 209, n. 11, p. 2215-2223, 2006.
ISMAN, Murray B. Botanical insecticides, deterrents, and repellents in modern agriculture and an increasingly regulated world. Annu. Rev. Entomol., v. 51, p. 45-66, 2006.
ISMAN, Murray B. Botanical insecticides in the twenty-first century—fulfilling their promise?. Annual Review of Entomology, v. 65, p. 233-249, 2020.
JUNQUEIRA, Luiz Carlos Uchoa; JUNQUEIRA, L. M. M. S. Técnicas básicas de citologia e histologia. São Paulo: Santos, v. 8, p. 3, 1983.
KIM, Heesu; LEE, Dong Gun. Nitric oxide–inducing Genistein elicits apoptosis-like death via an intense SOS response in Escherichia coli. Applied Microbiology and Biotechnology, v. 104, p. 10711-10724, 2020.
KLEIN, Alexandra-Maria et al. Importance of pollinators in changing landscapes for world crops. Proceedings of the royal society B: biological sciences, v. 274, n. 1608, p. 303-313, 2007.
KUMAR, Debaditya et al. Oxidative stress and apoptosis in Asian honey bees (A. cerana) exposed to multiple pesticides in intensive agricultural landscape. Apidologie, v. 53, n. 2, p. 25, 2022.
LI, Chun-Qi; WOGAN, Gerald N. Nitric oxide as a modulator of apoptosis. Cancer letters, v. 226, n. 1, p. 1-15, 2005.
LIAO, Ling-Hsiu; WU, Wen-Yen; BERENBAUM, May R. Behavioral responses of honey bees (Apis mellifera) to natural and synthetic xenobiotics in food. Scientific Reports, v. 7, n. 1, p. 15924, 2017.
LOSA, Marco et al. Determination of the proliferation and apoptotic index in adrenocorticotropin-secreting pituitary tumors: comparison between micro-and macroadenomas. The American journal of pathology, v. 156, n. 1, p. 245-251, 2000.
LOWRY, OliverH et al. Protein measurement with the Folin phenol reagent. Journal of biological chemistry, v. 193, n. 1, p. 265-275, 1951.
MARTINEZ, Sueli S.; VAN EMDEN, Helmut F. Growth disruption, abnormalities and mortality of Spodoptera littoralis (Boisduval)(Lepidoptera: Noctuidae) caused by azadirachtin. Neotropical Entomology, v. 30, p. 113-125, 2001.
MAULIK, Nilanjana; YOSHIDA, Tetsuya; DAS, Dipak K. Oxidative stress developed during the reperfusion of ischemic myocardium induces apoptosis. Free Radical Biology and Medicine, v. 24, n. 5, p. 869-875, 1998.
MICHENER, C. D. The Bees of the World Johns Hopkins University Press. Baltimore, Md, USA, 2007.
MILLER, Margaret A.; ZACHARY, James F. Mechanisms and morphology of cellular injury, adaptation, and death. Pathologic basis of veterinary disease, p. 2, 2017.
MULLIN, Christopher A. et al. High levels of miticides and agrochemicals in North American apiaries: implications for honey bee health. PloS one, v. 5, n. 3, p. e9754, 2010.
NEGREIRO, Maria Cláudia Cordeiro; DE ANDRADE, Fábio Goulart; FALLEIROS, Ângela Maria Ferreira. Sistema imunológico de defesa em insetos: uma abordagem em lagartas da soja, Anticarsia gemmatalis Hübner (Lepidoptera: Noctuidae), resistentes ao AgMNPV. Semina: Ciências Agrárias, v. 25, n. 4, p. 299-313, 2004.
OLIVEIRA, Fernanda M. et al. Histological, histochemical and energy disorders caused by R-limonene on Aedes aegypti L. larvae (Diptera: Culicidae). Acta Tropica, v. 221, p. 105987, 2021.
OHKAWA, Hiroshi; OHISHI, Nobuko; YAGI, Kunio. Assay for lipid peroxides in animal tissues by thiobarbituric acid reaction. Analytical biochemistry, v. 95, n. 2, p. 351-358, 1979.
POTTS, Simon G. et al. Global pollinator declines: trends, impacts and drivers. Trends in ecology & evolution, v. 25, n. 6, p. 345-353, 2010.
POTTS, Simon G. et al. The assessment report on pollinators, pollination and food production: summary for policymakers. Secretariat of the Intergovernmental Science-Policy Platform on Biodiversity and Ecosystem Services, 2016.
RUIZ-TOLEDO, Jovani; SÁNCHEZ-GUILLÉN, Daniel. Effect of the concentration of glyphosate present in body waters near transgenic soybean fields on the honeybee Apis mellifera, and the stingless bee Tetragonisca angustula. Acta zoológica mexicana, v. 30, n. 2, p. 408-413, 2014.
SABAHI, Qodratollah; KELLY, Paul Gordon; GUZMAN‐NOVOA, Ernesto. Carvone and citral, two promising compounds for controlling the honey bee ectoparasitic mite, Varroa destructor. Journal of Applied Entomology, v. 146, n. 8, p. 1003-1010, 2022.
SEDLAK, Jozef; LINDSAY, Raymond H. Estimation of total, protein-bound, and nonprotein sulfhydryl groups in tissue with Ellman’s reagent. Analytical biochemistry, v. 25, p. 192-205, 1968.
SILVA, Cristiane TS et al. Immune and nutritional responses of Podisus nigrispinus (Hemiptera: Pentatomidae) nymphs sprayed with azadirachtin. Austral Entomology, v. 59, n. 1, p. 215-224, 2020.
SOLOMON, Robert W. Free and open source software for the manipulation of digital images. American Journal of Roentgenology, v. 192, n. 6, p. W330-W334, 2009.
SOUZA, Catiane Oliveira et al. Toxicology, histophysiological and nutritional changes in Apis mellifera (Hymenoptera: Apidae) submitted to limonene and natural pesticides in comparison to synthetic pesticides. Journal of Apicultural Research, p. 1-12, 2023.
SUN, Zhipeng et al. Rotenone-induced necrosis in insect cells via the cytoplasmic membrane damage and mitochondrial dysfunction. Pesticide Biochemistry and Physiology, v. 173, p. 104801, 2021.
SCHMID-HEMPEL, Paul. Evolutionary ecology of insect immune defenses. Annu. Rev. Entomol., v. 50, p. 529-551, 2005.
WU, Xing et al. Determination of the apoptotic index in osteosarcoma tissue and its relationship with patients prognosis. Cancer Cell International, v. 13, p. 1-4, 2013.
YU, Lihua; YAN, Jing; SUN, Zhiguang. D-limonene exhibits anti-inflammatory and antioxidant properties in an ulcerative colitis rat model via regulation of iNOS, COX-2, PGE2 and ERK signaling pathways. Molecular medicine reports, v. 15, n. 4, p. 2339-2346, 2017.
ZARRAD, Khaoula et al. Chemical composition and insecticidal effects of Citrus aurantium of essential oil and its powdery formulation against Tuta absoluta. Tunis. J. Plant Prot, v. 12, p. 83-94, 2017.
ZATTARA, Eduardo E.; AIZEN, Marcelo A. Worldwide occurrence records suggest a global decline in bee species richness. One Earth, v. 4, n. 1, p. 114-123, 2021.
ZHAO, Kunyu et al. Effects of sublethal azadirachtin on the immune response and midgut microbiome of Apis cerana cerana (Hymenoptera: Apidae). Ecotoxicology and Environmental Safety, v. 229, p. 113089, 2022.
[1] Mestrado em Entomologia – UFRPE. ORCID: 0009-0009-3350-2334. Currículo Lattes: http://lattes.cnpq.br/3858015372572475.
[2] Doutorado em Tecnologia Nuclear – USP. ORCID: 0000-0001-9533-5476. Currículo Lattes: http://lattes.cnpq.br/4292195468804301.
[3] Orientador. Doutorado em Química – UFRPE. ORCID: 0000-0001-8508-1230. Currículo Lattes: http://lattes.cnpq.br/5615678215435460.
[4] Mestrado em Entomologia – UFRPE. ORCID: 0000-0002-6223-7113. Currículo Lattes: http://lattes.cnpq.br/5156282820589894.
[5] Doutorado no Programa de Pós-Graduação em Entomologia – UFRPE. ORCID: 0000-0001-6012-1945. Currículo Lattes: http://lattes.cnpq.br/3795270436231657.
[6] Doutorado em Entomologia – UFRPE. ORCID: 0000-0002-4270-1476. Currículo Lattes: http://lattes.cnpq.br/8583960034442631.
[7] Doutorado em Química – USP. ORCID: 0000-0002-7597-6775. Currículo Lattes: http://lattes.cnpq.br/6957579091162269.
[8] Doutor em Bioquímica. ORCID: 0000-0002-6041-1720. Currículo Lattes: http://lattes.cnpq.br/4162837199448101.
[9] Doutorado em Produção Animal pela Faculdade de Ciências Agrárias e Veterinárias, Jaboticabal, UNESP. ORCID: 0000-0002-3488-4778. Currículo Lattes: http://lattes.cnpq.br/3266223126925865.
[10] Doutorado em Bioquímica e Fisiologia, Mestrado em Fisiologia, Biólogo. ORCID: 0000-0003-1493-7964. Currículo Lattes: http://lattes.cnpq.br/9044747136928972.
[11] Doutorado em Morfologia – UNIFESP. ORCID: 0000-0001-5940-9220. Currículo Lattes: http://lattes.cnpq.br/1539131079574469.
Material recebido: 05 de dezembro de 2023.
Material aprovado pelos pares: 30 de janeiro de 2024.
Material editado aprovado pelos autores: 16 de fevereiro de 2024.

