ARTÍCULO ORIGINAL
NASCIMENTO, Bruno José do [1], PEREIRA, Alef de Moura [2], BRAGA, Valeska Andrea Ático [3], SILVA, Maria Vanessa da [4], SANTOS, Yasmim Barbosa dos [5], LAPA NETO, Clovis José Cavalcanti [6], MEDINA, Vanessa Bischoff [7], SOARES, Anísio Francisco [8], TEIXEIRA, Álvaro Aguiar Coelho [9], TEIXEIRA, Valéria Wanderley [10]
NASCIMENTO, Bruno José do. et al. Efecto de la melatonina en la histofisiología del hígado de ratas adolescentes expuestas al alcohol. Revista Científica Multidisciplinar Núcleo do Conhecimento. Año 08, Ed. 08, Vol. 04, pp. 152-174. Agosto de 2023. ISSN: 2448-0959. Enlace de acceso: https://www.nucleodoconhecimento.com.br/biologia-es/higado-de-ratas-adolescentes, DOI: 10.32749/nucleodoconhecimento.com.br/biologia-es/higado-de-ratas-adolescentes
RESUMEN
El presente estudio evaluó si la melatonina administrada durante la adolescencia puede prevenir los efectos perjudiciales producidos por el alcohol en el hígado. Se utilizaron treinta ratas albinas hembra (Rattus norvegicus albinus), de 40 días de edad, vírgenes, con un peso aproximado de 150±10g, de la línea Wistar, y se dividieron en los siguientes grupos: I – Ratas adolescentes que no recibieron alcohol y fueron sacrificadas a los 60 días de vida; II – Ratas adolescentes sometidas a consumo crónico de alcohol y sacrificadas a los 60 días de vida; III – Ratas adolescentes sometidas a consumo crónico de alcohol y tratadas simultáneamente con melatonina, y sacrificadas a los 60 días de vida. Los órganos recolectados fueron sometidos a procesamiento histológico y para obtener los resultados se realizaron análisis morfométricos, histopatológicos e histoquímicos. El alcohol se administró por gavage (sonda gástrica) en una dosis de 3 g/Kg de alcohol etílico en las ratas de los grupos II y III durante 20 días. La melatonina se administró en inyecciones diarias de 0,8 mg/Kg, siempre al inicio de la noche, por vía intraperitoneal durante 20 días. Al analizar el peso de los animales, no se observaron diferencias significativas entre los grupos. Los animales del grupo II presentaron alteraciones en los hígados, como congestión de la vena centrolobulillar, hepatocelular, microgoticular, infiltrado leucocitario, varios núcleos picnóticos en los hígados, aumento del parénquima lobulillar y reducción del parénquima no lobulillar, mayor deposición de colágeno y reducción de glucógeno. El tratamiento con melatonina previno todos estos cambios. Con esto, podemos concluir que la melatonina tiene un gran potencial terapéutico en la prevención del daño hepático en ratas adolescentes expuestas a un consumo moderado de alcohol, además de efectos positivos en la deposición de colágeno y glucógeno en el hígado.
Palabras clave: Adolescentes, Alcohol, Antioxidante, Hígado, Inflamación.
1. INTRODUCCIÓN
El consumo de bebidas alcohólicas es común en todo el mundo, y factores como la edad, la cultura, el género y la religión influyen tanto en la frecuencia como en el volumen consumido. Aproximadamente el 43% de la población mundial consume bebidas alcohólicas, y en la región de las Américas, este índice es más alto que a nivel global, alcanzando el 54% (OMS, 2018). En Brasil, aproximadamente 25 millones de habitantes, equivalentes al 16,5% de la población, consumieron más alcohol en 2015 (FIOCRUZ, 2017). Según Andrade; Siu (2019), en 2016, la región de las Américas ocupó el tercer lugar en el mundo en relación al consumo excesivo de alcohol por parte de los jóvenes, registrando un porcentaje del 18,5%, solo superada por el Pacífico Occidental (18,8%) y Europa (24,1%). En Brasil, los jóvenes de 18 a 24 años están en segundo lugar en la proporción de consumo de alcohol, correspondiendo al 35,1%, superados solo por los individuos de 35 a 34 años (38,1%) (FIOCRUZ, 2017). Según la OMS (2018), en 2016, la prevalencia de mujeres que consumían alcohol era del 32,3%, menor que la de los hombres, que era del 53,6%. A pesar de que los índices apuntan a un menor consumo de bebidas alcohólicas por parte de las mujeres, estas se ven más afectadas, ya que biológicamente son más vulnerables a los efectos del alcohol que los hombres. Por lo tanto, tienen más probabilidades de desarrollar problemas relacionados con el alcohol incluso con niveles de consumo más bajos y/o a una edad más temprana que los hombres (ANDRADE; SIU, 2019).
El EtOH es una molécula pequeña, no cargada y soluble en agua, y por esta razón puede cruzar fácilmente las membranas celulares (NORBERG et al., 2003; VONGHIA et al., 2008). El alcohol ingerido es metabolizado por el hígado, donde se encuentra la mayor cantidad de enzimas metabolizadoras (MINCIS; et al., 2011). Después de su absorción, el EtOH se convierte por la Alcohol Deshidrogenasa (ADH), la catalasa o el citocromo P450 2E1 (CYP2E1) en acetaldehído. Después de este paso, la Aldehído Deshidrogenasa (ALDH) convierte el acetaldehído en acetato (BEST; LAPOSATA, 2003). Estas reacciones promueven un aumento de la actividad de la cadena respiratoria y, en consecuencia, un aumento de la producción de ROS (BROCARDO et al., 2011). Los productos del alcohol han sido considerados hepatotoxinas que actúan directa o indirectamente en el órgano (ROCCO et al., 2014), además de causar necrosis o apoptosis de los hepatocitos (FARKAS; KEMÉNY, 2013).
Dado que el hígado es el principal órgano responsable de metabolizar el alcohol, es el que más sufre los efectos perjudiciales de este xenobiótico (ROCCO et al., 2014). La exposición continua al EtOH conduce a la progresión de la acumulación de grasa en el hígado, esteatosis, al estado inflamado, esteatohepatitis (YANG et al., 2010). La esteatosis es la enfermedad alcohólica inicial, luego pueden ocurrir inflamación subsiguiente y hepatitis alcohólica, lo que resulta en fibrosis hepática (FARKAS; KEMÉNY, 2013).
La melatonina, una hormona producida principalmente por la glándula pineal, con la capacidad de realizar numerosas acciones mediadas por receptores y no dependientes de estos, puede actuar en el control del ciclo circadiano, promover el sueño y realizar una acción antioxidante, reduciendo el estrés oxidativo, además de tener propiedades antiinflamatorias y antiapoptóticas (HARDELAND; PANDI-PERUMAL; CARDINALI, 2006; MAHIEU et al., 2009; REITER; TAN; GALANO, 2014). Su capacidad antioxidante se descubrió en 1993 (POEGGELER et al., 1993) y se ha utilizado en la prevención de enfermedades causadas por el estrés oxidativo, debido a su capacidad para eliminar los radicales libres y mejorar los niveles de antioxidantes (NWOZO; AJAGBE; OYINLOYE, 2012). Esta indolamina y sus metabolitos actúan en la eliminación directa de varios radicales libres, como el radical hidroxilo (OH), el peroxinitrito (ONOO), el óxido nítrico (NO) y el radical O2, además de las especies reactivas de oxígeno, nitrógeno y azufre (AMARAL et al., 2019; GALANO; TAN; REITER et al., 2018; GUNATA; PARLAKPINAR; ACET, 2020).
Con respecto al hígado, algunos estudios con ratas sometidas al consumo de alcohol ya han demostrado aspectos positivos de la administración de melatonina en la estructura del hígado (KURCER et al., 2007; KURHALUK; TKACHENKO; LUKASH, 2020), en la actividad de enzimas antioxidantes (KURCER et al., 2007), la inhibición de citocinas proinflamatorias (HU et al., 2019) y la apoptosis (ULLAH et al., 2020). Por lo tanto, esta indolamina tiene un gran potencial para prevenir los cambios causados por el alcohol. Por lo tanto, este trabajo tuvo como objetivo evaluar si la melatonina administrada a ratas adolescentes podría prevenir los efectos perjudiciales producidos por el alcohol en el hígado.
2. MATERIAL Y MÉTODOS
2.1 ADQUISICIÓN DE ANIMALES
Se utilizaron treinta ratas albinas hembra (Rattus norvegicus albinus), de 40 días de edad, vírgenes, con un peso aproximado de 130±10g, de la línea Wistar, procedentes del Vivero del Departamento de Morfología y Fisiología Animal (DMFA), de la Universidad Federal Rural de Pernambuco (UFRPE). Los animales fueron confinados en jaulas y se les proporcionó alimento y agua ad libitum, con una temperatura de 22±1ºC e iluminación artificial producida por lámparas fluorescentes (marca Phillips, modelo luz diurna, 40W), con un fotoperíodo de 12 horas de luz y 12 horas de oscuridad, considerando el período de luz de 6:00 a.m. a 6:00 p.m. Después de un período de adaptación de siete días, se tomaron frotis vaginales para determinar el ciclo estral. Se seleccionaron las hembras que tuvieron tres ciclos estrales regulares consecutivos para el experimento, que consistió en los siguientes grupos experimentales con 10 animales cada uno:
Control: ratas adolescentes que no recibieron alcohol y fueron sacrificadas a los 60 días de edad.
Alcohol: ratas adolescentes sometidas a consumo crónico de alcohol y sacrificadas a los 60 días de vida.
Alcohol + Melatonina: ratas adolescentes sometidas a consumo crónico de alcohol y tratadas simultáneamente con melatonina y sacrificadas a los 60 días de vida.
Los experimentos fueron aprobados por el comité de ética institucional bajo la licencia CEUA/UFRPE Nº 041/2019.
2.2 ADMINISTRACIÓN DE ETANOL
Se administró por gavage (sonda gástrica) en una dosis de 3 g/kg de etanol etílico en las ratas de los grupos II y III durante 20 días (ARAÚJO-FILHO et al., 2007; MARCO et al., 2017; SCHEIDT et al., 2015; VARLINSKAYA; SPEAR; SPEAR, 2001; VEIGA et al., 2007).
2.3 TRATAMIENTO CON MELATONINA
La melatonina, N-acetil-5-metoxitriptamina (Sigma Chemical Co., St. Louis, EE. UU.), se administró en inyecciones diarias de 0.8 mg/kg, durante un período de 20 días. Para esto, la melatonina se disolvió en 0.2 mL de etanol y se diluyó en 0.8 mL de NaCl al 0.9%. Las inyecciones se aplicaron por vía intraperitoneal, entre las 6:00 pm y las 7:00 pm. Esta dosis es comparable a la dosis humana (9 mg/kg), que se convirtió en función de la superficie corporal (ABD-ALLAH et al., 2003; MOUSTAFA et al., 1999; PAGET; BARNE, 1994). Los animales de los grupos I y II recibieron el vehículo de la hormona.
2.4 PESO DE LOS ANIMALES
Las ratas fueron pesadas diariamente durante todo el período experimental y para el análisis estadístico se consideraron los días 1, 10 y 20.
2.5 HISTOPATOLOGÍA E HISTOQUÍMICA DEL HÍGADO
Para la recolección del hígado, las ratas fueron anestesiadas con clorhidrato de ketamina (80 mg/kg) y xilazina (6.0 mg/kg) por vía intramuscular. Luego, se abrió la cavidad abdominal para extraer el órgano. Las ratas fueron sacrificadas utilizando anestesia profunda con clorhidrato de ketamina (80mg/Kg) y xilazina (6mg/Kg), asociada con tiopental (100 mg/kg), por vía intraperitoneal. Los fragmentos de hígado se sumergieron en formalina tamponada al 10% y pH 7.4, permaneciendo allí durante 48 horas. Después de estos procedimientos, se deshidrataron en alcohol etílico (concentraciones crecientes), se aclararon con xilol, se impregnaron y se incluyeron en parafina. Los bloques de parafina se cortaron en un microtomo tipo Minot (Leica RM 2035) ajustado a 5 μm. Las secciones obtenidas de esta manera se colocaron en portaobjetos de vidrio y se llevaron a un horno regulado a una temperatura de 37°C durante 24 horas, para secado y montaje. A continuación, las secciones se tiñeron con hematoxilina-eosina (HE), picrosirius y PAS (Pérdida de Schiff periódica) y se analizaron en un microscopio de luz OLYMPUS BX-49 y se fotografiaron en un microscopio OLYMPUS BX-50.
2.6 MORFOMETRÍA
Se llevó a cabo un estudio morfométrico según la metodología descrita por Engelman et al. (2001). La proporción entre el parénquima no lobulillar y lobulillar del hígado de las ratas en los grupos experimentales se determinó mediante métodos estereológicos, utilizando una rejilla con 100 puntos de prueba, colocada en las secciones de las preparaciones histológicas teñidas con tricromo de Mallory, ya que esto facilita la visualización. de los espacios portales al usar métodos estereológicos. El recuento se realizó en tres portaobjetos, de modo que se contaron 10 campos utilizando el objetivo 40x, haciendo un total de 3,000 puntos por grupo.
Se realizó una evaluación semicuantitativa de los puntajes de cambio hepático propuestos por el Comité NASH de la Red de Investigación Clínica sobre Patología (Esteatohepatitis no alcohólica) (KLEINER et al., 2005), que son los siguientes: esteatosis (<5% = 0; 5-33% = 1; 33-66% = 2; > 66% = 3); inflamación lobulillar (ninguna = 0; 2 focos = 1; 2-4 focos = 2; > 4 focos = 3); y balonización hepatocelular (ninguna = 0; pocas = 1; prominentes = 2). Todas las características se puntuaron a ciegas en tres portaobjetos/grupo, evaluados cinco campos/portaobjetos. Para ello, las imágenes se capturaron con una cámara de video Sony® acoplada a un microscopio Olympus® Bx50. Todas las cuantificaciones se realizaron utilizando el editor de imágenes Gimp®2.8.
2.7 ANÁLISIS ESTADÍSTICO
Para comparar el peso de las ratas, los datos de morfometría y triaje e histoquímica, se realizó el análisis de varianza y, cuando fue significativo, se complementó con la prueba de comparaciones múltiples de Tukey y Kramer. Se adoptó un nivel de significación de 0.05 (P < 0.05).
3. RESULTADOS
3.1 PESO DE LOS ANIMALES
No hubo diferencia significativa entre los pesos de las ratas tratadas con alcohol, alcohol + melatonina en comparación con el grupo control en los días 1, 10 y 20 (Tabla 1).
Tabla 1: Media ± desviación estándar del peso de las ratas en los grupos experimentales, en los días 1, 10 y 20
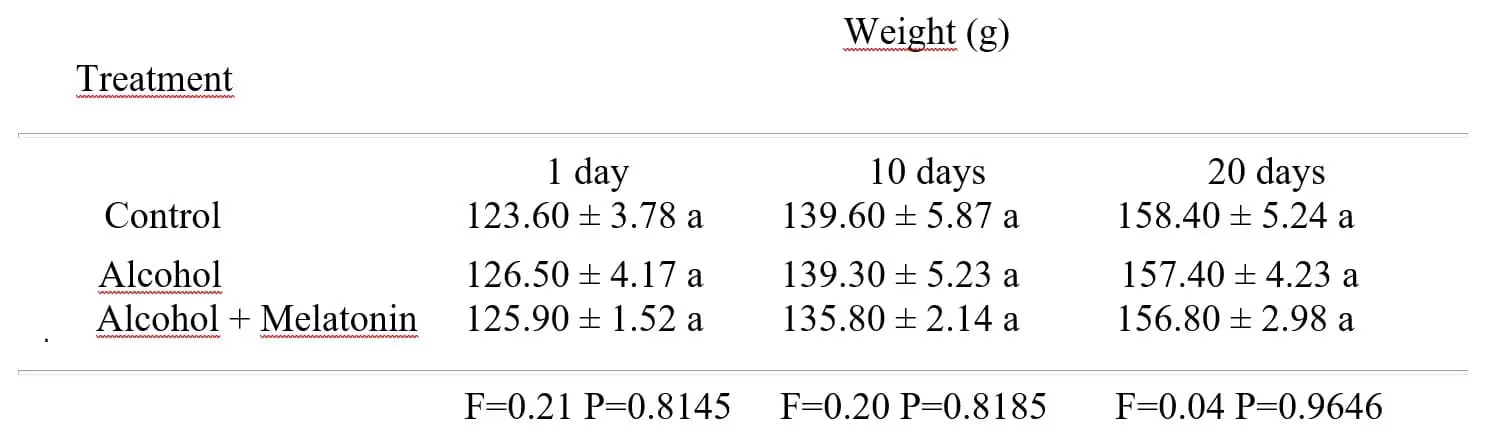
1 Las medias seguidas de la misma letra no difieren según la prueba de Tukey y Kramer (P < 0.05).
3.2 ANÁLISIS HISTOPATOLÓGICO DEL HÍGADO
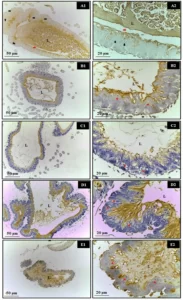
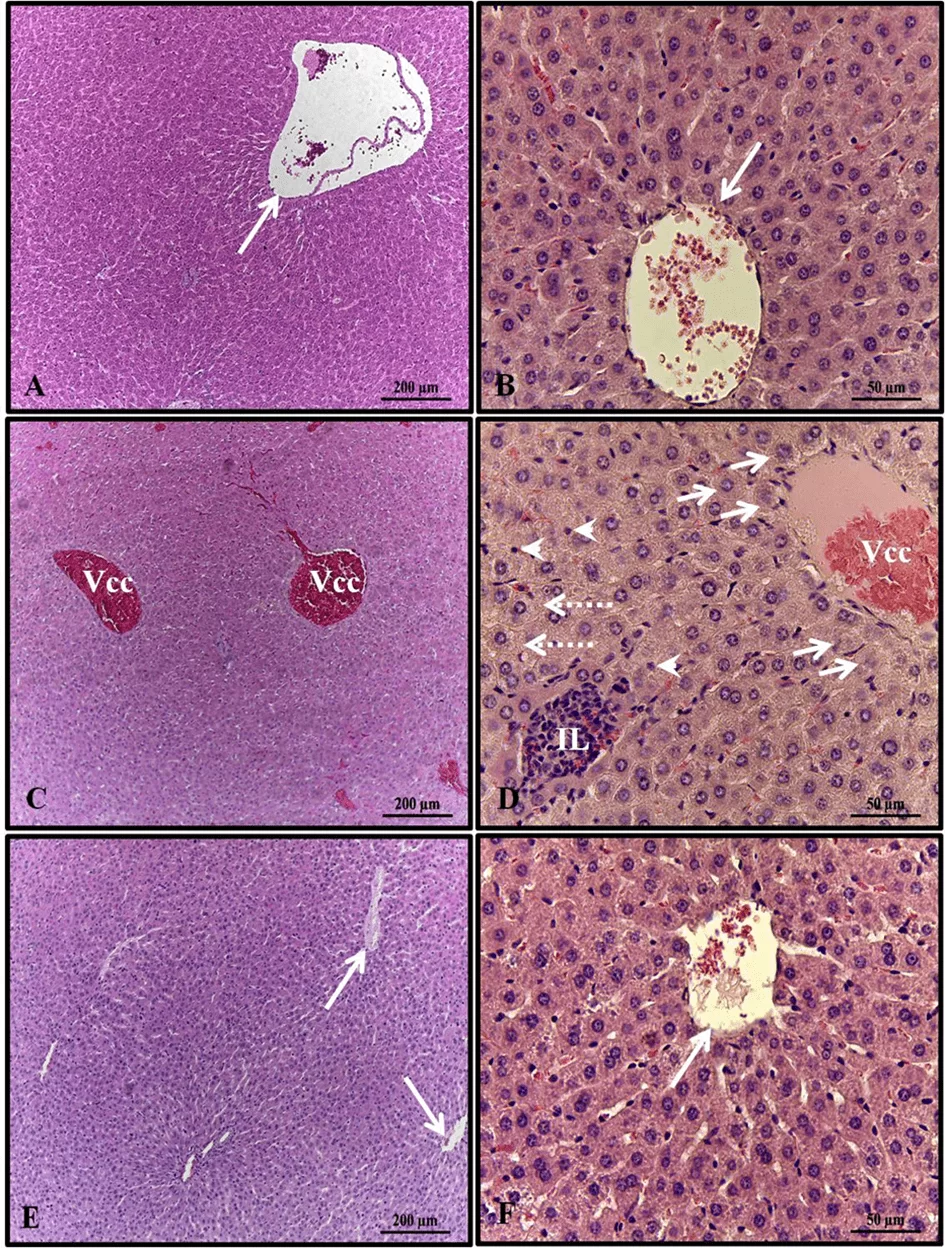
El análisis histopatológico del hígado de las hembras en los grupos de control y alcohol + melatonina reveló un parénquima hepático sin cambios, con cordones de hepatocitos organizados alrededor de la vena lobulillar central, entremezclados con capilares sinusoidales. Sin embargo, en los hígados de las ratas del grupo de alcohol, se observaron congestión de la vena centrilobulillar, hepatocitos con inflamación en las áreas alrededor de las venas centrilobulillares, esteatosis microgoticular, infiltrado de leucocitos y varios hepatocitos con núcleos picnóticos (Fig. 1).
Figura 1. Fotomicrografía de hígados de hembras en grupos experimentales. A – B (control); C–D (alcohol); E – F (alcohol + melatonina). Vena lobulillar central sin congestión (flecha larga); Vena lobulillar central con congestión (Vcc); Hepatocitos con inflamación (flechas cortas); infiltrado de leucocitos (IL); Esteatosis multigoticular (flechas punteadas); Hepatocitos con núcleos picnóticos (puntas de flecha). HE
3.3 ANÁLISIS MORFOMÉTRICO DEL HÍGADO
Hubo un aumento en el porcentaje de parénquima lobulillar, lo que provocó una reducción en el parénquima no lobulillar en el hígado de las ratas del grupo de alcohol. La melatonina previno este efecto, presentando parámetros similares en relación al grupo de control (Tabla 2).
Tabla 2. Media ± desviación estándar del porcentaje de parénquima lobulillar y no lobulillar en el hígado de hembras en los grupos experimentales
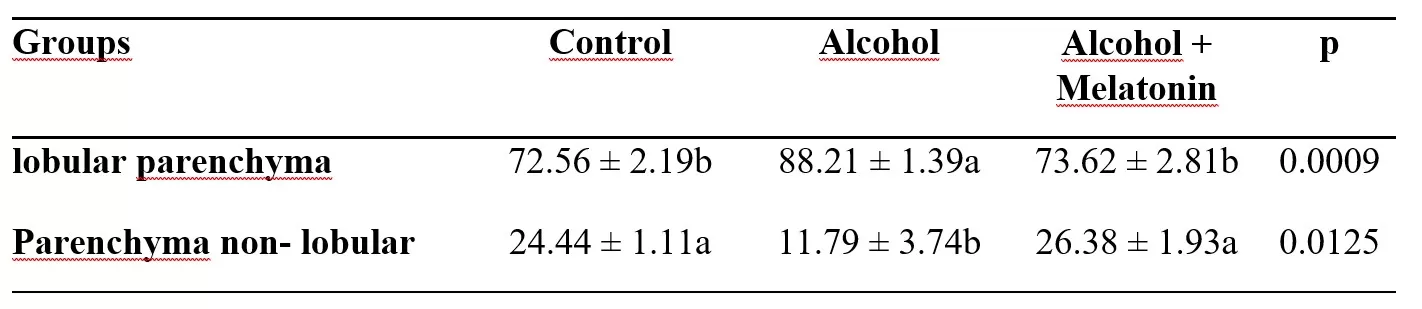
Las medias seguidas por la misma letra en las filas no difieren significativamente según la prueba de Tukey y Kramer (p<0,05).
3.4 PUNTUACIONES DE ALTERACIONES DEL HÍGADO
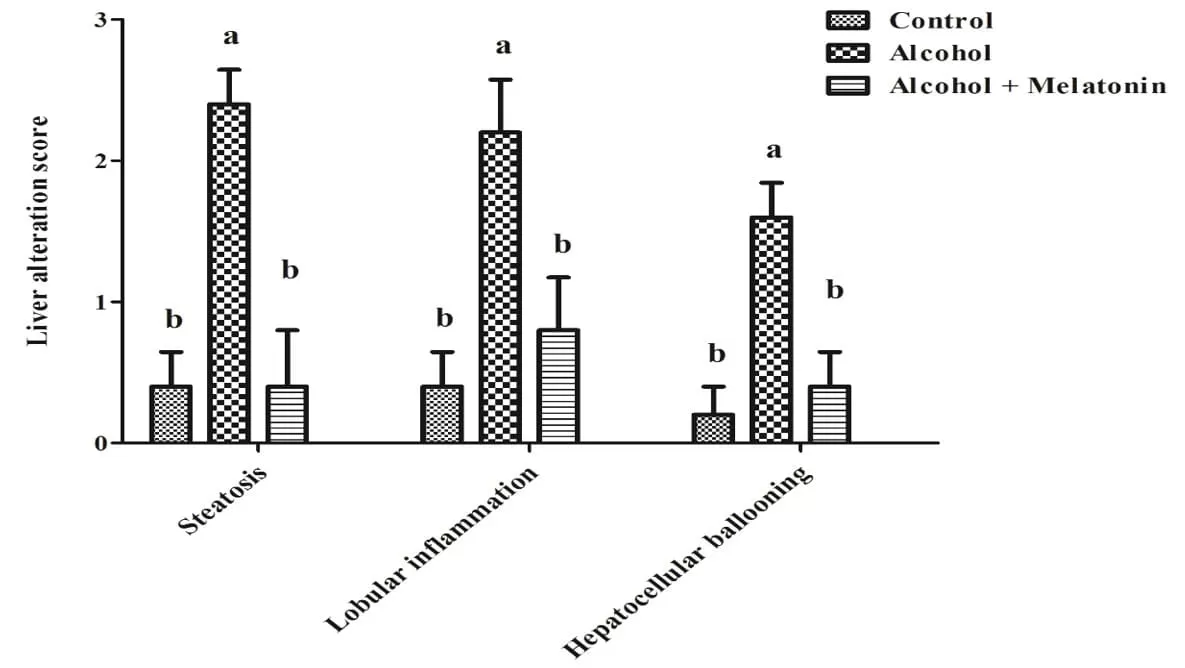
En la evaluación semicuantitativa de las puntuaciones de las alteraciones del hígado, las hembras del grupo de alcohol mostraron puntuaciones altas de esteatosis, inflamación lobulillar e hinchazón de hepatocitos. El tratamiento con melatonina redujo considerablemente estos efectos, con puntuaciones similares al grupo de control (Figura 2).
Figura 2. Gráfico de puntuación de alteraciones hepáticas en hembras de los grupos experimentales. Observar un aumento significativo en esteatosis, inflamación lobulillar e hinchazón de hepatocitos. Las medias seguidas de la misma letra no difieren significativamente según la prueba de Tukey y Kramer (p<0,05)
3.5 HISTOLOGÍA HEPÁTICA
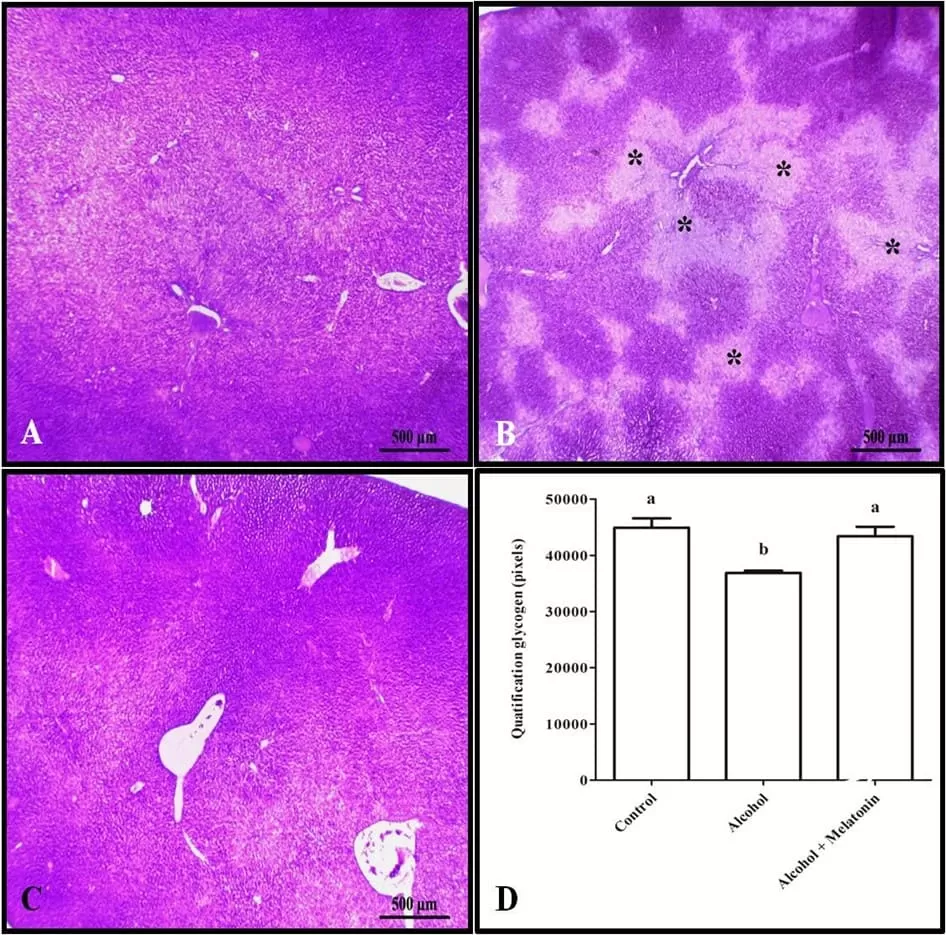
La tinción tricrómica y la cuantificación en píxeles revelaron un aumento de colágeno en el hígado alrededor de las venas, caracterizando fibrosis venular en las hembras que recibieron solo alcohol (Fig. 3). Sin embargo, en cuanto al glucógeno hepático, los animales de este grupo mostraron una reducción significativa en comparación con los otros grupos (Fig. 4).
Figura 3. Histología para colágeno en el hígado de las hembras en los grupos experimentales. A (control); B (alcohol); C (alcohol + melatonina). Observar en B una mayor marcación que caracteriza la fibrosis venular (flecha). D – Cuantificación en píxeles. Tricrómico de Mallory. Las medias seguidas por la misma letra no difieren significativamente según la prueba de Tukey y Kramer (p<0.05)
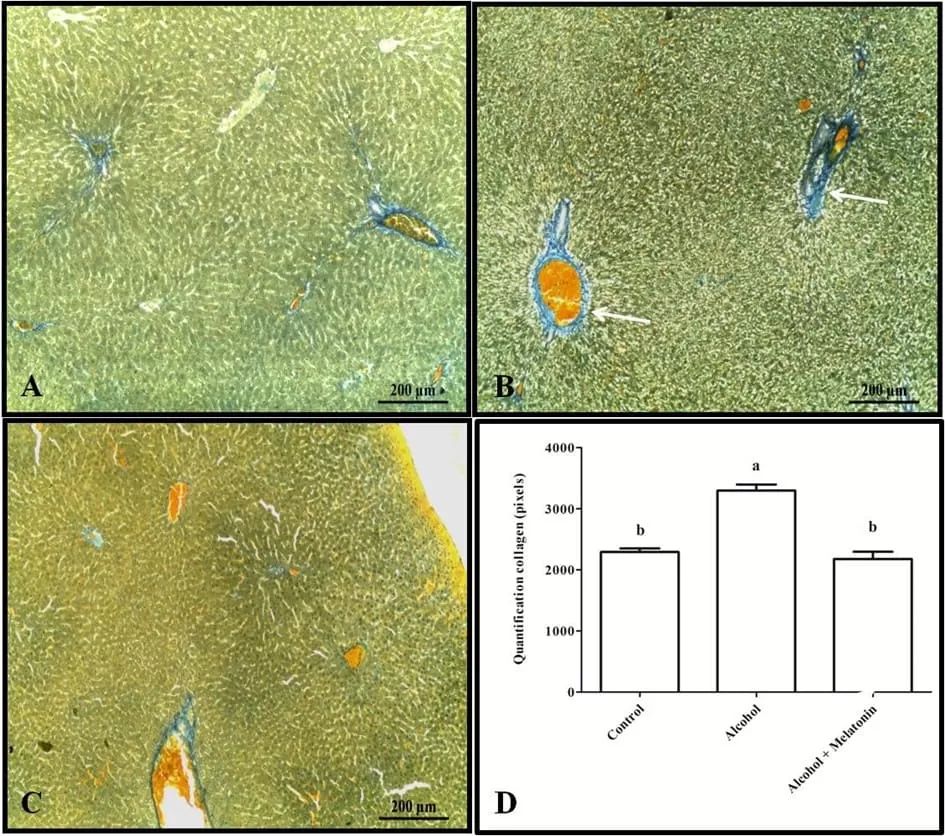
Figura 4. Histoquímica para glucógeno en el hígado de las hembras en los grupos experimentales. A (control); B (alcohol); C (alcohol + melatonina). Observar en B varias áreas menos teñidas (*), señalando la ausencia de glucógeno. D – Cuantificación en píxeles. SBP Las medias seguidas por la misma letra no difieren significativamente según la prueba de Tukey y Kramer (p<0.05)
4. DISCUSIÓN
El hígado es el principal órgano que sufre los efectos nocivos de las sustancias tóxicas (BHADORIA et al., 2015). El consumo de alcohol provoca cambios estructurales resultantes del estrés oxidativo. Por lo tanto, es uno de los mecanismos centrales del daño hepático (RADIC et al., 2019). En el presente estudio, se encontró que en el grupo de alcohol, el hígado mostró congestión de la vena central del lóbulo, corroborando los resultados presentados por Radic et al. (2021), donde, según Allaithi; Alazawi (2019), puede explicarse por la acumulación de grasa en el hígado, que a su vez estimula una respuesta inflamatoria por parte de las células estrelladas, liberando así citocinas inflamatorias para llevar una mayor cantidad de glóbulos blancos a la región afectada. Lo que también justificaría en nuestros hallazgos la presencia de infiltrado leucocitario en el parénquima hepático. La presencia de estos infiltrados, principalmente neutrófilos dentro del parénquima hepático, es una característica indicativa de hepatitis alcohólica (RAMAIAH; JAESCHKE, 2007) y se encuentra en abundancia en los tractos portales (MOSTAFA et al., 2020).
Según Tao et al. (2021) y Yeh; Brunt (2014), la esteatosis y la inflamación de hepatocitos se encuentran entre las lesiones hepáticas alcohólicas, lo cual también se evidenció en nuestro estudio. La esteatosis se considera la forma más frecuente de enfermedad hepática alcohólica y precede a otras alteraciones, como esteatohepatitis y fibrosis (KISSELEVA; BRENNER, 2019; GAO; BATALLER, 2011). Se caracteriza por el deterioro del parénquima lobular hepático resultante de la acumulación de lípidos en los hepatocitos. Este deterioro se observa principalmente alrededor de la vena central del lóbulo, sin embargo, con la progresión de la patología, puede involucrar todas las áreas, y a menudo está acompañado de un infiltrado inflamatorio crónico (MOSTAFA et al., 2020), como pudimos observar en nuestro estudio. El hepatocito globular, por otro lado, es la modificación morfológica debido al estrés hepatocelular resultante de la oxidación de ácidos grasos libres y el estrés del retículo endoplásmico debido a la acumulación de grasa, promoviendo así lesiones en el entorno intracelular, como cambios en la Perilipina. El daño se ve a través de cambios morfológicos como la hinchazón celular, agrandamiento de los hepatocitos, redondeo del contorno celular, reticulación y aclarado del citoplasma por un material viscoso llamado cuerpos de Mallory-Denk o hialina de Mallory, que está compuesto por filamentos intermedios bien fosforilados, proteína de unión a ubiquitina P62 y ubiquitina en el citoplasma de los hepatocitos (MOSTAFA et al., 2020; SCHILD; GUY, 2018).
La esteatosis puede progresar a su estado inflamatorio, esteatohepatitis. En casos posteriores y más graves, la disposición de colágeno resultante del daño parenquimatoso, como la inflamación crónica, la necrosis y la posterior regeneración celular, pueden causar fibrosis en respuesta a una actividad regenerativa exacerbada (MASSEY; ARTEEL, 2012; ROY et al., 2015), lo que justifica el aumento del colágeno en los animales del grupo de Alcohol. También se verificó en nuestros hallazgos hepatocitos con núcleo picnótico. Según la literatura, esto es indicativo de baja actividad celular, sugiriendo un proceso de necrosis celular (BHADORIA et al., 2015).
En nuestra investigación, la ingestión de EtOH también provocó una marcada disminución de la reserva de glucógeno del tejido parenquimatoso hepático. En el hígado, la glucosa es transportada a los hepatocitos mediante proteínas transportadoras que están presentes en su membrana plasmática (NANJI; FOGT; GRINIUVIENE 1995), promoviendo así la formación de la reserva de azúcar en forma de glucógeno a través de la Glucógeno Sintasa (GS). El consumo de EtOH no provoca cambios en la actividad de la fosforilasa de GS, sin embargo, promueve una reducción en los niveles de expresión y en su ARNm (MARTIN et al., 2004; SRINIVASAN; SHAWKY; KAPHALIA, 2019), lo que provoca una disminución de la reserva glicídica total en los hepatocitos periportales y perivenosos (STEINER; CROWELL; LANG, 2015).
El grupo Alcohol+melatonina mostró atenuación de los cambios estructurales encontrados en el hígado de los animales del grupo de alcohol, con parámetros cercanos a los del grupo de control. Ya se ha demostrado que esta indolamina es una espléndida antioxidante no enzimática (SINGH; JADHAV, 2014), con una gran capacidad para minimizar los cambios y ayudar a mantener la disposición habitual de los hepatocitos (GHOSH et al., 2023), además de estar ampliamente distribuida en el cuerpo. Esto se debe a que su estructura tiene sitios donadores de electrones en el carbono 2 y 3 del anillo de pirrol, y su naturaleza anfifílica, es decir, lipofílica e hidrofílica, proporciona la capacidad de pasar fácilmente a través de las membranas celulares y barreras hematoencefálicas (REITER et al., 2013), reduciendo así el estrés oxidativo al neutralizar los radicales libres de todo tipo (REITER et al., 2014). Por lo tanto, la melatonina puede haber actuado sobre las anormalidades, evitando el desequilibrio en los mecanismos antioxidantes y prooxidantes, lo que a su vez puede haber retrasado o prevenido el desarrollo de lesiones resultantes del estrés oxidativo (HU et al., 2009) en el grupo Alcohol+melatonina.
De acuerdo con Galano, Tan y Reiter (2011), esta indolamina tiene la capacidad de reducir la peroxidación lipídica y aumentar la concentración de antioxidantes al modular su expresión, además de tener el potencial de prevenir la reducción del glutatión (GSH) cuando se usa durante un período prolongado, además de disminuir la sensibilización de las células de Kupffer al alcohol, lo que reduce los niveles de ROS. Como resultado de esta reducción, actúa indirectamente en los infiltrados leucocitarios, promoviendo una mejora en la inflamación (ZHANG et al., 2021). Sin embargo, la melatonina también actúa directamente sobre la inflamación, ya que tiene la capacidad de atenuar la migración de los infiltrados de neutrófilos en respuesta a la lesión (KURHALUK; TKACHENKO 2020). Ya se ha demostrado por Ghosh et al. (2023) en un modelo experimental de estrés oxidativo en ratas, que esta indolamina actúa para reducir la deposición de colágeno en el hígado, evitando así la fibrosis a través y actuando para reducir la proliferación de fibroblastos (LI et al., 2020), promoviendo así una respuesta indirecta en la fibrosis por citoquinas. En cuanto a la reserva de azúcar en el hígado, el grupo Alcohol+melatonina presentó una reserva de glucógeno cercana al grupo de control. Estudios previos han señalado que la melatonina tiene la capacidad de aumentar el contenido de glucógeno hepático (FARIA et al., 2022), y este aumento se puede explicar por la mejora en la captación de glucosa en el tejido y / o la sensibilidad a la insulina a través de una vía dependiente. de Akt activada a través del receptor de melatonina (SHIEH et al., 2009). Por lo tanto, puede evitar la reducción de las reservas de glucógeno observada en el grupo sometido a consumo crónico de alcohol.
5. CONCLUSIONES
Los resultados del presente estudio demostraron que la melatonina tiene un gran potencial terapéutico para prevenir el daño en el hígado de ratas adolescentes sometidas a consumo immoderado de alcohol, además de efectos positivos en la deposición de colágeno y glucógeno en el hígado. Sin embargo, es necesario profundizar en los estudios en esta área para obtener más datos que prueben y refuercen el potencial de esta hormona en la terapia preventiva de alteraciones y patologías causadas por el consumo crónico de alcohol.
REFERENCIAS BIBLIOGRÁFICAS
ABD-ALLAH, A. R. A. et al. Effect of melatonin on estrogen and progesterone receptors in relation to uterine contractions in rats. Pharmacological Research , v . 47, pp. 349–354, 2003. DOI: 10.1016/s1043-6618(03)00014-8.
ALLAITHI, L. A. A.; Al-AZAWI, W. M. K. Study of the effect of salvia officinalis leaves extract and xenical drug on some of the biochemical and histological parameters in the rats induced with hyperlipidemia. Plant Archives, v . 19, pp. 1111–1122, 2019.
AMARAL, F. G. et al. New insights into the function of melatonin and its role in metabolic disturbances. Expert Review of Endocrinology & Metabolism, v. 14, no. 4, pp. 293–300, 2019. DOI: 10.1080/17446651.2019.1631158.
ANDRADE, A. G.; SIU, E. R. Alcohol and the health of Brazilians: panorama 2019. Health and alcohol information center. P. 104, 2019.
ARAÚJO-FILHO, J. L. S. et al. Histomorphometric analysis of the heart of rats indirectly exposed to ethanol and chronic malnutrition during the perinatal period. Journal of Medical and Biological Sciences, v. 6, no. 1, pp. 17-25, 2007. DOI: 10.9771/cmbio.v6i1.4144.
BEST, C. A.; LAPOSATA, M. Fatty acid ethyl esters toxic non-oxidative metabolites of ethanol and markers of ethanol intake. Frontiers in Bioscience, v. 8, no. 5, pp. e202-217, 2003. DOI: 10.2741/931.
BHADORIA, P. et al. Effect of Ethephon on the Liver in Albino Rats: A Histomorphometric Study. Biomedical Journal, v. 38, no. 5, pp. 421–427, 2015. DOI: 10.4103/2319-4170.155589.
BROCARDO, P. S.; GIL-MOHAPEL, J.; CHRISTIE, B. R. The role of oxidative stress in fetal alcohol spectrum disorders. brain Research Reviews, vol. 67, no. 1–2, pp. 209–225, 2011. DOI: 10.1016/j.brainresrev.2011.02.001.
ENGELMAN, M. F. B. et al. Morphometric study of the liver of rats submitted to supraphysiological doses of thyroxine. Brazilian Archives of Endocrinology & Metabolism, v. 45, no. 2, pp. 173-179, 2001. DOI: 10.1590/S0004-27302001000200009.
FARIA, V. S. et al. Melatonin Potentiates Exercise-Induced Increases in Skeletal Muscle PGC-1 α and Optimizes Glycogen Replenishment. Frontiers in Physiology, vol. 13, pp. 1–11, 2022. DOI: 10.3389/fphys.2022.803126.
FARKAS, Á.; KEMÉNY, L. Alcohol, Liver, Systemic Inflammation and Skin: A Focus on Patients with Psoriasis. Skin Pharmacology and Physiology, v. 26, no. 3, pp. 119–126, 2013. DOI: 10.1159/000348865.
FIOCRUZ. III national survey on drug use by the Brazilian population. [sl .: sn], 2017. Available at: <https: //www.arc a .fiocruz.br/bitstream/icict/34614/1/III%20LNUD_PORTUGU%C3%8 AS.pdf>.
GALANO, A.; TAN, D. X; REITER, R. J. Melatonin as a natural ally against oxidative stress: a physicochemical examination. Journal of Pineal Research, vol. 51, no. 1, pp. 1-16, 2011. DOI: 10.1111/j.1600-079X.2011.00916.x.
GALANO, A.; TAN, D. X.; REITER, R. J. Melatonin: A Versatile Protector against Oxidative DNA Damage. Molecules, v. 23, no. 3, pp. 530, 2018. DOI: 10.3390/molecules23030530.
GAO, B.; BATALLER, R. Alcoholic Liver Disease: Pathogenesis and New Therapeutic Targets. GASTROENTEROLOGY, v. 141, no. 5, pp. 1572-1585, 2011. DOI: 10.1053/j.gastro.2011.09.002.
GHOSH, P. et al. Insights into the antioxidative mechanisms of melatonin in ameliorating chromium-induced oxidative stress-mediated hepatic and renal tissue injuries in male Wistar rats. Food and Chemical Toxicology, v. 173, pp. 113630, 2023. DOI: 10.1016/j.fct.2023.113630.
GUNATA, M.; PARLAKPINAR, H.; ACET, H. A. Melatonin: A review of its potential functions and effects on neurological diseases. Revue Neurologique, vol. 176, no. 3, pp. 148–165, 2020. DOI: 10.1016/j.neurol.2019.07.025.
HARDELAND, R.; PANDI-PERUMAL, S. R.; CARDINALI, D. P. Melatonin. The International Journal of Biochemistry & Cell Biology, v. 38, no. 3, pp. 313-316, 2006. DOI: 10.1016/j.biocel.2005.08.020.
HU, C. et al. Protective role of melatonin in early-stage and end-stage liver cirrhosis. Journal of Cellular and Molecular Medicine, v. 23, no. 11, pp. 7151–7162, 2019. DOI: 10.1111/jcmm.14634.
HU, S. et al. Melatonin protects against alcoholic liver injury by attenuating oxidative stress, inflammatory response, and apoptosis. European Journal of Pharmacology, v. 616, pp. 287–292, 2009. DOI: 10.1016/j.ejphar.2009.06.044.
KISSELEVA, T.; BRENNER, D. A. The Crosstalk between Hepatocytes, Hepatic Macrophages, and Hepatic Stellate Cells Facilitates Alcoholic Liver Disease. Cell Metabolism, v. 30, no. 5, pp. 850-852, 2019. DOI: 10.1016/j.cmet.2019.10.010.
KLEINER, D. E. et al. Design and validation of a histological scoring system for nonalcoholic fatty liver disease. Hepatology, v. 41, no. 6, pp. 1313–1321, 2005. DOI: 10.1002/hep.20701.
KURCER, Z. et al. Melatonin improves methanol intoxication-induced oxidative liver injury in rats. Journal of Pineal Research, vol. 43, no. 1, pp. 42-49, 2007. DOI: 10.1111/j.1600-079X.2007.00441.x.
KURHALUK, N.; TKACHENKO, H. Melatonin and alcohol-related disorders. Chronobiology International, v. 37, no. 6, pp. 781–803, 2020. DOI:10.1080/07420528.2020.1761372.
KURHALUK, N.; TKACHENKO, H.; LUKASH, O. Melatonin modulates oxidative phosphorylation, hepatic and kidney autophagy-caused subclinical endotoxemia and acute ethanol-induced oxidative stress. Chronobiology International, v. 37, no. 12, pp. 1709–1724, 2020. DOI: 10.1080/07420528.2020.1830792.
LI, N. et al. Melatonin ameliorates renal fibroblast-myofibroblast transdifferentiation and renal fibrosis through miR-21-5p regulation. Journal of Cellular and Molecular Medicine, v. 24, no. 10, pp. 5615–5628, 2020. DOI: 10.1111/jcmm.15221.
MAHIEU, S. et al. Melatonin reduces oxidative damage induced by aluminum in rat kidney. Toxicology Letters, v. 190, no. 1, pp. 9-15, 2009. DOI: 10.1016/j.toxlet.2009.06.852.
MARCO, I. N. et al. Long-Term Effects of Intermittent Adolescent Alcohol Exposure in Male and Female Rats. Frontiers in Behavioral Neuroscience, v. 11, no. 233, pp. 1-13, 2017. DOI: 10.3389/fnbeh.2017.00233.
MARTIN, J. V. et al. Effects of dietary caffeine and alcohol on liver carbohydrate and fat metabolism in rats. Medical science monitor: international medical journal of experimental and clinical research, v. 10, no. 12, pp. BR455-BR461, 2004.
MASSEY, V. L.; ARTEEL, G. E. Acute Alcohol-Induced Liver Injury. Frontiers in Physiology, vol. 3 n. 193, pp. 1-8, 2012. DOI: 10.3389/fphys.2012.00193.
MINCIS, M. et al. Alcohol and the Liver. GED: Gastroenterology Endoscopy digestive, v. 30, no. 4, pp. 152-162, 2011.
MOSTAFA, M. et al. Fatty Liver Disease: A Practical Approach. Archives of Pathology & Laboratory Medicine, v. 144, no. 1, pp. 62–70, 2020. DOI: 10.5858/arpa.2019-0341-RA.
MOUSTAFA, A. M. et al. Effect of bromocriptine on uterine contractility in near term pregnant rats. Pharmacological Research, v. 39, no. 2, p. 89-95, 1999. DOI: 10.1006/phrs.1998.0399.
NANJI, A. A.; FOGT, F.; GRINIUVIENE, B. Alterations in Glucose Transporter Proteins in Alcoholic Liver Disease in the Rat. The American Journal of Pathology, v. 146, no. 2, pp. 329-334, 1995.
NORBERG, A. et al. Role of Variability in Explaining Ethanol Pharmacokinetics: Research and Forensic Applications. Clinical Pharmacokinetics, v. 42, no. 1, p. 1–31, 2003. DOI: 10.2165/00003088-200342010-00001.
NWOZO, S.; AJAGBE, A.; OYINLOYE, B. Hepatoprotective effect of Piper guineense aqueous extract against ethanol-induced toxicity in male rats. Journal of Experimental and Integrative Medicine, v. 2, no. 1, pp. 71-76, 2012. DOI: 10.5455/jeim.241111.or.016.
PAGET, G. E.; BARNE, J. M. Evaluation of results: quantitative application in different species. Pharmacometrics , vol. 1. p. 161. 9th ed. New York: Academic Press; 1994.
POEGGELER, B. et al. Melatonin, hydroxyl radical- mediated oxidative damage, and aging: A hypothesis. Journal of Pineal Research, v. 14, no. 4, pp. 151–168, 1993. DOI: 10.1111/j.1600-079x.1993.tb00498.x.
RADIC, I. et al. Protective effects of whey on rat liver damage induced by chronic alcohol intake. Human & Experimental Toxicology, v . 38, no. 6, pp. 632–645, 2019. DOI: 10.1177/0960327119829518.
RADIC, I. et al. Protective effects of pumpkin (Cucurbita pepo L.) seed oil on rat liver damage induced by chronic alcohol consumption. Archives of Biological Sciences, vol. 73, no. 1, pp. 123–133, 2021. DOI: 10.2298/ABS201205008R.
RAMAIAH, S. K.; JAESCHKE, H. Hepatic neutrophil infiltration in the pathogenesis of alcohol-induced liver injury. Toxicology Mechanisms and Methods, v.17, n. 7, pp. 431– 440, 2007. DOI: 10.1080/00952990701407702.
REITER, R. J. et al. Peripheral Reproductive Organ Health and Melatonin: Ready for Prime Time”, International Journal of Molecular Sciences, v. 14, no. 4, pp. 7231-7272, 2013. DOI: 10.3390/ijms14047231.
REITER, R. J.; TAN, D. X.; GALANO, A. Melatonin: exceeding expectations. Physiology (Bethesda, Md.), v. 29, no. 5, pp. 325–333, 2014. DOI: 10.1152/physiol.00011.2014.
ROCCO, A. et al. Alcoholic disease: Liver and beyond. World Journal of Gastroenterology, v. 20, no. 40, pp. 14652-14659, 2014. DOI: 10.3748/wjg.v20.i40.14652.
ROY S. et al. The role of miRNAs in the regulation of inflammatory processes during hepatofibrogenesis. Hepatobiliary Surgery and Nutrition, v. 4, no. 1, p. 24-33, 2015. DOI: 10.3978/j.issn.2304-3881.2015.01.05.
SCHEIDT, L. et al. Ethanol during adolescence decreased the BDNF levels in the hippocampus in adult male Wistar rats, but did not alter aggressive and anxiety -like behaviors. Trends Psychiatry Psychother. v. 7, no. 3, p. 143-151, 2015. DOI: 10.1590/2237-6089-2015-0017.
SCHILD, M. H.; GUY, C. D. Nonalcoholic Steatohepatitis. Surgical Pathology Clinics, v. 11, no. 2, pp. 267–285, 2018. DOI: 10.1016/j.path.2018.02.013.
SHIEH, J. M. et al. Melatonin ameliorates high fat diet-induced diabetes and stimulates glycogen synthesis via a PKC ζ -Akt-GSK3 β pathway in hepatic cells. Journal of Pineal Research, v. 47, no. 4, pp. 339–344, 2009. DOI: 10.1111/j.1600-079X.2009.00720.x.
SINGH, M., JADHAV, H. R. Melatonin: functions and ligands. Drug Discovery Today, v. 19, no. 9, pp. 1410-1418, 2014. DOI: 10.1016/j.drudis.2014.04.014.
SRINIVASAN, M. P.; SHAWKY, N. M.; KAPHALIA, B. S. Alcohol-induced ketonemia is associated with lowering of blood glucose, downregulation of gluconeogenic genes, and depletion of hepatic glycogen in type 2 diabetic db/db mice. Biochemical Pharmacology, v. 160, pp. 46-61, 2019. DOI: 10.1016/j.bcp.2018.12.005.
STEINER, J. L.; CROWELL, K. T.; LANG, C. H. Impact of Alcohol on Glycemic Control and Insulin Action. Biomoleculas, v. 5, no. 4, pp. 2223-2246, 2015. DOI: 10.3390/biom5042223.
TAO, Z. et al. Echinacoside ameliorates alcohol-induced oxidative stress and hepatic steatosis by affecting SREBP1c/FASN pathway via PPAR α. Food and Chemical Toxicology, v.148, pp. 1-9, 2021. DOI: 10.1016/j.fct.2020.111956.
ULLAH, U. et al. Hepatoprotective effects of melatonin and celecoxib against ethanol-induced hepatotoxicity in rats. Immunopharmacology and Immunotoxicology, v. 42, no. 3, pp. 255–263, 2020. DOI: 10.1080/08923973.2020.1746802.
VARLINSKAYA, E. I.; SPEAR, L. P.; SPEAR, N. E. Acute effects of ethanol on behavior of adolescent rats: Role of social context. Alcohol Clinical & Experimental Research, v. 25, no. 3, pp. 377–385, 2001. DOI: 10.1111/j.1530- 0277.2001.tb 02224.x.
VONGHIA, L. et al. Acute alcohol intoxication. European Journal of Internal Medicine, v. 19, no. 8, pp. 561–567, 2008. DOI: 10.1016/j.ejim.2007.06.033.
WHO – World Health Organization. Global status report on alcohol and health 2018. 2018, p. 472.
YANG, L. et al. Chronic Alcohol Exposure Increases Circulating Bioactive Oxidized Phospholipids. Journal of Biological Chemistry, v. 285, no. 29, pp. 22211–22220, 2010. DOI: 10.1074/jbc.M110.119982.
YEH, M. M.; BRUNT, E. M. Pathological features of fatty liver disease. Gastroenterology, v. 147, no. 4, pp. 754–764, 2014. DOI: 10.1053/j.gastro.2014.07.056.
ZHANG, H. et al. Melatonin ameliorates ochratoxin A induced liver inflammation, oxidative stress and mitophagy in mice involving in intestinal microbiota and restoring the intestinal barrier function. Journal of Hazardous Materials, v. 407, pp. 1-49, 2021. DOI: 10.1016/j.jhazmat.2020.124489.
[1] Doctorado en Biosciencias Animales – UFRPE.ORCID: 0000-0001-9404-7501. Curriculum Lattes: http://lattes.cnpq.br/8213260513385508.
[2] Licenciado en Ciencias Biológicas – UFRPE. ORCID: 0000-0003-3659-3947. Lattes curriculum: https://lattes.cnpq.br/5069796237775832.
[3] Maestría en Entomología Agrícola – UFRPE. ORCID: 0000-0003-3822-3050. Curriculum Lattes: http://lattes.cnpq.br/4008994020879541.
[4] Estudiante de doctorado en el Programa de Posgrado en Biosciencias Animales – UFRPE. ORCID: 0000-0002-4733-461X. Curriculum Lattes: http://lattes.cnpq.br/1906334502843226.
[5] Estudiante de doctorado en el Programa de Posgrado en Biosciencias Animales – UFRPE. ORCID: 0000-0002-6228-6951. Curriculum Lattes: http://lattes.cnpq.br/1783975917572458.
[6] Doctor en Biosciencias Animales – UFRPE. ORCID: 0000-0002-2507-3682 Lattes CV: http://lattes.cnpq.br/9465720906397764.
[7] Maestría en Gerontología – UFSM. ORCID: 0000-0001-9528-7312. Curriculum Lattes: http://lattes.cnpq.br/9959642679541707.
[8] Doctor en Bioquímica y Fisiología, Máster en Fisiología, Biólogo. ORCID: 0000-0003-1493-7964. Curriculum Lattes: http://lattes.cnpq.br/9044747136928972.
[9] Doctor en morfología – UNIFESP. ORCID: 0000-0001-5940-9220. Curriculum Lattes: http://lattes.cnpq.br/1539131079574469.
[10] Asesor. Doctor en Tecnología Nuclear – USP. ORCID: 0000-0001-9533-5476 Lattes CV: http://lattes.cnpq.br/4292195468804301.
Presentado: 11 de julio de 2023.
Aprobado: 14 de agosto de 2023.