ARTIGO ORIGINAL
NASCIMENTO, Bruno José do [1], PEREIRA, Alef de Moura [2], BRAGA, Valeska Andrea Ático [3], SILVA, Maria Vanessa da [4], SANTOS, Yasmim Barbosa dos [5], LAPA NETO, Clovis José Cavalcanti [6], MEDINA, Vanessa Bischoff [7], SOARES, Anísio Francisco [8], TEIXEIRA, Álvaro Aguiar Coelho [9], TEIXEIRA, Valéria Wanderley [10]
NASCIMENTO, Bruno José do. et al. Efeito da melatonina na histofisiologia do fígado de ratos adolescentes expostos ao álcool. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano 08, Ed. 08, Vol. 04, pp. 152-174. Agosto de 2023. ISSN: 2448-0959, Link de Acesso: https://www.nucleodoconhecimento.com.br/biologia/figado-de-ratos-adolescentes, DOI: 10.32749/nucleodoconhecimento.com.br/biologia/figado-de-ratos-adolescentes
RESUMO
O presente estudo avaliou se a administração de melatonina durante a adolescência pode prevenir os efeitos prejudiciais produzidos pelo álcool no fígado. Trinta ratos albinos (Rattus norvegicus albinus), fêmeas, com 40 dias de idade, virgens, pesando aproximadamente 150±10g, da linhagem Wistar, foram divididas nos seguintes grupos: I – Ratos adolescentes que não receberam álcool e foram sacrificadas aos 60 dias de vida; II – Ratos adolescentes submetidas ao consumo crônico de álcool e sacrificadas aos 60 dias de vida; III – Ratos adolescentes submetidas ao consumo crônico de álcool e simultaneamente tratadas com melatonina, e sacrificadas aos 60 dias de vida. Os órgãos coletados passaram por processamento histológico e, para obter os resultados, foram realizadas análises morfométricas, histopatológicas e histoquímicas. O álcool foi administrado por gavagem, por injeção intragástrica, na dose de 3 g/Kg de álcool etílico nos ratos dos grupos II e III, por 20 dias. A melatonina foi administrada em injeções diárias de 0,8 mg/Kg, sempre no início da noite, intraperitonealmente, por 20 dias. Ao analisar o peso dos animais, não foi observada diferença significativa entre os grupos. Os animais do grupo II apresentaram alterações nos fígados, como congestão da veia centrolobular, balonamento hepatocelular, esteatose microgoticular, infiltrado leucocitário, vários núcleos picnóticos nos fígados, aumento no parênquima lobular e redução no parênquima não lobular, maior deposição de colágeno e redução de glicogênio. O tratamento com melatonina preveniu todas essas mudanças. Com isso, podemos concluir que a melatonina possui grande potencial terapêutico na prevenção de danos hepáticos em ratos adolescentes submetidas ao consumo moderado de álcool, além de efeitos positivos na deposição de colágeno e glicogênio no fígado.
Palavras-chave: Adolescentes, Álcool, Antioxidante, Fígado, Inflamação.
1. INTRODUÇÃO
O consumo de bebidas alcoólicas é comum em todo o mundo, e fatores como idade, cultura, gênero e religião influenciam tanto a frequência quanto o volume consumido. Cerca de 43% da população global consome bebidas alcoólicas, e na região das Américas, esse índice é superior à média global, atingindo 54% (OMS, 2018). No Brasil, aproximadamente 25 milhões de habitantes, o que equivale a 16,5% da população, consumiram mais álcool em 2015 (FIOCRUZ, 2017). De acordo com Andrade; Siu (2019), em 2016, a região das Américas foi a terceira no mundo em relação ao consumo excessivo de álcool por jovens, registrando uma porcentagem de 18,5%, ficando atrás apenas do Oeste do Pacífico (18,8%) e da Europa (24,1%). No Brasil, os jovens de 18 a 24 anos estão em segundo lugar na proporção de consumo de álcool, correspondendo a 35,1%, perdendo apenas para indivíduos de 35 a 34 anos (38,1%) (FIOCRUZ, 2017). De acordo com a OMS (2018), em 2016, a prevalência de mulheres que consumiam álcool era de 32,3%, menor do que a dos homens, que era de 53,6%. Apesar dos índices apontarem para um menor consumo de bebidas alcoólicas pelas mulheres, elas são mais afetadas, pois são biologicamente mais vulneráveis aos efeitos do álcool do que os homens. Assim, têm mais chances de desenvolver problemas relacionados ao álcool, mesmo com níveis de consumo mais baixos e/ou em uma idade mais precoce do que os homens (ANDRADE; SIU, 2019).
O EtOH é uma molécula pequena, não carregada e solúvel em água, e por esse motivo pode atravessar facilmente as membranas celulares (NORBERG et al., 2003; VONGHIA et al., 2008). O álcool ingerido é metabolizado pelo fígado, onde se encontra a maior quantidade de enzimas metabolizadoras (MINCIS et al., 2011). Após sua absorção, o EtOH é convertido pela Álcool Desidrogenase (ADH), catalase ou citocromo P450 2E1 (CYP2E1) em acetaldeído. Após essa etapa, a Aldeído Desidrogenase (ALDH) converte o acetaldeído em acetato (BEST; LAPOSATA, 2003). Essas reações promovem o aumento da atividade da cadeia respiratória e, consequentemente, o aumento da produção de ROS (BROCARDO et al., 2011). Os produtos do álcool têm sido considerados hepatotóxicos que atuam diretamente ou indiretamente no órgão (ROCCO et al., 2014), além de causar necrose ou apoptose dos hepatócitos (FARKAS; KEMÉNY, 2013).
Como o fígado é o principal órgão responsável pela metabolização do álcool, é o que mais sofre com os efeitos prejudiciais desse xenobiótico (ROCCO et al., 2014). A exposição contínua ao EtOH leva à progressão do acúmulo de gordura no fígado, esteatose, ao estado inflamado, esteato-hepatite (YANG et al., 2010). A esteatose é a doença alcoólica inicial, posteriormente podem ocorrer inflamação subsequente e hepatite alcoólica, resultando em fibrose hepática (FARKAS; KEMÉNY, 2013).
A melatonina, um hormônio produzido principalmente pela glândula pineal, com a capacidade de realizar inúmeras ações mediadas por receptores e independentes deles, pode atuar no controle do ciclo circadiano, promovendo o sono e exercendo uma ação antioxidante, reduzindo o estresse oxidativo, além de possuir propriedades anti-inflamatórias e antiapoptóticas (HARDELAND; PANDI-PERUMAL; CARDINALI, 2006; MAHIEU et al., 2009; REITER; TAN; GALANO, 2014). Sua capacidade antioxidante foi descoberta em 1993 (POEGGELER et al., 1993), e tem sido utilizada na prevenção de doenças causadas pelo estresse oxidativo, devido à sua capacidade de eliminar radicais livres e melhorar os níveis de antioxidantes (NWOZO; AJAGBE; OYINLOYE, 2012). Essa indolamina e seus metabólitos atuam na eliminação direta de vários radicais livres, como o radical hidroxila (OH), peroxinitrito (ONOO), óxido nítrico (NO) e radical O2, além das espécies reativas de oxigênio, nitrogênio e enxofre (AMARAL et al., 2019; GALANO; TAN; REITER et al., 2018; GUNATA; PARLAKPINAR; ACET, 2020).
Com relação ao fígado, alguns estudos com ratos submetidos ao consumo de álcool já demonstraram aspectos positivos da administração de melatonina na estrutura hepática (KURCER et al., 2007; KURHALUK; TKACHENKO; LUKASH, 2020), na atividade de enzimas antioxidantes (KURCER et al., 2007), inibição de citocinas pró-inflamatórias (HU et al., 2019) e apoptose (ULLAH et al., 2020). Assim, essa indolamina possui grande potencial para prevenir alterações causadas pelo álcool. Diante disso, este trabalho teve como objetivo avaliar se a melatonina administrada em ratos adolescentes poderia prevenir os efeitos deletérios produzidos pelo álcool no fígado.
2. MATERIAIS E MÉTODOS
2.1 AQUISIÇÃO DOS ANIMAIS
Trinta ratos albinos fêmeas (Rattus norvegicus albinus), com 40 dias de idade, virgens, pesando aproximadamente 130±10g, da linhagem Wistar, provenientes do Biotério do Departamento de Morfologia e Fisiologia Animal (DMFA) da Universidade Federal Rural de Pernambuco (UFRPE) foram utilizadas. Os animais foram mantidos em gaiolas e alimentados com ração e água ad libitum, com temperatura de 22±1ºC e iluminação artificial produzida por lâmpadas fluorescentes (marca Phillips, modelo luz do dia, 40W), com um fotoperíodo de 12 horas de luz e 12 horas de escuridão, considerando o período de luz das 6:00 às 18:00 horas. Após um período de adaptação de sete dias, foram feitos esfregaços vaginais para determinar o ciclo estral. As fêmeas que apresentaram três ciclos estrais regulares consecutivos foram selecionadas para o experimento, que consistiu nos seguintes grupos experimentais, com 10 animais cada:
Controle – Ratos adolescentes que não receberam álcool e foram eutanasiados aos 60 dias de idade;
Álcool – Ratos adolescentes submetidos ao consumo crônico de álcool e eutanasiadas aos 60 dias de vida;
Álcool + Melatonina – Ratos adolescentes submetidos ao consumo crônico de álcool e simultaneamente tratadas com melatonina, e eutanasiadas aos 60 dias de vida.
Os experimentos foram aprovados pelo comitê de ética institucional sob a licença CEUA/UFRPE Nº 041/2019.
2.2 ADMINISTRAÇÃO DE ETANOL
Foi administrado por gavagem, injeção intragástrica, na dose de 3 g/kg de álcool etílico nos ratos dos grupos II e III por 20 dias (ARAÚJO-FILHO et al., 2007; MARCO et al., 2017; SCHEIDT et al., 2015; VARLINSKAYA; SPEAR; SPEAR, 2001; VEIGA et al., 2007).
2.3 TRATAMENTO COM MELATONINA
A melatonina, N-acetil-5-metoxitriptamina (Sigma Chemical Co., St. Louis, EUA), foi administrada em injeções diárias de 0,8 mg/kg, por um período de 20 dias. Para isso, a melatonina foi dissolvida em 0,2 mL de etanol e diluída em 0,8 mL de NaCl 0,9%. As injeções foram aplicadas por via intraperitoneal, entre as 18:00 e 19:00 horas. Essa dose é comparável à dose humana (9 mg/kg), que foi convertida com base na área da superfície corporal (ABD-ALLAH et al., 2003; MOUSTAFA et al., 1999; PAGET; BARNE, 1994). Os animais dos grupos I e II receberam o veículo do hormônio.
2.4 PESO DOS ANIMAIS
Os ratos foram pesados diariamente ao longo do período experimental, e para análise estatística, foram considerados os dias 1, 10 e 20.
2.5 HISTOPATOLOGIA E HISTOQUÍMICA DO FÍGADO
Para a coleta do fígado, os ratos foram anestesiados com cloridrato de cetamina (80 mg/kg) e xilazina (6,0 mg/kg) por via intramuscular. Em seguida, a cavidade abdominal foi aberta para a remoção do órgão. Os ratos foram eutanasiados com aprofundamento da anestesia com cloridrato de cetamina (80mg/Kg) e xilazina (6mg/Kg), associado ao tiopental (100 mg/kg), por via intraperitoneal. Fragmentos de fígado foram imersos em formalina tamponada a 10% e pH 7,4, permanecendo lá por 48 horas. Após esses procedimentos, foram desidratados em álcool etílico (concentrações crescentes),
clarificados com xilol, impregnados e incluídos em parafina. Os blocos de parafina foram cortados em um microtomdo tipo Minot (Leica RM 2035) ajustado para 5 μm. As seções obtidas dessa maneira foram colocadas em lâminas de vidro e levadas a um forno regulado a uma temperatura de 37°C por 24 horas, para secagem e montagem. Em sequência, as seções foram coradas com hematoxilina-eosina (HE), picrosirius e PAS (ácido periódico de Schiff) e analisadas em um microscópio de luz OLYMPUS BX-49 e fotografadas em um microscópio OLYMPUS BX-50.
2.6 MORFOMETRIA
O estudo morfométrico foi realizado de acordo com a metodologia descrita por Engelman et al. (2001). A proporção entre o parênquima não lobular e lobular do fígado dos ratos nos grupos experimentais foi determinada por métodos estereológicos, utilizando uma grade com 100 pontos de teste, colocada nas seções das preparações histológicas coradas com tricrômio de Mallory, pois isso facilita a visualização dos espaços portais ao usar métodos estereológicos. A contagem foi feita em três lâminas, de modo que foram contados 10 campos usando a objetiva 40x, totalizando 3.000 pontos por grupo.
Foi realizada uma avaliação semiquantitativa dos escores de alterações hepáticas propostos pelo Comitê de Patologia da Rede de Pesquisa Clínica sobre Esteato-hepatite não alcoólica (Nonalcoholic Steatohepatitis) (KLEINER et al., 2005), que são os seguintes: esteatose (<5% = 0; 5–33% = 1; 33–66% = 2; >66% = 3); inflamação lobular (nenhuma = 0; 2 focos = 1; 2-4 focos = 2; >4 focos = 3); e balonamento hepatocelular (nenhum = 0; alguns = 1; proeminente = 2). Todos os aspectos foram pontuados de forma cega em três lâminas/grupo, avaliadas cinco campos/lâmina. Para isso, as imagens foram capturadas com uma câmera de vídeo Sony® acoplada a um microscópio Olympus® Bx50. Todas as quantificações foram realizadas usando o editor de imagem Gimp®2.8.
2.7 ANÁLISE ESTATÍSTICA
Para comparar o peso dos ratos, dados de morfometria e triagem e histoquímica, foi realizada a Análise de Variância e, quando significativa, complementada pelo teste de Comparação Múltipla de Tukey e Kramer. Foi adotado um nível de significância de 0,05 (P < 0,05).
3. RESULTADOS
3.1 PESO DOS ANIMAIS
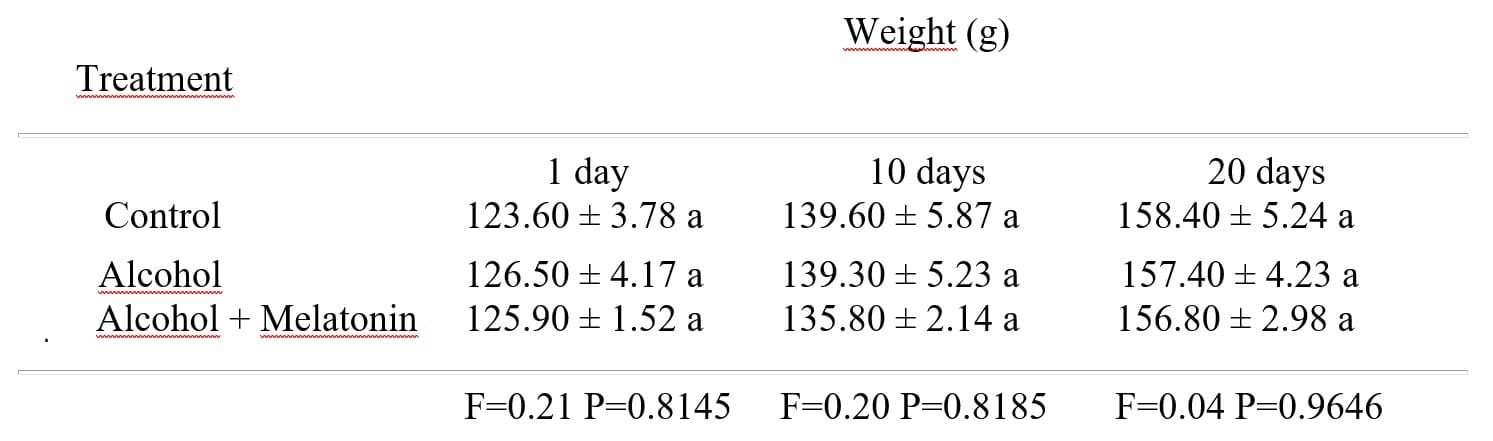
Não houve diferença significativa entre os pesos dos ratos tratados com álcool, álcool + melatonina quando comparadas ao grupo controle nos dias 1, 10 e 20 (Tabela 1).
Tabela 1: Média ± desvio padrão do peso dos ratos nos grupos experimentais, nos dias 1, 10 e 20
3.2 ANÁLISE HISTOPATOLÓGICA DO FÍGADO
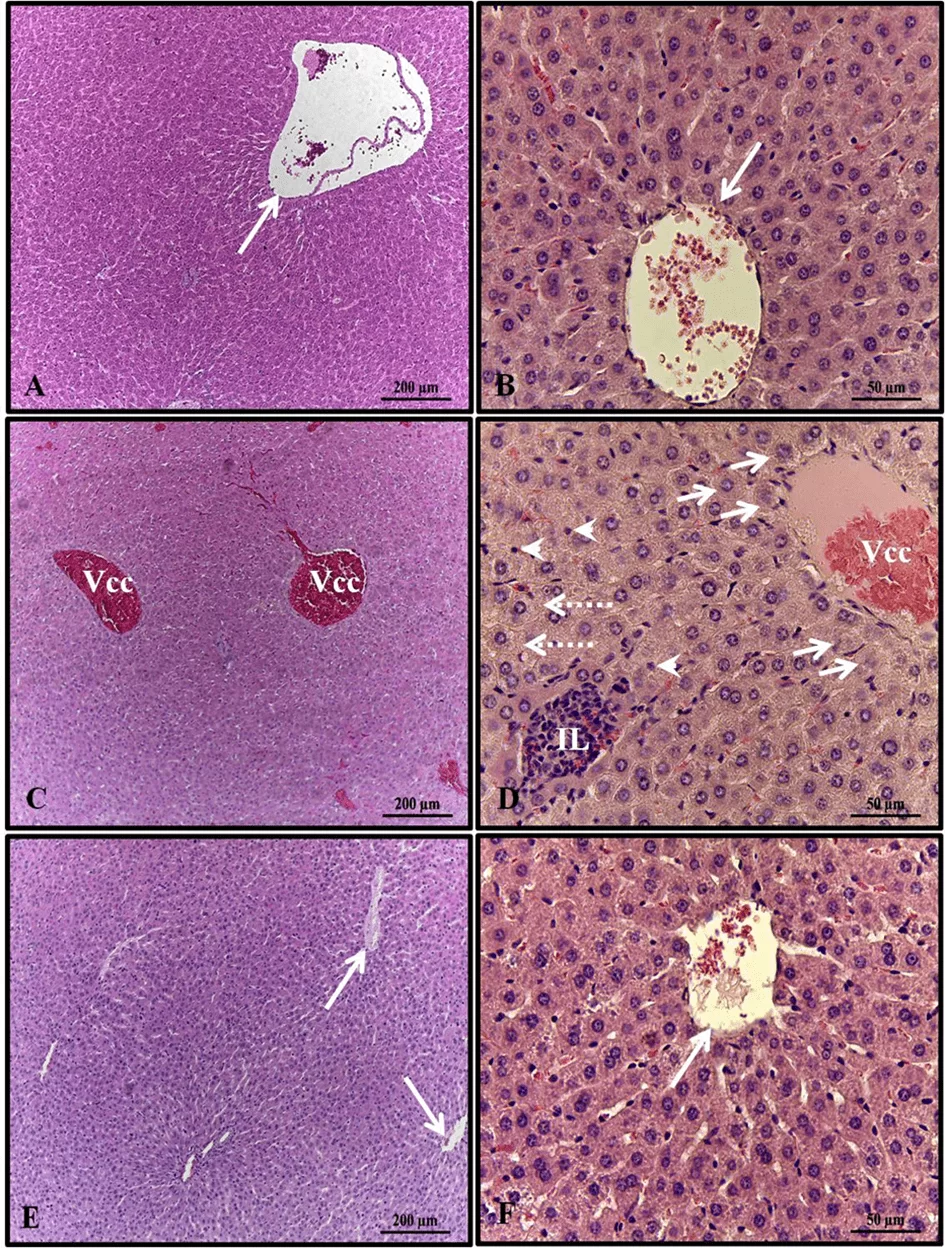
A análise histopatológica do fígado das fêmeas nos grupos controle e álcool + melatonina revelou parênquima hepático inalterado com cordões de hepatócitos organizados ao redor da veia central lobular, entremeados por capilares sinusoidais. No entanto, nos fígados dos ratos no grupo do álcool, observaram-se congestão da veia centrolobular, hepatócitos com balonamento na área ao redor das veias centrolobulares, esteatose microvesicular, infiltrado de leucócitos e vários hepatócitos com núcleos picnóticos (Figura 1).
Figura 1. Fotomicrografias dos fígados das fêmeas nos grupos experimentais. A – B (controle); C–D (álcool); E – F (álcool + melatonina). Veia central lobular sem congestão (seta longa); Veia central lobular com congestão (Vcc); Balonamento dos hepatócitos (setas curtas); Infiltrado de leucócitos (IL); Esteatose microvesicular (setas tracejadas); Hepatócitos com núcleos picnóticos (setas). HE
3.3 ANÁLISE MORFOMÉTRICA DO FÍGADO
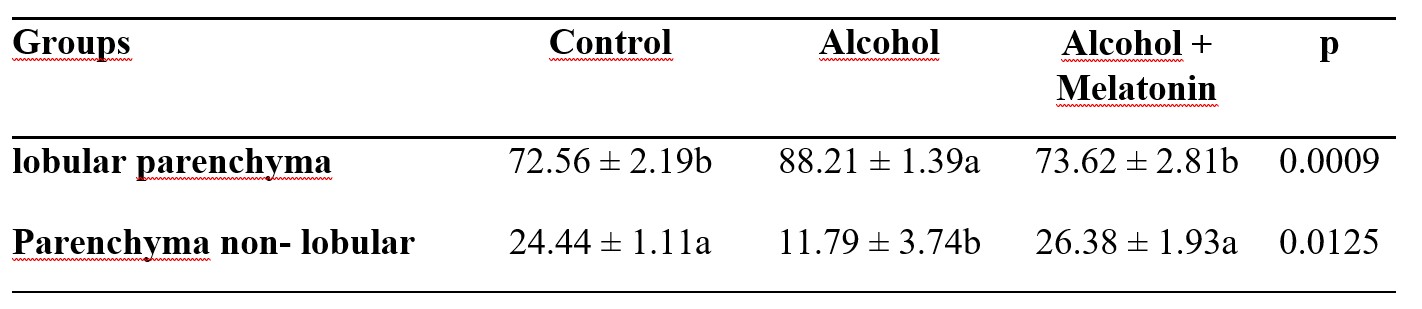
Houve um aumento no percentual de parênquima lobular, promovendo uma redução no parênquima não-lobular no fígado dos ratos no grupo do álcool. A melatonina preveniu esse efeito, apresentando parâmetros semelhantes ao grupo controle (Tabela 2).
Tabela 2. Média ± desvio padrão do percentual de parênquima lobular e não-lobular no fígado das fêmeas nos grupos experimentais
3.4 PONTUAÇÕES DE ALTERAÇÃO DO FÍGADO
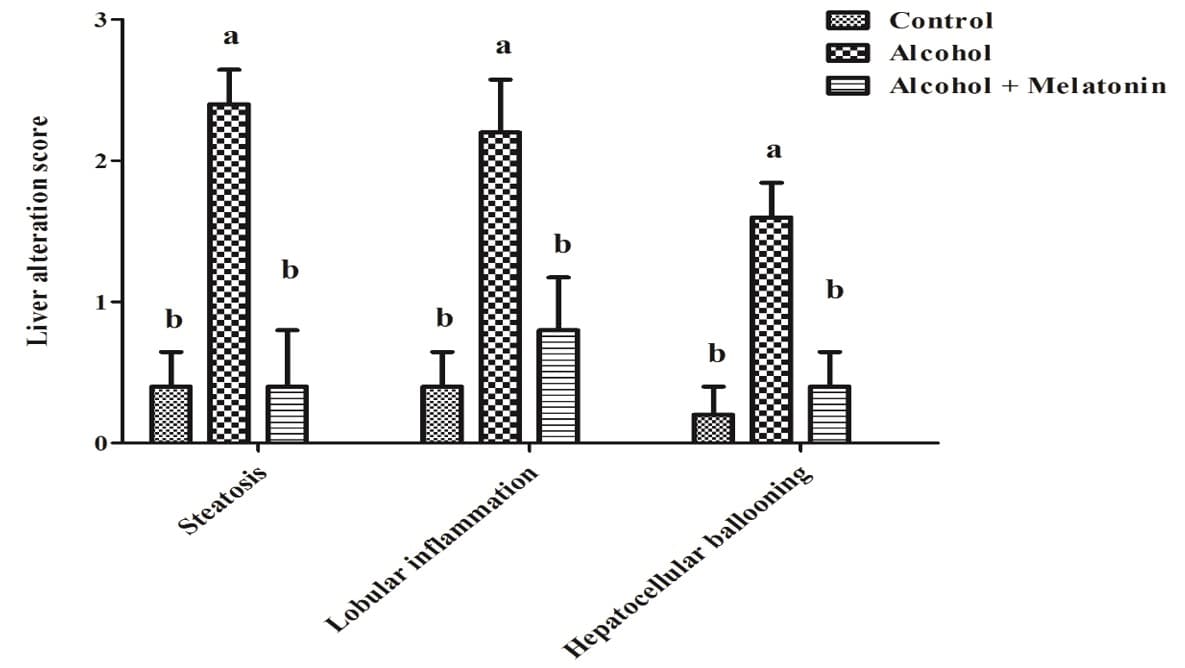
Na avaliação semiquantitativa das pontuações das alterações no fígado, as fêmeas no grupo do álcool revelaram pontuações elevadas de esteatose, inflamação lobular e balonamento dos hepatócitos. O tratamento com melatonina reduziu consideravelmente esses efeitos, com pontuações semelhantes ao grupo controle (Figura 2).
Figura 2. Gráfico de pontuação de alteração do fígado em fêmeas dos grupos experimentais. Observa-se um aumento significativo na esteatose, inflamação lobular e balonamento hepatocelular. As médias seguidas da mesma letra não diferem significativamente segundo o teste de Tukey e Kramer (p<0,05)
3.5 HISTOQUÍMICA DO FÍGADO
A coloração tricrômica e a quantificação em pixels revelaram aumento de colágeno no fígado ao redor das veias, caracterizando fibrose venular em fêmeas que receberam apenas álcool (Figura 3). No entanto, em relação ao glicogênio hepático, os animais deste grupo apresentaram uma redução significativa quando comparados aos outros grupos (Figura 4).
Figura 3. Histoquímica para colágeno no fígado de fêmeas nos grupos experimentais. A (controle); B (álcool); C (álcool + melatonina). Observa-se em B uma marcação mais intensa caracterizando fibrose venular (seta). D – Quantificação em pixels. Tricrômico de Mallory. As médias seguidas da mesma letra não diferem significativamente segundo o teste de Tukey e Kramer (p<0,05)
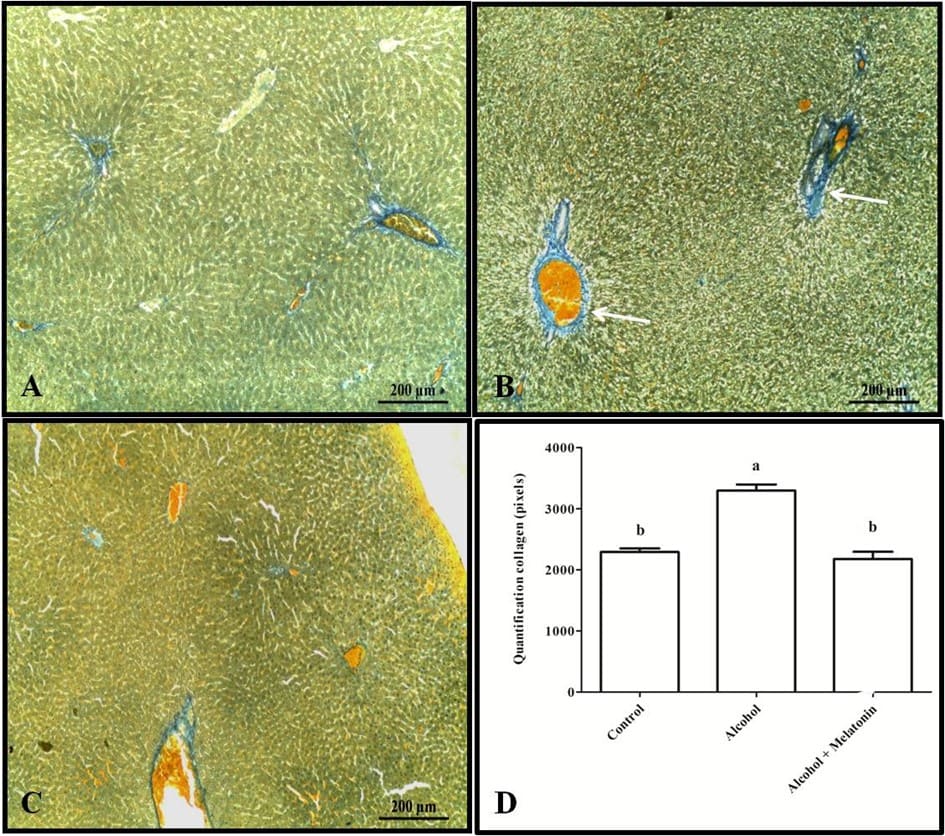
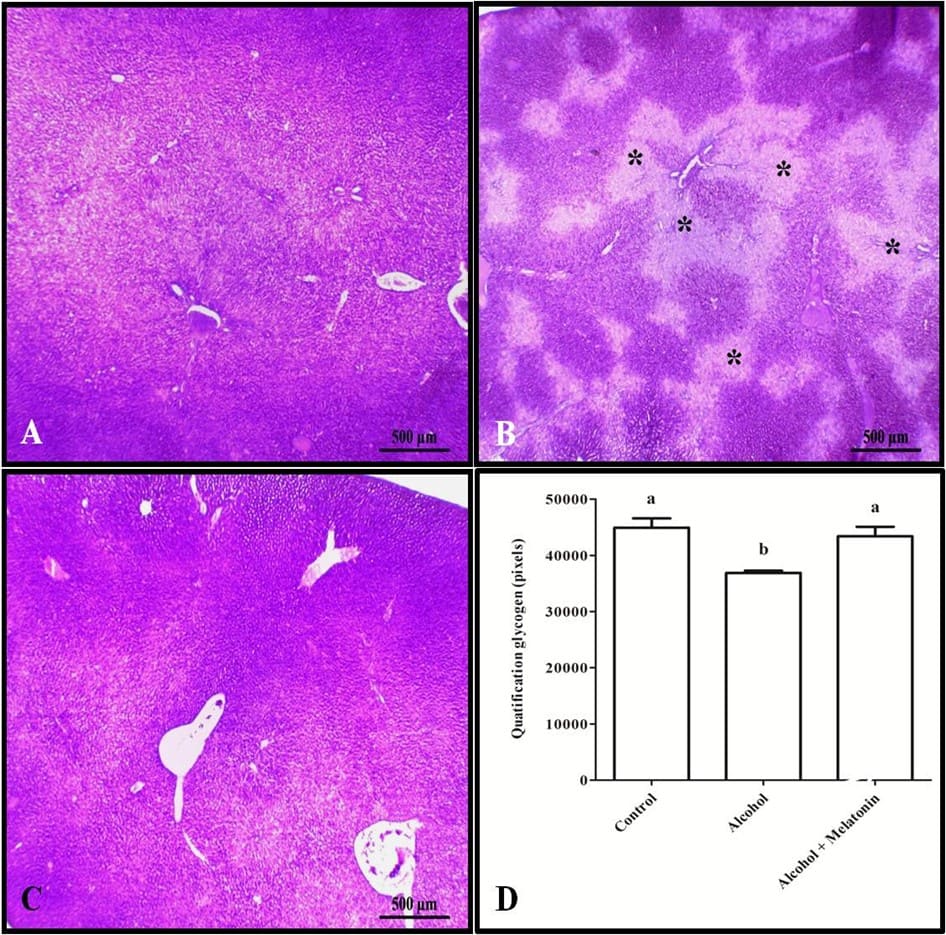
Figura 4. Histoquímica para glicogênio no fígado de fêmeas nos grupos experimentais. A (controle); B (álcool); C (álcool + melatonina). Observa-se em B várias áreas menos coradas (*), sinalizando a ausência de glicogênio. D – Quantificação em pixels. SBP As médias seguidas da mesma letra não diferem significativamente segundo o teste de Tukey e Kramer (p<0,05)
4. DISCUSSÃO
O fígado é o principal órgão que sofre os efeitos deletérios de substâncias tóxicas (BHADORIA et al., 2015). O consumo de álcool provoca alterações estruturais resultantes do estresse oxidativo. Portanto, é um dos mecanismos centrais de danos ao fígado (RADIC et al., 2019). No presente estudo, verificou-se que no grupo do álcool, o fígado apresentou congestão da veia central do lóbulo, corroborando os resultados apresentados por Radic et al. (2021), onde, segundo Allaithi; Alazawi (2019), pode ser explicado pelo acúmulo de gordura no fígado, que por sua vez estimula uma resposta inflamatória pelas células estreladas, liberando assim citocinas inflamatórias para trazer uma maior quantidade de glóbulos brancos para a região afetada. O que justificaria também em nossos achados a presença de infiltrado leucocitário no parênquima hepático. A presença desses infiltrados, principalmente neutrófilos dentro do parênquima hepático, é uma característica indicativa de hepatite alcoólica (RAMAIAH; JAESCHKE, 2007) e ocorre abundantemente nos tratos porta (MOSTAFA et al., 2020).
Segundo Tao et al. (2021) e Yeh; Brunt (2014), esteatose e balonamento hepatocitário estão entre as lesões hepáticas alcoólicas, o que também foi evidenciado em nosso estudo. A esteatose é considerada a forma mais frequente de doença hepática alcoólica e precede outras alterações, como esteato-hepatite e fibrose (KISSELEVA; BRENNER, 2019; GAO; BATALLER, 2011). Caracteriza-se pelo comprometimento do parênquima lobular hepático resultante do acúmulo de lipídios nos hepatócitos. Esse comprometimento é observado principalmente ao redor da veia central do lóbulo, no entanto, com a progressão da patologia, pode envolver todas as áreas, sendo frequentemente acompanhado por um infiltrado inflamatório crônico (MOSTAFA et al., 2020), como pudemos observar em nosso estudo. O balonamento hepático, por outro lado, é a modificação morfológica devido ao estresse hepatocelular resultante da oxidação de ácidos graxos livres e estresse do retículo endoplasmático devido ao acúmulo de gordura, promovendo assim lesões ao ambiente intracelular, como alterações em Perilipina. As lesões são vistas por meio de alterações morfológicas como o inchaço celular, aumento dos hepatócitos, arredondamento do contorno celular, reticulação e clareamento do citoplasma a partir de um material viscoso chamado corpos de Mallory-Denk ou hialino de mallory, que é composto de filamentos intermediários bem fosforilados, proteína ubiquitina ligante P62 e ubiquitina no citoplasma dos hepatócitos (MOSTAFA et al., 2020; SCHILD; GUY, 2018).
A esteatose pode progredir para seu estado inflamatório, a esteato-hepatite. Em casos posteriores e mais graves, a disposição de colágeno resultante do dano parenquimatoso, como inflamação crônica, necrose e subsequente regeneração celular, pode causar fibrose em resposta à atividade regenerativa exacerbada (MASSEY; ARTEEL, 2012; ROY et al., 2015), o que justifica o aumento de colágeno nos animais do grupo Álcool. Também verificamos em nossos achados, hepatócitos com núcleo picnótico. De acordo com a literatura, isso é indicativo de baixa atividade celular, sugestivo de um processo de necrose celular (BHADORIA et al., 2015).
Em nossa pesquisa, a ingestão de EtOH causou ainda uma marcante diminuição da reserva de glicogênio do tecido parenquimatoso hepático. No fígado, a glicose é transportada para os hepatócitos por meio de proteínas de transporte presentes em sua membrana plasmática (NANJI; FOGT; GRINIUVIENE, 1995), promovendo assim a formação da reserva de açúcar sob a forma de glicogênio por meio da Glicogênio Sintase (GS). O consumo de EtOH não promove alterações na atividade de fosforilação da GS, porém, promove uma redução nos níveis de expressão e em seu mRNA (MARTIN et al., 2004; SRINIVASAN; SHAWKY; KAPHALIA, 2019), o que ocasiona uma diminuição da reserva glicídica total nos hepatócitos periportais e perivenosos (STEINER; CROWELL; LANG, 2015).
O grupo Álcool+melatonina apresentou atenuação das alterações estruturais encontradas no fígado dos animais do grupo Álcool, com parâmetros próximos aos do grupo Controle. Já foi demonstrado que esta indolamina é uma esplêndida antioxidante não enzimática (SINGH; JADHAV, 2014), com alta capacidade de minimizar alterações e auxiliar na manutenção do arranjo habitual dos hepatócitos (GHOSH et al., 2023), além de estar amplamente distribuída no corpo. Isso se deve à sua estrutura possuir sítios doadores de elétrons nos carbonos 2 e 3 do anel pirrólico, e sua natureza anfifílica, ou seja, lipofílica e hidrofílica, proporcionando assim a capacidade de atravessar facilmente as membranas celulares e as barreiras hematoencefálicas (REITER et al., 2013), reduzindo assim o estresse oxidativo por meio da eliminação de radicais livres de todos os tipos (REITER et al., 2014). Portanto, a melatonina pode ter atuado sobre as anormalidades, prevenindo o desequilíbrio nos mecanismos antioxidantes e pró-oxidantes, que por sua vez podem ter retardado ou prevenido o desenvolvimento de lesões resultantes do estresse oxidativo (HU et al., 2009) no grupo Álcool+melatonina.
De acordo com Galano, Tan e Reiter (2011), esta indolamina tem a capacidade de promover uma redução na peroxidação lipídica e um aumento na concentração de antioxidantes ao modular sua expressão, além do potencial de prevenir a redução do glutationa (GSH) quando utilizado por um período prolongado, além de diminuir e a sensibilização das células de kupffer ao álcool, o que reduz os níveis de ROS. Como resultado dessa redução, age de forma indireta nos infiltrados de leucócitos, promovendo uma melhora na inflamação (ZHANG et al., 2021). No entanto, a melatonina age também diretamente sobre a inflamação, pois tem a capacidade de atenuar a migração dos infiltrados de neutrófilos em resposta a lesões (KURHALUK; TKACHENKO, 2020). Já foi demonstrado por Ghosh et al. (2023) em modelo experimental de estresse oxidativo em ratos, que esta indolamina atua para reduzir a deposição de colágeno no fígado, prevenindo assim a fibrose por meio e agindo para reduzir a proliferação de fibroblastos (LI et al., 2020), promovendo assim uma resposta indireta na fibrose por citocinas. Quanto à reserva de açúcar no fígado, o grupo Álcool+melatonina apresentou uma reserva de glicogênio próxima ao grupo Controle. Estudos anteriores apontaram que a melatonina tem a capacidade de aumentar o conteúdo de glicogênio hepático (FARIA et al., 2022), e esse aumento pode ser explicado pela melhoria na captação de glicose nos tecidos e/ou na sensibilidade à insulina por meio de uma via dependente. do Akt ativada via receptor de melatonina (SHIEH et al., 2009). Assim, pode prevenir a redução das reservas de glicogênio observadas no grupo submetido ao consumo crônico de álcool.
5. CONCLUSÕES
Os resultados do presente estudo demonstraram que a melatonina possui grande potencial terapêutico na prevenção de danos ao fígado de ratos adolescentes submetidos ao consumo imoderado de álcool, além de efeitos positivos na deposição de colágeno e glicogênio no fígado. No entanto, é necessário aprofundar os estudos nessa área para obter mais dados que comprovem e reforcem o potencial dessa hormona na terapia preventiva de alterações e patologias causadas pelo consumo crônico de álcool.
REFERÊNCIAS BIBLIOGRÁFICAS
ABD-ALLAH, A. R. A. et al. Effect of melatonin on estrogen and progesterone receptors in relation to uterine contractions in rats. Pharmacological Research , v . 47, pp. 349–354, 2003. DOI: 10.1016/s1043-6618(03)00014-8.
ALLAITHI, L. A. A.; Al-AZAWI, W. M. K. Study of the effect of salvia officinalis leaves extract and xenical drug on some of the biochemical and histological parameters in the rats induced with hyperlipidemia. Plant Archives, v . 19, pp. 1111–1122, 2019.
AMARAL, F. G. et al. New insights into the function of melatonin and its role in metabolic disturbances. Expert Review of Endocrinology & Metabolism, v. 14, no. 4, pp. 293–300, 2019. DOI: 10.1080/17446651.2019.1631158.
ANDRADE, A. G.; SIU, E. R. Alcohol and the health of Brazilians: panorama 2019. Health and alcohol information center. P. 104, 2019.
ARAÚJO-FILHO, J. L. S. et al. Histomorphometric analysis of the heart of rats indirectly exposed to ethanol and chronic malnutrition during the perinatal period. Journal of Medical and Biological Sciences, v. 6, no. 1, pp. 17-25, 2007. DOI: 10.9771/cmbio.v6i1.4144.
BEST, C. A.; LAPOSATA, M. Fatty acid ethyl esters toxic non-oxidative metabolites of ethanol and markers of ethanol intake. Frontiers in Bioscience, v. 8, no. 5, pp. e202-217, 2003. DOI: 10.2741/931.
BHADORIA, P. et al. Effect of Ethephon on the Liver in Albino Rats: A Histomorphometric Study. Biomedical Journal, v. 38, no. 5, pp. 421–427, 2015. DOI: 10.4103/2319-4170.155589.
BROCARDO, P. S.; GIL-MOHAPEL, J.; CHRISTIE, B. R. The role of oxidative stress in fetal alcohol spectrum disorders. brain Research Reviews, vol. 67, no. 1–2, pp. 209–225, 2011. DOI: 10.1016/j.brainresrev.2011.02.001.
ENGELMAN, M. F. B. et al. Morphometric study of the liver of rats submitted to supraphysiological doses of thyroxine. Brazilian Archives of Endocrinology & Metabolism, v. 45, no. 2, pp. 173-179, 2001. DOI: 10.1590/S0004-27302001000200009.
FARIA, V. S. et al. Melatonin Potentiates Exercise-Induced Increases in Skeletal Muscle PGC-1 α and Optimizes Glycogen Replenishment. Frontiers in Physiology, vol. 13, pp. 1–11, 2022. DOI: 10.3389/fphys.2022.803126.
FARKAS, Á.; KEMÉNY, L. Alcohol, Liver, Systemic Inflammation and Skin: A Focus on Patients with Psoriasis. Skin Pharmacology and Physiology, v. 26, no. 3, pp. 119–126, 2013. DOI: 10.1159/000348865.
FIOCRUZ. III national survey on drug use by the Brazilian population. [sl .: sn], 2017. Available at: <https: //www.arc a .fiocruz.br/bitstream/icict/34614/1/III%20LNUD_PORTUGU%C3%8 AS.pdf>.
GALANO, A.; TAN, D. X; REITER, R. J. Melatonin as a natural ally against oxidative stress: a physicochemical examination. Journal of Pineal Research, vol. 51, no. 1, pp. 1-16, 2011. DOI: 10.1111/j.1600-079X.2011.00916.x.
GALANO, A.; TAN, D. X.; REITER, R. J. Melatonin: A Versatile Protector against Oxidative DNA Damage. Molecules, v. 23, no. 3, pp. 530, 2018. DOI: 10.3390/molecules23030530.
GAO, B.; BATALLER, R. Alcoholic Liver Disease: Pathogenesis and New Therapeutic Targets. GASTROENTEROLOGY, v. 141, no. 5, pp. 1572-1585, 2011. DOI: 10.1053/j.gastro.2011.09.002.
GHOSH, P. et al. Insights into the antioxidative mechanisms of melatonin in ameliorating chromium-induced oxidative stress-mediated hepatic and renal tissue injuries in male Wistar rats. Food and Chemical Toxicology, v. 173, pp. 113630, 2023. DOI: 10.1016/j.fct.2023.113630.
GUNATA, M.; PARLAKPINAR, H.; ACET, H. A. Melatonin: A review of its potential functions and effects on neurological diseases. Revue Neurologique, vol. 176, no. 3, pp. 148–165, 2020. DOI: 10.1016/j.neurol.2019.07.025.
HARDELAND, R.; PANDI-PERUMAL, S. R.; CARDINALI, D. P. Melatonin. The International Journal of Biochemistry & Cell Biology, v. 38, no. 3, pp. 313-316, 2006. DOI: 10.1016/j.biocel.2005.08.020.
HU, C. et al. Protective role of melatonin in early-stage and end-stage liver cirrhosis. Journal of Cellular and Molecular Medicine, v. 23, no. 11, pp. 7151–7162, 2019. DOI: 10.1111/jcmm.14634.
HU, S. et al. Melatonin protects against alcoholic liver injury by attenuating oxidative stress, inflammatory response, and apoptosis. European Journal of Pharmacology, v. 616, pp. 287–292, 2009. DOI: 10.1016/j.ejphar.2009.06.044.
KISSELEVA, T.; BRENNER, D. A. The Crosstalk between Hepatocytes, Hepatic Macrophages, and Hepatic Stellate Cells Facilitates Alcoholic Liver Disease. Cell Metabolism, v. 30, no. 5, pp. 850-852, 2019. DOI: 10.1016/j.cmet.2019.10.010.
KLEINER, D. E. et al. Design and validation of a histological scoring system for nonalcoholic fatty liver disease. Hepatology, v. 41, no. 6, pp. 1313–1321, 2005. DOI: 10.1002/hep.20701.
KURCER, Z. et al. Melatonin improves methanol intoxication-induced oxidative liver injury in rats. Journal of Pineal Research, vol. 43, no. 1, pp. 42-49, 2007. DOI: 10.1111/j.1600-079X.2007.00441.x.
KURHALUK, N.; TKACHENKO, H. Melatonin and alcohol-related disorders. Chronobiology International, v. 37, no. 6, pp. 781–803, 2020. DOI:10.1080/07420528.2020.1761372.
KURHALUK, N.; TKACHENKO, H.; LUKASH, O. Melatonin modulates oxidative phosphorylation, hepatic and kidney autophagy-caused subclinical endotoxemia and acute ethanol-induced oxidative stress. Chronobiology International, v. 37, no. 12, pp. 1709–1724, 2020. DOI: 10.1080/07420528.2020.1830792.
LI, N. et al. Melatonin ameliorates renal fibroblast-myofibroblast transdifferentiation and renal fibrosis through miR-21-5p regulation. Journal of Cellular and Molecular Medicine, v. 24, no. 10, pp. 5615–5628, 2020. DOI: 10.1111/jcmm.15221.
MAHIEU, S. et al. Melatonin reduces oxidative damage induced by aluminum in rat kidney. Toxicology Letters, v. 190, no. 1, pp. 9-15, 2009. DOI: 10.1016/j.toxlet.2009.06.852.
MARCO, I. N. et al. Long-Term Effects of Intermittent Adolescent Alcohol Exposure in Male and Female Rats. Frontiers in Behavioral Neuroscience, v. 11, no. 233, pp. 1-13, 2017. DOI: 10.3389/fnbeh.2017.00233.
MARTIN, J. V. et al. Effects of dietary caffeine and alcohol on liver carbohydrate and fat metabolism in rats. Medical science monitor: international medical journal of experimental and clinical research, v. 10, no. 12, pp. BR455-BR461, 2004.
MASSEY, V. L.; ARTEEL, G. E. Acute Alcohol-Induced Liver Injury. Frontiers in Physiology, vol. 3 n. 193, pp. 1-8, 2012. DOI: 10.3389/fphys.2012.00193.
MINCIS, M. et al. Alcohol and the Liver. GED: Gastroenterology Endoscopy digestive, v. 30, no. 4, pp. 152-162, 2011.
MOSTAFA, M. et al. Fatty Liver Disease: A Practical Approach. Archives of Pathology & Laboratory Medicine, v. 144, no. 1, pp. 62–70, 2020. DOI: 10.5858/arpa.2019-0341-RA.
MOUSTAFA, A. M. et al. Effect of bromocriptine on uterine contractility in near term pregnant rats. Pharmacological Research, v. 39, no. 2, p. 89-95, 1999. DOI: 10.1006/phrs.1998.0399.
NANJI, A. A.; FOGT, F.; GRINIUVIENE, B. Alterations in Glucose Transporter Proteins in Alcoholic Liver Disease in the Rat. The American Journal of Pathology, v. 146, no. 2, pp. 329-334, 1995.
NORBERG, A. et al. Role of Variability in Explaining Ethanol Pharmacokinetics: Research and Forensic Applications. Clinical Pharmacokinetics, v. 42, no. 1, p. 1–31, 2003. DOI: 10.2165/00003088-200342010-00001.
NWOZO, S.; AJAGBE, A.; OYINLOYE, B. Hepatoprotective effect of Piper guineense aqueous extract against ethanol-induced toxicity in male rats. Journal of Experimental and Integrative Medicine, v. 2, no. 1, pp. 71-76, 2012. DOI: 10.5455/jeim.241111.or.016.
PAGET, G. E.; BARNE, J. M. Evaluation of results: quantitative application in different species. Pharmacometrics , vol. 1. p. 161. 9th ed. New York: Academic Press; 1994.
POEGGELER, B. et al. Melatonin, hydroxyl radical- mediated oxidative damage, and aging: A hypothesis. Journal of Pineal Research, v. 14, no. 4, pp. 151–168, 1993. DOI: 10.1111/j.1600-079x.1993.tb00498.x.
RADIC, I. et al. Protective effects of whey on rat liver damage induced by chronic alcohol intake. Human & Experimental Toxicology, v . 38, no. 6, pp. 632–645, 2019. DOI: 10.1177/0960327119829518.
RADIC, I. et al. Protective effects of pumpkin (Cucurbita pepo L.) seed oil on rat liver damage induced by chronic alcohol consumption. Archives of Biological Sciences, vol. 73, no. 1, pp. 123–133, 2021. DOI: 10.2298/ABS201205008R.
RAMAIAH, S. K.; JAESCHKE, H. Hepatic neutrophil infiltration in the pathogenesis of alcohol-induced liver injury. Toxicology Mechanisms and Methods, v.17, n. 7, pp. 431– 440, 2007. DOI: 10.1080/00952990701407702.
REITER, R. J. et al. Peripheral Reproductive Organ Health and Melatonin: Ready for Prime Time”, International Journal of Molecular Sciences, v. 14, no. 4, pp. 7231-7272, 2013. DOI: 10.3390/ijms14047231.
REITER, R. J.; TAN, D. X.; GALANO, A. Melatonin: exceeding expectations. Physiology (Bethesda, Md.), v. 29, no. 5, pp. 325–333, 2014. DOI: 10.1152/physiol.00011.2014.
ROCCO, A. et al. Alcoholic disease: Liver and beyond. World Journal of Gastroenterology, v. 20, no. 40, pp. 14652-14659, 2014. DOI: 10.3748/wjg.v20.i40.14652.
ROY S. et al. The role of miRNAs in the regulation of inflammatory processes during hepatofibrogenesis. Hepatobiliary Surgery and Nutrition, v. 4, no. 1, p. 24-33, 2015. DOI: 10.3978/j.issn.2304-3881.2015.01.05.
SCHEIDT, L. et al. Ethanol during adolescence decreased the BDNF levels in the hippocampus in adult male Wistar rats, but did not alter aggressive and anxiety -like behaviors. Trends Psychiatry Psychother. v. 7, no. 3, p. 143-151, 2015. DOI: 10.1590/2237-6089-2015-0017.
SCHILD, M. H.; GUY, C. D. Nonalcoholic Steatohepatitis. Surgical Pathology Clinics, v. 11, no. 2, pp. 267–285, 2018. DOI: 10.1016/j.path.2018.02.013.
SHIEH, J. M. et al. Melatonin ameliorates high fat diet-induced diabetes and stimulates glycogen synthesis via a PKC ζ -Akt-GSK3 β pathway in hepatic cells. Journal of Pineal Research, v. 47, no. 4, pp. 339–344, 2009. DOI: 10.1111/j.1600-079X.2009.00720.x.
SINGH, M., JADHAV, H. R. Melatonin: functions and ligands. Drug Discovery Today, v. 19, no. 9, pp. 1410-1418, 2014. DOI: 10.1016/j.drudis.2014.04.014.
SRINIVASAN, M. P.; SHAWKY, N. M.; KAPHALIA, B. S. Alcohol-induced ketonemia is associated with lowering of blood glucose, downregulation of gluconeogenic genes, and depletion of hepatic glycogen in type 2 diabetic db/db mice. Biochemical Pharmacology, v. 160, pp. 46-61, 2019. DOI: 10.1016/j.bcp.2018.12.005.
STEINER, J. L.; CROWELL, K. T.; LANG, C. H. Impact of Alcohol on Glycemic Control and Insulin Action. Biomoleculas, v. 5, no. 4, pp. 2223-2246, 2015. DOI: 10.3390/biom5042223.
TAO, Z. et al. Echinacoside ameliorates alcohol-induced oxidative stress and hepatic steatosis by affecting SREBP1c/FASN pathway via PPAR α. Food and Chemical Toxicology, v.148, pp. 1-9, 2021. DOI: 10.1016/j.fct.2020.111956.
ULLAH, U. et al. Hepatoprotective effects of melatonin and celecoxib against ethanol-induced hepatotoxicity in rats. Immunopharmacology and Immunotoxicology, v. 42, no. 3, pp. 255–263, 2020. DOI: 10.1080/08923973.2020.1746802.
VARLINSKAYA, E. I.; SPEAR, L. P.; SPEAR, N. E. Acute effects of ethanol on behavior of adolescent rats: Role of social context. Alcohol Clinical & Experimental Research, v. 25, no. 3, pp. 377–385, 2001. DOI: 10.1111/j.1530- 0277.2001.tb 02224.x.
VONGHIA, L. et al. Acute alcohol intoxication. European Journal of Internal Medicine, v. 19, no. 8, pp. 561–567, 2008. DOI: 10.1016/j.ejim.2007.06.033.
WHO – World Health Organization. Global status report on alcohol and health 2018. 2018, p. 472.
YANG, L. et al. Chronic Alcohol Exposure Increases Circulating Bioactive Oxidized Phospholipids. Journal of Biological Chemistry, v. 285, no. 29, pp. 22211–22220, 2010. DOI: 10.1074/jbc.M110.119982.
YEH, M. M.; BRUNT, E. M. Pathological features of fatty liver disease. Gastroenterology, v. 147, no. 4, pp. 754–764, 2014. DOI: 10.1053/j.gastro.2014.07.056.
ZHANG, H. et al. Melatonin ameliorates ochratoxin A induced liver inflammation, oxidative stress and mitophagy in mice involving in intestinal microbiota and restoring the intestinal barrier function. Journal of Hazardous Materials, v. 407, pp. 1-49, 2021. DOI: 10.1016/j.jhazmat.2020.124489.
[1] Doutorado em Biotecnologia Animal – UFRPE. ORCID: 0000-0001-9404-7501. Currículo Lattes: http://lattes.cnpq.br/8213260513385508.
[2] Bacharel em Ciências Biológicas – UFRPE. ORCID: 0000-0003-3659-3947. Currículo Lattes: https://lattes.cnpq.br/5069796237775832.
[3] Mestre em Entomologia Agrícola – UFRPE. ORCID: 0000-0003-3822-3050. Currículo Lattes: http://lattes.cnpq.br/4008994020879541.
[4] Doutorado no Programa de Pós-Graduação em Biotecnologia Animal – UFRPE. ORCID: 0000-0002-4733-461X. Currículo Lattes: http://lattes.cnpq.br/1906334502843226.
[5] Doutorado no Programa de Pós-Graduação em Biotecnologia Animal – UFRPE. ORCID: 0000-0002-6228-6951. Currículo Lattes http://lattes.cnpq.br/1783975917572458.
[6] Doutora em Biotecnologia Animal – UFRPE. ORCID: 0000-0002-2507-3682. Currículo Lattes: http://lattes.cnpq.br/9465720906397764.
[7] Mestre em Gerontologia – UFSM. ORCID: 0000-0001-9528-7312. Currículo Lattes: http://lattes.cnpq.br/9959642679541707.
[8] Doutora em Bioquímica e Fisiologia, Mestre em Fisiologia, Bióloga. ORCID: 0000-0003-1493-7964. Currículo Lattes: http://lattes.cnpq.br/9044747136928972.
[9] Doutora em Morfologia – UNIFESP. ORCID: 0000-0001-5940-9220. Currículo Lattes: http://lattes.cnpq.br/1539131079574469.
[10] Orientador. Doutor em Tecnologia Nuclear – USP. ORCID: 0000-0001-9533-5476. Currículo Lattes: http://lattes.cnpq.br/4292195468804301.
Enviado: 11 de julho, 2023.
Aprovado: 14 de agosto, 2023.

