ARTÍCULO ORIGINAL
SANTOS, Yasmim Barbosa dos [1], MELO, Ismaela Maria Ferreira de [2], ALVES, Érique Ricardo [3], NASCIMENTO, Bruno José do [4], SILVA, Maria Vanessa da [5], FRANÇA, Marcelle Mariana Sales de [6], PEREIRA, Alef de Moura [7], SOARES, Anísio Francisco [8], TEIXEIRA, Álvaro Aguiar Coelho [9], TEIXEIRA, Valéria Wanderley [10]
SANTOS, Yasmim Barbosa dos. et al. Melatonina y consumo crónico de etanol: efectos en el hígado y riñones de la descendencia. Revista Científica Multidisciplinar Núcleo do Conhecimento. Año 08, Ed. 08, Vol. 04, pp. 133-151. Agosto de 2023. ISSN: 2448-0959, Enlace de acceso: https://www.nucleodoconhecimento.com.br/biologia-es/consumo-cronico-de-etanol, DOI: 10.32749/nucleodoconhecimento.com.br/biologia-es/consumo-cronico-de-etanol
RESUMEN
El objetivo de esta investigación fue evaluar si la administración de melatonina durante el embarazo y la lactancia puede mitigar el daño hepático y renal inducido por el alcohol en la descendencia. Se formaron tres grupos con la descendencia de 30 ratas Wistar albinas del bioterio de la UFRPE: grupo de control, descendencia de ratas que no consumieron alcohol; grupo de alcohol, descendencia de ratas que consumieron alcohol; grupo de alcohol+mel, descendencia de ratas que consumieron alcohol y recibieron melatonina. Las ratas hembra recibieron 3 g/Kg de alcohol y 0.8 mg/Kg de melatonina durante el período gestacional y de lactancia. Las crías de rata fueron sacrificadas a los 30 días de edad. Los órganos recolectados fueron sometidos a procedimientos histológicos para análisis morfométricos, histopatológicos y estadísticos. En el hígado del grupo de alcohol, se observó congestión en las venas portal y centrolobulares, esteatosis y alteraciones en el tamaño del parénquima hepático, que no estaban presentes en los grupos de alcohol+mel y control. En el grupo de alcohol, los riñones también mostraron congestión en el área cortical, sin espacio subcapsular y con tamaño alterado de los glomérulos; en cambio, el grupo tratado con melatonina no presentó alteraciones en estos órganos. Los análisis estadísticos de los pesos y longitudes del grupo de alcohol+mel tampoco revelaron alteraciones significativas en comparación con el grupo expuesto solo al alcohol. Así, la melatonina actuó de manera positiva, interfiriendo y mitigando los efectos perjudiciales que el etanol tenía en el hígado, los riñones, el peso y la longitud de la descendencia cuyas madres fueron sometidas a un consumo crónico de alcohol.
Palabras clave: Alcohol, Antioxidante, Feto, Radicales libres, Ratón.
INTRODUCCIÓN
Casi el 10% de las mujeres en todo el mundo consumen alcohol durante el período gestacional (POPOVA et al., 2017). Esta prevalencia en las Américas es del 11,2%, según la Organización Panamericana de la Salud (OPS, 2019). Esta ingestión de bebidas alcohólicas durante el embarazo se considera aún más grave, ya que puede llevar a varias consecuencias adversas no solo para la madre, sino también para el embrión o feto. Estos resultados perjudiciales se conocen como Trastornos del Espectro Alcohólico Fetal (TEAF), que incluyen cambios mentales, físicos, cognitivos y conductuales (BERTRAND et al., 2005).
Los problemas causados a la descendencia de madres alcohólicas se consideran los más perjudiciales derivados del alcoholismo, ya que el alcohol llega fácilmente a los tejidos fetales (MESQUITA; SEGRE, 2009). Además, según algunos autores, el alcohol también puede llegar a la leche materna en grandes o pequeñas cantidades (BURGOS et al., 2002).
Durante el metabolismo del alcohol, se liberan radicales libres que aumentan el estrés oxidativo y causan cambios en la actividad de las proteínas (GONÇALVES; PEREIRA, 2007). El hígado es principalmente responsable de metabolizar el alcohol, siendo la magnitud del daño hepático determinada por la cantidad y regularidad del consumo, lo que puede causar hepatitis, esteatosis hepática, fibrosis, cirrosis y carcinoma hepatocelular (LIEBER, 2005; FONSECA; RODRIGUES, 2018).
Según Batista et al., (2010), el consumo constante de alcohol también puede causar varios efectos en los riñones y en grandes cantidades puede llevar al síndrome de necrosis tubular aguda. Así, el consumo de bebidas alcohólicas está relacionado con la promoción de la insuficiencia renal crónica, además de que los autores presentan la relación entre el alcoholismo y los cambios en la fisiología y morfología renal (THIEL et al., 1977).
En vista de esto, el uso de antioxidantes ha sido una alternativa para compensar los daños causados por el estrés oxidativo en los órganos, como la melatonina, que además de reducir la formación de radicales libres y estimular la acción de enzimas antioxidantes, también disminuye la oxidación hepática, protege el ADN nuclear y mitocondrial y aumenta los niveles de ARN mensajero para enzimas antioxidantes (GUERRERO et al., 2007; SOLÍS-HERRUZO; SOLÍS-MUÑOZ, 2009; SOUZA; MORAIS, 2016). Durante el período gestacional, la melatonina materna llega al feto a través de la placenta, por lo que puede desempeñar sus funciones en el feto o embrión y en las primeras semanas de vida, esta hormona puede llegar al recién nacido a través de la leche materna (ALVES et al., 1998; THOMAS et al., 2002; CARPENTIERI et al., 2012; REITER et al., 2013).
Considerando los efectos perjudiciales que puede causar el consumo excesivo de alcohol en el organismo, es pertinente investigar la posible acción protectora de la melatonina sobre el daño causado por el etanol en la descendencia de ratas. Así, esta investigación tuvo como objetivo evaluar si la melatonina exógena administrada durante el embarazo y la lactancia puede prevenir los efectos perjudiciales causados por el alcohol en el hígado y los riñones de la descendencia de ratas.
MATERIAL Y MÉTODOS
Esta investigación se llevó a cabo en la Universidad Federal Rural de Pernambuco (UFRPE) y fue aprobada por el Comité de Ética Institucional bajo el registro n.º 3325300821. Participaron en este estudio 30 ratas hembra albinas vírgenes (Rattus norvegicus albinus), de 90 días de edad, con un peso de aproximadamente 250±30 g, de la cepa Wistar, adquiridas a través del bioterio del Departamento de Morfología y Fisiología Animal (DMFA). Los animales fueron provistos de alimento y agua, y se alojaron en jaulas a una temperatura ambiente de 22±1 °C. La iluminación fue proporcionada por lámparas fluorescentes de 40W (marca Philips, modelo luz del día), estableciendo un fotoperíodo de 12 horas. Las ratas hembra se sometieron a exámenes colpocitológicos para identificar el ciclo estral y se seleccionaron aquellas que presentaron tres ciclos estrales regulares consecutivos para el experimento. Después del apareamiento y confirmación del embarazo, se dividieron en 3 grupos experimentales con 10 animales cada uno, para la futura formación de los siguientes grupos con la descendencia: grupo de control: crías de ratas que no recibieron alcohol durante el embarazo y la lactancia, sacrificadas después de 30 días de vida; grupo de alcohol: crías de ratas sometidas a consumo crónico de alcohol durante el embarazo y la lactancia, sacrificadas después de 30 días de vida; grupo de alcohol + mel: crías de ratas sometidas a consumo crónico de alcohol y tratadas simultáneamente con melatonina durante el embarazo y la lactancia, sacrificadas después de 30 días de vida.
APAREAMIENTO DE LOS ANIMALES
Las hembras en los experimentos fueron apareadas al comienzo de la noche (18:00 h). Al día siguiente, se realizaron exámenes colpocitológicos utilizando el método de tinción de Shorr-Harris, tomando la presencia de espermatozoides como parámetro para la confirmación del apareamiento.
ADMINISTRACIÓN DE ETANOL
Se administró una dosis de 3 g/Kg de etanol intragástricamente a las ratas durante el embarazo (VARLINSKAYA et al., 2001; ARAÚJO-FILHO et al., 2007; VEIGA et al., 2007; SCHEIDT et al., 2015; MARCO et al., 2017).
TRATAMIENTO CON MELATONINA
La melatonina, N-acetil-5-metoxitriptamina (Sigma Chemical Co., St. Louis, EE. UU.), se administró en inyecciones diarias de 0.8 mg/Kg durante todo el embarazo. Para este propósito, la melatonina se disolvió en 0.2 mL de etanol y se diluyó en 0.8 mL de solución salina al 0.9%. Las inyecciones se aplicaron por vía intraperitoneal, siempre entre las 6:00 p. m. y las 7:00 p. m. Esta dosis es comparable a la dosis humana (9 mg/kg), que se convirtió en función de la superficie corporal (MOUSTAFA et al., 1999; ABD-ALLAH et al., 2003). Los grupos de control y alcohol recibieron el vehículo de la hormona.
PESO Y MEDICIÓN DE LOS ANIMALES
Los pesos y longitudes de las crías se registraron el día del nacimiento, utilizando una balanza de precisión y una cinta métrica. Las medias de los datos obtenidos se utilizaron para los análisis estadísticos.
HISTOPATOLOGÍA
Para recolectar el hígado y los riñones de las crías a los 30 días de edad, los animales fueron anestesiados con clorhidrato de ketamina (80 mg/kg) y xilazina (6.0 mg/kg) por vía intramuscular. A continuación, se abrió la cavidad abdominal para extraer los órganos. Doce cachorros fueron utilizados por grupo, independientemente del sexo. Los animales fueron sacrificados mediante anestesia profunda con clorhidrato de ketamina (80 mg/Kg) y xilazina (6.0 mg/Kg), asociada a tiopental (100 mg/kg), por vía intraperitoneal. Fragmentos de hígado y riñón fueron sumergidos en formaldehído tamponado, permaneciendo allí durante 48 horas. Luego, partes de estos órganos pasaron por el proceso de deshidratación y diafanización para ser embebidos en parafina. Las secciones se realizaron en un microtomo tipo Minot (Leica RM 2035) ajustado a 5 mm. Cuando se obtuvieron, se colocaron en portaobjetos previamente engrasados con albúmina de Mayer y se dejaron secar durante 24 horas a una temperatura de 37°C en un horno. Finalmente, las secciones fueron teñidas con hematoxilina-eosina (H.E.) y analizadas en un microscopio de luz OLYMPUS BX-49 y fotografiadas en un microscopio OLYMPUS BX-50.
ANÁLISIS MORFOMÉTRICO
HÍGADO
El estudio morfométrico se realizó según la metodología descrita por Engelman et al., (2001). Se determinó la proporción entre el parénquima no lobulillar y lobulillar del hígado de las crías a los 30 días de los grupos experimentales mediante métodos estereológicos, utilizando una rejilla con 100 puntos de prueba, colocada en las secciones de las preparaciones histológicas teñidas con tricrómico de Mallory, ya que esto facilita la visualización de los espacios porta al utilizar métodos estereológicos. Se utilizaron cinco portaobjetos para el conteo, considerando 10 campos visualizados a través del objetivo de 40x, concluyendo 5.000 puntos por grupo.
RIÑONES
Para el análisis morfométrico de los riñones de las crías a los 30 días de los grupos experimentales, se utilizaron cinco portaobjetos de cada grupo y se analizaron diez glomérulos en cada portaobjetos. Las medidas se limitaron a los glomérulos, que demostraron, en un solo corte, los polos vascular y urinario. Este arreglo indica la sección que coincide con la región ecuatorial del glomérulo. Para las mediciones, se utilizaron glomérulos seleccionados al azar. Con el uso de una cámara de video Sony®, acoplada al microscopio Olympus® Bx50, se grabaron las imágenes y se realizó el análisis morfométrico utilizando la aplicación Line Morphometry, calibrada en micrómetros, asociada al programa Optimas® 6.2 para Windows. El valor del área glomerular se obtuvo posicionando el cursor para dibujar una línea circular externa, coincidiendo con los límites del penacho glomerular. Para medir la cápsula de Bowman, se adoptó la misma metodología (AKAOKA et al., 1994). Para calcular el volumen del glomérulo y la cápsula de Bowman, se utilizaron los criterios descritos por Pagtalunan et al., (2000). Para esta estimación, se utilizó la ecuación 4/3πr3, destinada a calcular el volumen de la esfera, en la que “r” representa el radio.
ANÁLISIS ESTADÍSTICO
Para la comparación de los datos morfométricos, se realizó el análisis de varianza, y cuando fue significativo, se complementó con la prueba de comparaciones múltiples de Tukey y Kramer. Se adoptó un nivel de significancia de 0,05 (P <0,05).
RESULTADOS
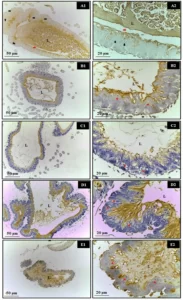
En cuanto al peso y la longitud de las crías después del nacimiento, hubo una reducción significativa en el grupo que recibió solo alcohol (Figuras 1 y 2). El análisis histopatológico del hígado de los animales en el grupo de control mostró un parénquima hepático sin cambios con cordones de hepatocitos organizados bordeando la vena central lobulillar, intercalados con capilares sinusoidales. Sin embargo, las crías de ratas que recibieron alcohol durante el embarazo y la lactancia mostraron parénquima hepático con congestión en las venas portal y centrolobulillar, además de un alto grado de esteatosis. Estos efectos no se observaron en los animales del grupo Alcohol + Mel (Figura 3).
Los riñones de los animales en el grupo de control estaban bien conservados, con la mayoría de los glomérulos y el espacio subcapsular bien definidos, además de túbulos contorneados proximales y distales con características normales, sin ninguna alteración. Estas características también se verificaron en los riñones de los animales que recibieron melatonina. En los riñones de los animales que recibieron solo alcohol, se observó la presencia de áreas de congestión en la corteza y corpúsculos con ausencia de espacio subcapsular (Figura 4).
El análisis morfométrico del hígado de los animales, cuyas madres recibieron solo alcohol durante el embarazo y la lactancia, mostró un parénquima lobulillar significativamente reducido y un parénquima no lobulillar aumentado. En el análisis morfométrico de los riñones, también se observó una reducción significativa en el diámetro y el volumen del glomérulo, además del diámetro y el volumen de la cápsula de Bowman, en este grupo. Mientras que los grupos de control y Alcohol+Mel no presentaron estas alteraciones (Tablas 1 y 2).
Figura 1: Peso de las crías al nacer. Alcohol: Observar reducción de peso significativa; Control y Alcohol+Mel: No hubo diferencia significativa. Medias seguidas de la misma letra en las líneas no difieren significativamente por la prueba Anova de una vía de Tukey con post hoc (p < 0.05)
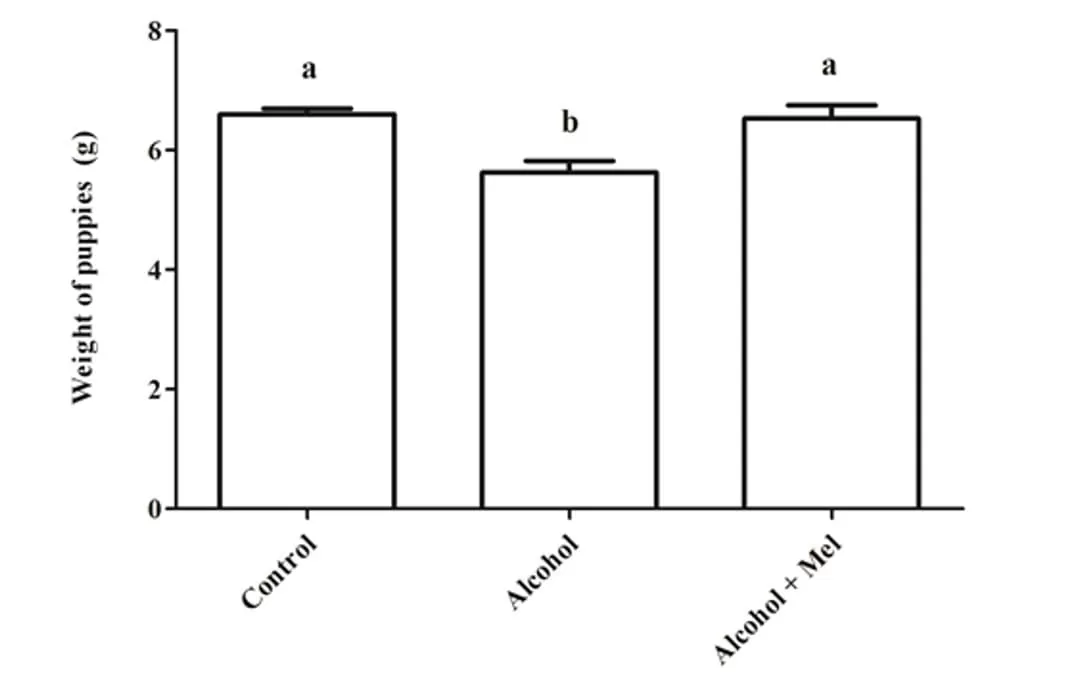
Figura 2: Longitud de las crías al nacer. Alcohol: Observar reducción significativa en la longitud; Control y Alcohol+Mel: No hubo diferencia significativa. Medias seguidas de la misma letra en las filas no difieren significativamente por la prueba Anova de una vía de Tukey con post hoc (p < 0.05)
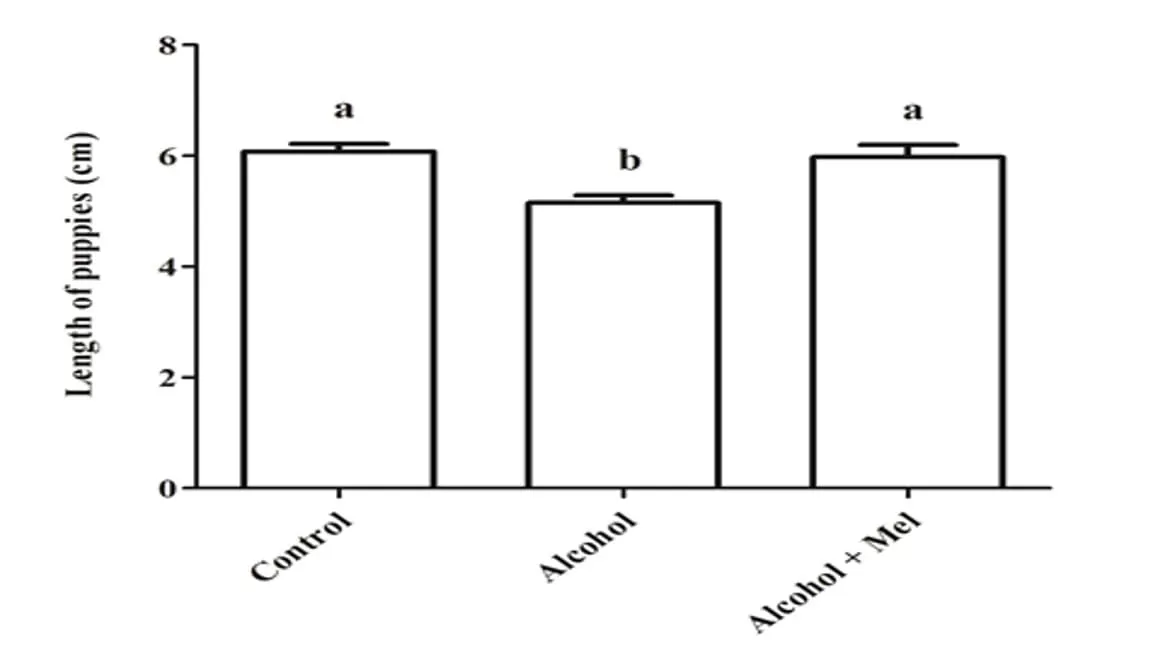
Figura 3: Fotomicrografía del hígado de los animales a los 30 días de edad. (AB) – Control: sin alteraciones con cordones de hepatocitos organizados; (CD) – Alcohol: observe congestión de venas portal y centrolobulillar y alto grado de esteatosis; (EF) – Alcohol + Mel: estructuras similares al control. Flechas largas – vena centrolobulillar; Flechas cortas – cordones de hepatocitos; Asterisco – conducto bilífero; Puntas de flecha – sinusoides; Flechas discontinuas – co-manejo de la vena centrolobulillar; Flechas blancas – hepatocitos que muestran esteatosis. H.E.
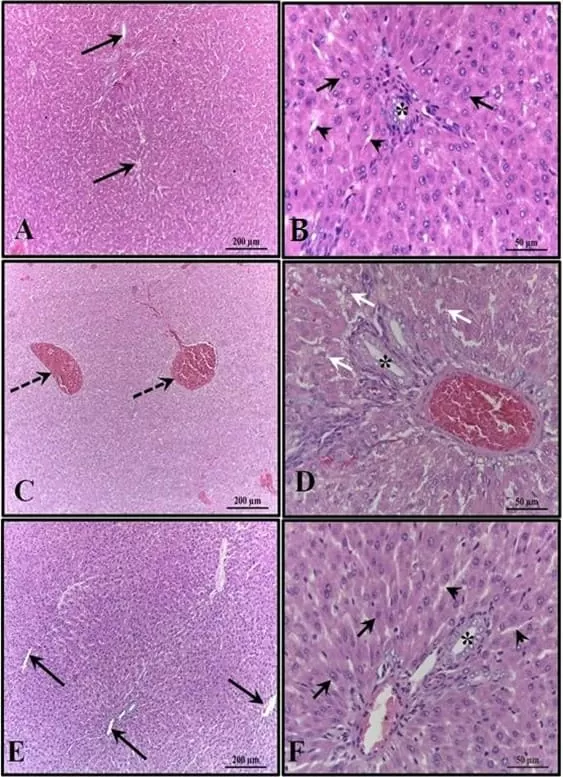
Figura 4: Fotomicrografía de los riñones de los animales a los 30 días de edad. (AB) – Control: estructura histológica preservada; (CD) – Alcohol: observe la presencia de áreas de congestión en la corteza y corpúsculos con ausencia del espacio subcapsular; (EF) – Alcohol + Mel: estructuras similares al control. Flechas largas – cápsula de Bowman; Asterisco – glomérulo; Flechas discontinuas – congestión cortical; Flechas cortas – ausencia de espacio subcapsular; Rc – Región Cortical. H.E.
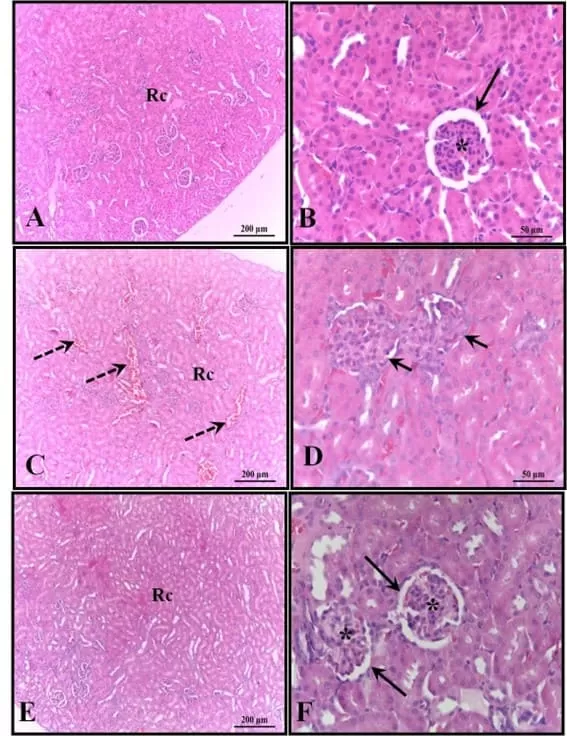
Tabla 1. Media ± desviación estándar del porcentaje de parénquima lobulillar y no lobulillar en el hígado de los animales a los 30 días de vida
| Grupos | Control | Alcohol | Alcohol + Mel | P |
| Parénquima lobulillar | 81.59 ± 2.95y | 73.26 ± 1.40b | 80.53 ± 1.42a | 0.0050 |
| Parénquima no lobulilla | 18.43 ± 2.97y | 26.50 ± 1.04b | 19.50 ± 1.48y | 0.0053 |
Fuente: Autores, 2023.
Las medias seguidas de la misma letra en las filas no difieren significativamente según la prueba Anova de una vía de Tukey con post hoc (p < 0,05).
Tabla 2. Media ± desviación estándar del diámetro glomerular (DG), volumen del glomérulo (VG), diámetro de la cápsula de Bowman (DCB), volumen de la cápsula de Bowman (VCB) en los riñones de los animales a los 30 días de vida
| Grupos | Control | Alcohol | Alcohol + Mel | P | |
| DG (µm) | 6629 ± 351a | 4670 ± 121b | 6302 ± 157a | 0.0017 | |
| VG (µm 3) | 35212 ± 3584a | 20329 ± 1734b | 33319 ± 216a | 0.0094 | |
| DCB(µm) | 7338 ± 296a | 5877 ± 380b | 7202 ± 110a | 0.0024 | |
| VCB(µm3) | 41645 ± 544a | 30881 ± 761b | 42972 ± 464a | 0.0317 | |
Fuente: Autores, 2023.
Prueba Anova de una vía de Tukey con post hoc (p < 0,05).
DISCUSIÓN
La exposición intrauterina al alcohol puede causar varios efectos perjudiciales en el feto o embrión, tales como anomalías estructurales y deficiencias conductuales, neurocognitivas, y uno de los primeros síntomas prenatales, la deficiencia de crecimiento (longitud y/o peso) que posiblemente persiste en el período postnatal (HOYME et al., 2005).
En este trabajo, se observó una disminución en el peso y la longitud de las crías con el consumo de alcohol por las madres, mientras que en los grupos de control y alcohol+mel no hubo diferencias significativas para este resultado. Autores como Domingues et al., (2009) también encontraron la interferencia del etanol en el crecimiento de los fetos. Dado que el consumo excesivo de alcohol puede afectar la capacidad materna para mantener el desarrollo del feto, interfiriendo en la absorción de nutrientes por parte de la madre y causando vasoconstricción del cordón umbilical y la placenta, alterando su capacidad para proporcionar nutrientes al feto a través del flujo sanguíneo (GOODLETT; HORN, 2001).
A su vez, la melatonina en el grupo alcohol+mel logró preservar el crecimiento fetal, ya que tiene una acción antioxidante, protegiendo la placenta contra daños, además de estimular el paso de nutrientes a través del cordón umbilical (EIFERT et al., 2015). Así como Nagai et al., (2008) encontraron en su estudio que el tratamiento con melatonina evitó la restricción del crecimiento fetal y el daño oxidativo a la placenta.
En los análisis histopatológicos y morfométricos del hígado en el grupo de alcohol, se detectó congestión en las venas centrolobulillares y portal, además de esteatosis, que es considerada la primera etapa de la enfermedad hepática alcohólica, siendo una consecuencia directa de los impactos causados por el metabolismo del alcohol (BREITKOPF et al., 2009). La esteatosis puede ser causada por la acumulación de NADH en los hepatocitos durante el metabolismo del etanol, provocando cambios en el metabolismo de los lípidos al inhibir la β-oxidación de los ácidos grasos y aumentar su síntesis para eliminar el exceso de hidrógeno (ALBANO, 2006; SOZIO; CRABB, 2008).
Por otro lado, estas alteraciones no se observaron en el grupo de alcohol+mel, indicando la acción beneficiosa de la melatonina y demostrando su eficacia en la protección del hígado de las crías contra las lesiones causadas por la exposición al alcohol. Las actividades antioxidantes y antiinflamatorias de la melatonina son bien conocidas, además de sus propiedades protectoras contra el estrés oxidativo y su capacidad para prevenir la esteatosis hepática alcohólica (ZHANG et al., 2017). Según Hu et al., (2009), la melatonina demostró la capacidad de inhibir la generación de radicales libres, lo que resulta en una reducción considerable de la esteatosis, la peroxidación lipídica y la actividad de citocinas inflamatorias en ratas adultas expuestas al consumo de alcohol. Nuestro trabajo mostró que la administración de melatonina también puede detener el desarrollo del daño hepático causado en las crías de madres que consumen alcohol durante el embarazo y la lactancia.
En el grupo de alcohol, los hallazgos histológicos y morfométricos también mostraron congestión en la región cortical y ausencia de espacio subcapsular en los corpúsculos renales, además de una reducción significativa en el volumen y el diámetro de los glomérulos y la cápsula de Bowman. Estudios han confirmado la relación entre la Enfermedad Arterial Renal Aterosclerótica (ARAD) y el consumo crónico de alcohol, lo que lleva a la atrofia renal, así como al aumento de la producción de especies reactivas de oxígeno por el metabolismo del etanol, lo que puede afectar los riñones y dañar los túbulos renales; estos radicales libres también afectan a las células del sistema inmunológico y estimulan la producción de citocinas proinflamatorias, lo que puede llevar al desarrollo de enfermedades renales (KONOPKA et al., 2007; BARR et al., 2016; VARGA et al., 2017; WANG et al., 2017).
El grupo de alcohol + mel no reveló estas lesiones en los riñones, lo que indica la acción de la melatonina con sus efectos antiinflamatorios, antioxidantes y moduladores de citocinas en este órgano también. El tratamiento con melatonina es capaz de reducir de manera significativa el estrés oxidativo en los riñones, además de ejercer una acción antiapoptótica, con la capacidad de reducir las citocinas proinflamatorias, mejorar la actividad mitocondrial y tener efectos beneficiosos sobre las alteraciones en la presión renal (RUSSCHER et al., 2012, ZHANG et al., 2021). Esto explica la protección contra los cambios en la histología renal y cómo evitó la congestión causada por la estimulación de acciones inflamatorias en el grupo de alcohol + mel, ya que la melatonina tiene una variedad de actividades biológicas realizadas en diferentes órganos a través de sus receptores. Estudios con ratas adultas muestran que la melatonina evita el deterioro estructural y funcional del tejido renal causado por el estrés oxidativo inducido por el etanol (KURHALUK et al., 2020). Sin embargo, nuestros hallazgos indican que la melatonina es capaz de atenuar estas lesiones también en las crías que estuvieron expuestas al etanol durante el embarazo y la lactancia.
CONCLUSIONES
Así, la melatonina fue capaz de interferir y mitigar los efectos perjudiciales que el etanol ejerció sobre la histología del hígado y los riñones de las crías cuyas madres fueron sometidas a un consumo crónico de alcohol. Esta investigación también mostró un efecto positivo de esta hormona sobre el peso y
la longitud, lo que significa que el exceso de alcohol no altera la absorción y el transporte de nutrientes entre la madre y las crías. Así, sugiriendo que la melatonina puede ser un adyuvante importante en el tratamiento de los daños causados por el alcohol en el hígado y los riñones de los hijos de mujeres alcohólicas.
REFERENCIAS
ALBANO, E. Alcohol, oxidative stress and free radical damage. Proceed. of the Nutri. Society., v.65, n.3, p. 278-290, 2006.
ABD-ALLAH, A. R. A. et al. Effect of melatonin on estrogen and progesterone receptors in relation to uterine contraction in rats. Pharmacol. Res., v.47, n.4, p.349 – 354, 2003.
AKAOKA, K.; WHITE, R. H.; RAAFAT, F. Human glomerular growth during childhood: a morphometric study. J. Pathol., v.173, n.3, p.261-268, 1994.
ALVES, R. S. C. et al. Melatonin and sleep in children. Div. Ped., v.20, n.2, p.99- 954, 1998.
ARAÚJO-FILHO, J. L. S. et al. Histomorphometric analysis of the heart of rats indirectly exposed to ethanol and chronic malnutrition during the perinatal period. Rev. Ciênc. Méd. Biol., v.6, n.1, p.17-25, 2007.
BARR, T. et al. Opposing effects of alcohol on the immune system. Prog Neuropsychopharmacol Biol Psychiatry., v. 65, p. 242-251, 2016.
BATISTA, A. H.; SEGUI, G. P.; CANDINA, H. R. Alteraciones en las características morfométricas del riñón de ratas albinas machos provocadas por la ingestión crónica de etanol desde la adolescencia. Rev. Cubana Invest. Biomédicas, v. 29, n. 2, p. 194-202, 2010.
BERTRAND, J.; FLOYD, R. L.; WEBER, M. K. Guidelines for identifying and referring persons with fetal alcohol syndrome. MMWR Recomm Rep., v. 54, n.11, p. 1-12, 2005.
BREITKOPF, K. et al. Current experimental perspectives on the clinical progression of alcoholic liver disease. Alcohol Clin Exp Res., v.33, n.10, p. 1647-1655, 2009.
BURGOS, M. G. P. A. et al. The effect of alcoholic beverages in nursing mothers and their impact on children. Rev. Bras. Saúde Matern. Infant., v.2, n. 2, p.129-135, 2002.
CARPENTIERI, A. et al. New perspectives in melatonin uses. Pharmacol. Research., v. 65, n.4, p. 437-444, 2012.
DOMINGUES, J. A. et al. Maternal and fetal liver histomorphological analysis of malnourished pregnant rats submitted to exposure to ethanol. Rev. da Facul. de Ciências Méd. de Sorocaba, v. 11, n. 3, p.9-17, 2009.
EIFERT, A. W. et al. Effect of melatonin or maternal nutrient restriction on vascularity and cell proliferation in the ovine placenta. Anim Reprod Sci., v.153, p. 13-21, 2015.
ENGELMAN, M. F. B. et al. Morphometric study of the liver of rats submitted to supraphysiological doses of thyroxine. Arq. Bras. Endocrinol. Metab., v.45, n.2, p.173-179, 2001.
FONSECA, C. F.; RODRIGUES, F. F. Action of ethanol on the liver. Altus Ciência: Rev. Acad. Multi. da Facul. Cid. de João Pinheiro. v.7, n.7, p. 75-90, 2018.
GONÇALVES, C. S.; PEREIRA, F. E. L. Alcoholic Hepatopathy: Pathogenesis and Treatment. Prog. de Educação Médica Continuada: Socied. Bras. De Hepatol., v.7, n.102, p. 1799-1807, 2007.
GOODLETT, C. R.; HORN, K. H. Mechanisms of Alcohol-Induced Damage to the Developing Nervous System. National Institute on Alcohol Abuse and Alcoholism, v.25, n.3, p.175-184, 2001.
GUERRERO, J. M. et al. La Melatonina. Investig. y Cienc., p.30-38, 2007.
HOYME, H. E. et al. A practical clinical approach to diagnosis of fetal alcohol spectrum disorders: clarification of the 1996 institute of medicine criteria. Pediatrics, v.115, n.1, p. 39-47, 2005.
HU, S. et al. Melatonin protects against acoholic liver injury by attenuating oxidative stress, inflammatory response, and apoptosis. Europ. J. of Pharmacol., v.616, n.1-3, p. 287-292, 2009.
KONOPKA, C. L. et al. Experimental model for the study of chronic renal ischemia in rats: morphologic, histological and ultra-structural analysis. Acta Cir Bras., v.22, n. 1, p.12-21, 2007.
KURHALUK, N. et al. Melatonin modulates oxidative phosphorylation, hepatic and kidney autophagy-caused subclinical endotoxemia and acute ethanol-induced oxidative stress. Chronobiol Int., v. 37, n. 12, p. 1709-1724, 2020.
LIEBER, C. S. Metabolism of Alcohol. Clinics in Liver Disease, v.9, n.1, p. 1–35, 2005.
MARCO, E. M. et al. Long-term effects of intermittent adolescent alcohol exposure in male and female rats. Front. Behav. Neurosci., v.11, n.233, p.1-13, 2017.
MESQUITA, M. A.; SEGRE, C. A. M. Frequency of alcohol effects in fetus and pattern of alcohol consumption by pregnant women at a public maternity hospital in São Paulo city, Brazil. Rev Bras Crescimento Desenvol. Hum., v.1, n.19, p. 63-77, 2009.
MOUSTAFA, A. M. et al. Effect of bromocriptine on uterine contractility in near term pregnant rats. Pharmacol. Res., v. 39, n.2, p. 89 – 95, 1999.
NAGAI, R. et al. Melatonin Preserves Fetal Growth in Rats by Protecting against Ischemia/Reperfusion-Induced Oxidative/Nitrosative Mitochondrial Damage in the Placenta. J. of Pineal Research., v. 45, n. 3, p. 271– 76, 2008.
PAHO (Pan American Health Organization). PAHO virtual course addresses alcohol consumption during pregnancy, 2019. Disponível em: https://www.paho.org/pt/noticias/25-6-2019-curso-virtual-da-opas-aborda-consumo-alcool-durante-gravidez
PAGTALUNAN, M. E. et al. Methods for estimating the volume of individual glomeruli. Kidney Int., v. 57, p. 2644-2649, 2000.
POPOVA, S. et al. Estimation of national, regional, and global prevalence of alcohol use during pregnancy and fetal alcohol syndrome: a systematic review and meta-analysis. Lancet Glob. Health, v. 5, p. 290-299, 2017.
REITER, R. J. et al. Melatonin and stable ccircadian rhythms optimize maternal, placental and fetal physiology. Human Reprod. Update, v.20, n.2, p. 293–307, 2013.
RUSSCHER, M. et al. The role of melatonin treatment in chronic kidney disease. Front Biosci., v.17, n. 7, p. 2644-56, 2012.
SCHEIDT, L. et al. Ethanol during adolescence decreased the BDNF levels in the hippocampus in adult male Wistar rats, but did not alter aggressive and anxiety-like behaviors. Trends Psych. Psychother., v.7, n.3, p. 143-151, 2015.
SOLÍS-HERRUZO, J. A.; SOLÍS-MUÑOZ, P. Melatonin and oxidative stress. Rev. Esp. de Enfermeiras Digest., v.101, n. 7, p. 453- 459, 2009.
SOUZA, W. L.; MORAIS, E. A. Antioxidant activity of melatonin on oxidative stress in spermatozoa: literature review. Nutri. Rev. Eletrônica, v.13, n. 5, p.4831-4839, 2016.
SOZIO, M.; CRABB, D. W. Alcohol and lipid metabolism. J. americ. de fisiol. Endocrin. e metabol., v.295, n. 1, 2008.
THOMAS, L. et al. Melatonin receptors in human fetal brain: 2- [125I] iodomelatonin binding and MT1 gene expression. J. of Pineal Research, v. 33, n. 4, p.218–224, 2002.
THIEL, D. H. et al. Alcohol: Its effect on the kidney. Metabolism, v. 26, n. 8, p. 857–866, 1977.
VARGA, Z. V. et al. Alcohol misuse and kidney injury: Epidemiological evidence and potential mechanisms. Alcoh. research: current reviews, v.38, n. 2, p. 283-288, 2017.
VARLINSKAYA, E. I. et al. Acute effects of ethanol on behavior of adolescent rats: Role of social context. Alcohol Clin. Exp. Res., v.25, n.3, p. 377–385, 2001.
VEIGA, R. K. A. et al. Morphometric changes in the thymus, spleen and Peyer’s patches during pre and postnatal alcohol exposure. Rev. Eletronica Farm., v.4, n.1, p. 32-42, 2007.
WANG, L. et al. Effects of chronic alcohol exposure on ischemia-reperfusion-induce acute kidney injury in mice: the role of β-arrestin 2 and glycogen synthase kinase. Exper. & Mol. Medic., v. 49, n. 6, 2017.
ZHANG, C. et al. Melatonin Alleviates Contrast-Induced Acute Kidney Injury by Activation of Sirt3. Oxid Med Cell Longev., v. 25, 2021.
ZHANG, J. J. et al. Effects of melatonin on liver injuries and diseases. Inter. J. of mol. Sci., v. 18, n. 4, p. 673, 2017.
[1] Máster por el Programa de Posgrado en Biosciencias Animales – UFRPE. ORCID: 0000-0002-6228-6951. Curriculum Lattes: http://lattes.cnpq.br/1783975917572458.
[2] Doctor en el Programa de Posgrado en Biosciencias Animales/UFRPE. ORCID: 0000-0002-4150-1923. Curriculum Lattes: https://lattes.cnpq.br/3537458174521270.
[3] Doctor por el Programa de Posgrado en Biosciencias Animales. ORCID: 0000-0002-7925-9212. Curriculum Lattes: http://lattes.cnpq.br/6892417222004207.
[4] Doctor por el Programa de Posgrado en Biosciencias Animales. ORCID: 0000-0001-9404-7501. Curriculum Lattes: http://lattes.cnpq.br/8213260513385508.
[5] Máster por el Programa de Posgrado en Biosciencias Animales. ORCID: 0000-0002-4733-461X. Curriculum LatteS: http://lattes.cnpq.br/1906334502843226.
[6] Licenciatura en Ciencias Biológicas. ORCID: 0000-0002-9662-0372. Curriculum Lattes: http://lattes.cnpq.br/2810228771568915.
[7] Licenciatura en Ciencias Biológicas – UFRPE. ORCID: 0000-0003-3659-3947. Curriculum Lattes: http://lattes.cnpq.br/5069796237775832.
[8] Doctor en Bioquímica y Fisiología, Máster en Fisiología, Biólogo. ORCID: 0000-0003-1493-7964. Curriculum Lattes: http://lattes.cnpq.br/9044747136928972.
[9] Doctor en Morfología/UNIFESP-EPM. ORCID: 0000-0001-5940-9220. Curriculum Lattes: http://lattes.cnpq.br/1539131079574469.
[10] Asesor. Doctor en Tecnología Nuclear por la Universidad de São Paulo (USP). ORCID: 0000-0001-9533-5476. Curriculum Lattes: http://lattes.cnpq.br/4292195468804301.
Presentado: 11 de julio, 2023.
Aprobado: 08 de agosto, 2023.