ARTIGO ORIGINAL
SANTOS, Yasmim Barbosa dos [1], MELO, Ismaela Maria Ferreira de [2], ALVES, Érique Ricardo [3], NASCIMENTO, Bruno José do [4], SILVA, Maria Vanessa da [5], FRANÇA, Marcelle Mariana Sales de [6], PEREIRA, Alef de Moura [7], SOARES, Anísio Francisco [8], TEIXEIRA, Álvaro Aguiar Coelho [9], TEIXEIRA, Valéria Wanderley [10]
SANTOS, Yasmim Barbosa dos. et al. Melatonina e consumo crônico de etanol: efeitos no fígado e nos rins da prole. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano 08, Edição 08, Vol. 04, pp. 133-151. Agosto de 2023. ISSN: 2448-0959, Link de acesso: https://www.nucleodoconhecimento.com.br/biologia/melatonina-e-consumo-cronico, DOI: 10.32749/nucleodoconhecimento.com.br/biologia/melatonina-e-consumo-cronico
RESUMO
O objetivo desta pesquisa foi avaliar se a administração de melatonina durante a gravidez e lactação pode atenuar os danos no fígado e nos rins induzidos pelo álcool na prole. Foram formados três grupos com a prole de 30 ratas albinas Wistar do biotério da UFRPE: grupo controle – Prole de ratas que não consumiram álcool; grupo álcool – Prole de ratas que consumiram álcool; grupo álcool+mel – Prole de ratas que consumiram álcool e receberam melatonina. As ratas fêmeas receberam 3 g/Kg de álcool e 0,8 mg/Kg de melatonina durante o período gestacional e de lactação. Os filhotes de rato foram eutanasiados aos 30 dias de idade. Os órgãos coletados foram submetidos a procedimentos histológicos para análises morfométricas, histopatológicas e estatísticas. No fígado do grupo álcool, foram observadas congestão nas veias portais e centrolobulares, esteatose e alterações nos tamanhos do parênquima hepático, que não estavam presentes nos grupos álcool+mel e controle. No grupo álcool, os rins também mostraram congestão na área cortical, sem o espaço subcapsular e com tamanho glomerular alterado; por outro lado, o grupo tratado com melatonina não apresentou alterações nesses órgãos. As análises estatísticas dos pesos e comprimentos do grupo álcool+mel também não revelaram alterações significativas quando comparadas ao grupo exposto apenas ao álcool. Assim, a melatonina atuou de forma positiva, interferindo e atenuando os efeitos prejudiciais que o etanol teve no fígado, rins, peso e comprimento da prole cujas mães foram submetidas ao consumo crônico de álcool.
Palavras-chave: Álcool, Antioxidante, Feto, Radicais livres, Rato.
INTRODUÇÃO
Aproximadamente 10% das mulheres em todo o mundo consomem álcool durante o período gestacional (POPOVA et al., 2017). Essa prevalência nas Américas é de 11,2%, de acordo com a Organização Pan-Americana da Saúde (PAHO, 2019). Essa ingestão de bebidas alcoólicas durante a gravidez é considerada ainda mais grave, pois pode levar a várias consequências adversas não apenas para a mãe, mas também para o embrião ou feto. Esses resultados prejudiciais são conhecidos como Transtornos do Espectro Alcoólico Fetal (TEAF), que incluem alterações mentais, físicas, cognitivas e comportamentais (BERTRAND et al., 2005).
Os problemas causados à prole de mães alcoólatras são considerados os mais prejudiciais resultantes do alcoolismo, uma vez que o álcool atinge facilmente os tecidos fetais (MESQUITA; SEGRE, 2009). Além disso, de acordo com alguns autores, o álcool também pode chegar ao leite materno em grandes ou pequenas quantidades (BURGOS et al., 2002).
Durante o metabolismo do álcool, são liberados radicais livres que aumentam o estresse oxidativo e causam alterações na atividade das proteínas (GONÇALVES; PEREIRA, 2007). O fígado é o principal responsável por metabolizar o álcool, sendo que a magnitude dos danos ao fígado é determinada pela quantidade e regularidade do consumo, o que pode causar hepatite, esteatose hepática, fibrose, cirrose e carcinoma hepatocelular (LIEBER, 2005; FONSECA; RODRIGUES, 2018).
De acordo com Batista et al., (2010), o consumo constante de álcool também pode causar vários efeitos nos rins e, em grandes quantidades, pode levar à síndrome da necrose tubular aguda. Assim, o consumo de bebidas alcoólicas está relacionado à promoção da insuficiência renal crônica, além de os autores apresentarem a relação entre o alcoolismo e as alterações na fisiologia e morfologia renal (THIEL et al., 1977).
Diante disso, o uso de antioxidantes tem sido uma alternativa para compensar os danos causados pelo estresse oxidativo nos órgãos, como a melatonina, que além de reduzir a formação de radicais livres e estimular a ação de enzimas antioxidantes, também diminui a oxidação hepática, protege o DNA nuclear e mitocondrial e aumenta os níveis de RNAm para enzimas antioxidantes (GUERRERO et al., 2007; SOLÍS-HERRUZO; SOLÍS-MUÑOZ, 2009; SOUZA; MORAIS, 2016). Durante o período gestacional, a melatonina materna atinge o feto através da placenta, podendo assim desempenhar suas funções no feto ou embrião e, nas primeiras semanas de vida, esse hormônio pode chegar ao recém-nascido através do leite materno (ALVES et al., 1998; THOMAS et al., 2002; CARPENTIERI et al., 2012; REITER et al., 2013).
Diante dos efeitos prejudiciais que o consumo excessivo de álcool pode causar ao organismo, é pertinente investigar a possível ação protetora da melatonina sobre os danos causados pelo etanol na prole de ratos. Assim, esta pesquisa teve como objetivo avaliar se a melatonina exógena administrada durante a gravidez e lactação pode prevenir os efeitos deletérios causados pelo álcool no fígado e nos rins da prole de ratos.
MATERIAIS E MÉTODOS
Esta pesquisa foi conduzida na Universidade Federal Rural de Pernambuco (UFRPE) e foi aprovada pelo Comitê de Ética Institucional sob o registro nº 3325300821. Trinta ratas albinas virgens (Rattus norvegicus albinus), com 90 dias de idade, pesando aproximadamente 250±30g, da linhagem Wistar, foram adquiridas através do biotério do Departamento de Morfologia e Fisiologia Animal (DMFA) e participaram deste estudo. Os animais foram fornecidos com comida e água e foram alojados em gaiolas com temperatura ambiente de 22±1°C. A iluminação foi fornecida por lâmpadas fluorescentes de 40W (marca Philips, modelo luz do dia), estabelecendo um fotoperíodo de 12 horas. As ratas fêmeas foram submetidas a exames colpocitológicos para identificar o ciclo estral, e aquelas que apresentaram três ciclos estrais regulares consecutivos foram selecionadas para o experimento. Após o acasalamento e confirmação da gravidez, elas foram divididas em 3 grupos experimentais com 10 animais cada, para a formação futura dos seguintes grupos com a prole: Grupo controle – Filhotes de ratas que não receberam álcool durante a gravidez e lactação, eutanasiados após 30 dias de vida; Grupo álcool – Filhotes de ratas submetidas a consumo crônico de álcool durante a gravidez e lactação, eutanasiados após 30 dias de vida; Grupo álcool + mel – Filhotes de ratas submetidas a consumo crônico de álcool e simultaneamente tratadas com melatonina durante a gravidez e lactação, eutanasiados após 30 dias de vida.
ACASALAMENTO DOS ANIMAIS
As fêmeas nos experimentos foram acasaladas no início da noite (18:00h). No dia seguinte, foram realizados exames colpocitológicos utilizando o método de coloração Shorr-Harris, utilizando a presença de espermatozoides como parâmetro para a confirmação do acasalamento.
ADMINISTRAÇÃO DE ETANOL
Uma dose de 3 g/Kg de álcool etílico foi administrada por via intragástrica nas ratas durante a gravidez (VARLINSKAYA et al., 2001; ARAÚJO-FILHO et al., 2007; VEIGA et al., 2007; SCHEIDT et al., 2015; MARCO et al., 2017).
TRATAMENTO COM MELATONINA
A melatonina, N-acetil-5-metoxitriptamina (Sigma Chemical Co., St. Louis, EUA), foi administrada em injeções diárias de 0,8 mg/Kg, durante toda a gestação. Para este fim, a melatonina foi dissolvida em 0,2 mL de etanol e diluída em 0,8 mL de NaCl 0,9%. As injeções foram aplicadas por via intraperitoneal, sempre entre 18:00 e 19:00. Essa dose é comparável à dose humana (9 mg/kg), que foi convertida com base na área de superfície corporal (MOUSTAFA et al., 1999; ABD-ALLAH et al., 2003). Os grupos controle e álcool receberam o veículo hormonal.
PESO E MEDIDA DOS ANIMAIS
Os pesos e comprimentos dos filhotes foram registrados no dia do nascimento, usando uma balança de precisão e fita métrica. E as médias dos dados obtidos foram usadas para as análises estatísticas.
HISTOPATOLOGIA
Para coletar o fígado e os rins dos filhotes aos 30 dias de idade, os animais foram anestesiados com cloridrato de cetamina (80 mg/kg) e xilazina (6,0 mg/kg) por via intramuscular. Em seguida, a cavidade abdominal foi aberta para remover os órgãos. Doze filhotes foram utilizados por grupo, independentemente do sexo. Os animais foram eutanasiados utilizando aprofundamento da anestesia com cloridrato de cetamina (80mg/Kg) e xilazina (6,0 mg/Kg), associados ao tiopental (100 mg/kg), por via intraperitoneal. Fragmentos do fígado e dos rins foram imersos em formaldeído tamponado, permanecendo lá por 48 horas. Em seguida, partes desses órgãos passaram pelo processo de desidratação e diafanização para serem incluídos em parafina. As secções foram feitas em um microtom Minot tipo (Leica RM 2035) ajustado para 5 mm. Quando obtidas, foram colocadas em lâminas previamente untadas com albumina de Mayer e deixadas secar por 24 horas a uma temperatura de 37°C em um forno. Por fim, as secções foram coradas com hematoxilina-eosina (H.E.) e analisadas em um microscópio óptico OLYMPUS BX-49 e fotografadas em um microscópio OLYMPUS BX-50.
ANÁLISE MORFOMÉTRICA
FÍGADO
O estudo morfométrico foi realizado de acordo com a metodologia descrita por Engelman et al., (2001). A proporção entre o parênquima não lobular e lobular do fígado dos filhotes aos 30 dias dos grupos experimentais foi determinada por métodos estereológicos, usando uma grade com 100 pontos de teste, colocada nas seções dos preparados histológicos corados com tricrômio de Mallory, pois isso facilita a visualização dos espaços portais ao usar métodos estereológicos. Foram usadas cinco lâminas para a contagem, considerando 10 campos visualizados através da objetiva de 40x, totalizando 5.000 pontos por grupo.
RINS
Para a análise morfométrica dos rins dos filhotes aos 30 dias dos grupos experimentais, foram utilizadas cinco lâminas de cada grupo e foram analisados dez glomérulos em cada lâmina. As medições foram restritas aos glomérulos, que demonstraram, em um único corte, os polos vascular e urinário. Essa disposição indica a seção coincidente com a região equatorial do glomérulo. Para as medições, foram usados glomérulos selecionados aleatoriamente. Com o uso de uma câmera de vídeo Sony® acoplada ao microscópio Olympus® Bx50, as imagens foram registradas e a análise morfométrica foi realizada usando o aplicativo Line Morphometry, calibrado em micrômetros, associado ao programa Optimas® 6.2 para Windows. O valor da área glomerular foi obtido posicionando o cursor para desenhar uma linha circular externa, coincidindo com os limites do tufo glomerular. Para medir a cápsula de Bowman, a mesma metodologia foi adotada (AKAOKA et al., 1994). Para calcular o volume do glomérulo e da cápsula de Bowman, foram utilizados os critérios descritos por Pagtalunan et al., (2000). Para essa estimativa, foi usada a equação 4/3πr3, destinada a calcular o volume da esfera, onde “r” representa o raio.
ANÁLISE ESTATÍSTICA
Para a comparação dos dados morfométricos, foi realizada a Análise de Variância, quando significativa esta foi complementada pelo teste de Comparação Múltipla de Tukey e Kramer. Foi adotado um nível de significância de 0,05 (P <0,05).
RESULTADOS
No que diz respeito ao peso e comprimento dos filhotes após o nascimento, houve uma redução significativa no grupo que recebeu apenas álcool (Figuras 1 e 2). A análise histopatológica do fígado dos animais do grupo controle mostrou parênquima hepático inalterado com cordões de hepatócitos organizados circundando a veia central lobular, intercalados com capilares sinusoidais. No entanto, os animais nascidos de ratas que receberam álcool durante a gravidez e lactação apresentaram parênquima hepático com congestão nas veias porta e centrolobular, além de um alto grau de esteatose. Esses efeitos não foram observados nos animais do grupo Álcool + Mel (Figura 3).
Os rins dos animais do grupo controle estavam bem preservados, com a maioria dos glomérulos e espaço subcapsular bem definidos, além de túbulos contorcidos proximais e distais com características normais, sem qualquer alteração. Essas características também foram verificadas nos rins dos animais que receberam melatonina. Nos rins dos animais que receberam apenas álcool, foi observada a presença de áreas de congestão no córtex e corpúsculos com ausência do espaço subcapsular (Figura 4).
A análise morfométrica do fígado dos animais, cujas matrizes receberam apenas álcool durante a gravidez e lactação, mostrou parênquima lobular significativamente reduzido e aumento do parênquima não lobular. Na análise morfométrica dos rins, também foi observada uma redução significativa no diâmetro e volume do glomérulo, além do diâmetro e volume da cápsula de Bowman, nesse grupo. Enquanto os grupos controle e álcool+mel não apresentaram essas alterações (Tabelas 1 e 2).
Figura 1: Peso dos filhotes ao nascer. Álcool: Observa-se redução de peso significativa; Controle e Álcool+Mel: Não houve diferença significativa. Médias seguidas pela mesma letra nas linhas não diferem significativamente pelo teste de Anova unidirecional de Tukey com pós-teste (p < 0,05)
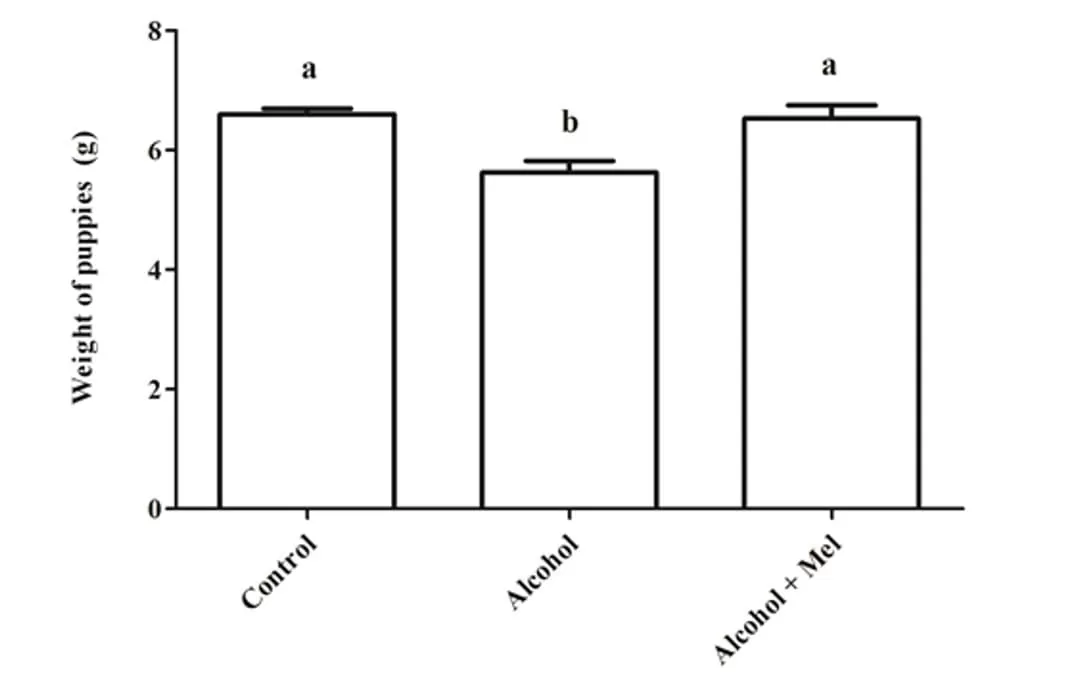
Figura 2: Comprimento dos filhotes ao nascer. Álcool: Observa-se uma redução significativa no comprimento; Controle e Álcool+Mel: Não houve diferença significativa. Médias seguidas pela mesma letra nas linhas não diferem significativamente pelo teste Anova unifatorial de Tukey com pós-teste (p < 0,05)
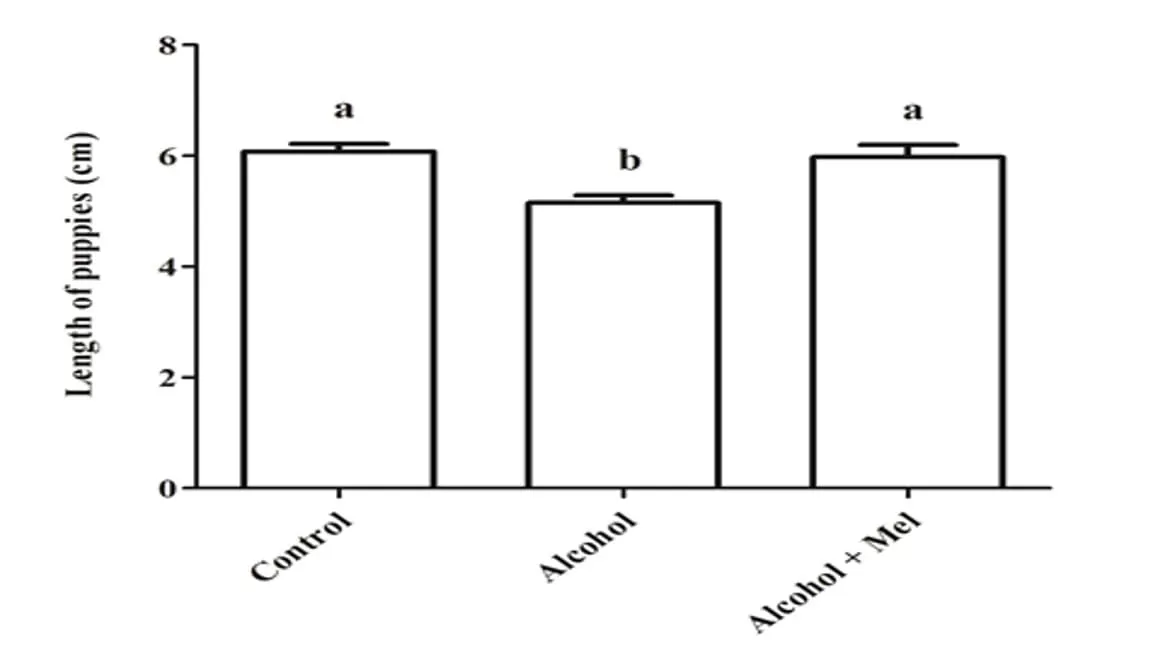
Figura 3: Fotomicrografia do fígado dos animais aos 30 dias de idade. (AB) – Controle: sem alterações, com cordões de hepatócitos organizados; (CD) – Álcool: observa-se congestão das veias porta e centrolobular e alto grau de esteatose; (EF) – Álcool + Mel: estruturas semelhantes ao controle. Setas longas – veia centrolobular; Setas curtas – cordões de hepatócitos; Asterisco – ducto biliar; Pontas de seta – sinusoides; Setas tracejadas – co-gerenciamento da veia centrolobular; Setas brancas – hepatócitos apresentando esteatose. HE
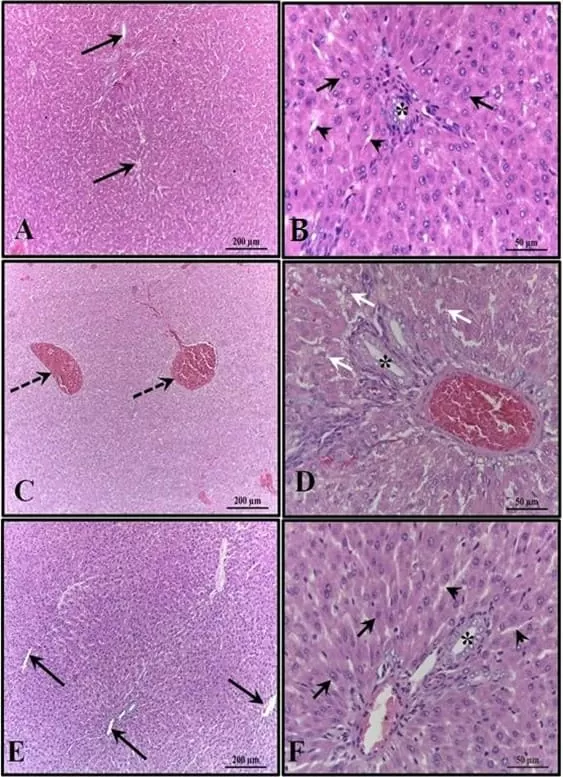
Figura 4: Fotomicrografia dos rins dos animais aos 30 dias de idade. (AB) – Controle: estrutura histológica preservada; (CD) – Álcool: observa-se a presença de áreas de congestão no córtex e corpúsculos com ausência de espaço subcapsular; (EF) – Álcool + Mel: estruturas semelhantes ao controle. Setas longas – Cápsula de Bowman; Asterisco – glomérulo; Setas tracejadas – congestão cortical; Setas curtas – ausência de espaço subcapsular; Rc – Região Cortical. HE
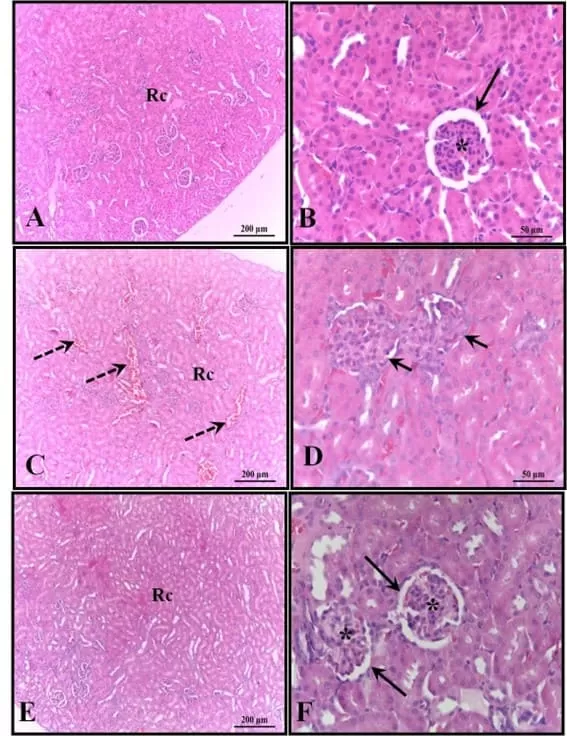
Tabela 1. Média ± desvio padrão da porcentagem de parênquima lobular e não lobular no fígado dos animais aos 30 dias de vida
| Grupos | Controle | Álcool | Álcool + mel | P |
| Parênquima Lobular | 81.59 ± 2.95y | 73.26 ± 1.40b | 80.53 ± 1.42a | 0.0050 |
| Parênquima Não Lobular | 18.43 ± 2.97y | 26.50 ± 1.04b | 19.50 ± 1.48y | 0.0053 |
Fonte: Autores, 2023.
Médias seguidas pela mesma letra nas linhas não diferem significativamente pelo teste Anova unifatorial de Tukey com pós-teste (p < 0,05).
Tabela 2. Média ± desvio padrão do diâmetro glomerular (DG), volume do glomérulo (VG), diâmetro (DCB) e volume (VCB) da cápsula de Bowman nos rins dos animais aos 30 dias de vida
| Grupos | Controle | Álcool | Álcool + mel | P | |
| DG (µm) | 6629 ± 351a | 4670 ± 121b | 6302 ± 157a | 0.0017 | |
| VG (µm 3) | 35212 ± 3584a | 20329 ± 1734b | 33319 ± 216a | 0.0094 | |
| DCB(µm) | 7338 ± 296a | 5877 ± 380b | 7202 ± 110a | 0.0024 | |
| VCB(µm3) | 41645 ± 544a | 30881 ± 761b | 42972 ± 464a | 0.0317 | |
Fonte: Autores, 2023.
Teste Anova unifatorial de Tukey com pós-teste (p < 0,05).
DISCUSSÃO
A exposição intrauterina ao álcool pode causar diversos efeitos deletérios ao feto ou embrião, tais como anomalias estruturais e deficiências comportamentais e neurocognitivas, sendo um dos primeiros sintomas pré-natais o comprometimento do crescimento (comprimento e/ou peso), o qual possivelmente persiste no período pós-natal (HOYME et al., 2005).
Neste estudo, observou-se uma redução no peso e comprimento da prole com o consumo de álcool pelas porcas, enquanto nos grupos controle e álcool+mel não houve diferenças significativas para este resultado. Autores como Domingues et al., (2009) também encontraram interferência do etanol no crescimento dos fetos. Uma vez que o consumo excessivo de álcool pode prejudicar a capacidade materna de manter o desenvolvimento do feto, interferindo na absorção de nutrientes pela mãe e causando vasoconstrição do cordão umbilical e placenta, alterando sua capacidade de fornecer nutrientes ao feto através do fluxo sanguíneo (GOODLETT; HORN, 2001).
Por sua vez, a melatonina no grupo álcool+mel foi capaz de preservar o crescimento fetal, uma vez que possui ação antioxidante, protegendo a placenta contra danos, além de estimular a passagem de nutrientes via cordão umbilical (EIFERT et al., 2015). Assim como Nagai et al., (2008) encontraram em seu estudo que o tratamento com melatonina preveniu a restrição de crescimento fetal e danos oxidativos à placenta.
Nas análises histopatológicas e morfométricas do fígado no grupo álcool, foi detectada congestão nas veias centrolobulares e porta, além de esteatose, que é considerada a primeira etapa da doença hepática alcoólica, sendo uma consequência direta dos impactos causados pelo metabolismo do álcool (BREITKOPF et al., 2009). A esteatose pode ser causada pelo acúmulo de NADH nos hepatócitos durante o metabolismo do etanol, ocasionando alterações no metabolismo lipídico ao inibir a β-oxidação de ácidos graxos e aumentar sua síntese para eliminar o excesso de hidrogênio (ALBANO, 2006; SOZIO; CRABB, 2008).
Por outro lado, essas alterações não foram observadas no grupo álcool+mel, indicando a ação benéfica da melatonina e demonstrando sua eficácia em proteger o fígado da prole contra lesões decorrentes da exposição ao álcool. As atividades antioxidantes e anti-inflamatórias da melatonina são bem conhecidas, além de suas propriedades protetoras contra o estresse oxidativo e sua capacidade de prevenir a esteatose hepática alcoólica (ZHANG et al., 2017). De acordo com Hu et al., (2009), a melatonina demonstrou a capacidade de inibir a geração de radicais livres, resultando em uma redução considerável na esteatose, peroxidação lipídica e atividade de citocinas inflamatórias em ratos adultos expostos ao consumo de álcool. Nosso trabalho mostrou que a administração de melatonina também pode interromper o desenvolvimento de danos hepáticos causados nos filhotes de mães que consomem álcool durante a gravidez e lactação.
No grupo álcool, os achados histológicos e morfométricos também mostraram congestão na região cortical e ausência de espaço subcapsular nos corpúsculos renais, além de uma redução significativa no volume e diâmetro dos glomérulos e da cápsula de Bowman. Estudos já confirmaram a relação entre Doença Renal Arterial Aterosclerótica (ARAD) e consumo crônico de álcool, o que leva à atrofia renal, bem como ao aumento da produção de espécies reativas de oxigênio pelo metabolismo do etanol, o que pode afetar os rins e danificar os túbulos renais, esses radicais livres afetam também células do sistema imune e estimulam a produção de citocinas pró-inflamatórias, o que pode levar ao desenvolvimento de doenças renais (KONOPKA et al., 2007; BARR et al., 2016; VARGA et al., 2017; WANG et al., 2017).
O grupo álcool+mel não revelou essas lesões nos rins, o que indica a ação da melatonina com seus efeitos anti-inflamatórios, antioxidantes e moduladores de citocinas também nesse órgão. O tratamento com melatonina é capaz de reduzir significativamente o estresse oxidativo nos rins, além de também exercer uma ação antiapoptótica, com capacidade de reduzir citocinas pró-inflamatórias, melhorar a atividade mitocondrial e ter efeitos benéficos sobre alterações na pressão renal (RUSSCHER et al., 2012; ZHANG et al., 2021). Isso explica a proteção contra as alterações na histologia renal e como evitou a congestão causada pelo estímulo de ações inflamatórias no grupo álcool+mel, visto que a melatonina possui uma variedade de atividades biológicas realizadas em diferentes órgãos por meio de seus receptores. Estudos com ratos adultos mostram que a melatonina evita o comprometimento estrutural e funcional do tecido renal causado pelo estresse oxidativo induzido pelo etanol (KURHALUK et al., 2020). No entanto, nossos achados indicam que a melatonina é capaz de atenuar essas lesões também em filhotes expostos ao etanol durante a gravidez e lactação.
CONCLUSÕES
Assim, a melatonina foi capaz de interferir e mitigar os efeitos prejudiciais que o etanol exerceu sobre a histologia do fígado e rins da prole cujas porcas foram submetidas ao consumo crônico de álcool. Esta pesquisa também mostrou um efeito positivo deste hormônio sobre peso e comprimento, significando que o excesso de álcool não altera a absorção e o transporte de nutrientes entre mãe e prole. Dessa forma, sugere-se que a melatonina pode ser um adjuvante importante no tratamento dos danos causados pelo álcool ao fígado e rins de crianças de mulheres alcoólatras.
REFERÊNCIAS
ALBANO, E. Alcohol, oxidative stress and free radical damage. Proceed. of the Nutri. Society., v.65, n.3, p. 278-290, 2006.
ABD-ALLAH, A. R. A. et al. Effect of melatonin on estrogen and progesterone receptors in relation to uterine contraction in rats. Pharmacol. Res., v.47, n.4, p.349 – 354, 2003.
AKAOKA, K.; WHITE, R. H.; RAAFAT, F. Human glomerular growth during childhood: a morphometric study. J. Pathol., v.173, n.3, p.261-268, 1994.
ALVES, R. S. C. et al. Melatonin and sleep in children. Div. Ped., v.20, n.2, p.99- 954, 1998.
ARAÚJO-FILHO, J. L. S. et al. Histomorphometric analysis of the heart of rats indirectly exposed to ethanol and chronic malnutrition during the perinatal period. Rev. Ciênc. Méd. Biol., v.6, n.1, p.17-25, 2007.
BARR, T. et al. Opposing effects of alcohol on the immune system. Prog Neuropsychopharmacol Biol Psychiatry., v. 65, p. 242-251, 2016.
BATISTA, A. H.; SEGUI, G. P.; CANDINA, H. R. Alteraciones en las características morfométricas del riñón de ratas albinas machos provocadas por la ingestión crónica de etanol desde la adolescencia. Rev. Cubana Invest. Biomédicas, v. 29, n. 2, p. 194-202, 2010.
BERTRAND, J.; FLOYD, R. L.; WEBER, M. K. Guidelines for identifying and referring persons with fetal alcohol syndrome. MMWR Recomm Rep., v. 54, n.11, p. 1-12, 2005.
BREITKOPF, K. et al. Current experimental perspectives on the clinical progression of alcoholic liver disease. Alcohol Clin Exp Res., v.33, n.10, p. 1647-1655, 2009.
BURGOS, M. G. P. A. et al. The effect of alcoholic beverages in nursing mothers and their impact on children. Rev. Bras. Saúde Matern. Infant., v.2, n. 2, p.129-135, 2002.
CARPENTIERI, A. et al. New perspectives in melatonin uses. Pharmacol. Research., v. 65, n.4, p. 437-444, 2012.
DOMINGUES, J. A. et al. Maternal and fetal liver histomorphological analysis of malnourished pregnant rats submitted to exposure to ethanol. Rev. da Facul. de Ciências Méd. de Sorocaba, v. 11, n. 3, p.9-17, 2009.
EIFERT, A. W. et al. Effect of melatonin or maternal nutrient restriction on vascularity and cell proliferation in the ovine placenta. Anim Reprod Sci., v.153, p. 13-21, 2015.
ENGELMAN, M. F. B. et al. Morphometric study of the liver of rats submitted to supraphysiological doses of thyroxine. Arq. Bras. Endocrinol. Metab., v.45, n.2, p.173-179, 2001.
FONSECA, C. F.; RODRIGUES, F. F. Action of ethanol on the liver. Altus Ciência: Rev. Acad. Multi. da Facul. Cid. de João Pinheiro. v.7, n.7, p. 75-90, 2018.
GONÇALVES, C. S.; PEREIRA, F. E. L. Alcoholic Hepatopathy: Pathogenesis and Treatment. Prog. de Educação Médica Continuada: Socied. Bras. De Hepatol., v.7, n.102, p. 1799-1807, 2007.
GOODLETT, C. R.; HORN, K. H. Mechanisms of Alcohol-Induced Damage to the Developing Nervous System. National Institute on Alcohol Abuse and Alcoholism, v.25, n.3, p.175-184, 2001.
GUERRERO, J. M. et al. La Melatonina. Investig. y Cienc., p.30-38, 2007.
HOYME, H. E. et al. A practical clinical approach to diagnosis of fetal alcohol spectrum disorders: clarification of the 1996 institute of medicine criteria. Pediatrics, v.115, n.1, p. 39-47, 2005.
HU, S. et al. Melatonin protects against acoholic liver injury by attenuating oxidative stress, inflammatory response, and apoptosis. Europ. J. of Pharmacol., v.616, n.1-3, p. 287-292, 2009.
KONOPKA, C. L. et al. Experimental model for the study of chronic renal ischemia in rats: morphologic, histological and ultra-structural analysis. Acta Cir Bras., v.22, n. 1, p.12-21, 2007.
KURHALUK, N. et al. Melatonin modulates oxidative phosphorylation, hepatic and kidney autophagy-caused subclinical endotoxemia and acute ethanol-induced oxidative stress. Chronobiol Int., v. 37, n. 12, p. 1709-1724, 2020.
LIEBER, C. S. Metabolism of Alcohol. Clinics in Liver Disease, v.9, n.1, p. 1–35, 2005.
MARCO, E. M. et al. Long-term effects of intermittent adolescent alcohol exposure in male and female rats. Front. Behav. Neurosci., v.11, n.233, p.1-13, 2017.
MESQUITA, M. A.; SEGRE, C. A. M. Frequency of alcohol effects in fetus and pattern of alcohol consumption by pregnant women at a public maternity hospital in São Paulo city, Brazil. Rev Bras Crescimento Desenvol. Hum., v.1, n.19, p. 63-77, 2009.
MOUSTAFA, A. M. et al. Effect of bromocriptine on uterine contractility in near term pregnant rats. Pharmacol. Res., v. 39, n.2, p. 89 – 95, 1999.
NAGAI, R. et al. Melatonin Preserves Fetal Growth in Rats by Protecting against Ischemia/Reperfusion-Induced Oxidative/Nitrosative Mitochondrial Damage in the Placenta. J. of Pineal Research., v. 45, n. 3, p. 271– 76, 2008.
PAHO (Pan American Health Organization). PAHO virtual course addresses alcohol consumption during pregnancy, 2019. Disponível em: https://www.paho.org/pt/noticias/25-6-2019-curso-virtual-da-opas-aborda-consumo-alcool-durante-gravidez
PAGTALUNAN, M. E. et al. Methods for estimating the volume of individual glomeruli. Kidney Int., v. 57, p. 2644-2649, 2000.
POPOVA, S. et al. Estimation of national, regional, and global prevalence of alcohol use during pregnancy and fetal alcohol syndrome: a systematic review and meta-analysis. Lancet Glob. Health, v. 5, p. 290-299, 2017.
REITER, R. J. et al. Melatonin and stable ccircadian rhythms optimize maternal, placental and fetal physiology. Human Reprod. Update, v.20, n.2, p. 293–307, 2013.
RUSSCHER, M. et al. The role of melatonin treatment in chronic kidney disease. Front Biosci., v.17, n. 7, p. 2644-56, 2012.
SCHEIDT, L. et al. Ethanol during adolescence decreased the BDNF levels in the hippocampus in adult male Wistar rats, but did not alter aggressive and anxiety-like behaviors. Trends Psych. Psychother., v.7, n.3, p. 143-151, 2015.
SOLÍS-HERRUZO, J. A.; SOLÍS-MUÑOZ, P. Melatonin and oxidative stress. Rev. Esp. de Enfermeiras Digest., v.101, n. 7, p. 453- 459, 2009.
SOUZA, W. L.; MORAIS, E. A. Antioxidant activity of melatonin on oxidative stress in spermatozoa: literature review. Nutri. Rev. Eletrônica, v.13, n. 5, p.4831-4839, 2016.
SOZIO, M.; CRABB, D. W. Alcohol and lipid metabolism. J. americ. de fisiol. Endocrin. e metabol., v.295, n. 1, 2008.
THOMAS, L. et al. Melatonin receptors in human fetal brain: 2- [125I] iodomelatonin binding and MT1 gene expression. J. of Pineal Research, v. 33, n. 4, p.218–224, 2002.
THIEL, D. H. et al. Alcohol: Its effect on the kidney. Metabolism, v. 26, n. 8, p. 857–866, 1977.
VARGA, Z. V. et al. Alcohol misuse and kidney injury: Epidemiological evidence and potential mechanisms. Alcoh. research: current reviews, v.38, n. 2, p. 283-288, 2017.
VARLINSKAYA, E. I. et al. Acute effects of ethanol on behavior of adolescent rats: Role of social context. Alcohol Clin. Exp. Res., v.25, n.3, p. 377–385, 2001.
VEIGA, R. K. A. et al. Morphometric changes in the thymus, spleen and Peyer’s patches during pre and postnatal alcohol exposure. Rev. Eletronica Farm., v.4, n.1, p. 32-42, 2007.
WANG, L. et al. Effects of chronic alcohol exposure on ischemia-reperfusion-induce acute kidney injury in mice: the role of β-arrestin 2 and glycogen synthase kinase. Exper. & Mol. Medic., v. 49, n. 6, 2017.
ZHANG, C. et al. Melatonin Alleviates Contrast-Induced Acute Kidney Injury by Activation of Sirt3. Oxid Med Cell Longev., v. 25, 2021.
ZHANG, J. J. et al. Effects of melatonin on liver injuries and diseases. Inter. J. of mol. Sci., v. 18, n. 4, p. 673, 2017.
[1] Mestrado pelo Programa de Pós-Graduação em Biosciência Animal – UFRPE. ORCID: 0000-0002-6228-6951. Currículo Lattes: http://lattes.cnpq.br/1783975917572458.
[2] Doutorado pelo Programa de Pós-Graduação em Biosciência Animal/UFRPE. ORCID: 0000-0002-4150-1923. Currículo Lattes: https://lattes.cnpq.br/3537458174521270.
[3] Doutorado pelo Programa de Pós-Graduação em Biosciência Animal. ORCID: 0000-0002-7925-9212. Currículo Lattes: http://lattes.cnpq.br/6892417222004207.
[4] Mestrado pelo Programa de Pós-Graduação em Biosciência Animal. ORCID: 0000-0001-9404-7501. Currículo Lattes: http://lattes.cnpq.br/8213260513385508.
[5] Mestrado pelo Programa de Pós-Graduação em Biosciência Animal. ORCID: 0000-0002-4733-461X. Currículo Lattes: http://lattes.cnpq.br/1906334502843226.
[6] Graduação em Ciências Biológicas. ORCID: 0000-0002-9662-0372. Currículo Lattes: http://lattes.cnpq.br/2810228771568915.
[7] Graduação em Ciências Biológicas – UFRPE. ORCID: 0000-0003-3659-3947. Currículo Lattes: http://lattes.cnpq.br/5069796237775832.
[8] Doutorado em Bioquímica e Fisiologia, Mestre em Fisiologia, Biólogo. ORCID: 0000-0003-1493-7964. Currículo Lattes: http://lattes.cnpq.br/9044747136928972.
[9] Doutorado em Morfologia/UNIFESP-EPM. ORCID: 0000-0001-5940-9220. Currículo Lattes: http://lattes.cnpq.br/1539131079574469.
[10] Orientador. Doutorado em Tecnologia Nuclear pela Universidade de São Paulo (USP). ORCID: 0000-0001-9533-5476. Currículo Lattes: http://lattes.cnpq.br/4292195468804301.
Enviado: 11 de julho, 2023.
Aprovado: 8 de agosto, 2023.

