ARTICLE D’EXAMEN
SILVA, Izael Oliveira [1], AMORIM, Edna Peixoto da Rocha [2], NASCIMENTO JUNIOR, Nelson Augusto [3], PEIXINHO, Georgia Souza [4], CARNAÚBA, Juliana Paiva [5], NETO, Vicente Ferreira de Araujo [6]
SILVA, Izael Oliveira. Et al. Trichoderma spp antagonisme aux phytopathogènes causant la pourriture des racines de manioc dans les alagoas. Revista Científica Multidisciplinar Núcleo do Conhecimento. An 05, Ed. 06, vol. 12, p. 149 à 177. juin 2020. ISSN: 2448-0959, Lien d’accès: https://www.nucleodoconhecimento.com.br/agronomie-fr/trichoderma-antagonisme, DOI: 10.32749/nucleodoconhecimento.com.br/agronomie-fr/trichoderma-antagonisme
RÉSUMÉ
Plusieurs sont des phytopathogènes qui limitent la production de manioc (Manihot esculata Crants) étant la pourriture des racines auxquelles ils épousent la plus grande perte dans la culture atteignant 70%. Cette culture est d’un grand intérêt pour la région du nord-est du Brésil, fournissant de grandes pertes. Les difficultés de gestion ont orienté la recherche d’alternatives, parmi lesquelles les biocontrôleurs ont donné des résultats significatifs. Cette revue de littérature visait à recueillir des informations liées à la pourriture de la racine de manioc cv Rosinha, les principaux phytopathogènes et les activités antagonistes de Trichoderma dans le contrôle des maladies dans l’état d’Alagoas. Une enquête bibliographique a été réalisée dans les bases de données Scielo, Google Acadêmico, Capes portail (thèses et thèses), revues et livres. Pour obtenir des informations sur: la pourriture des racines du manioc de table, Trichoderma spp., comme un agent de biocontrôle de phytopathogènes.
Mots clés: Racine tubéreuse, contrôle biologique, phytopathologie.
1. INTRODUCTION
En raison de sa valeur nutritive, Manihot esculenta Crantz se distingue au Brésil et dans le monde avec une contribution économique et sociale importante en raison de sa polyvalence, car il est utilisé dans les aliments animaux et humains et largement utilisé dans l’industrie. La culture exerce un soutien important à la population à faible pouvoir d’achat, car en plus d’être une source nutritive, elle est aussi un générateur de revenus dans l’agriculture familiale (NOTARO et al. 2013).
Dans le monde, la consommation de manioc et de ses dérivés se trouve en sixième position dans le classement étant le soja, le blé, le riz, le maïs et les pommes de terre, les cultures qui occupent les premières positions selon les données de la Fao (2012). Le Brésil est le quatrième producteur mondial, avec une récolte estimée à 25 millions de tonnes en 2016 (IBGE, 2015).
D’une grande polyvalence, la culture est entièrement utilisée, non seulement la partie aérienne (feuilles et tiges) mais aussi la racine. Les feuilles ont leur utilisation dans la nourriture humaine (supplément) et animale (écrasée). Les tiges, dans l’alimentation animale, sous forme d’ensilages et de foins et encore en natura. La racine, dans l’alimentation humaine, animale et aussi par les industries, principalement la farine, les amidons, les plastiques biodégradables, les produits textiles et les biocarburants (CONAB, 2013).
La culture du manioc est confrontée à de nombreux défis, y compris des problèmes phytosanitaires (NASCIMENTO JÚNIOR, 2015). Plusieurs maladies ont déjà été signalées dans la culture, parmi les autres, la pourriture des racines, dont les agents peuvent être Lasiodiplodia sp., Pythium sp., Rosellinia sp., Fusarium sp., Neoscytalidium lignicola, Phytophthora drechsleri Tucker cependant, les trois derniers phytopathogènes sont les plus fréquemment impliqués dans la pourriture des racines dans l’état d’Alagoas (figure 1) et dans la plupart des régions productrices. L’information sur la pourriture des racines de manioc est encore naissante et est d’une importance capitale pour servir d’outil dans la prise de décision sur la meilleure stratégie à utiliser (MASSOLA JR; BEDENDO, 2005; MUNIZ et al., 2006; NOTARO et al., 2013; SILVA, 2013; FUKUDA; OTSUBO, 2015).
Parmi les micro-organismes causant la pourriture des racines de manioc P. drechsleri et F. solani, ils sont les plus importants en raison de la portée et la gravité causant des pertes importantes dans la production. Dans les sols denses et acidifiés, l’apparition de Fusarium sp., est plus fréquente, et l’une des caractéristiques de ces agents pathogènes est de causer des dommages à la tige près du sol par l’infection des vaisseaux xylémiques et, par conséquent, interférer dans la circulation de la sève, causant ainsi la pourriture indirecte de la racine dans toute cause de développement végétal. Contrairement à Phytophthora, dont les symptômes provoqués dans les racines sont de couleur brune et la pourriture de consistance molle qui dégagent un liquide avec une mauvaise odeur, déjà les pourritures de Fusarium sp., sans perturbations apparentes dans les tissus avec des signes de déshydratation et l’apparence momifiée d’une pourriture sèche (MOURA; SILVA, 1997; POLTRONIERI et al., 2001; SILVA; TEIXEIRAS, 2012).
En tant que mesures de protection et de contrôle de la pourriture des racines, la gestion physique et chimique des sols est utilisée, mais l’utilisation de variétés tolérantes associées à des pratiques culturelles telles que la rotation des cultures et le système de culture a été soutenue positivement. Nascimento Júnior (2015), souligne qu’il est d’une importance fondamentale de connaître les conditions edapho-climatiques de la région cultivée et l’utilisation de techniques appropriées qui peuvent être adoptées par l’agriculteur, pour avoir un rendement économique au sein d’un système agricole durable. Le contrôle alternatif des phytopathogènes avec antagonistes, en particulier les espèces de trichoderma, a déjà été étudié, en raison de l’intérêt mondial d’utiliser des produits moins agressifs pour l’environnement (SOUSA et al., 2012; SILVA et al., 2014). Pour Robbs (1992) et Barbosa; Meza (2009) la concurrence pour l’alimentation et l’antibiose, sont les mécanismes les plus fréquemment utilisés par certaines espèces de Trichoderma, étant donc considéré comme un excellent agent de lutte biologique.
Compte tenu de ce qui précède, l’objectif de la présente œuvre était d’effectuer un examen bibliographique sur les principaux phytopathogènes et le potentiel de l’antagonisme de Trichoderma impliqué dans la pourriture des racines du manioc dans l’état d’Alagoas.
2. MÉTHODOLOGIE
La présente étude se compose d’une revue documentaire, réalisée entre décembre 2014 et mars 2016, dans laquelle une consultation a été faite sur des articles scientifiques, sélectionnés par recherche dans la base de données de google academic, LILACS, MEDLINE, SciELO, portail des Caps (thèses et dissertations), revues et livres. Sur les nombreux articles connexes, 84 ont été utilisés. En tant que descripteurs que nous avons utilisés : pourriture des racines, contrôle biologique des phytopathogènes, phytosanité.
3. EXAMEN DE LA LITTÉRATURE
3.1 CULTURE DU MANIOC
Le manioc, une culture d’un grand intérêt pour le Nord-Est brésilien, notamment pour l’État d’Alagoas, est une plante vivace, arbustive, appartenant à la famille euphorbèe, riche en amidon, utilisée dans l’alimentation humaine et animale ou comme matière première pour diverses industries (FRAIRE FILHO; BAHIA, 2015).
Nascimento Júnior (2015), souligne les avantages de cette culture, en raison de sa rusticité, faible coût, l’adaptation par rapport au climat, le sol et ses caractéristiques nutritionnelles qui sont liées à la grande accumulation d’amidon dans ses racines, ainsi que des protéines et des acides aminés dans les feuilles. Il s’agit d’une plante originaire des régions tropicales d’Amérique du Sud, mais qui avait comme lieux de sa domestication l’Asie du Sud-Est, l’Afrique et l’Amérique tropicale (NOTARO et al., 2013; SILVA, 2013; FRAIRE FILHO; BAHIA, 2015).
En 2013, 281 718 000 tonnes de manioc ont été produites dans le monde, le Brésil étant le quatrième producteur mondial avec 23 977 757 tonnes, derrière le Nigeria, l’Indonésie et la Thaïlande. Les régions du nord et du nord-est du Brésil ont un grand volume de production et la superficie cultivée est dans le sud, le sud-est et le Midwest, ceux avec le rendement agricole le plus élevé. L’État de Pará est le plus grand producteur national de racines de manioc, suivi de Paraná, Maranhão et Bahia (IBGE, 2015).
À Alagoas, les régions qui se distinguent comme producteurs de manioc sont avec 70% de la production totale de l’Etat (Arapiraca, São Sebastião et Campo Alegre), la zone forestière et la côte nord, étant la première région, celle avec le plus grand nombre de producteurs, responsable de 13,36 t.ha-¹ et 240.448 tonnes, occupant la deuxième place en productivité par rapport aux autres États du nord-est (CONAB 2013).
Notaro (2012) a souligné que cette culture est encore l’agriculture familiale et se développe d’une manière rudimentaire, et le principal moyen de propagation est végétatif et des variétés de faible qualité génétique sont encore cultivées. Son utilité est associée à la teneur en acide hydrocyanique (HCN) présent dans les feuilles et les racines, qui le classe comme doux ou doux(<180 mg kg-¹ de HCN), aussi connu sous le nom « macaxeira », utilisé pour la consommation fraîche; intermédiaire (180 – 300 mg kg-¹) et amer ou sauvage (> 300 mg kg-¹) les deux derniers sont utilisés pour la production d’aliments pour animaux, d’amidon, de farine et de biocarburant (OLIVEIRA et al., 2012).
La plus grande utilité du manioc est dans l’industrie alimentaire, principalement dans la production d’amidon destiné au marché modifié de l’amidon, qui en plus de servir la cuisine régionale dans les pains, tapiocas, beijus, gâteau aux gommes et pied de garçon manqué; est l’un des produits dérivés de l’usine qui emploie plus de main-d’œuvre et ajoute une valeur élevée dans le produit transformé, selon Nascimento Júnior (2015). En ce qui concerne l’utilisation pour l’extraction de produits fermentés dans l’industrie des biocarburants, le manioc s’est avéré être une bonne alternative dans la fabrication de l’éthanol, car il présentait un coût énergétique inférieur en production, en comparant la canne à sucre et le maïs, selon Salla et al., (2010).
Selon Alves (2006), la phénologie du manioc peut varier de 6 à 24 mois de culture, mais commercialement, il est de 12 à 18 mois pour la transformation de la farine et de l’amidon et entre 8 et 10 mois pour la table. Parmi les variétés plantées à Alagoas, la rosinha se distingue, dont le cycle varie entre 9 et 10 mois en terre ferme, et peut être prévu pendant 7 à 8 mois dans des conditions de système irrigué. Cette variété peut atteindre trois mètres de hauteur, maintient le stand de la plante à la fin de la récolte avec une bonne production de branches et la productivité dans 21 t ha-¹ (DINIZ et al., 2009).
Nascimento Júnior (2015), rapporte dans son travail que même avec la rusticité de la culture est nécessaire est attentif aux conditions adafo-climatiques, indiquant que le manioc produit bien dans les sols fertiles, avec un pH entre 5,5 et 7,0 avec la classe texturale sablonneuse ou moyenne et un bon drainage naturel. La condition climatique idéale se situe entre 20°C et 27°C, et peut être établie dans des environnements dont les températures se situent entre 16 °C et 38°C; avec des précipitations comprises entre 1000 et 1500 mm de l’année-¹, dans les régions semi-arides entre 500 et 700 mm année-¹; altitudes de 600 à 800 mètres au-dessus du niveau de la mer et période légère de 12 heures jour-¹ (SILVA; ANDRADE, 2011; SILVA, 2013).
3.2 MALADIES DANS LES CULTURES DE MANIOC
Plusieurs facteurs peuvent limiter la production de manioc, comme l’apparition d’insectes nuisibles et de phytopathogènes pathogènes, ce qui nuit à la qualité et au développement de la culture au Brésil et dans le monde. Selon Nascimento Júnior (2015), le manioc est sensible à plusieurs phytopathogènes, ce qui entraîne de graves pertes économiques en production.
Parmi les maladies d’importance se distinguent les causes des lésions foliaires telles que la tache brune (Cercosporidium henningsii), la tache blanche (Phaeoramularia manihotis), les feuilles brûlantes (Cercospora vicosae), la tache noire (C. manihobaea) et l’anthracnose (Colletotrichum gloeosporioides f.sp. manihotis) qui limitent les photoassimiles (SILVA; ANDRADE, 2011; MORAIS et al., 2013; OLIVEIRA et al., 2013). Et la pourriture des racines, causée par les champignons et les oomicétes, tels que Lasiodiplodia sp., Pythium sp., Rosellinia sp., Fusarium sp., Neoscytalidium lignicola, Phytophthora drechsleri Tucker cependant, les trois derniers phytopathogènes sont les plus fréquemment impliqués dans la pourriture des racines dans l’état d’Alagoas (figure 1) et dans la plupart des régions productrices. L’information sur la pourriture des racines de manioc est encore naissante et est d’une importance capitale pour servir d’outil dans la prise de décision sur la meilleure stratégie à utiliser (MASSOLA JR; BEDENDO, 2005; MUNIZ et al., 2006; NOTARO et al., 2013; SILVA, 2013; FUKUDA; OTSUBO, 2015).
Notaro et al., (2013) et Silva (2013) mettent en garde contre les effets socio-économiques élevés causés par la pourriture des racines du manioc dans les États de Maranhão, Pará, Alagoas et Pernambuco, car il cause des pertes importantes de productivité, en plus de rendre les zones non viables pour la plantation tout au long des cycles de culture. Selon Nascimento Júnior (2015), étant Omyceto Phytophthora sp et le champignon Fusarium sp., sont les principaux agents pathogènes de la culture dans le Nord-Est et causer des pertes allant de 30 et 70%. L’auteur déclare également que dans des conditions favorables la maladie peut causer une perte de 100%.
Figure 1. Aspect des colonies et des structures reproductrices des isolats de pourriture de manioc causant des phytopathogènes dans l’État d’Alagoas: Fusarium sp. (A1-A6), Neoscytalidium sp. (B1-B6) et Phytophthora sp. (C1-C6). Colonie de Fusarium sp. (A1); conidie (A2); cellules conidiogéniques (A3-A6). Neoscytalidium sp. colonie (B1); Conidia (B2-B6). Phytophthora sp colonie (C1); Spomangio (C2); Chlamydospores (C3 et C4); Spomangios (C5) et Spolantia en reproduction (C6).
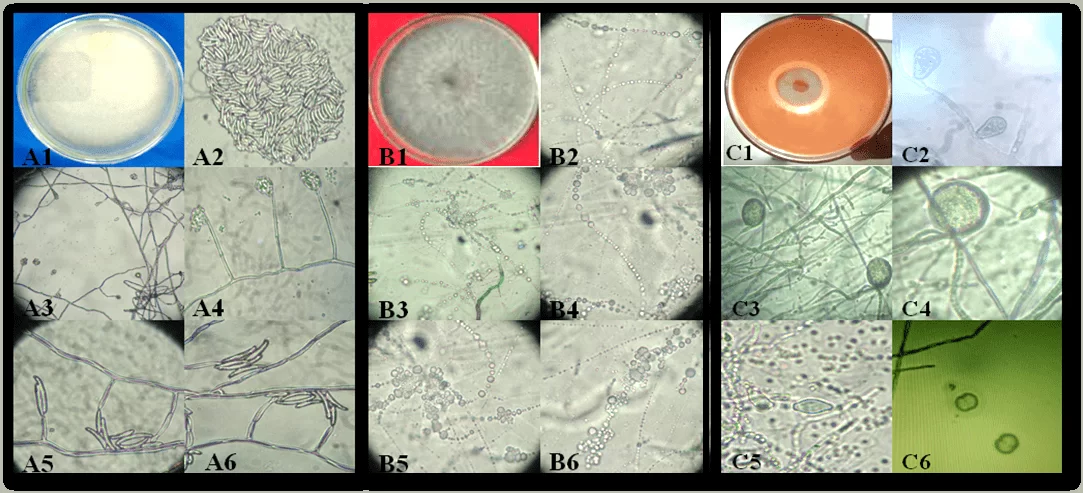
La pourriture causée par Fusarium sp., se produit chez les jeunes et les plantes adultes, avec des symptômes de flétrissement soudain et de défoliation sévère, qui peut être potentialisé dans les zones de terre battue et le sol mal drainé (SILVA; TEXEIRA, 2012). Ce fait a déjà été rapporté par Gomes; Leal (2003), qui lorsqu’il travaille avec le manioc dans les États de Sergipe, Bahia et Alagoas, déclare que la pourriture des racines est la maladie la plus limitante de la culture dans la région du Nord-Est, en particulier quand il est implanté dans les zones formées par le sol compacté.
Les phytopathogènes causant la pourriture ont des symptômes distincts. Les auteurs rapportent que Phytophthora sp. attaque habituellement les plantes adultes, causant la pourriture « douce » dans les racines, avec une odeur très forte, semblable à celle de la matière organique en décomposition et de la coloration grisâtre. L’apparition de signes sont plus fréquentes et visibles dans les racines, mais il ya des rapports de l’existence de jeunes présentant des symptômes à la base des tiges de plantes nouvellement jumelées, causant le flétrissement et la mort totale. Dans le cas de la pourriture sèche causée par Fusarium sp., les dommages directs aux racines se produisent rarement, mais le problème est accentué à n’importe quel stade du développement de l’usine. (GOMES; LEAL, 2003; SILVA; TEXEIRA, 2012; NASCIMENTO JÚNIOR, 2015).
3.3 LE FUSARIUM PHYTOPATHOGÈNE
Le genre Fusarium a été décrit en 1809 par Link. Les représentants de ce genre appartiennent au royaume Champignons, phylum Ascomycota, classes Eauscomycetes et Pyrenomycètes, ordre Hypocreales, présentant 65 espèces, 55 variétés et 22 formes spéciales, selon Wollenweber; Reinking (1935)1 cité par Ventura (1999). C’est l’un des phytopathogènes les plus importants au monde, avec une large répartition géographique, distribué dans le sol et en association avec les plantes. Avoir des espèces cosmopolites et autres dont l’occurrence est limitée à certains environnements (VENTURA, 1999). La plupart des espèces sont saprobies, mais il y a des représentants du complexe Fusarium qui produisent des mycotoxines qui peuvent affecter la santé humaine et animale (URBEN et al. 2009). Seifert (2006); Querales (2010) rapportent que le genre Fusarium est un groupe complexe qui se développe en nombre d’espèces et génère des controverses taxonomiques pour les phytopathologistes.
Milanesi (2009), commente que Fusarium sp., peut se produire en particulier dans les endroits des climats tropicaux et subtropicaux, et a une grande capacité à survivre pendant de longues périodes dans le sol en dehors de ses hôtes, grâce à la formation de structures de résistance appelées chlamydospores. Trois groupes du genre sont les exemples les plus spécifiques de ces changements, nommés d’après le groupe téléomorphe du complexe Gibberella fujikuroi (Sawada) Wollenw, le Fusarium solani (Mart.) Sacc., et le complexe F. graminearum.
Le genre peut présenter des colonies de couleurs allant du violet, purpura foncé à l’orange, mais la prédominance est de colonie pâle de croissance rapide, aérée et diffuse mycélium (MARTINS, 2005). Puhalla (1981); Martins (2005); Agrios (2005), rapport que les structures de conidia (micro et macro), la morphologie, la disposition, la variété des conidiophores et des chlamydospores étaient la base pour l’identification des espèces de Fusarium sp. Les taxonomistes classiques décrivent la présence de microconidies unicellulaires et uninucléées uninucléées et de macroconidies multicellulaires fréquentes avec la cellule avec un seul noyau comme progénieur génétiquement identique. Les stades sexuels de Fusarium sont des ascomycetes; la spore sexuelle est l’ascospore. Ceux qui sont attribués dans le genre Nectria ont des ascospores bicellulaires.
Chaque cellule de l’ascopore bicellulaire est uninucléée et les deux noyaux sont génétiquement identiques. D’autres, comme c’est le cas dans Gibberella, forment des ascospores multicellulaires. Martins (2005) mentionne que les caractéristiques morphologiques sont influencées par l’environnement et la nutrition, de sorte que les milieux de culture sont utilisés pour sélectionner les micro-organismes et les regrouper, en fonction des besoins nutritionnels qui sont mis à disposition dans l’environnement culturel dans des conditions normalisées pour les identifier. En raison de cette plasticité et des variations des caractéristiques phénotypiques que l’on retrouve dans ce champignon, la taxonomie basée uniquement sur des concepts morphologiques n’est pas fiable. (MARTINS, 2005; URBENS et al., 2009; QUERALES, 2010).
L’identification des espèces de Fusarium est l’une des premières étapes de son étude. Traditionnellement, il a été réalisé sur la base de la morphologie, depuis la publication du traité du genre « Die Fusarien » en 1935 par Wollenweber; Reinkin1. D’autres systèmes ont été proposés, mais n’ont pas résolu le problème de l’identification des espèces. Les outils d’identification ont été augmentés et comprennent l’utilisation de microscopies optiques et électroniques, de moyens sélectifs et différentiels, de comparaisons enzymatiques, de métabolites secondaires, ainsi que l’utilisation de technologies immunologiques et moléculaires (LEAL-BERTIOLI, 1998; MARTINS 2005). O’Donnell et al., (2000); Summerell et al., (2003); Ottoni, (2008); commentaire qu’avec l’avènement des outils moléculaires l’identification de Fusarium est basée sur la morphologie, la biologie et la caractéristique de l’espèce, basée sur la compatibilité sexuelle, la phylogénie et les séquences des régions génomiques.
Pendant des décennies, l’identification classique utilise les caractéristiques morphologiques comme base, mais a suscité la controverse, parce que plusieurs taxonomistes et phytopathologistes trouvent nécessaire d’utiliser d’autres modèles pour séparer l’espèce, tandis que d’autres croient que ces modèles affectent la taxonomie du genre. Il est à noter que la pratique dans le diagnostic des agents causals des maladies dans la plantation de l’adoption de modèles génétiques sont plus adaptées aux études menées par les mycologues. Néanmoins, ces changements sont pertinents, car dans un genre il peut y avoir des espèces très proches et cela peut conduire à un diagnostic erroné avec des conséquences pratiques importantes (QUEREALES, 2010).
Selon Notaro et al. (2013), Fusarium solani Math (Sacc) est l’espèce qui provoque la pourriture des racines dans le manioc cv branquinha dans l’État de Pernambuco. Cette espèce produit, en milieu de culture, du mycélium aérien, avec une couleur allant du blanc à la crème, devenant bleu-brun lorsque des sporodochios sont présents. Il produit trois types de spores asexuées : la macroconidie en forme de slece, avec des dimensions approximatives de 15-35 x 4-7 μm avec 3-5 septa; les microconidies, qui ont ou n’ont pas de septum, mesurent environ 5-10 x 1-3 μm et chlamydospores, qui sont hyaline, globose, lisse à rugueux, mesurant 6-10 μm.
L’état sexuel du champignon est Nectria haematococca (Ascoycete). Ce champignon survit sur les restes culturels infectés, le sol, les tubercules et les graines, et peut persister pendant plusieurs années. Les conditions idéales pour votre établissement sont des températures allant de 15 à 25 °C, une humidité de 50 à 75 %, des blessures, des plantations dans des sols contaminés et un stockage inadéquat. Les blessures au système racinaire, en particulier celles causées par les nématodes, facilitent la pénétration du champignon dans les racines des hôtes.
3.4 LUTTE CONTRE LA MALADIE
Étant donné qu’il s’agit d’un agent pathogène transporté par le sol, son élimination après l’installation dans la zone de plantation devient une tâche très difficile et les mesures de contrôle chimique n’existent pratiquement pas, sauf pour les mesures préventives, telles que l’utilisation de traitements des semences ou d’autres matériaux de propagation (LAZAROTTO et al., 2012). Le contrôle culturel, basé sur la prévention des blessures pendant la récolte et le stockage, l’utilisation de semences saines et le substrat exempt de l’agent pathogène, utilisé qu’une seule fois, l’application équilibrée des nutriments, l’efficacité dans l’irrigation, ainsi que les variétés qui présentent des caractéristiques de résistance et le traitement des boutures (maniva) et le substrat avec fongicide pour semis lorsqu’ils sont infectés , peut minimiser les pertes de production.
À titre de mesure de contrôle, la mesure la plus efficace était basée sur des recherches menées dans le Nord-Est par Embrapa Manioc and Fruit And Agricultural Development Company (EMAGRO), était l’utilisation de variétés tolérantes (Osso Duro, Cedinha, Bibiana, clone 148/02, Aramaris et Kiriris), associées à la rotation des cultures et au système de plantation, qui réduisait la pourriture d’environ 80 % (GOMES; LEAL, 2003; BETTIOL, 2009; LOBO JÚNIOR et al., 2009; LAZAROTTO et al., 2012).
Pour le contrôle de Fusarium sp., le difenochonazol chimique et le thiram, dans le traitement du sol et des graines, sont les plus recommandés en raison de l’efficacité présentée. Cependant, le contrôle chimique est devenu constant et avec l’utilisation aveugle des problèmes écologiques ont surgi, comme ceux-ci causent des changements dans l’environnement favorisant les phytopathogènes avec la résistance due à la pression sélective, l’émergence de flambées secondaires, la réduction de la population de micro-organismes bénéfiques, en raison du dépôt de résid qui s’accumule dans le sol, l’eau et la nourriture les rendant nocifs, avec un effet délétère pour les animaux et les humains (BIZI, 2015).
En général, les coûts élevés de la pratique du contrôle chimique, associés à l’émergence de la résistance aux produits couramment utilisés, ainsi qu’à l’interdiction du bromure de méthyle, rendent essentiel le développement de techniques de contrôle alternatives (BETTIOL, 2009; LOBO JÚNIOR et al., 2009; LAZAROTTO et al., 2012). Pour l’induction biologique, la résistance végétale est une alternative prometteuse, car elle utilise des extraits naturels aux propriétés microbiennes et/ou inducantes (MORAES, 1992; STANGARLIN et al., 2008).
3.5 BIOCONTRÔLE DES PHYTOPATHOGÈNES
La tentative de réduire les actions délétères d’un agent pathogène ou d’un inoculum a été une constante dans l’agriculture, et la substitution des produits agrochimiques par des produits naturels par une activité de suppression ou de contrôle a été l’une des alternatives viables, parce que le résidu laissé est plus rapidement assimilé et décomposé par l’environnement en raison de sa faible persistance (SOUZA, 2013; BIZI, 2015).
Ethur, (2006) et Dianese, (2007); signaler l’importance de la recherche dans le domaine de la lutte biologique, comme l’introduction d’organismes antagonistes dans les environnements où l’agent pathogène cause des dommages. Cancela (2015), affirme que la dynamique de l’action de contrôle biologique se produit de manière naturelle et consiste en la régulation du nombre de plantes et d’animaux par des ennemis naturels. Cette stratégie est un élément fondamental de l’équilibre de la nature et de la façon dont le contrôle chimique présente des avantages et des inconvénients. Parmi les avantages est le fait qu’il s’agit d’une mesure non toxique, ne provoque pas de déséquilibre, n’a pas de contre-indications, fournit un contrôle étendu et efficace quand il n’y a pas de contrôle chimique, parce qu’il aura besoin de plus de technologie en raison de son effet lent, difficile à acquérir et ne peut pas toujours être appliquée à tout moment de l’année.
Le maintien de l’équilibre dans l’Agroécosystème est une pratique de contrôle biologique afin que le pathostème ne cause pas de dommages significatifs dans l’action de biocontrôle des organismes non pathogènes du système. Les auteurs rapportent également que la maladie est plus qu’une relation d’interaction agent pathogène/hôte, parce que l’influence de l’environnement et aussi une diversité d’organismes non pathogènes repose sur le site de l’infection peut limiter ou augmenter l’agressivité de l’agent pathogène, ou la résistance de l’hôte. Ainsi, les agents pathogènes, l’hôte et l’antagoniste interagissent entre eux dans les composantes de la lutte biologique (BIZI, 2015; CANCELA 2015).
Un facteur limitant pour l’utilisation des produits biologiques est la disponibilité sur le marché pour cette modalité de contrôle. Un autre problème est que de nombreux produits naturels ne sont pas correctement homologués à l’échelle commerciale (SILVA et al., 2008). La présence du phytopathogène interfère avec l’homéostasie végétale, mais elle peut aussi agir en déclenchant des mécanismes de défense et/ou en activant des gènes qui confèrent une résistance à la plante hôte (AGRIOS, 2005). Michereff et al., (1993), affirment que l’agent pathogène a des activités déterminantes impliquant la croissance, l’infectiosité, l’agressivité, la virulence et d’autres attributions de l’agent pathogène ou des processus, qui déterminent l’infection, le développement des symptômes et la reproduction. L’interaction entre l’antagoniste, l’hôte et l’agent pathogène ne se produit pas d’une manière particulière, mais mutuellement.
Plusieurs auteurs ont déjà décrit la capacité des biocontrangers d’interagir et d’interférer dans le développement du phytopathogène par des mécanismes d’action tels que la concurrence pour l’espace et les nutriments à l’antibiose, le mycoparasitisme ou l’hyperparasitisme, la prédation, l’induction de la résistance, augmentant ainsi l’avantage concurrentiel dans l’environnement. Ces mécanismes varient d’une espèce à l’autre et aussi d’une lignée à l’autre au sein d’une même espèce, selon l’interaction hôte-parasite. (CARVALHO, 2006; BETTIOL; MORANDI, 2009; BRITO et al., 2010; ZUCCHI, 2010; DIAS, 2011; MACHADO et al., 2012; BIZI, 2015; CANCELA, 2015; FIPKE, et al., 2015).
De nombreux micro-organismes ont présenté un fort potentiel de biocontrôleur et le genre Trichoderma Pers. a été utilisé dans plusieurs études. T. hamatum (Bonord.) Bainier, T. viride Pers., T. aureoviride Rifai, T. harzianum Rifai, T. koningii Oudem, T. pseudokoningii Rifai et T. longibrachiatum Rifai sont les plus cités (BETTIOL; GHINI, 2005). Ezziyyani et al., (2007) rapportent que la fréquence de Trichoderma spp., est due à sa polyvalence soit par la concurrence, l’hyperparasitisme et l’antibiose aux phytopathogènes tels que Phytophthora, Fusarium et Neoscytalidium. Remuska et Pria (2007) évaluant l’effet antagoniste de Trichoderma spp., dans le contrôle de la croissance mycéliale des champignons phytopathogènes observé que cet antagonisme exercé sur certains phytopathogènes racinaires, tels que Sclerotium rolfsii, Pythium aphanidermatum et Fusarium solani, ce dernier genre étant décrit comme l’un des principaux phytopathogènes associés à la pourriture des racines de manioc dans l’état de Pernambuco.
Hoffmann et al., (2015) ont indiqué qu’ils avaient 80% de contrôle de Fusarium sp., utilisant des isolats de Trichoderma spp. Da Silva et al., (2011); Pereira (2013) a prouvé dans ses œuvres un grand niveau d’inhibition de la croissance mycéliale de F. solani par l’espèce Trichoderma spp. Souza et al., (2015) ont également obtenu des résultats prometteurs avec Fusarium sp., et Bipolaris sp., utilisant le même biocontrôleur. Autres études de Bomfim et al., (2010); Dias (2011); Lazarotto et al., (2012); Santos et al., (2012); Marques et al., (2014), ont obtenu des résultats prometteurs présentant de bonnes à excellentes performances, en ce qui concerne l’inhibition de la croissance mycéliale des phytopathogènes testés par eux.
3.6 STRATÉGIES DE BIOCONTRÔLE TRICHODERMA
Le genre Trichoderma, appartenant au Fongicide Kingdom, phylum Ascomycota, classes Eauscomycetes et Pyrenomycètes, ordre Hypocreales, famille Hypocreaceae, genre Hypocrea (teleomorph). Ce champignon a un grand potentiel antagoniste et est souvent associé à des sols suppressifs. (MELO, 1991). Selon Harman et coll. (2004); Harman (2005), son utilisation peut offrir d’autres avantages : décomposition de la matière organique, concurrence avec une microflore délétère par la colonisation de la rhizosphère, production d’antibiose et induction de résistance.
Des espèces de Trichoderma ont déjà été documentées pour le contrôle de divers agents pathogènes, tels que Rhizoctonia solani Kühn, Sclerotium rolfsii Sacc., Sclerotina sclerotiorum (Lib.) par Bary, Fusarium spp. e Pythium spp. (MELO; AZEVEDO, 1998). De nombreuses espèces de Trichoderma, dont T. harzianum Hifai, ont montré un taux élevé de parasitisme et d’activité antagoniste pour les phytopathogènes tels que S. rolfsii, S. minor et S. sclerotiorum, R. solani et Pyricularia grisea Sacc. (ROLLAN et al., 1999; RONDÓN et al., 2007).
Selon Dos Santos (2010), l’isolat de T. harzianum a présenté l’antagonisme in vitro sur le champignon S. rolfsii; être capable d’hyperparasitiser les hyphes de l’agent pathogène et de rivaliser pour l’espace et les nutriments. Silva et al. (2013), travaillant avec des isolats de Trichodema spp., en tant qu’agent de contrôle biologique de S. lignicola, a observé que d’abord l’isolat de Neoscytalidium sp. il était très prometteur lorsqu’il a été confronté à Trichoderma spp., mais quand ils ont été trouvés dans la boîte de Petri, Trichoderma spp., superposé la colonie pathogène. En observant la région où l’antagoniste se chevauche aux phytopathogènes, il a été possible de remarquer une dégradation des hyphes de l’agent pathogène par action enzymatique, puisqu’il n’a été distingué avec précision que les spores et les hyphes de l’antagoniste.
Pour Robbs (1992) et Barbosa; Meza (2009), la concurrence pour l’alimentation et l’antibiose, sont les mécanismes les plus fréquemment utilisés par les agents de lutte biologique, puisque la reproduction et la colonisation rapide sont des attributs d’organismes qui utilisent les ressources disponibles plus efficacement et plus rapidement, assurant leur survie. Selon Ethur (2006), la compétition est l’une des principales stratégies des isolats Trichoderma sp.
La sécrétion de substances antibiotiques organiques (antibiose), produites par des micro-organismes, qui, même en faible concentration, interfèrent dans les activités métaboliques, l’inhibition ou l’arrêt de la croissance et de la sporulation, la réduction de la germination des spores et les distorsions des hyphes et de l’endolyse, qu’elles soient spécifiques ou à large aspect, sont des dispositifs importants pour l’efficacité des organismes antagonistes (LOBO JUNIOR; ABREU, 2000; BOMFIM, 2007; SOUZA, 2013). Selon Claydon et al., (1987), les antibiotiques sont des produits du métabolisme secondaire de leurs producteurs, et peuvent être plus importants pour inhiber d’autres organismes que la concurrence pour les nutriments. L’antibiose a également été signalée par plusieurs chercheurs comme l’un des mécanismes d’action des espèces de Trichoderma (BETTIOL, 1991; DIAS, 2011; CARVALHO FILHO, 2013). La glototoxine, la viridine et la trichodermine sont quelques-unes des substances produites par les espèces de Trichoderma capables d’inhiber le développement d’autres champignons (Amorim et al., 2011). Ethur (2006) a rapporté que la glotoxine était responsable de l’inhibition de la germination des spomangios et de la croissance mycéliale de Pythium ultimum.
Selon Bomfim et al., (2010) et Souza (2013), le biocontrôleur sera efficace s’il est capable de dégrader la paroi cellulaire (composée de glucides, comme la chitine), ainsi que des protéines et des lipides dans des quantités importantes du phytopathogène ou interrompre les processus liés à sa synthèse. Par conséquent, la production d’enzymes qui hydrolysent les composants de la paroi cellulaire des phytopathogènes, en particulier les chitinases et les glucanases, est une caractéristique commune dans de nombreux agents de lutte biologique. Certains représentants du gendre Trichoderma sont cités dans les œuvres comme un excellent producteur de cellulase et de chitinases, enzymes qui dégradent la cellulose et la chitine (MELO, 1991; HARMAN et al., 2004).
Le mycoparasitisme, une situation dans laquelle le micro-organisme antagoniste vit sur ou à l’intérieur du champignon antagonisé, se nourrissant et se développant à ses dépens, est un autre mécanisme important d’action comme attribut d’un bon biocontrôleur. Le mycoparasitisme implique l’antibiose et le cannibalisme causés par l’action d’enzymes hydrolytiques, telles que les chitinases, les glucides, les protéases et les lipases, qui causent la mort de l’un d’eux qui sert ainsi de nourriture pour le survivant (LOBO JUNIOR; ABREU, 2000; HARMAN, 2000; BOMFIM, 2007; BARRA et al., 2008; ZUCCHI, 2010).
Les chitinases et les β-1,3-glucanases sont directement impliquées dans les interactions du mycoparasitisme entre les espèces de Trichoderma et leurs hôtes, en raison de la majorité des champignons phytopathogènes possédant dans leur paroi cellulaire de chitine, organisés en couches régulièrement ordonnées et β-1,3-glucanes disposés comme remplissage de manière amorphe. Chitinase agit au hasard et dégrade les structures biologiques et les composants des cellules fongiques, libérant des oligomères qui induisent des exoquitinas, commençant ainsi l’attaque mycoparasitique, hydrolysant les oligosaccharides de la paroi cellulaire phytopathogène. (GIESE et al., 2003; MARCELLO, 2008; BAUERMEISTER et al., 2010).
Melo (1996) rapporte que le mycoparasitisme nécrotrophique est efficace dans l’antagonisme des phytopathogènes, en particulier ceux dont les structures de résistance sont considérées comme difficiles à attaquer par des micro-organismes, tels que les spros, la sclérotie, les chlamydospores et les microsclérotiques. Melo, Melo. Azevedo (1998) déclare celui Trichoderma sp. il a des caractéristiques mycoparasites, parce qu’ils peuvent localiser et détecter les phytopathogènes, peut-être par des stimuli biochimiques, se développent vers les hyphes des champignons sensibles, et quand ils entrent en contact, ils forment des structures telles que les apperssoriums, se recroquevillent, dans toute leur étendue, les pénètrent et les digèrent. Le genre Trichoderma est sans aucun doute un excellent agent de contrôle microbien, car il présente, en plus des compétences décrites ci-dessus, les caractéristiques essentielles, étant: impact environnemental et faible ou nulle, propagation facile (SPIEGEL; CHET, 1998), capacité de survivre dans des environnements défavorables, en plus de contenir des populations d’agents pathogènes vivant dans le sol (VINALE et al., 2008).
4. CONSIDÉRATIONS FINALES
Les relations écologiques interspécifiques sont des événements qui se produisent à différents niveaux dans la nature et sont principalement faits de formes démmoniques, dans l’état de relation entre les micro-organismes étant la concurrence, l’antibiose et le parasitisme les plus fréquents. Ainsi, les micro-organismes pathogènes dans les plantes non seulement causent des pertes économiques, mais évoluent simultanément, causant ainsi des dommages dès le stade initial du développement des cultures. Les méthodes traditionnelles de lutte contre le phytopathogène ont été utilisées, l’application de pesticides chimiques et de fongicides, a également été une forme très fréquente qui causent des problèmes majeurs en raison des impacts environnementaux.
L’un des moyens les plus prometteurs de réduire l’utilisation de ces produits agrochimiques, voire une substitution future, le contrôle biologique par le biais des nombreux biocontrôleurs tels que les champignons du genre Trichoderma qui sont efficaces et ne causent pas d’impacts destructeurs sur l’environnement.
RÉFÉRENCES
AGRIOS, G.N. Plant pathology. Amsterdam : Elsevier Academic Press. 5.ed, 2005. 922p.
ALVES, A., A., C.. Fisiologia da mandioca. In: Aspectos socioeconômicos e agronômicos da mandioca. EMBRAPA Mandioca e Fruticultura Tropical, Cruz das Almas, 2006., 817p.
AMORIM, L.; REZENDE, J. A. M.; BERGAMIN FILHO, A. Manual de Fitopatologia. Piracicaba: Agronômica Ceres. v. 1,4. Ed, p. 383 -387, 2011.
BARBOSA, R.J.F.; MEZA, C.L.S. Antagonismo in vitro de Trichoderma harzianum rifai sobre Fusarium oxysporum schlecht f. sp passiflorae en maracuyá (Passiflora edulis sims var. flavicarpa) del municipio zona bananera colombiana. Rev. Fac. Nal. Agr. Medellín, v.62, n.1, p.4743-4748, 2009.
BARRA, V. R.; ROMEIRO, R.S.; FERRAZ, H.G.M.; MACAGNAN, D.; SILVA, H. S. A.; MOURA, A. B.; HALFELD-VIEIRA, B. A; MENDONÇA, H. L.; VIEIRA JÚNIOR, J. R. Potencialidade antagonística em alguns procariotas agentes de biocontrole de enfermidades de plantas. Ver. Summa Phytopathologica, v.34, n.2, p.121-126, 2008.
BAUERMEISTER, A.; REZENDE, M. I.; GIESE, E. C.; DEKKER, R. F. H.; BARBOSA, A. M. 1,3-Glucanases Fúngicas: produção e aplicações biotecnológicas. LONDRINA SP. rev. Semina: Ciências Exatas e Tecnológicas, , v. 31, n. 2, p. 75-86, jul./dez. 2010. http://www.uel.br/seer/index.php/semexatas/article/view/5249
BETTIOL, W. Controle biológico de doencas do filoplano. In: BETTIOL, W., org. Controle biológico de doencas de plantas. Jaguariuna: EMBRAPA-CNPDA, 1991. p.33-52 (EMBRAPA-CNPDA. Documentos, 15).
BETTIOL, W.: MORANDI, M.A.B. Controle Biológico de Doenças de Plantas no Brasil. In: BETTIOL, W.: MORANDI, M.A.B. (Org). Biocontrole de Doenças de Plantas: uso e perspectivas. Jaguariúna – SP: Embrapa Meio Ambiente, p. 7-14, 2009.
BETTIOL, W.; GHINI, R. Solos Supressivos. In: MICHEREFF,S. J.; ANDRADE, D. E. G. T.; MENEZES, M. (Eds.) Ecologia e Manejo de patógenos radiculares em solos tropicais. Recife:UFRPE, Imprensa Universitária, 2005. cap.6, p. 125-143.
BIZI, R. M., Utilização de fungos no Controle Biológico de Doenças. < http://www.floresta.ufpr.br/alias/lpf/public_html/contbio03.html.> Acesso em 16/11/2015.
BOMFIM, M. P., Antagonismo in vitro e in vivo de Trichoderma spp. a Rhizopus stolonifer em maracujazeiro amarelo. Vitória da Conquista BA, 2007. 74f.: Dissertação de Mestrado. Universidade Estadual do Sudoeste da Bahia. 2007
BOMFIM, M. P., SÃO JOSÉ, A. R., REBOUÇAS, T. N. H., ALMEIDA, S. S. D., SOUZA, I. V. B., & DIAS, N. O . Avaliação antagônica in vitro e in vivo de Trichoderma spp. a Rhizopusstolonifer em maracujazeiro amarelo. Summa Phytopathologyca, v.36, n.1, p. 61-67, 2010.
BRITO, F. S.; MILLER, P. R. M., STADNIK, M. Presença de Trichoderma spp em composto e suas características para o controle de fitopatógenos. Revista. Bras. de Agroecologia, Porto Alegre , p. 43-53. 2010.
CANCELA, K. C., Controle Biológico Florestal Conceitos, Terminologia, Descrição e Caracterização de Agente. Proteção florestal Disponível em <http://www.floresta.ufpr.br/alias/lpf/public_html/contbio01.html> Acesso em 16/11/2015.
CARVALHO FILHO, M. R., Relações filogenéticas, identificação e potencial de uso de isolados de Trichoderma no controle do mofo branco e como promotores de crescimento do feijoeiro. Brasília-DF, 2013. 123f. Tese de Doutorado. Programa de Pós-graduação em Fitopatologia, Universidade de Brasília. Brasília. 2013.
CARVALHO, A. C., Bioprospecção de isolados de Trichoderma stromaticum para o controle biológico da Vassoura-de-Bruxa do Cacaueiro. 2006. 82f. Dissertação de Mestrado. Universidade Estadual de Santa Cruz. 2006.
CONAB– CLAYDON, N.; ALLAN, M.; ITANSON, J.R.; AVENT, A. G. Antifungal alkyl pyrones of Trichoderma harzianum. Transactions of the British Mycological Society, v.88, p.503-513, 1987. COMPANHIA NACIONAL DE ABASTECIMENTO. Perspectivas para a agropecuária. Conab, Brasília , v.1, 2013., 154p.
DA SILVA, D. C. V., TIAGO, P. V., & DE SOUZA-MOTTA, C. M. . Isolamento e seleção de fungos filamentosos do solo de sistemas agroflorestais do Município de Bom Jardim (PE) com base na capacidade de produção de enzimas hidrolíticas1. Revista Brasil. Bot, 34(4), 607-610. 2011
DIANESE, A. de C. Variabilidade e controle de Phytophthora palmivora (Podridão-do-pé) e controle da varíola (Aperisporium caricae) do mamoeiro (Carica papaya). 2007. 109f. Tese Doutorado – Universidade de Brasília, Brasília. 2007
DIAS, P. P., Controle biológico de fitopatógenos de solo por meio de isolados de fungos do gênero Trichoderma e sua contribuição no crescimento de plantas. 2011. 101 f. Tese Doutorado. Universidade Federal Rural do Rio de Janeiro. Seropédica – Rio de Janeiro. 2011
DINIZ, M. de S.. Efeito da manipueira na adubação da mandioca. Revista Raízes e Amidos Tropicais, v. 5, 2009.
DOS SANTOS, J. et al. Atividade hiperparasíticade Trichoderma spp. sobre escleródios de Sclerotinia sclerotiorum em solo. In: SEMINÁRIO DE INICIAÇÃO CIENTÍFICA E TECNOLÓGICA,7,2010.Anais…EPAMIG,2010.Online.Disponívelem:http://www.epamig.br/index.phpoption=com_docman&task=cat_view&gid=121&dir=DESC&order=date&limit=10&limitstart=10.Acesso em Dezembro 2015
ETHUR, L.Z. Dinâmica populacional e ação de Trichoderma no controle de fusariose em mudas de tomateiro e pepino. 2006. 154p. Tese (Doutorado em Fitopatologia) – Universidade Federal de Santa Maria, Santa Maria-RS. 2006.
EZZIYYANI, M.; REQUENA, M. E.; EGEA-GILABERT, C.; CANDELA, M. E. Biological Control of Phytophthora Root Rot of Pepper Using Trichoderma harzianum and Streptomyces rochei in Combination. Journal of Phytopathology , [S.I], v.155, n.6, p. 342-349, 2007
FAO. Faostatidtics Database. Disponivel em <https://www.fao.org.br/FAO_Brf2mpu3a.asp> Acesso em Dezembro de 2015.
FIPKE, G. M; PAZINI, J.B.; ETHU,L. Z. Antagonismo de isolados de Trichoderma spp. ao Sclerotinia sclerotiorum em diferentes temperaturas. Magistra, Cruz das Almas BA, V. 27, N.1, p. 23 – 32, Jan./Mar. 2015
FUKUDA C.; OTSUBO A.A. Cultivo da mandioca na região centro sul do Brasil. Embrapa Mandioca e Fruticultura. HTTP://sistemasdeproducao.cnptia.embrapa.br/FontesHTML/Mandioca/mandioca_centrosul/doenc s.htm . Acessado em 16 de julho de 2015.
FRAIFE FILHO G. A., BAHIA J. J. S., Mandioca. Ceplac-Cepec-BA. http://www.ceplac.gov.br/radar/mandioca.htm . Acessado Dezembro de 2015.
GIESE, E. C.; BARBOSA, A. M.; SILVA M.L.C. Glucanases Fúngica: Produção e aplicações das -1,3 e -1,6 glucanases. Revista Biotecnologia Ciência e Desenvolvimento, Brasília-DF, nº 30 , P.97-104.. jan/jun 2003.
GOMES, J. C.; LEAL, E. C., Cultivo da Mandioca para a Região dos Tabuleiros Costeiros. In.: Podridão Radicular. Embrapa Mandioca e Fruticultura. Sistemas de Produção, 11. ISSN 1678-8796 Versão eletrônica/Jan/2003. https://sistemasdeproducao.cnptia.embrapa.br/FontesHTML/Mandioca/mandioca_tabcosteiros/doencas.htm . Acesso 13/12/2015.
HOFFMANN, C. A. et al.. Potencial de antagonismo de isolados de Trichoderma sp. contra o isolados de Fusarium sp., in vitro. Revista Verde de Agroecologia e Desenvolvimento Sustentável, v. 10, n. 1, p. 236-242, 2015.
HARMAN, G. E. The Nature and Application of Biocontrol Microbes II: Trichoderma spp. Overview of Mechanisms and Uses of Trichoderma spp. Phytopathology, St Paul, v. 96, p. 190-194. 2005
HARMAN, G. E. Myth and dogmas of biocontrol changes in perceptions derived from research on Trichoderma harzianum T-22. Plant Disease, St. Paul, v. 84, p.377-393, 2000.
HARMAN, G.E. HOWELL, C. R., VITERBO, A., CHET, I., & LORITO, M. Trichoderma species-opportunistic, avirulent plant symbionts. Nature Reviews Microbiology. V.2, p. 43-56. 2004.
IBGE – Instituto Brasileiro de Geografia e estatística. PAS – Pesquisa Anual de Serviços, 2015. [online]Disponível na internet via WWW URL: http://www.ibge.gov.br/home/. Arquivo consultado Dezembro de 2015.
LAZAROTTO, M.; BOVOLINI, M. P.; MACIEL, C. G.; MUNIZ, M. F. B. Seleção in vitro de Isolados de Trichoderma spp. com Potencial de Antagonismo a Isolados Patogênicos de Fusarium spp. In: XVI Simpósio De Ensino, Pesquisa E Extensão, Unifra, v. 3, 2012.
LEAL- BERTIOLI, S. C. DE M. O enfoque molecular na sistemática de fungos. Revisão Anual de Patologia de Plantas. V.6. p. 197-230, 1998
LOBO JÚNIOR, M. e ABREU, M.S. Inibição do crescimento micelial de Sclerotinia sclerotiorum por metabólitos voláteis produzidos por alguns antagonistas em diferentes temperaturas e pH’s. Ciência Agrotécnica, Lavras, v.24, p.521-526, 2000.
LOBO JUNIOR, M.; BRANDÃO, R. S.; CORRÊA, C. A.; GÖRGEN, C. A.; CIVARDI, E. A.; OLIVEIRA, P. de. Uso de braquiárias para o manejo de doenças causadas por patógenos habitantes do solo.Santo Antônio de Goiás: Embrapa Arroz e Feijão, 2009. 8 p. (Embrapa Arroz e Feijão. Comunicado técnico, 183).
MACHADO, D. F. M.; PARZIANELLO, F. R.; SILVA, A. C.F. e ANTONIOLLI, Z. I. Trichoderma no Brasil: o fungo e o bioagente. Revista de Ciências Agrárias, v.35, n.1, p. 274-288, 2012.
MARCELLO, C. M. Avaliação da expressão e caracterização de uma exo-b-1,3-glucanase envolvida no mecanismo de micoparasitismo de Trichoderma asperellum. Brasília-DF, 2008. 89f. Tese de Doutorado. Laboratório de Enzimologia Departamento de Biologia Celular do Instituto de Biologia da Universidade de Brasília – UnB. Brasília – DF. 2008.
MARQUES, H. I. P.; SILVA, M. B.; MARQUES, M. D. P.; RODRIGUES, R. C.; RIBEIRO, P. R. C. C. Inibição do crescimento micelial de Trichoderma harzianum por fertilizantes líquidos. Enciclopédia Biosfera, v. 10, n. 18, p. 2040, 2014.
MARTINS, M. K.. Variabilidade genética de isolados de Fusarium spp. e estudo da interação com a planta hospedeira. 2005. 110f. Diss. Tese (Doutorado em Agronomia)-Escola Superior de Agricultura” Luiz de Queiroz”, Universidade de São Paulo, SP.[Links], 2005
MASSOLA JR, N.S.; BEDENDO, I. P.. Doenças da mandioca. In: KIMATI, H. et al. Manual de fitopatologia: Doenças das plantas cultivadas;. 4ª Ed.vol. 2, p. 340-341 – São Paulo: Agronômica Ceres, 2005
MELO, I. S. Potencialidades da utilização de Trichoderma spp. no controle biológico de doenças de plantas. In: BETTIOL, W. (Ed.). Controle biológico de doenças de plantas. Jaguariúna: CNPDA/EMBRAPA, 1991. p. 135-156.
MELO, I. S.; AZEVEDO, J. L. Ecologia Microbiana. Jaguariúna: Embrapa DNPMA, p. 393-419, 1998.
MELO, I.S. Trichoderma e Gliocladium como bioprotetores de plantas. Revis. Anu. Patol. Plantas v. 4, p. 261-295. 1996.
MENEZES, J. P., LUPATINI, M., ANTONIOLLI, Z. I., BLUME, E., JUNGES, E., & MANZONI, C. G. Variabilidade genética na região its do rDNA de isolados de trichoderma spp.(Biocontrolador) e Fusarium oxysporum f. sp. Chrysanthemi. Ciência e Agrotecnologia, 34(1), 132-139.2010
MICHEREFF, S.J.; MENEZES, M.; MARIANO, R.L.R. Potencial de Trichoderma para o controle da antracnose do sorgo. Fitopatologia Brasileira, Brasília, v. 18, p. 392-398, 1993.
MILANESI, P.M. Caracterização, toxicidade e patogenicidade de Fusarium spp. em genótipos de soja em sistema plantio direto. 2009. 91 p. Dissertação (Mestrado em Agronomia) – Universidade Federal de Santa Maria, Santa Maria, 2009.
MORAES, W. B. C. Controle alternativo de fitopatógenos. Pesquisa Agropecuária Brasileira, v. 27, n. 13, p. 175-190, 1992.
MORAIS, M. dos S.; NASCIMENTO, L. C do; MOREIRA, K. A.; SILVA, M. da; CAVALCANTI, N. T. D. O. Levantamento e avaliação da incidência das doenças da mandioca no estado da Paraíba. Summa Phytopathologica, v. 39, n. 3, p. 204. 2013.
MOURA, G. de M.; SILVA, M. D. O. da. Avaliação de resistência de cultivares de mandioca à podridão de raízes. Embrapa-CPAF/AC. Comunicado Técnico, 4p. Rio Branco 1997.
MUNIZ J. N, RUFFINO-NETTO A, YAMAMURA M, VILLA TCS, ARCENCIO R. Aspectos epidemiológicos da coinfecção tuberculose e vírus da imunodeficiência humana em Ribeirão Preto (SP), de 1998 a 2003. J. Bras. Pneumol., 32(6):529-34, 2006
NASCIMENTO JÚNIOR, N. A. Efeito da casca de mandioca no controle da podridão radicular causada por Phytophthora sp. em mandioca de mesa (Manihot esculenta Crantz) var. Rosinha em ambiente irrigado. Rio Largo-AL,2015.82f. Tese de Doutorado. (Programa de Pós-Graduação em Proteção de Plantas da Universidade Federal de Alagoas. Alagoas. 2015.
NOTARO, K. A. MEDEIROS, E. V., SILVA, C. A. D., & Barros, J. A. Prospecção de fitopatógenos associados á podridão radicular da mandioca em Pernambuco, Brasil. Biosci. J., Uberlândia, v. 29, n. 5, p. 1832-1839, 2013.
NOTARO, K. A. Prospecção de fitopatógenos e caracterização de solos arenosos envolvidos na supressividade ou conducividade da podridão radicular da mandioca, causada por Neoscytalidium lignicola/ Krystal de Alcantara Notaro. Garanhuns-PE, 2012. 111f. Dissertação (PROGRAMA DE PÓS-GRADUAÇÃO EM PRODUÇÃO AGRÍCOLA). Universidade Federal Rural de Pernambuco – Unidade Acadêmica de Garanhuns, 2012.
O`DONNELL, K.; NIRENBERG, H.I.; AOKI, T.; CIGELNIK, E. A multigene phylogeny of the Gibberella fujikoroi species complex: detection of additional phylogenetically distinct species.Mycoscience, Tokyo, v. 41, p. 61-78, 2000.
OLIVEIRA, L. G. SILVA, A.C.S; SILVA, R. L. ,LIMA, D. W. S & LIMA, G; COSTA. Atividade proteolítica de fungos de solo fitopatogênicos ao Feijão-Caupi [Vigna unguiculata (L.) Walp.] In: III CONAC Congresso Nacional de Feijão-Caupi. Pernambuco. Resumo expandido. 4p. 22-24 de abril Recife Pernambuco 2013.
OLIVEIRA, N. T; J. M. A., UCHÔA, S. C. P., RODRIGUES, G. S., MELVILLE, C. C., & de ALBUQUERQUE, J. D. A. A.. Caracterização e identificação de clones de mandioca produzidas em Roraima para o consumo in natura. Revista Agro@mbiente On-line, v. 5, n. 3, p. 188-193, 2012.
OTTONI, R.J. Analise da incidência de Fusarium spp. toxigenicos e de níveis de fumonisinas em grãos ardidos de milho hibrido. 2008. 54 p. Dissertação (Mestrado em Microbiologia Agrícola) – Escola Superior de Agricultura “Luiz de Queiroz”, Universidade de São Paulo, Piracicaba, 2008.
PEREIRA, C O.F. Estudo da patogenicidade e controle biológico de Fusarium sp. Com Trichoderma sp. 2013.74f. Dissertação. Universidade de Caxias do Sul. 2013.
PUHALLA, J.E. Genetic considerations of the genus Fusarium. In: Nelson, P.E.; Toussoun, T.A.; Cook, R.J. (Ed) Fusarium: diseases, biology, and taxonomy. Pennsylvania: Pennsylvania State University, v.27, p.291-305, 1981.
QUERALES, P. J.. Caracterização morfológica e genética de Fusarium spp. isolados de sementes e associados à podridão do colmo de milho (Zea mays L.). Diss. Escola Superior de Agricultura “Luiz de Queiroz, 2010.
REMUSKA, A.C.; DELLA PRIA, M. Efeito de Bacillus truringiensis e Trichoderma sp. no crescimento de fungos fitopatogênicos. Publication UEPG: Ciências Exatas e da Terra, Agrárias e Engenharia, Ponta Grossa, v.13, n.3, p.31-36, 2007.
ROBBS, F. C. Controle Biológico de doenças em plantas. In: NETO, A. M. A.; BARAN, C. L. (ed.). Manual de Controle Biológico. Rio de Janeiro: Lidador. 1992. p.46-51.
ROLLAN, MONACO C, NICO A. Efecto de la tempratura sobre la interaccion invitr o entre especies de Tricihoderma y Sclerotinia sclerotiorum, S. minor y Sclerotium rolfsii. Invest. Agr.: Prod. Prot. Veg. 14:1-16. 1999.
RONDÓN T.R, GUTIÉRREZ GR, ZAYAS A.D.P, PÉREZ LA, CUTIÑO Y.L. Efectividad in vitro de Trichoderma harzianum Rifai para el biocontrol de Rhizoctonia solani Kühn y Pyricularia Grisea sacc. aislados en el cultivo del arroz (Oryza sativa l.). Fitosanidad 11: 29-34.2007.
SALLA, D. A., CABELLO, C. Análise energética de sistemas de produção de etanol de mandioca, cana-de-açúcar e milho. Revista Energia na Agricultura. Botucatu, vol. 25, n.2, p.32-53., 2010.
SANTOS, C. C., OLIVEIRA, F. A. de; SANTOS, M. S. dos; TALAMINI, V.; FERREIRA, J. M. S.; SANTOS, F. J. dos., Influência de Trichoderma spp. sobre o crescimento micelial de Thielaviopsis paradoxa. Scientia Plena 8, 047309 www.scientiaplena.org.br . 2012
SEIFERT, K.A. Enhancing the relevance of fungal taxonomy to plant pathology: phylogenetics, molecular diagnostics, and long-term memory1. Symposium contribution. Canadian Journal of Plant Pathology, Otawa, v. 28, p. S280-S287, 2006.
SILVA, A. N.; AZEVEDO, G. B.; ROCHA-SOBRINHO, G. G.; NOVAES, Q. S.; Efeito de produtos químicos e de Trichoderma spp. no controle de Fusarium solani do maracujazeiro. Interciencia, v. 6, p. 398-403, 2014.
SILVA, C. A. D., DE MEDEIROS, E. V., BEZERRA, C. B., DE MORAIS; SILVA, W., DE BARROS, J. A., & DOS SANTOS, U. J. Interferência da incorporação de matéria orgânica no solo no controle da podridão negra da mandioca, causada por Scytalidium lignicola. Biosci. J., Uberlândia, v. 29, n. 6 , p. 1823-1831, Nov./Dec. 2013.
SILVA, C. A. D., Prospecção em fitopatógenicos e avaliação de fontes de matéria orgânica sobre a supressividade da podridão radicular da mandioca. Garanhuns- PE, 2013. 77 f. Dissertação (Mestrado em Produção Agrícola). Universidade Federal Rural de Pernambuco – Unidade Acadêmica de Garanhuns, 2013.
SILVA, H. S. A.; ANDRADE, E. C. Impacto potencial das mudanças climáticas sobre as doenças da mandioca no Brasil. In: Impactos das mudanças climáticas sobre doenças de importantes culturas no Brasil. Jaguariúna: Embrapa Meio Ambiente, p. 263-272, 2011.
SILVA, J. L.; TEIXEIRA, R. N. V. Esporulação e crescimento micelial de Fusarium solani em diferentes meios de cultura e regimes de luminosidade. Revista Agrombiente On-line,v.6,n.1,p.47-52, 2012. Disponível em: <http://revista.ufrr.br/index.php/agroambiente/article/view/604>
SILVA, K. S.; REBOUÇAS, T. N. H.; BOMFIM, M. P.; SILVA, D. S.; SÃO JOSÉ, A. R.; BENETT, C. G. S. Atividade antagônica in vitro de isolados de Trichoderma spp. ao fungo Phytophthora citrophthora. Londrina. Semina: Ciências Agrárias, v. 29, n. 4, p. 749-754, out./dez. 2008.
SILVA, M.B.; NICOLI, A. COSTA, A.S.V.; BRASILEIRO, B.G.; JAMAL, C.M., SILVA, C. A.; PAULA JÚNIOR, T. J.; TEIXEIRA, H. Ação antimicrobiana de extratos de plantas medicinais sobre espécies fitopatogênicas de fungos do gênero Colletotrichum. Revista Brasileira de Plantas Medicinais , Botucatu, v.10, n.3, p.57-60, 2008.
SOUSA, R.M.S.; SERRA, I.M.R.S.; MELO, T.A. Effect of essential oils as an alternative in the control of Colletotrichum gloesporioides in pepper.Summa Phytopathologica , v.38, n.1, p.42-47, 2012.
SOUZA, J. R., Potencialidade de fungicida e agente biológico no controle de requeima do tomateiro. 2013. 63f. Dissertação. Universidade Estadual do Sudoeste da Bahia, Vitória da Conquista. Bahia – BR. 2013.
SOUZA, K. de A.;VAZ, M. C. A.; ALVES, G. C. S.; PAZ -LIMA, M. L.. Confronto in vitro de isolados de Trichoderma spp. com fungos filamentosos. 2p. IV Congresso Estadual de Iniciação Científica do IF Goiano 21 a 24 de setembro de 2015.
SPIEGEL, Y.; CHET, I. Evolution of Trichoderma spp. as a biocontrol agent against soilborne fungi and plant parasitic nematodes in Israel. Integrated Pest Management Review, v. 03, p. 167-175, 1998.
STANGARLIN, J.R. et al. Controle de doenças de plantas por extratos de origem vegetal. Revisão Anual de Patologia de Plantas, v.16, p.265-304, 2008.
URBEN, A.F., et al., Curso taxonomia de Fusarium. Embrapa recursos genéticos e biotecnologia. Brasilia-DF: Embrapa informação tecnólogica, 2009.
VENTURA, J. A. Taxonomia de Fusarium e seus segregados: I- história, meios e procedimentos de cultivo. Revisão Anual de Patologia de Plantas , Passo Fundo, v. 7, p. 271-298, 1999.
VINALE F, SIVASITHAMPARAM, K., GHISALBERTI, E. L., MARRA, R., WOO, S. L., & LORITO, M.. Trichoderma–plant–pathogen interactions. Soil Biology and Biochemistry, v. 40, p.1-10.2008.
ZUCCHI, F. O. Trichoderma sp. em áreas agrícolas visando o controle de doenças fúngicas de raízes de plantas cultivadas. Campinas SP. JV Biotecnologia. 15p. 2010.
ANNEXE – RÉFÉRENCE DES NOTES DE BAS DE PAGE
1. WOLLENWEBER, H. W.; REINKING, O. A.. Die fusarien: ihre beschreibung, schadwirkung und bekämpfung. Berlin: P. Parey, 1935
[1] Doctorat en protection des plantes, maîtrise en production végétale, baccalauréat et baccalauréat en sciences biologiques.
[2] Doctorat en agronomie (Agriculture). Maîtrise en phytopathologie. Spécialisation en didactique pour l’enseignement supérieur. Diplôme en agronomie.
[3] Doctorat en protection des plantes. Maîtrise en agronomie (irrigation et drainage). Diplôme en agronomie.
[4] Maîtrise en horticulture irriguée. Diplôme en agronomie.
[5] Doctorat en phytopathologie. Maîtrise en agronomie (production végétale et protection des végétaux). Amélioration de l’amélioration des sciences biologiques. Diplôme en agronomie.
[6] Diplômé en agronomie.
Envoyé : Mai 2020.
Approuvé : juin 2020.


