ARTICOLO ORIGINALE
BEDIN, Rafael Antonio Caldart [1], SCHULTZ, Maisa [2], BEDIN, Antonio [3]
BEDIN, Rafael Antonio Caldart. SCHULTZ, Maisa. BEDIN, Antonio. Anestesia per conigli sottoposti a interventi chirurgici sperimentali: Rapporto di una serie di otto anestesie. Revista Científica Multidisciplinar Núcleo do Conhecimento. Anno 05, Ed. 06, Vol. 03, pp. 151-158. giugno 2020. ISSN: 2448-0959, Link di accesso: https://www.nucleodoconhecimento.com.br/salute/anestesia-per-conigli, DOI: 10.32749/nucleodoconhecimento.com.br/salute/anestesia-per-conigli
RIEPILOGO
L’anestesia per animali da laboratorio è una questione di interesse biomedico e uno dei dilemmi più presenti nell’attuale dibattito bioetico. L’uso di agenti anestetici nella chirurgia sperimentale mira all’analgesia e al contenimento dell’animale, al fine di ottenere un ragionevole grado di rilassamento muscolare e produrre una sufficiente analgesia. Questa pratica richiede l’uso di protocolli per la somministrazione di dosi sicure ed efficienti. Otto conigli neozelandesi sono stati sottoposti a laparotomia dimostrando la disciplina della tecnica chirurgica del corso di medicina locale. Per i farmaci pre-anestetici, è stata utilizzata per via sottocutanea acepromazina 1 mg.kg-1 associata a ketamina 15 mg.kg-1 . L’anestesia è stata mantenuta con isoflurano e ossigeno sotto una maschera laringea in un sistema di anestesia Mapleson D e con respirazione spontanea. L’idratazione è stata eseguita con 10 ml.kg-1 di soluzione salina ogni ora. È stato utilizzato un materasso termico. Per il monitoraggio sono stati utilizzati stetoscopio precordiale, pulsossimetria e parametri clinici. Per l’eutanasia, ketamina 10 mg.kg-1 associata a cloruro di potassio 19,1% 1 ml.kg-1 è stata utilizzata per via endovenosa. Il peso medio dei conigli era di 2721,25 ± 275,01 grammi e la durata della procedura anestetica era di 120 ± 87 minuti. Discussione. Nell’anestesia a lungo termine, come la laparotomia, si raccomanda l’uso di farmaci pre-anestetici e quindi l’induzione dell’anestetico mediante la combinazione di agenti. Tuttavia, la gestione dell’anestesia richiede il monitoraggio per evitare che si verifichino dosi insufficienti o eccessive.
Parole chiave: Conigli, isoflurane, anestesia generale.
INTRODUZIONE
L’anestesia per animali da laboratorio è oggetto di dibattito etico ed è stato uno degli argomenti più conflittuali in questo campo della conoscenza (BEDIN et.al., 2013). L’uso di anestetici nella chirurgia sperimentale mira a contenere l’animale, al fine di raggiungere un ragionevole grado di rilassamento muscolare e produrre un’analgesia sufficiente. Questa pratica richiede l’uso di protocolli per la somministrazione di dosi sicure ed efficienti (BEDIN et.al., 2013).
ARTICOLO DI LETTERATURA
I conigli di solito presentano stress a causa della gestione preoperatoria e durante i farmaci preanesteni e durante l’induzione con agenti anestetici endovenosi o volatili. Qui è possibile aggiungere stress con la manipolazione dell’animale per la somministrazione di anestesia e può causare arresto respiratorio e cardiaco. L’insorgenza di infezioni respiratorie da parte di Pasteurella multocida può portare a gravi complicazioni respiratorie durante l’anestesia. Nell’esame preoperatorio di questi animali, dovremmo prestare molta attenzione alla presenza di sintomi respiratori (naso che cola e rumori accidentali all’auscultazione), che possono essere forti indicazioni di infezione delle vie respiratorie (BEDIN et al., 2013).
L’anestesia nei conigli può variare dalla semplice sedazione ai piani di anestesia profonda, che consentono procedure chirurgiche sempre più piccole. L’uso di anestetici volatili alogenati nei conigli è spesso usato per procedure a lungo termine, specialmente quando si intende mantenere l’omeostasi degli animali il più equilibrata possibile (BEDIN et.al., 2013).
Dopo la somministrazione di farmaci preanestetici, sono 15 minuti per adattare la maschera laringea, collegandolo al dispositivo di anestesia. O2 dal 50 al 100% e isoflurane dall’1 al 5% (BEDIN et al., 2013; RAILLARD et al., 2019; TUNCALI et.al., 2018). La procedura di intubazione tracheale presenta grandi difficoltà tecniche quando gli animali sono conigli (BEDIN et.al., 2013). La visualizzazione del glotwith laringoscopio è praticamente impossibile in questi animali (BEDIN et.al., 2013). La tecnica di respirazione orientata alla cieca è di solito la modalità più frequente per l’intubazione nei conigli. A causa della difficoltà di intubazione tracheale, la tracheostomia o le maschere laringee sono utilizzate da molti che lavorano in questo settore (THOMPSON et.al., 2017). Le procedure anestetiche nei conigli possono essere tenute sotto maschera facciale o maschera laringea con ossigeno e agente anestetico alogenato nella respirazione spontanea (BEDIN et.al., 2013).
Nelle procedure in cui è necessaria la ventilazione polmonare, questo può essere manuale, con l’uso di un sistema Mapleson D, o ventilazione meccanica controllata con un filtro circolare (BEDIN et.al., 2013). Il monitoraggio si basa principalmente clinicamente osservando dati vitali come frequenza cardiaca, frequenza respiratoria, colorazione della mucosa e presenza di riflessi oculopalpebrali. Sono regolarmente utilizzati per questo monitoraggio dello stetoscopio precordiale, dell’elettrocardioscopio e dell’ossimametria degli impulsi. Gli altri monitor devono essere utilizzati in base alle esigenze imposte dal progetto di studio e possono essere utili capnografi, pressione sanguigna invasiva e non invasiva.
Il periodo postoperatorio fa parte del protocollo anestetico e la cura data all’animale è fondamentale in questo momento. Complicazioni come la depressione respiratoria, che può verificarsi durante l’atto anestetico, diventano fatali in questo periodo. Dopo la fine della procedura anestetico-chirurgica, gli animali devono essere indirizzati per il recupero anestetico. Questo posto dovrebbe rimanere silenzioso, con scarsa illuminazione, e per evitare lo stress degli animali, si deve avere una manipolazione minima. Se l’eutanasia è prevista nel protocollo di studio, le tecniche per questo signore dovrebbero fornire incoscienza seguita dalla cessazione del battito cardiaco e dalla cessazione respiratoria e definitiva delle funzioni cerebrali. Idealmente, la tecnica ridurrebbe al minimo l’ansia vissuta dall’animale prima della perdita di coscienza.
Per i conigli, le tecniche più utilizzate per l’eutanasia sono: CO2 inalato, agenti inalati, barbiturici venosi e cloruro di potassio venoso, che viene utilizzato solo negli animali sotto sedazione profonda perché l’iniezione venosa è dolorosa (BEDIN et.al., 2013).
Sulla base di questi dati della letteratura, è stato adottato come procedura anestetica utilizzata come routine nella disciplina della tecnica operativa e dell’anestesiologia del corso di medicina della regione dell’Università di Joinville (UNIVILLE) per l’anestesia nei conigli (BEDIN et.al., 2013):
- Dopo l’identificazione, viene eseguita la pesatura: questa identificazione e la registrazione degli animali sono parte integrante del periodo preoperatorio. Dopo la pesatura, questo animale deve essere identificato con il suo numero e il peso corrispondente.
- Per i farmaci preanestenitici, l’acepromazina 1 mg.kg-1 e la ketamina 15 mg.kg-1 vengono utilizzate circa quindici-venti minuti prima dell’inizio della trichotomia.
- La trichotomia viene eseguita nella regione anteriore del collo, dell’addome e del margine dell’orecchio.
- L’immobilizzazione viene eseguita sul tavolo operatorio a tutti:00.
- La cateterizzazione venosa viene eseguita nella vena marginale dell’orecchio, con un catetere a 24 G. Successivamente, viene eseguita l’installazione endovenosa di soluzione salina 0,9% 250 ml.
- Per l’anestesia la ketamina da 5 a 10 mg.kg-1 in dosi sequenziali, se necessario. La maschera laringea numero 1 viene utilizzata per la ventilazione. In determinate situazioni (interventi toracici) viene eseguita l’intubazione tracheale con cannula numero 2 o 3 o tracheostomia.
- Il monitoraggio viene eseguito con uno stetoscopio precordiale (o, se possibile, esofageo), un’ossimametria a impulsi (se disponibile) ed elettrocardioscopia (se disponibile).
- Per l’anestesia inalatoria utilizzata per la manutenzione, l’isoflurane è costituito dall’1% al 3% di isoflurane e ossigeno da due a tre litri al minuto sotto maschera nel sistema Mapleson D.
- I segni vitali vengono notati ogni 5-10 minuti per la preparazione della forma di anestesia.
- Durante il periodo post-anestetico, i dati vengono notati dall’inizio del recupero fino al ripristino della coscienza e i modelli fisiologici sono all’interno dell’intervallo normale.
- Per il controllo postoperatorio del dolore, il paracetamolo orale viene utilizzato tra 10 e 15 mg.kg-1, tre volte al giorno, avendo il dipirone qui come alternativa.
- Se il protocollo di studio prevede l’eutanasia può essere eseguito in una camera di inalazione di CO2 con 10 l.min-1 per 10 minuti. La seconda scelta può essere il cloruro di potassio al 19,1 % 1 ml.kg-1 venoso, ma con l’animale sedato con ketamina da 1 a 10 mg mg.kg-1 venoso o sottocutaneo da quindici a venti minuti prima del cloruro di potassio (BEDIN et.al., 2013).
RELAZIONE SUL CASO
Le anestesie che fanno parte di questa serie sono state autorizzate dal Comitato Etico per la Ricerca sull’Uso Animale della Regione dell’Università di Joinville (CEUA) numero 0103/2018.
Otto conigli neozelandesi sottoposti a laparotomie che dimostrano la disciplina della tecnica operativa del corso medico locale (tabella 1).
Tabella 1. Demografia.

Per i farmaci preanestenitici, l’acepromazina 1 mg.kg-1 è stata utilizzata con chetamina 15 mg.kg-1 per via sottocutanea (tabella 2).
Tabella 2. Farmaci preanestentici e intraoperatori.
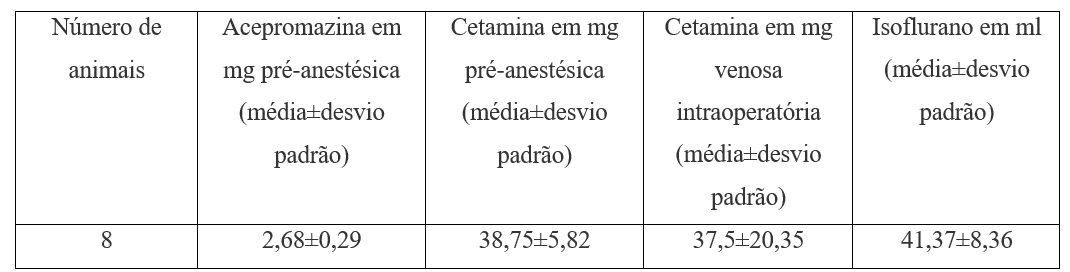
Per il mantenimento dell’anestesia, l’isoflurane e l’ossigeno sono stati utilizzati nel vaporizzatore non calibrato dopo il passaggio della maschera laringea numero 1 e del sistema di anestesia per inalazione di acero D sotto respirazione spontanea sempre. L’idratazione era con soluzione salina 10 ml.kg-1 (tabella 2). È stato utilizzato un materasso termico. Per il monitoraggio sono stati utilizzati uno stetoscopio precordiale, un’ossimametria cardiaca e parametri clinici (movimenti involontari, riflesso oculopalpebrale). Per l’eutanasia, 10 mg.kg-1 ketamina sono seguiti da 5 a 15 minuti dopo l’uso del cloruro di potassio 19,1% 1 ml.kg-1, anche per via endovenosa (tabella 3).
Tabella 3. Farmaci per l’eutanasia.

DISCUSSIONE
L’isoflurane è spesso usato come agente singolo o associato agli oppioidi per le procedure anestetiche nei conigli (BAILEY et.al., 2017; TEARNEY et.al.,2015). La somministrazione di fentanil nei conigli anestetizzati con isoflurane ha portato a una migliore pressione sanguigna media e alla produzione cardiaca, rispetto alla sola isoflurana (BAILEY e et.al., 2017; TEARNEY et.al., 2015). L’acetazina (principale tranquillante) e la ketamina (anestetico dissociativo) sono farmaci frequentemente usati come farmaci preanesteni e anestetici per i conigli1,8,9. Sia l’acepromazina che la ketamina riducono il consumo di isoflurane come principale anestetico nei conigli (BEDIN et.al., 2013; BOTMAN et.al., 2019; ECKLEY et.al., 2020).
CONCLUSIONE
Nelle anestesie a lungo termine, come le laparotomie, si raccomanda e l’uso di farmaci preanestenitici e successivamente l’induzione anestetica fatta dalla combinazione di agenti (ECKLEY et.al., 2020). Tuttavia, la gestione anestetica richiede un monitoraggio per evitare che si verifichino dosi insufficienti o esagerate. Per evitare che si verificano variazioni, si raccomanda di monitorare i segni vitali fin dall’inizio della gestione degli animali sottoposti ad anestesia inalatoria e l’intero periodo durante il quale l’anestesia viene mantenuta fino all’eutanasia (BEDIN et.al., 2013).
RIFERIMENTI
ATALAN, Güneri e colab. Comparison of systemic effects of midazolam, ketamine, and isoflurane anaesthesia in rabbits. Journal of Veterinary Research (Poland), v. 63, n. 2, p. 275–283, 2019.
BAILEY, Ryan S. e BARTER, Linda S. e PYPENDOP, Bruno H. Pharmacokinetics of dexmedetomidine in isoflurane-anesthetized New Zealand White rabbits. Veterinary Anaesthesia and Analgesia, v. 44, n. 4, p. 876–882, 1 Jul 2017.
BEDIN, Antonio e JUNIOR, Harry e KRELING, Patricia. Anestesia para cirurgia experimental em coelhos. v. 42, n. 2, p. 33–37, 2013.
BOTMAN, Julie e colab. Postanaesthetic effects of ketamine-midazolam and ketamine-medetomidine on gastrointestinal transit time in rabbits anaesthetised with isoflurane. Veterinary Record, 2019.
ECKLEY, Samantha S e colab. Acepromazine and Chlorpromazine as Pharmaceutical-grade Alternatives to Chlorprothixene for Pupillary Light Reflex Imaging in Mice. Journal of the American Association for Laboratory Animal Science : JAALAS, 8 Jan 2020. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/31915106>. Acesso em: 10 fev 2020.
RAILLARD, Mathieu e colab. Anaesthetic and perioperative management of 14 male new zealand white rabbits for calvarial bone surgery. Animals, v. 9, n. 11, 1 Nov 2019.
TEARNEY, Caitlin C. e BARTER, Linda S. e PYPENDOP, Bruno H. Cardiovascular effects of equipotent doses of isoflurane alone and isoflurane plus fentanyl in New Zealand white rabbits (Oryctolagus cuniculus). American Journal of Veterinary Research, v. 76, n. 7, p. 591–598, 6 Jul 2015.
THOMPSON, Krista L. e MEIER, Thomas R. e SCHOLZ, Jodi A. Endotracheal intubation of rabbits using a polypropylene guide catheter. Journal of Visualized Experiments, v. 2017, n. 129, 13 Nov 2017.
TUNCALI, Bahattin e colab. Retrospective Evaluation of Patients who Underwent Laparoscopic Bariatric Surgery. Turkish Journal of Anesthesia and Reanimation, v. 46, n. 4, p. 297–304, 16 Ago 2018. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/30140537>. Acesso em: 29 set 2019.
[1] Laurearsi in medicina.
[2] Laureato in medicina.
[3] Anestesista. Maestro della Salute. Dottore in Anestesiologia.
Inviato: Aprile, 2020.
Approvato: giugno 2020.