REVISÃO INTEGRATIVA
MOREIRA, Raíssa Martins [1], ZARIFE, Mariana Maluf Moreno [2], FIALHO, Maria Eduarda Duarte [3], NICÁCIO, Tatiana Federici [4], ALONSO, Thiago Dutra [5], PEREIRA, André Luís Campos Louredo [6]
MOREIRA, Raíssa Martins. et al. Como mecanismos imunológicos influenciam no desenvolvimento da diabetes mellitus tipo 1: uma revisão integrativa. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano. 08, Ed. 09, Vol. 02, pp. 99-112. Setembro de 2023. ISSN: 2448-0959, Link de acesso: https://www.nucleodoconhecimento.com.br/saude/mecanismos-imunologicos, DOI: 10.32749/nucleodoconhecimento.com.br/saude/mecanismos-imunologicos
RESUMO
Introdução: Na Diabetes Mellitus Tipo 1 (DM1) ocorre uma destruição maciça das células beta do pâncreas, produtoras de insulina, acarretando redução desse hormônio. Assim, é necessária administração exógena de insulina para controle diário da glicemia. No entanto, o controle é difícil, predispondo os pacientes acometidos pela doença a problemas na saúde pelo descontrole glicêmico. Por isso é de grande importância o estudo dos mecanismos imunológicos envolvidos na patogênese dessa doença. Objetivo: Evidenciar os mecanismos imunológicos envolvidos na patogênese da DM1. Método: Trata-se de uma revisão integrativa, em que os estudos foram buscados nas bases de dados PubMed e Scielo pelos descritores. Após a seleção, tais estudos foram avaliados e submetidos aos critérios de exclusão pelos pesquisadores, restando 20 artigos para a realização do estudo. Resultados: Os locus do MHC II são os mais correlacionados com o desenvolvimento de DM1. Os locus estudados que apresentam correlação com a doença são DP, DQ e DR, responsáveis por expressar a proteína da membrana. Pacientes com genótipos específicos presentam maior chance de desenvolvimento da doença. Essas alterações genéticas podem ser de origem hereditária, sendo mais relacionadas com irmão e pai afetados do que com mãe afetada. Além disso, Células Treg e células TCD8+ fazem parte do fator imunológico que exerce influência sobre o desenvolvimento da DM1, porque há uma modificação das funções dessas células, criando um fator autoimune. Há uma certa limitação em relação a esses estudos, já que não se pode afirmar nada de maneira assertiva, uma vez que os mecanismos genéticos e imunológicos, abordando os biomarcadores, ainda não são muito elucidados. Conclusão: Há fatores imunológicos genéticos e celulares envolvidos no desenvolvimento de DM1. Entretanto, são necessários estudos mais aprofundados para compreender como essas ferramentas poderiam ser utilizadas no rastreio e mapeamento dos pacientes com predisposição a DM1.
Palavras-chave: Diabetes mellitus tipo 1, Doenças do Sistema Imunitário, Mecanismos imunológicos.
1. INTRODUÇÃO
A diabetes mellitus tipo 1A (DM1) é caracterizada pela destruição de células β do pâncreas, responsáveis pela produção de insulina, hormônio mediador da entrada de glicose nas células (SUGAHARA; TANAKA; NANGAKU, 2020). Essa doença desenvolve-se geralmente em crianças ou adolescentes, sendo comum aparecer até os 15 anos de idade. Ademais, a incidência da doença aumentou em crianças menores de 15 anos de 1978 até 2015 (LUDVIGSSON, 2017), sendo a doença crônica mais prevalente na infância (PACAUD et al., 2020).
Essa doença é causada por fatores autoimunes em que células TCD8+ citotóxicas apresentam algum erro e então manifestam especificidade para autoantígenos de células β. Dessa forma, essas células imunes são encontradas nas ilhotas pancreáticas destruindo as células secretoras de insulina (YEO et al., 2018).
Além disso, as células T reguladoras (Tregs) de crianças com DM1 de início recente têm uma assinatura do gene Treg (TGS) alterada, sugerindo ser um biomarcador imunoregulador (PESENACKER et al., 2019). No entanto, o mecanismo exato pelo qual esses processos ocorrem não é elucidado, sabendo-se apenas que o desenvolvimento de DM1 envolve uma complexa interação entre fatores genéticos e fatores ambientais, que podem ser gatilhos para o aparecimento da doença (HARIS et al., 2021).
Nesse contexto, ocorre uma redução na produção de insulina, sendo necessário administração do hormônio para controle da glicemia. No entanto, esse equilíbrio exógeno é complexo e afetado por diversos fatores, acarretando amplas variações glicêmicas na maioria dos pacientes afetados pela doença (HEROLD et al., 2019). Esse descontrole desencadeia uma série de complicações no organismo.
No curto prazo, a hipoglicemia severa pode ser letal e, no longo prazo, a hiperglicemia prolongada pode ter desfechos como retinopatia, neuropatia, doença cardiovascular e insuficiência renal (DONG et al., 2021). Assim, pelas complicações causadas e pelo transtorno causado pelo controle da alimentação e glicemia, a DM1 afeta a vida social e ocupacional dos indivíduos acometidos, e acarreta custos diretos aos portadores e aos sistemas de saúde (MALTA et al.,2019).
Portanto, tendo em vista a relevância da doença no contexto médico e social, é necessário compreender os mecanismos imunológicos e metabólicos da DM1, para o avanço da detecção precoce da doença e melhora na qualidade de vida dos diabéticos.
2. OBJETIVO
Sintetizar, por meio da revisão integrativa, os mecanismos imunológicos envolvidos na fisiopatologia do desenvolvimento da DM1 por meio da incorporação de resultados de estudos significativos.
3. MÉTODO
Trata-se de uma revisão integrativa, com um protocolo de busca elaborado em seis etapas (WHITTEMORE; KNAFL, 2005): 1. elaboração da pergunta de busca e objetivos; 2. determinação das bases de dados para a busca dos estudos e dos critérios de inclusão e exclusão; 3. definição e extração dos dados da amostra de publicações selecionadas; 4. avaliação da amostra de estudos selecionados; 5. análise e discussão dos resultados; 6. apresentação da revisão ou síntese das evidências encontradas.
Para formulação da questão norteadora da busca, utilizou-se a estratégia PICo, acrônimo de População, Interesse e Contexto (SANTOS; PIMENTA; NOBRE, 2007). No caso do estudo realizado, a análise foi feita com base nos seguintes parâmetros: P – pacientes com DM 1, I – variações genéticas na expressão do sistema imunológico, Co: em comparação com paciente que não apresentam variações. A questão norteadora da revisão foi: Os pacientes que têm variações no sistema imunológico em comparação com aqueles sem essas alterações correm mais risco de apresentarem diabetes mellitus tipo 1?
Estratégia de busca:
Para estruturar as estratégias de buscas foi realizado uma pesquisa inicial na base de dados Medical Literature Analysis and Retrieval System Online (MEDLINE), via National Library of Medicine (PubMed), para verificar os descritores controlados e sinônimos, incluindo palavras-chave identificados em estudos com temáticas semelhantes a questão de revisão. Os descritores controlados foram selecionados nos Descritores em Ciências da Saúde (DeCS). Para localizar o máximo de publicações que respondessem aos objetivos desta revisão foram incluídas palavras chaves nas estratégias de buscas, sendo essas “(Diabetes Mellitus, Type 1) AND ((Genes, MHC Class II) OR (Genes, MHC Class II))”, “(Diabetes Mellitus, Type 1) AND (T-Lymphocytes)”, “(Diabetes Mellitus, Type 1) AND (Immunology)” AND “(Diabetes Mellitus, Type 1) AND (Epidemiology)”.
A busca foi realizada por meio das bases de dados selecionadas, sendo essas: Medical Literature Analysis and Retrieval System Online (MEDLINE) via National Library of Medicine (PubMed), Literatura Latino-Americana e do Caribe em Ciências da Saúde (LILACS) e banco de dados Scielo.
Na sequência é apresentado no Quadro 1 as estratégias de buscas e o número da amostra identificado nas bases de dados, respectivamente, para a presente revisão.
Figura 1 – Fluxograma do processo de seleção dos estudos primários incluídos na revisão na revisão integrativa de acordo com o Preferred Reported Items for Systematic Review Meta-Analysis (PRISMA). Belo Horizonte, MG, Brasil, 2023
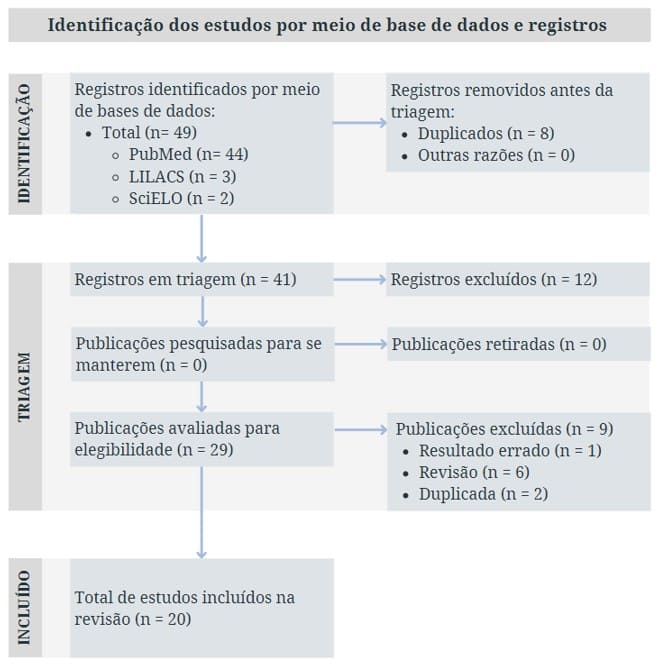
Após a seleção dos artigos para a realização do estudo restaram textos entre os níveis de evidência 1.b (Revisão sistemática de ensaios clínicos randomizados, controlados e outros tipos de estudos) a 3.d (Estudo caso-controle). Esses níveis de evidência foram classificados de acordo com a tabela do Anexo 1. A maior parte dos estudos utilizados para a realização dessa revisão foram do tipo observacional.
4. RESULTADOS
Tabela 1: Resultados dos estudos utilizados para a revisão
| AUTORES/ ANO | TÍTULO | OBJETIVO DO ESTUDO | RESULTADOS |
| Ana M Valdes (2013) | Receiver operating characteristic analysis of HLA, CTLA4, and insulin genotypes for type 1 diabetes | Avaliar a capacidade de distinguir entre indivíduos afetados por DM1 e seus parentes não afetados usando genótipos HLA e polimorfismo de nucleotídeo único (SNP). | Informações genotípicas, principalmente dos alelos HLA-DRB1-DQB1, DPB1, HLA-A e HLA-B apresentam grande diferença entre os pacientes DM1 e seus irmãos. Esse dado pode ser relevante para identificação de pacientes com predisposição a DM1 em combinação com valores glicose e peptídeo C. |
| Anne M Pesenacker (2019) | Treg gene signatures predict and measure type 1 diabetes trajectory | Analisar estratégias terapêuticas para restaurar a regulação imunológica e retardar a progressão do DM1; definir biomarcadores para identificar prospectivamente indivíduos que possam se beneficiar da imunoterapia e/ou medir os efeitos da intervenção. | Biomarcadores baseados na medição de TGSs (genes Tregs) podem ser uma nova abordagem para estratificar pacientes e monitorar a atividade autoimune em DM1. Esses dados sugerem que o TGS pode detectar alterações mediadas por ustequinumabe na expressão do gene Treg-intrínseco e no equilíbrio entre Tregs e Tconvs na imunoterapia. |
| Danièle Pacaud (2020) | Association between family history, early growth and the risk of beta cell autoimmunity in children at risk for type 1 diabetes | Demonstrar a relação entre história familiar de DM1 e o desenvolvimento de múltiplos autoanticorpos de células beta em crianças com parentes de primeiro grau com DM1 e susceptibilidade conferida por HLA. | O risco de desenvolver múltiplos autoanticorpos foi menor em crianças com mães com DM1 em comparação com aquelas com um pai afetado ou um irmão afetado.
Nos resultados do estudo foi constatado que a autoimunidade foi desenvolvida em 13% das crianças com mãe afetada, 16% com pai afetado e 18% com irmão acometidos pela DM1. |
| Ezio Bonifacio (2018) | Genetic scores to stratify risk of developing multiple islet autoantibodies and type 1 diabetes: A prospective study in children | Atestar a capacidade de um escore de risco genético (GRS) de DM1 de prever a progressão da autoimunidade das ilhotas e DM1 em indivíduos em risco. | O risco de desenvolver DM1 pré-sintomático e DM1 foi determinado a partir dos genótipos de risco: HLA DR3/DR4-DQ8 ou DR4-DQ8/DR4-DQ8. Os alelos do MHC II heterozigotos adicionavam pontuação de 3,98 pontos enquanto os homozigotos de 3,15.
Ademais, foram investigados outros 41 SNPs, que adicionavam em média um escore de 0,21 cada um. Foi constatado, então, que o risco de desenvolvimento de DM1 aumentou conforme o aumento do escore. |
| Lorraine Yeo (2018) | Autoreactive T effector memory differentiation mirrors β cell function in type 1 diabetes | Avaliar a presença de células TCD8+ citotóxicas com especificidade para autoantígenos de células β encontradas nas ilhotas pancreáticas, que implicam na destruição de células β secretoras de insulina e o desenvolvimento de DM1. | Células TCD8+ são encontradas nas ilhotas pancreáticas, implicando na destruição de células β secretoras de insulina. No entanto, nos primeiros 6 meses da doença ainda existe uma produção residual de insulina com liberação de peptídeo C. Essa proteína aumenta a citotoxidade das células TCD8+ e estimula a proliferação de células TCD57+. Essas células matam as células β que fazem a secreção residual, acabando com a fase de lua de mel da DM1. |
| Maria J Redondo (2018) | A type 1 diabetes risk genetic score predicts progression of islet autoimumunity and development of type 1 diabetes in individuals at risk | Testar a capacidade de um escore de risco genético (GRS) DM1 para prever a progressão da autoimunidade das ilhotas e DM1 em indivíduos em risco. | A predição de risco para DM1 foi efetiva por um modelo combinado do genetic risk score (GRS), número de autoanticorpos positivos, pontuação de risco DM1 e idade.
Foi comprovada a proporcionalidade entre o escore de risco genético e o posterior desenvolvimento de DM1 nos pacientes estudados. Foram analisados 6 genes relacionados à expressão do MHC tipo II e 2 genes relacionados ao MHC tipo 1. Ademais, mais 25 genes ligados a outras proteínas foram analisados. |
| Rajashree Mishra (2019) | Genetic discrimination between LADA and childhood-onset type 1 diabetes within the MHC | Evidenciar as associações de regiões no MHC (Complexo principal de histocompatibilidade) classe I e MHC classe II e o risco de desenvolvimento de diabetes latente em adultos (LADA). | A análise de pacientes LADA versus indivíduos controle mostrou associação significativa na região MHC classe II, no entanto, não foram observados efeitos independentes significativos dos alelos do MHC classe I no risco de desenvolvimento de DM1 LADA. |
| Tyyne Viisanen (2019) | FOXP3 regulatory T cell compartment is altered in children with newly diagnosed type 1 diabetes but not in atoantibody-positive at risk children
|
Comprovar o papel da disfunção das células Treg+ para FOXP3 na patogênese de doenças autoimunes como DM1. | A frequência de Tregs Naive FOXP3+ e CD4+CD25+CD127lowCD45RA+ é aumentada em crianças com DM1 recentemente diagnosticada. Também há um aumento da frequência de células T reguladoras e efetoras do tipo CCR6-CXCR3+ Th1, bem como os níveis plasmáticos de CXCL10. Ademais, há um aumento de células Treg de memória FOXP3lo. Já Tregs de memória produtoras de IFN-γ é diminuída em crianças com DM1.
O aumento de Naive Tregs está associado à progressão para DM1 clínica, mas não ao número de autoanticorpos na apresentação da doença. |
Fonte: Elaborado pelos autores, 2022.
5. DISCUSSÃO
A DM1 é uma doença autoimune com mecanismos que ainda não foram completamente elucidados. Nesta revisão, foram estudados 8 artigos relacionados à patogênese da DM1, visando esclarecer a influência dos genes responsáveis pelo complexo principal de histocompatibilidade (MHC) e variações de linfócitos T.
5.1 MHC
Em relação ao MHC, foram selecionados artigos relacionando genes de maior chance de aparecimento da doença, sendo considerado o fator genético mais importante no desenvolvimento de DM1. Atualmente, foram identificados cerca de 60 diferentes locus relacionados ao desenvolvimento de DM1. Os locus relacionados ao MHC II apresentam maior correlação com a doença, demonstrando maior valor nos escores genéticos utilizados pelos estudos (SAVASTIO et al., 2020). Assim, nos artigos analisados, as correlações comprovadas foram referentes ao MHC tipo II, sendo genes de MHC tipo I apresentando baixa relação.
Dessa forma, os locus do MHC tipo II estudados são os DP, DQ e DR, que são os responsáveis pela expressão da proteína de membrana. Comparando os estudos, os genes mais relacionados à DM1 são DRB1-DQB1, DPB1, DR3/DR4-DQ8, DR4-DQ8/DR4-DQ8, DR3/DR3, DR4-DQ8/X, DR3/X, DRB11. Assim, pacientes com estes genótipos apresentam risco aumentado para desenvolvimento da doença (VALDES et al., 2013), (BONIFACIO et al., 2018).
Ademais, foram encontradas fracas ligações do MHC I com a patologia. Os genes relacionados são A24, B5701, mas nos escores genéticos tais locus apresentam um peso estatístico muito menor em comparação ao MHC classe II, sendo então menos impactantes no desenvolvimento da doença (VALDES et al., 2013), (BONIFACIO et al., 2018). Sua associação é mais relacionada à regulação positiva que ocorre na patogênese da doença, que tem o potencial de aumentar as interações entre células TCD8+ e células β, influenciando na lesão patológica da DM1 (WAGNER, 2017).
Dessa forma, o complexo principal de histocompatibilidade foi conectado diretamente à predisposição de DM1. Além disso, com base nos resultados dos estudos, compreende-se que essas variações genéticas podem ser de origem hereditária, tendo maior relação com irmãos ou pai afetados e menor com mãe afetada (PACAUD et al., 2020).
5.2 CÉLULAS Treg
Em um indivíduo sadio, as células Treg são responsáveis pela tolerância periférica dos linfócitos para o autoantígeno, evitando a reatividade dos linfócitos às células do próprio corpo (LONG et al., 2017). O que ocorre na patogênese da DM1 é a modificação dessa função, fazendo com que essas células se tornem reagentes ao próprio antígeno.
Sabe-se que as células Treg que expressam os autoantígenos CD4+CD25+FoxP3+ representam um fator predisponente para o DM1 (SAVASTIO et al., 2020). Nos estudos revisados, foram encontrados dados que complementam essa informação.
Em relação às células Treg naives, foi encontrada a existência de biomarcadores, como FOXP3+, CD4+CD25+CD127lowCD45RA+ e CXCL10, indicando a maior probabilidade de falha na regulação da resposta imune (CREUSOT; POSTIGO-FERNANDEZ; TETELOSHVILI, 2018). Porém, a presença desses biomarcadores está associada à progressão da doença, mas não propriamente ao aumento do número de autoanticorpos.
Já em relação às células Treg de memória, como células FOXP3lo, foram encontrados valores aumentados em pacientes DM1, enquanto as produtoras de IFN- γ são diminuídas nos pacientes com essa doença (VIISANEN et al., 2019). Esses fatores são relacionados a polimorfismos em genes envolvidos no desenvolvimento e função do FOXP31 e outros marcadores células T reguladoras (Tregs) (LIU et al., 2022). Dessa forma, pacientes com esses biomarcadores alterados apresentam maior predisposição para desenvolver autoimunidade e, consequentemente, DM1 (VIISANEN et al., 2019), (PESENACKER et al., 2019).
5.3 CÉLULAS TCD8+
Os linfócitos TCD8+, em indivíduos sadios, são responsáveis por induzir a morte de células infectadas por meio de mecanismos citotóxicos. No contexto do paciente com DM1, a família de células alterada é a TCD8+TCD57+, que são entendidas como células com capacidade de se proliferar reduzida, mas elevada citotoxicidade.
Essas células têm papel ativo no processo de destruição das células beta do pâncreas, responsáveis efetivamente pelo desenvolvimento da doença (YEO et al., 2018), sendo reativas contra epítopos do polipeptídio amiloide das ilhotas pancreáticas (IAPP) e o gene da proteína potenciadora da insulina (ISL1) (RODRIGUEZ-CALVO et al., 2021).
6. CONCLUSÃO
Levando em conta o que foi apresentado ao longo do estudo, é perceptível que diversos mecanismos imunológicos estão envolvidos na patogênese da DM1. O MHC classe II apresentou-se muito correlacionado com o desenvolvimento da doença, sendo alguns locus gênicos mais predisponentes. Além disso, os fatores genéticos que predispõem a manifestação patológica das células Treg e TCD8+ são outro meio de possível intervenção clínica.
Essas correlações ainda devem ser mais estudadas e seus esclarecimentos são de extrema valia para a prática clínica, uma vez que auxiliariam a estratificar o risco de os pacientes desenvolverem a doença por meio de biomarcadores. Dessa forma, é relevante que pesquisas sejam realizadas para atualizar e ampliar os conhecimentos sobre o tema, dando enfoque nos mecanismos falhos do sistema imunológico e possíveis pontos de intervenção clínica.
REFERÊNCIAS
BONIFACIO, E. et al. Genetic scores to stratify risk of developing multiple islet autoantibodies and type 1 diabetes: A prospective study in children. PLoS medicine, v. 15, n. 4, p. e1002548, 1 abr. 2018.
CREUSOT, R. J.; POSTIGO-FERNANDEZ, J.; TETELOSHVILI, N. Altered Function of Antigen-Presenting Cells in Type 1 Diabetes: A Challenge for Antigen-Specific Immunotherapy? Diabetes, v. 67, n. 8, p. 1481–1494, 20 jul. 2018.
DONG, S. et al. The effect of low-dose IL-2 and Treg adoptive cell therapy in patients with type 1 diabetes. JCI Insight, v. 6, n. 18, 22 set. 2021.
HARIS, B. et al. Clinical features, epidemiology, autoantibody status, HLA haplotypes and genetic mechanisms of type 1 diabetes mellitus among children in Qatar. Scientific Reports, v. 11, p. 18887, 23 set. 2021.
HEROLD, K. C. et al. An Anti-CD3 Antibody, Teplizumab, in Relatives at Risk for Type 1 Diabetes. New England Journal of Medicine, v. 381, n. 7, p. 603–613, 15 ago. 2019.
LIU, Y.-F. et al. Immune and Metabolic Effects of Antigen-Specific Immunotherapy Using Multiple β-Cell Peptides in Type 1 Diabetes. Diabetes, v. 71, n. 4, p. 722–732, 24 jan. 2022.
LONG, S. A. et al. Remodeling T cell compartments during anti-CD3 immunotherapy of type 1 diabetes. Cellular Immunology, v. 319, p. 3–9, set. 2017.
LUDVIGSSON, J. Increasing Incidence but Decreasing Awareness of Type 1 Diabetes in Sweden. Diabetes Care, v. 40, n. 10, p. e143–e144, 7 ago. 2017.
MALTA, D. C. et al. Prevalência de diabetes mellitus determinada pela hemoglobina glicada na população adulta brasileira, Pesquisa Nacional de Saúde. Revista Brasileira de Epidemiologia, v. 22, n. suppl 2, 2019.
MISHRA, R. et al. Genetic Discrimination Between LADA and Childhood-Onset Type 1 Diabetes Within the MHC. Diabetes Care, v. 43, n. 2, p. 418–425, 16 dez. 2019.
PACAUD, D. et al. Association between family history, early growth and the risk of beta cell autoimmunity in children at risk for type 1 diabetes. Diabetologia, v. 64, n. 1, p. 119–128, 7 out. 2020.
PAGE, M. J. et al. The PRISMA 2020 statement: An updated guideline for reporting systematic reviews. British Medical Journal, v. 372, n. 71, 29 mar. 2021.
PESENACKER, A. M. et al. Treg gene signatures predict and measure type 1 diabetes trajectory. JCI Insight, 7 fev. 2019.
PETERS, M. D. J. et al. Guidance for conducting systematic scoping reviews. International Journal of Evidence-based Healthcare , v. 13, n. 3, p. 141–146, 1 set. 2015.
REDONDO, M. J. et al. A Type 1 Diabetes Genetic Risk Score Predicts Progression of Islet Autoimmunity and Development of Type 1 Diabetes in Individuals at Risk. Diabetes Care, v. 41, n. 9, p. 1887–1894, 12 jul. 2018.
RODRIGUEZ-CALVO, T. et al. Neoepitopes in Type 1 Diabetes: Etiological Insights, Biomarkers and Therapeutic Targets. Frontiers in Immunology, v. 12, 19 abr. 2021.
SANTOS, C. M. C.; PIMENTA, C. A. M.; NOBRE, M. R. C. The PICO strategy for the research question construction and evidence search. Revista Latino-Americana de Enfermagem, v. 15, n. 3, p. 508–511, jun. 2007.
SAVASTIO, S. et al. Vitamin D Supplementation Modulates ICOS+ and ICOS− Regulatory T Cell in Siblings of Children With Type 1 Diabetes. The Journal of Clinical Endocrinology & Metabolism, v. 105, n. 12, p. e4767–e4777, 26 ago. 2020.
SUGAHARA, M.; TANAKA, T.; NANGAKU, M. Modulating the immune system to delay the clinical onset of type 1 diabetes. Kidney International, v. 97, n. 2, p. 248–250, fev. 2020.
VALDES, A. M. et al. Receiver Operating Characteristic Analysis of HLA, CTLA4, and Insulin Genotypes for Type 1 Diabetes. Diabetes Care, v. 36, n. 9, p. 2504–2507, 29 abr. 2013.
VIISANEN, T. et al. FOXP3+ Regulatory T Cell Compartment Is Altered in Children With Newly Diagnosed Type 1 Diabetes but Not in Autoantibody-Positive at-Risk Children. Frontiers in Immunology, v. 10, 22 jan. 2019.
WAGNER, D. H. Overlooked Mechanisms in Type 1 Diabetes Etiology: How Unique Costimulatory Molecules Contribute to Diabetogenesis. Frontiers in Endocrinology, v. 8, 23 ago. 2017.
WHITTEMORE, R.; KNAFL, K. The integrative review: updated methodology. Journal of Advanced Nursing, v. 52, n. 5, p. 546–553, dez. 2005.
YEO, L. et al. Autoreactive T effector memory differentiation mirrors β cell function in type 1 diabetes. The Journal of Clinical Investigation, v. 128, n. 8, p. 3460–3474, 1 ago. 2018.
ANEXOS
Anexo 1
| Níveis | Tipos de Pesquisas/Desenhos | ID | Subtipos de Pesquisas/Desenhos |
| Nível 1 | Experimentais | 1.a | Revisão sistemática de ensaios randomizados controlados |
| 1.b | Revisão sistemática de ensaios randomizados, controlados e outros desenhos de estudo | ||
| 1.c | Ensaio controlado randomizado | ||
| 1.d | Pseudoensaios controlados, randomizados | ||
| Nível 2
|
Quase-experimentos | 2.a | Revisão sistemática de estudos quase-experimentais |
| 2.b | Revisão sistemática de quase-experimento e outros desenhos de estudo de menor evidência | ||
| 2.c | Estudos prospectivamente controlados de quase-experimentos | ||
| 2.d | Pré-teste e pós-teste ou estudos de grupos controlados históricos retrospectivos | ||
| Nível 3 | Observacional (Analíticos) | 3.a | Revisão sistemática de estudos de coortes comparáveis |
| 3.b | Revisão sistemática de coortes comparáveis e outros desenhos de estudo de menor evidência | ||
| 3.c | Estudo de coorte com grupo-controle | ||
| 3.d | Estudo de caso-controle | ||
| 3.e | Estudos observacionais sem um grupo-controle | ||
| Nível 4 | Observacional (Descritivos) | 4.a | Revisão sistemática de estudos descritivos |
| 4.b | Estudo transversal | ||
| 4.c | Séries de casos | ||
| 4.d | Estudo de caso | ||
| Nível 5 | Opinião de especialistas (Pesquisas de bancada em laboratório) | 5.a | Revisão sistemática de opinião de especialistas |
| 5.b | Consenso de especialistas | ||
| 5.c | Pesquisa de bancada de laboratório/opinião de um especialista |
Fonte: Peters, 2015 (adaptada).
[1] Graduanda em Medicina. ORCID: 0009-0003-5284-6382. Currículo Lattes: http://lattes.cnpq.br/9482226005270788.
[2] Graduanda em Medicina. ORCID: 0009-0001-2944-4188. Currículo Lattes: http://lattes.cnpq.br/7630063337092876.
[3] Graduanda em Medicina. ORCID: 0009-0000-7867-1558. Currículo Lattes: https://lattes.cnpq.br/3906707803206962.
[4] Graduanda em Medicina. ORCID: 0009-0007-9054-0017. Currículo Lattes: https://lattes.cnpq.br/5609645823905400.
[5] Graduando em Medicina. ORCID: 0009-0000-2847-6738. Currículo Lattes: https://lattes.cnpq.br/8959563823753667.
[6] Orientador. ORCID: 0009-0008-2121-9518.
Enviado: 13 de março, 2023.
Aprovado: 04 de agosto, 2023.