ARTIGO DE REVISÃO
FRANCO, Larissa Barros Pinto [1], PINTO, Fernanda Neves [2], BENTO, Claudia Teresa [3]
FRANCO, Larissa Barros Pinto. PINTO, Fernanda Neves. BENTO, Claudia Teresa. Sensibilidade ao glúten e tireoidite de Hashimoto: uma interação viável. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano 06, Ed. 07, Vol. 06, pp. 110-149. Julho de 2021. ISSN: 2448-0959, Link de acesso: https://www.nucleodoconhecimento.com.br/nutricao/tireoidite-de-hashimoto, DOI: 10.32749/nucleodoconhecimento.com.br/nutricao/tireoidite-de-hashimoto
RESUMO
Nos últimos anos a prevalência de desordens relacionadas ao glúten vem aumentando exponencialmente, podendo alcançar até 10% da população mundial. Dentre as mais estudadas, que são a doença celíaca e a alergia ao trigo, tem-se observado notoriamente uma crescente manifestação conhecida como sensibilidade ao glúten não celíaco (Non-celiac gluten sensitivity – NCGS), que apesar de ter tido seus primeiros relatos na década de 80, ainda assim não está totalmente elucidada sobre suas condições clínicas e de diagnóstico. Com a ingestão de glúten, indivíduos com NCGS podem apresentar tanto sintomas gastrointestinais como também extraintestinais, repercutindo em possíveis agravos sistêmicos. Diante do crescente número de publicações a fim de melhor compreender a NCGS, foi encontrado certa relação sistêmica em doenças de caráter autoimune como no caso da tireoidite de Hashimoto, que antes era vista somente em associação com a doença celíaca e que agora, sendo presente também na NCGS, abre uma lacuna de questionamentos sobre a interação fisiopatológica entre essas duas doenças. Com o objetivo de constatar a associação entre a sensibilidade ao glúten não celíaco e a tireoidite de Hashimoto foi efetuada uma revisão bibliográfica por meio de consultas a bases de dados da Biblioteca Virtual de Saúde, Medline e Pubmed, além de pesquisas feitas no Scielo e Clinical Medicine and Research, levando em consideração artigos abordando apenas seres humanos e critérios clínicos que abordavam as duas manifestações. A partir dessa revisão pudemos constatar que a sensibilidade ao glúten não celíaco teria uma correlação promissora com a tireoidite de Hashimoto e que poderia sim influenciar negativamente na resposta tireoidiana, sendo necessário adaptações na dieta alimentar a fim de ter uma redução nos danos causados por essa associação.
Palavras-chave: glúten, desordens relacionadas ao glúten, sensibilidade ao glúten não celíaco, tireoidite, Hashimoto.
1. INTRODUÇÃO
O glúten, proteína presente no trigo, cevada, centeio, malte e aveia, é constituído por duas moléculas que diferem pela solubilidade em álcoois aquosos: as gliadinas solúveis e as gluteninas levemente solúveis. Quando ocorre alguma disfunção no organismo, ele sofre um processo inflamatório e passa a não digerir e absorver o glúten, refletindo na intolerância deste nutriente (SHEWRY et al., 2002; SILVA, 2015).
Processos fisiopatológicos relacionados à intolerância ao glúten são vistos frequentemente na doença celíaca (DC), síndrome da má absorção caracterizada por uma reação autoimune pela ação de células T e pelo autoantígeno transglutaminase 2; e na alergia ao trigo (AT), mediada pela imunoglobulina E (IgE), onde anticorpos interferem na resposta inflamatória a várias proteínas alergênicas – alfa-amilase/inibidor de tripsina, proteína não específica de transferência de lipídios (nsLTP), gliadinas e gluteninas. Além dessas etiologias, tem-se observado também outro distúrbio associado ao glúten, caracterizado como sensibilidade ao glúten não celíaco (HUSBY; MURRAY, 2015; DI SABATINO et al., 2016).
Na NCGS o quadro clínico é caracterizado por sintomas gastrointestinais e/ou extraintestinais que surgem após ingestão de glúten e depois rápida melhora com a sua retirada da dieta em pacientes não-DC/não-AT (ELLI et al., 2015; MOLINA-INFANTE; CARROCCIO, 2017). Essa doença possui peculiaridades que são desconhecidas, porém, mecanismos como a estimulação do sistema imune, os efeitos das citocinas e quimiocinas do glúten e a contribuição com outras moléculas de trigo, têm sido a chave para o aprofundamento da fisiopatologia em questão (CATASSI, 2015; DI SABATINO et al., 2016; FRANCAVILLA et al., 2018).
Sua prevalência ainda é questionável, já que até um tempo atrás era considerada como sinônimo da doença celíaca, mas, apesar da necessidade de critérios de diagnósticos mais claros, é bem provável que sua existência seja muito mais frequente que a DC (BROWN, 2012; CAPILI; CHANG; ANASTASI, 2014; KESSLER, 2015). Além disso, mesmo a NCGS sendo considerada uma manifestação imunomediada, tem se observado a existência de complicações sistêmicas, que por seletiva ativação oriunda da atividade da resposta imune inata, pode ocasionar gatilhos inflamatórios que corroboram para uma associação positiva com doenças autoimunes, que antes eram associadas preferivelmente com a doença celíaca (LOSURDO et al., 2018).
Dentre essas fisiopatologias autoimunes, podemos destacar um crescente destaque para a tireoidite de Hashimoto (Hashimoto thyroiditis – HT) que também representa uma disfunção imunológica em que se caracteriza pela elevação da secreção da glândula tireoidiana em resposta a produção de anticorpos anti-tiroperoxidase (anti-TPO) e atuação da resposta inflamatória pela produção de citocinas, prostaglandinas e produtos reativos de oxigênio, com consequente destruição parcial ou total da glândula da tireoide (ASSOCIAÇÃO AMERICANA DA TIREOIDE – ATA, 2017).
A relação da HT com a DC é significativamente percebida, já que umas das estratégias de tratamento dietético era o uso de uma dieta isenta de glúten com o objetivo de retardar a progressão da tireoidite e, por ambas serem autoimunes, indivíduos com DC tinham uma prevalência quatro vezes maior que a população em geral de apresentarem disfunções tireoidianas (MAINARDI, 2002; METSO et al, 2011; BAHARVAND; HORMOZI; AALIEHPOUR, 2020). Entretanto, estudos já têm evidenciado uma ascendência para sua correlação com a NCGS, evidenciando dessa forma, que a tireoidite de Hashimoto pode estar relacionada a um espectro geral de condições relacionadas ao glúten (LOSURDO et al., 2015).
Como se pode perceber, por muito tempo foram feitos diagnósticos de DC em que grande parte deles podem ter sido equivocados por falta de conhecimento na literatura científica sobre a existência da NCGS e, quando associado a disfunções tireoidianas como no caso da HT, seus achados são ainda mais escassos, o que nos leva a buscar por maiores informações de como indivíduos com sensibilidade ao glúten, sem diagnóstico aparente de DC, ainda podem ter complicações tireoidianas e também da necessidade de estratégias alimentares específicas.
Diante disso, neste trabalho foi realizado uma abordagem de correlação entre a sensibilidade ao glúten não celíaco e a tireoidite de Hashimoto, por possuírem aspectos clínicos relevantes quando associados e sendo de fundamental importância o seu conhecimento para auxiliar em possíveis tratamentos/controle de sinais e sintomas manifestados em ambas as doenças.
2. GLÚTEN
2.1 ASPECTOS DIETÉTICOS E COMPOSIÇÃO QUÍMICA
O glúten é uma proteína de caráter elástico, coeso e insolúvel tanto em água como em diluição de soluções salinas, amplamente encontrado para composição de produtos alimentícios, fármacos, bebidas industrializadas e produtos não comestíveis. É composto por duas moléculas fundamentais que se diferem pelo tipo de solubilidade: as prolaminas, também conhecidas como gliadinas, que são insolúveis em água e em soluções salinas e solúveis em álcool a 70%; e as gluteninas, parcialmente solúveis em soluções fluidas de ácido ou alcalino ou em detergentes (VAQUERO et al., 2015; SCIARINI; STEFFOLANI; LEON, 2016; ASSOCIAÇÃO DOS CELÍACOS DO BRASIL, 2017).
Além da classificação por solubilidade, também possui sistema de especificação chamado “prolaminas” para subdividir todas as proteínas do glúten; distribuição com base em sequências homólogas ou de sequências diferentes e por pesos moleculares semelhantes que são ordenados em três grupos distintos: grupo de alto peso molecular; grupo de médio peso molecular e grupo de baixo peso molecular (BALAKIREVA; ZAMYATNIN, 2016; SCHERF et al, 2016).
O cereal que possui quantidades expressivas de glutenina e de gliadina em quantidades consideráveis para formação do glúten é o trigo, totalizando 85% do seu valor proteico. Ainda assim, essas substâncias também são obtidas através de cereais como cevada, centeio e aveia, com suas respectivas nomenclaturas hordeína, secalina e avenina, as quais possuem características indispensáveis na qualidade sensorial, cinética, estrutural, de hidratação e de ação superficial na formulação de produtos (ARAÚJO et al, 2010; FASANO et al., 2015).
Quando indivíduos predispostos para intolerância ao glúten o introduzem na dieta, a partícula de gliadina, constituída de prolina e glutamina, se torna extremamente resistente a hidrólise pelas proteases presentes no epitélio gástrico e intestinal, culminando em uma reação imunológica no organismo que irá ativar uma cascata de estímulos de células T, aumento da permeabilidade intestinal, indução de apoptose e por fim refletindo em um grau de toxicidade que vai depender do tipo e da quantidade do cereal ingerido (SPAENIJ–DEKKING et al., 2005; BALAKIREVA; ZAMYATNIN, 2016; HENGGELER; VERÍSSIMO; RAMOS, 2017).
Segundo Vaquero et al. (2015), o transtorno causado pelo glúten pode acarretar a existência de três dispositivos que variam entre si pela fisiopatologia que os compõe, demonstrado na figura 1.
Figura 1.Principais transtornos relacionados ao glúten.
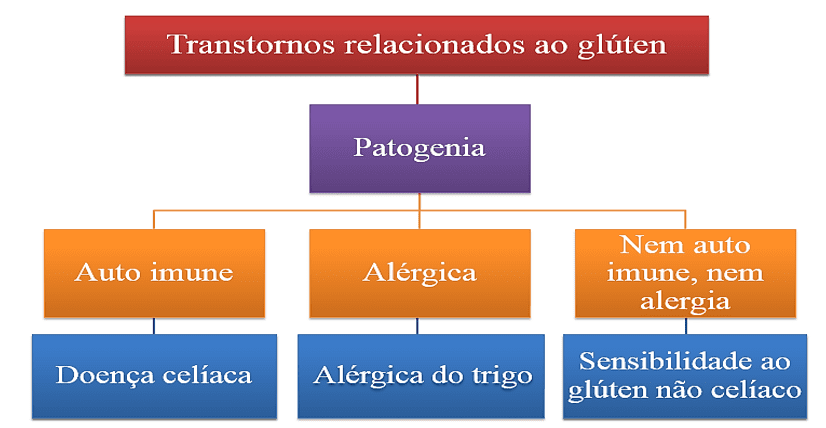
2.2 TRANSTORNOS RELACIONADOS AO GLÚTEN
2.2.1 DOENÇA CELÍACA
2.2.1.1 DEFINIÇÃO E CARACTERÍSTICAS
A doença celíaca permeia em uma enteropatia autoimune que induz um processo inflamatório em indivíduos suscetíveis geneticamente ou quando ocorre infecções no início da vida e/ou desequilíbrio da microbiota intestinal, atrelados ao grau de exposição ao glúten. Essa conformidade, além de se caracterizar por uma doença de base intestinal, acometendo principalmente o intestino delgado, pode provocar manifestações sistêmicas em outros órgãos (NYLUND; KAUKINEN; LINDFORS, 2016; WATKINS; ZAWAHIR; ORTIZ et al., 2017).
Quando a gliadina, um dos componentes do glúten, é absorvida no organismo em pacientes celíacos, incita resposta imune inata, tóxica e imediata, causando estresse oxidativo devido a formação de óxido nítrico e induzindo tanto em alterações nas células epiteliais, quanto enfraquecimento das junções apertadas. Esse processo oxidativo induz a liberação da interleucina 1 (IL1), citocina que corrobora para geração de apoptose celular com redução das microvilosidades, achatamento do epitélio intestinal, aumento da permeabilidade seletiva e consequente manifestação da resposta imune adaptativa (MAIURI et al. 2003; GUANDALINI; ASSIRI, 2014; NYLUND; KAUKINEN; LINDFORS, 2016).
A resposta imune adaptativa é a responsável por acionar os linfócitos T e os antígenos leucocitário humano (HLA) dos tipos DQ2 e DQ8, influenciando na produção elevada de macrófagos e das células dendríticas, que sofrem pela ativação da IL1 da resposta inata. Dessa forma, os linfócitos T da lâmina própria passam a identificar as frações de gliadina, gerando quantidades significativas de autoanticorpos altamente sensíveis e específicos contra a enzima humana chamada transglutaminase tissular 2 (TG2). Esse autoanticorpo estimula a liberação de citocinas pró-inflamatórias como interferon-gama (IFNγ), fator de necrose tumoral (TNFα), IL18, IL15, entre outros, e reduz a produção de citocinas anti-inflamatórias como IL10 e fator de transformação do crescimento beta (TGFβ), fomentando então em hiperplasia das criptas, atrofia das vilosidades intestinais e ativação de linfócitos B, responsáveis pela geração de anticorpos (JABRI; SOLLID, 2006; LUNDIN; SOLLID, 2014; SCHERF et al., 2016).
Na DC ocorre alterações de segmentos proximais do intestino delgado distal que culminam em uma redução da sua funcionalidade, repercutindo na diminuição da digestão dos alimentos, diminuição absortiva de macro e micronutrientes, além da elevação da secreção de água e solutos. Essa problemática gera características sintomáticas que pode variar de acordo com a idade, sexo, predisposição genética e influenciar no surgimento de outras doenças (SCHUPPAN, ZIMMER, 2013; VAQUERO et al., 2015).
As manifestações clínicas da DC mais frequentemente vistas são diarreia ou constipação crônica, vômitos, anorexia, significativa perda de peso, estado nutricional precário, neurastenia, fadiga, retardo no crescimento, dor/distensão abdominal e baixa taxa de absorção de ferro, causando problemas anêmicos (NYLUND; KAUKINEN; LINDFORS, 2016; WATKINS; ZAWAHIR, 2017; MAJSIAK, 2018).
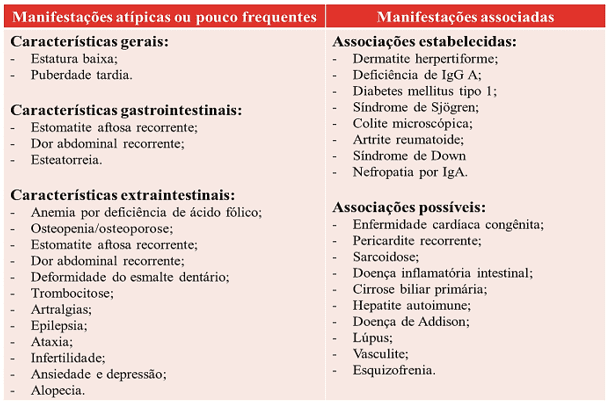
Para Cobos-Quevedo, Hernández-Hernández e Remes-Troche (2017), a DC também pode manifestar intercorrências atípicas ou presença de doenças associadas, como visto no quadro 1.
Quadro 1. Manifestações clínicas da doença celíaca.
2.2.1.2 DIAGNÓSTICO DA DOENÇA CELÍACA
O diagnóstico da DC possui particularidades que só podem ser esclarecidas por uma detalhada anamnese do paciente somado a interpretação dos resultados obtidos por exames clínicos, análise histopatológica e marcadores sorológicos (GUANDALINE; ASSIRI, 2014).
Para tal, se utiliza como abordagem de diagnóstico testes como prova de absorção D-xilose, dosagem de gordura nas fezes e estudos hematológicos, fundamentais para entender todo o processo digestivo e absortivo em pacientes celíacos (Associação dos Celíacos do Brasil – ACELBRA (2017); realização de biópsia de intestino delgado (BID), que somado com a classificação de Marsh-Oberhuber, permite verificar o padrão da mucosa, o grau de lesão, aumento de linfócitos intraepiteliais e presença de hiperplasia intestinal (OBERHUBER; GRANDITSCH; VOGELSANG, 1999; SCHUPPAN; ZIMMER, 2013; CASTILLO; THEETHIRA; LEFFLER, 2015) e também uso de ultrassonografia abdominal, em que é preciso que o indivíduo esteja consumindo glúten para obter respostas suficientes das análises das alças intestinais e alterações no fluxo sanguíneo esplâncnico (SILVA; SILVA, 2014).
Outra possibilidade é a avaliação de marcadores imunológicos indicados para aqueles que possuem suspeita e/ou risco da doença iminente. Para a realização dos testes, os indivíduos necessitam ingerir previamente alimentos contendo glúten por dias ou semanas, uma vez que os anticorpos séricos possuem uma meia-vida de trinta a sessenta dias. A constatação é feita a partir de anticorpos transglutaminase (tTG), antiendomísio (EMA), anti-reculina (ARA), peptídeos desaminados de gliadina (DPG) e análise de anticorpos IgA e IgG. O que vai diferir na escolha do tipo de exame proposto será a rentabilidade e o nível de especificidade e sensibilidade necessários para verificação da doença (NASCIMENTO; TAKEITI; BARBOSA, 2012; TONUTTI; BIZZARO, 2014; RASHID; LEE, 2016).
2.2.1.3 TRATAMENTO DA DOENÇA CELÍACA
O tratamento que melhor minimiza a DC é o controle dietoterápico que emprega a exclusão permanente do glúten para pacientes sintomáticos e assintomáticos, buscando a atenuação sintomatológica, recompor morfológica e fisiologicamente o epitélio e mucosa intestinais, além da melhoria na qualidade de vida (NASCIMENTO; TAKEITI; BARBOSA, 2012; BAI et al, 2016).
Todos os alimentos ou preparações que contenham glúten devem ser substituídos por outras opções como produtos cárneos, leite, legumes, verduras, frutas, sementes, gorduras –óleos, azeites – e cereais – milho, arroz, batata e mandioca. Também é necessário separar utensílios, materiais e embalagens de forma exclusiva ou pelo menos realizar uma boa higienização dos mesmos para que não tenha contaminação cruzada por vestígios de glúten (CASTILLO et al. 2015; ASSOCIAÇÃO DOS CELÍACOS DO BRASIL, 2017).
Outras abordagens terapêuticas têm sido testadas em ensaios clínicos a fim obter alternativas eficazes para auxílio no tratamento de DC. Como exemplos disso, tem-se os grãos geneticamente modificados com o objetivo de diminuir a toxicidade do glúten através da produção de cepas com baixo teor de glúten e assim reduzir a resposta dos epítopos estimulantes das células T, e o emprego de vacinas que utilizam a combinação de três pépticos imunogênicos (gliadina, hordeína e secalina) para leitura de células T em pacientes com genótipos HLA-DQ e utilização de terapias biológicas (CASTILLO et al., 2015; SCHERF et al., 2016).
2.2.2 ALERGIA AO TRIGO
2.2.2.1 DEFINIÇÃO E CARACTERÍSTICAS
A alergia ao trigo é uma afecção imunológica em que os componentes proteicos deste cereal, ao serem absorvidos na mucosa intestinal permeável, desencadeia uma cascata de mecanismos imunológicos, como resposta mediada por imunoglobulina E (IgE), e ocasionando um quadro hostil ao organismo, com consequente ocorrência de manifestações clínicas adversas (COBOS-QUEVEDO; HERNÁNDEZ-HERNÁNDEZ, REMES-TROCHE, 2017; FERREIRA; INÁCIO, 2018).
Muitos fatores de risco podem propiciar e agravar essa fisiopatologia, a citar: gênero, principalmente o masculino; etnia, com maior prevalência em negros e asiáticos; genética, devido a HLA, alguns genes específicos ou hereditariedade; insuficiência de vitamina D, já que alguns estudos têm mostrado significante influência desta vitamina no papel imunológico; qualidade da gordura dietética, pelo consumo inadequado de ácidos graxos poli-insaturados como o ômega 3; ingestão reduzida de antioxidantes, que é um importante componente para o controle inflamatório; elevado uso de antiácidos, que influencia negativamente na digestibilidade de alérgenos; obesidade, por toda a cascata inflamatória que a mesma propicia; aumento da higiene e por isso menor exposição a antígenos e ambiental, que sofrerá interferência pelo período e via de exposição quando em contato com alimentos contendo componentes do trigo (UNTERSMAYR; JENSEN-JAROLIM, 2008; LACK, 2012; SICHERER; SAMPSON, 2014).
Sobre o aspecto fisiológico, o trato gastrointestinal (TGI), quando em contato com o alimento, produz uma extensa barreira protetora a fim de digerir e absorver nutrientes importantes e separar aqueles que não possuem serventia. Nesse processo, o sistema imunológico interage com a barreira e permite que o tecido linfoide associado ao intestino, seja capaz de secretar substâncias inofensivas, organismos estranhos e patógenos perigosos (NIGGERMANN et al., 2001; SICHERER; SAMPSON, 2014).
Os transtornos dessa patogênese acontecem quando ocorre irregularidade na expressão gênica devido a vários riscos agravantes que culminam na ineficácia de componentes específicos da barreira intestinal, no sistema imune e induzem em reações de alergia alimentar ou de hipersensibilidade alimentar (PRESCOTT; ALLEN, 2011; PASHA et al., 2013).
A alergia ao trigo que pode ser propiciada pela exposição através da ingestão, inalação ou contato da pele/mucosa, sucede em uma sensibilidade alergênica que faz com que as células apresentadoras de antígenos (células dendríticas) ativem os linfócitos T com predomínio de resposta imune do tipo helper 2 (Th2) (QUIRCE; BOYANO-MARTÍNEZ; DÍAZ-PERALES, 2016; JERICHO; ASSIRI; GUANDALINE, 2017).
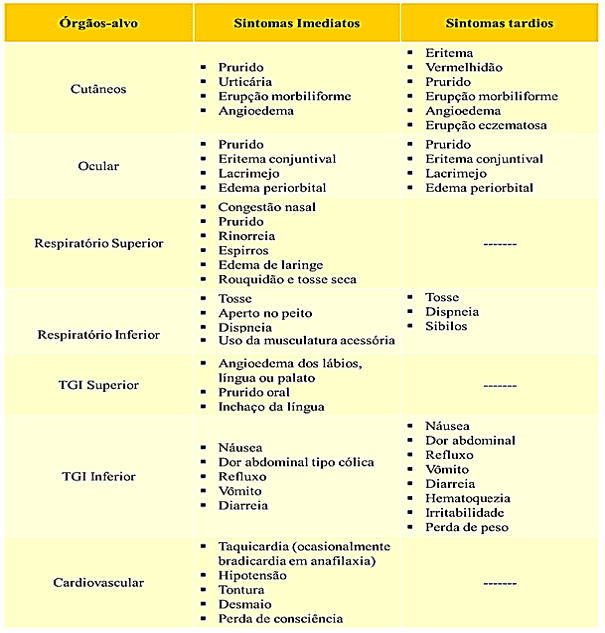
Sequencialmente, ocorre uma cooperação entre os linfócitos T e B estimulando a produção de eosinófilos, neutrófilos e síntese de IgE específicas do trigo, com posterior fixação e liberação de mediadores mastocitários e basófilos, que influenciarão nas dosagens de histamina, fator ativador de plaquetas, serotonina, proteases neutras, heparina, ácido hialurônico e diversas prostaglandinas, leucotrienos e citocinas que causam sintomas clínicos específicos, como apresentado no quadro 2 (VAQUERO et al., 2015; BALAKIREVA; ZAMYATNIN, 2016).
Quadro 2. Sintomas de reações alérgicas induzidas por alimentos.
2.2.2.2 DIAGNÓSTICO DA ALERGIA AO TRIGO
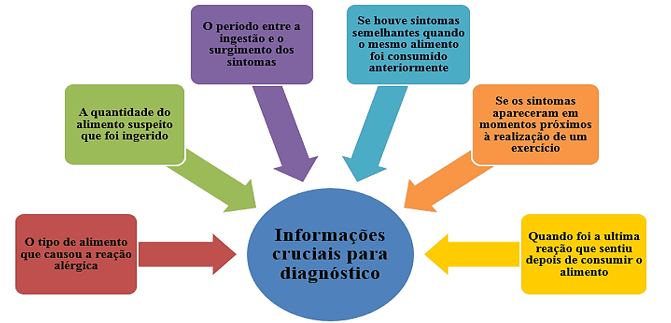
Segundo Sampson (2003) deve-se realizar uma anamnese detalhada para averiguar se houve uma reação alérgica e qual o grau de exposição antes de dar continuidade a qualquer teste para diagnóstico, como pode ser visto na figura 5. Além disso, o uso de um diário alimentar pode ser uma estratégia eficiente uma vez que, não é dependente da memória do paciente e toda as informações vão sendo preenchidas paulatinamente.
Figura 2.Informações cruciais para diagnóstico de alergia alimentar.
Depois dessas avaliações são feitos testes que mensuram a produção de anticorpos IgE especificamente para o trigo como teste sorológico RAST e os testes de contato como Skin-prick test e o de Patch, que terão seus resultados consentidos de forma imediata ou tardia a depender do paciente (SOARES-WEISER et al., 2013; MÄKELÄ et al., 2014; UNIVERSIDADE AMERICANA DE ALERGIA, ASMA E IMUNOLOGIA, 2014).
O diagnóstico da AT para todas as faixas etárias com base nos testes citados acima, ainda não é totalmente eficiente, já que podem ocorrer reações tardias de alergia que se tornam difíceis de associar com a fisiopatologia em questão. Ademias, podem existir erros na técnica e resultados falsos positivos caso o paciente tenha uma sensibilidade ao pólen da grama ao invés do trigo ou falso-negativos se os testes foram feitos sem a devida instrução de não usar medicação anti-histamínica durante o período da avaliação (QUIRCE; BOYANO-MARTÍNEZ; DÍAZ-PERALES, 2016; CIANFERONI, 2016).
Para aprimorar o diagnóstico tem-se utilizado como padrão-ouro de avaliação o teste de tolerância oral do trigo e o teste de desafio brônquico por nebulização ou por inalação do trigo, pois possuem maior eficácia nos resultados dos exames obtidos, além da necessidade de buscar mais respostas específicas de IgE para diferentes proteínas do trigo a fim de obter uma variedade clínica fenotípica mais detalhada para AT (UNIVERSIDADE AMERICANA DE ALERGIA, ASMA E IMUNOLOGIA, 2014; TORDESILLAS; BERIN; SAMPSON, 2017).
2.2.2.3 TRATAMENTO DA ALERGIA A TRIGO
A terapia efetiva para o controle da AT ainda é a rigorosa eliminação na dieta do agressor alergênico. Para isso, o paciente e sua família devem ser educados para limitar a ingestão acidental de alimentos contendo trigo, além da precaução do contato pelas vias cutânea e respiratória, orientações para a leitura dos rótulos dos produtos e explorar materiais educativos que sensibilizem a importância desse tratamento (SAMPSON, 2003; BOYCE et al., 2010; CIANFERONI, 2016).
Como terapia coadjuvante existem alguns medicamentos que podem aliviar os sintomas da intolerância oral, dermatites, anafilaxia e/ou desordens crônicas de IgE, mas, em contrapartida, possuem efeitos colaterais de grande risco que expõe gravemente o indivíduo a depender de suas características genéticas como: anti-histamínicos; glicocorticoides; β-agonistas, isolados ou em combinação; em casos particulares o uso de epinefrina; anticorpos monoclonais anti-IgE e, por último, a utilização promissora de imunoterapias através de três técnicas possíveis – imunoterapia oral, imunoterapia sublingual e imunoterapia epicutânea (BOYCE et al., 2011; QUIRCE; BOYANO-MARTÍNEZ; DÍAZ-PERALES, 2016; CIANFERONI, 2016).
2.2.3 SENSIBILIDADE AO GLÚTEN NÃO CELÍACO
2.2.3.1 DEFINIÇÃO E CARACTERÍSTICAS
Sensibilidade ao glúten não celíaco (NCGS), também conhecida como sensibilidade ao trigo não celíaco, é uma condição que faz parte das desordens relacionadas ao glúten e é caracterizada por sintomas intestinais e/ou extra intestinais que surgem após ingestão de glúten e depois rápida melhora com a sua retirada da dieta em pacientes não diagnosticados com DC e/ou AT (VAZQUEZ-ROQUE; OXENTENKO, 2015; ORTIZ; VALENZUELA; LUCERO, 2017; SERGI; VILLANACCI; CARROCCIO, 2021).
Os primeiros relatos dessa doença foram vistos em meados dos anos 80, onde pacientes eram sensíveis ao trigo, mas sem doença celíaca presente. Mais tarde, sua caracterização teve maior atenção depois do trabalho de Sapone et al., datado em 2010, que buscava retratar características clínicas e diagnósticas da NCGS, com diferenciação das particularidades da DC (SAPONE et al., 2010; NIJEBOER et al., 2013; GREUTER, et al. 2017).
Muitas pesquisas foram feitas a fim de caracterizar essa “nova” enfermidade até que em fevereiro de 2011, em Londres, houve a reunião de vários especialistas com o objetivo de definir um consenso sobre a NCGS. Desde então, têm tido buscas de mais conteúdos sobre a doença, que ainda são difíceis de se estimar, porém já se mostrou importante para possíveis implicações em doenças humanas, maior tendência para o sexo feminino e em adultos jovens / idade média, residentes em área urbana, além de sua relação com a síndrome do intestino irritável (SII) e doença de Crohn no que diz respeito a suas semelhanças sintomatológicas (SAPONE et al., 2012; HUSBY; MURRAY, 2015; NYLUND; KAUKINEN; LINDFORS, 2016; ROSZKOWSKA et al., 2019).
Para Catassi et al. (2013), a literatura sobre NCGS ainda é questionável com relação as suas características, que podem ser plausíveis de alteração nos seguintes aspectos: agentes causais, permanência versus transição, grau de sensibilidade, frequência e abordagem entre os pacientes que apresentam essa fisiopatologia.
Na NCGS, os mecanismos de ação ainda são considerados incertos, porém sua atuação tem sido percebida não somente sobre sua relação com o sistema imune, como também sobre a barreira epitelial e aspectos genéticos (VAQUEIRO et al., 2015; CZAJA-BULSA, 2015). Fisiologicamente, tanto os monócitos, quanto os macrófagos e as células dendríticas da lâmina própria são os responsáveis por tolerar qualquer presença de antígenos no lúmen intestinal, a não ser quando os peptídeos de gliadina não conseguem ser totalmente digeridos, causando alterações de funções a nível de mucosa, sistêmica e imunológica (SAPONE et al., 2010; NAVARRO; ARAYA, 2015).
No caso da NCGS, e diferentemente da DC, os inibidores da alfa-amilase/tripsina do trigo, carboidratos específicos e até mesmo o fermento fazem associação principalmente com a resposta imune inata, porém, sem expressão de marcador inflamatório da gliadina e sem ativação basófila (DI SABATINO et al., 2016; WATKINS; ZAWAHIR, 2017; USAI-SATTA et al., 2018). Já sobre os anticorpos antigliadinas (Antigliadin antibodies – AGA), que são produzidos pelo sistema imune em resposta a presença de gliadina do trigo, foi possível observar em alguns indivíduos com NCGS a presença desses anticorpos como no caso do IgG-AGA, entretanto, seu uso ainda não é considerado um marcador específico para NCGS, mas podendo ser utilizado como critério de diferenciação em relação a outras doenças derivadas do glúten (VOLTA et al, 2012; CZAJA-BULSA, 2015).
Outra peculiaridade da NCGS que ainda necessita mais estudos é com relação à barreira epitelial da mucosa do intestino delgado, que apresenta permeabilidade normal e sem alterações de componentes da junções apertadas como as claudinas (Claudin – CLDN) do tipo 1 e zonulina -1, mas, por outro lado, ocorre diminuição da produção de células T, resposta aumentada de CLDN-4 e participação de marcadores do receptor Toll-like (TLR) dos tipos 1, 2 e 4, que são proteínas transmembrânicas responsáveis pelo reconhecimento de padrões moleculares associados a microrganismos (Microbe-Associated Molecular Patterns – MAMP’s) (BUCCI et al, 2013; NYLUND; KAUKINEN; LINDFORS, 2016; GREUTER et al. 2017).
As manifestações clínicas na NCGS podem ser acometidas por horas ou dias após a ingestão de glúten e melhora/ausência dos sintomas quando há a retirada desse nutriente na dieta, mostrando uma relação promissora entre o consumo de alimentos contendo glúten e a piora sintomatológica (FASANO et al, 2015; VAZQUEZ-ROQUE; OXENTENKO; 2015).
Estudos mostram que a retirada do glúten da dieta também faz diminuir o consumo de outros componentes dietéticos que poderiam influenciar ou serem os principais agravantes dos transtornos clínicos da NCGS, como no caso dos oligossacarídeos, dissacarídeos, monossacarídeos e polióis, fermentáveis (Fermentable Oligo-, Di- and Mono-Saccharides and Polyols – FODMAPs). Esses hidratos de carbono são metabolizados pela microbiota intestinal e, devido a sua elevada osmolaridade, aumenta a quantidade de água no lúmen, permitindo fermentação bacteriana. (BIESIEKIERSKI et al., 2013; FASANO et al, 2015; ZINGONE et al., 2017; ROSZKOWSKA et al., 2019).
Os gatilhos da NCGS são uma combinação entre os sintomas típicos da SII, da DC, da AT e diversas manifestações sistêmicas, onde os pacientes apresentam pelo menos dois ou mais transtornos, a citar no quadro 3 abaixo (CATASSI et al., 2013; WATKINS; ZAWAHIR, 2017; ROSZKOWSKA et al., 2019).
Quadro 3. Manifestações clínicas na sensibilidade ao glúten não celíaco.
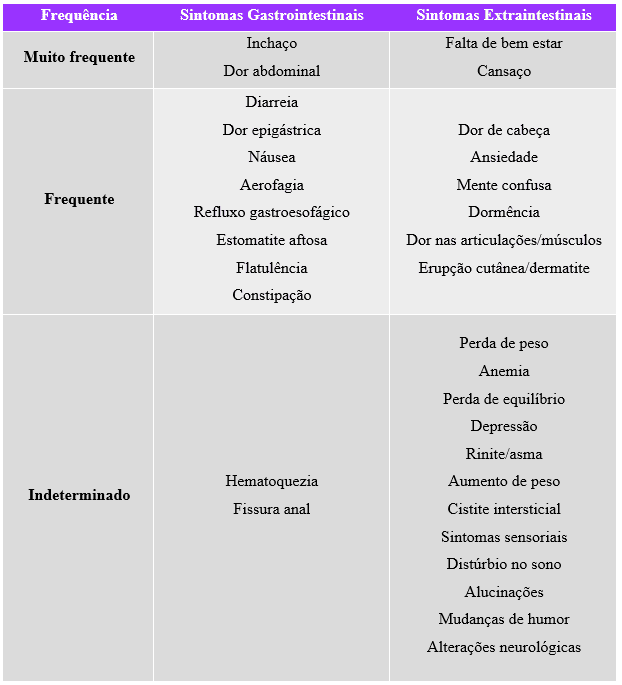
2.2.3.2 DIAGNÓSTICO DA SENSIBILIDADE AO GLÚTEN NÃO CELÍACO
O diagnóstico da NCGS ainda não relata biomarcadores específicos, porém pode ser baseada pela associação de achados da história clínica do paciente juntamente com o teste oral de glúten, testes sorológicos, teste de Skin-prick, teste de Patch e biópsias intestinais, que serão avaliados e diagnosticados através de critérios de exclusão da DC e da AT (NIJEBOER et al., 2013; VAQUEIRO et al., 2015).
Na NCGS é percebido aumento de anticorpos antigliadina do tipo 4 (IgG4-AGA) em mais de 50% dos casos relatados, com certas elevações dos linfócitos intraepiteliais e infiltração linfocitária da mucosa, com classificação de Marsh-Oberhuber a nível zero a um. Nos marcadores sorológicos presentes na DC e AT, os resultados para DGP, EMA, tTG e IgE são negativos para a sensibilidade ao glúten (GUANDALINI; POLANCO, 2015; INFANTINO et al., 2017; WATKINS; ZAWAHIR, 2017).
Para melhores achados clínicos, o médico precisa investigar o histórico alimentar para diferenciar a NCGS dos outros tipos de desordens relacionada ao glúten. Para tal, são usados técnicas fundamentais, onde ensaios com e/ou sem a ingestão de glúten são usados como comparativos para teste de desafio, recomendado quando os sintomas-alvo são vômito ou diarreia e teste duplo-cego de exposição controlada com placebo (Double-Blind Placebo-Controlled Food Challenge – DBPCFC), que é considerado uma avaliação de alto nível de evidência diagnóstica e, para evitar um diagnóstico ao acaso, pode ser realizada por duas vezes para controle dos resultados. (SAPONE et al., 2012; CZAJA-BULSA, 2015; MOLINA-INFANTE; CARROCCIO, 2017; SERGI; VILLANACCI; CARROCCIO, 2021).
Além dessas possibilidades de averiguação de diagnóstico, também citadas por Catassi et al (2015), no chamado critérios de avaliação dos especialistas de Salerno, esses mesmos autores também acrescentaram como critério de diagnóstico a utilização de um questionário autoadministrativo que engloba questões modificadas de uma escala base conhecida como Escala de Avaliação de Sintomas Gastrointestinais. Nessa versão modificada, utiliza-se de um questionário com itens que avaliam tanto sintomatologias gastrointestinais gerais como as específicas para a NCGS.
O 4º quadro e a figura de número 3 mostram detalhadamente informações indispensáveis para diferenciação da NCGS das outras desordens relacionadas ao glúten e a abordagem diagnóstica dessas fisiopatologias
Quadro 4. Diferenciação das desordens relacionadas ao glúten.
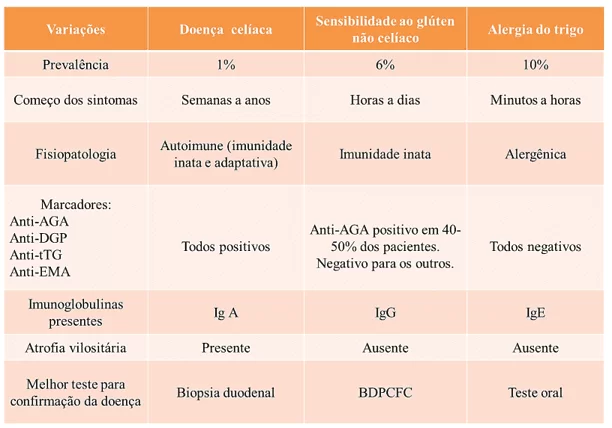
Fonte: adaptada de VAQUERO et al., 2015.
Figura 3.Critérios de diagnóstico para diferenciação entre sensibilidade ao glúten não celíaco, doença celíaca e alergia do trigo.
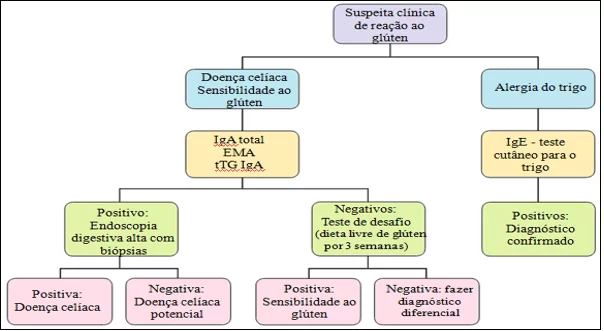
Fonte: adaptada de NAVARRO et al., 2015.
2.2.3.3 TRATAMENTO DA SENSIBILIDADE AO GLÚTEN NÃO CELÍACO
A estratégia atual para o tratamento da NCGS é exclusão da dieta de alimentos contendo glúten, atrelado ao monitoramento de um nutricionista e outros profissionais de saúde, afim de acompanhar periodicamente o paciente e verificar a condição da doença, já que não se sabe ainda se é uma conformidade transitória ou permanente; observar se houve adesão a dieta; realizar um suporte nutricional de macro e micronutrientes conforme a necessidade e evitar riscos de complicações futuras (RIBEIRO et al., 2017; WATKINS; ZAWAHIR; 2017).
Como a dieta sem glúten é considerada uma terapia complexa devido à restrita condição alimentar e por todo o agravo social que causa, como visto também na DC, tem-se optado por abordagens terapêuticas diferentes para auxiliar no tratamento que incluem redução da exposição ao glúten por modificação genética e bloqueio HLA DQ2/DQ8 (GREUTER, et al., 2017).
Esse tratamento ainda precisa de maiores esclarecimentos, porém, já pode ser percebido claramente que seus efeitos trazem impactos importantes na qualidade de vida dos pacientes, além de um aumento considerável das suas implicações para os serviços de saúde. Dessa forma, tem-se a necessidade de mais estudos e a elaboração de diretrizes que auxiliem na identificação e manejo da doença em questão, com o objetivo de beneficiar os pacientes que fazem restrição na dieta (LUNDIN, 2014; RIBEIRO et al., 2017).
3. TIREOIDITE DE HASHIMOTO
A tireoidite de Hashimoto ou tireoidite linfocitária crônica é uma desordem autoimune, na qual representa uma disfunção imunológica que se caracteriza pela elevação da secreção da glândula tireoidiana em resposta a produção de anticorpos e resultando em inflamação crônica. Com o tempo, a capacidade da glândula tireoidiana de produzir seus respectivos hormônios se torna reduzida, com consequente disfunção do órgão (GUEDIN et al., 2015; AKAMISU; AMINO; DEGROOT, 2017; ASSOCIAÇÃO AMERICANA DA TIREOIDE – ATA; RODRIGUES JUNIOR et al., 2017).
A etiologia da HT ainda é incerta, entretanto, suspeita-se que seja decorrente de uma relação entre os aspectos geneticamente suscetíveis devido à associação com alelos do HLA, agravantes epigenéticos e estímulo ambiental. Além disso, essa doença pode implicar no surgimento do bócio, apesar de não ser uma complicação frequente, e tem uma prevalência superior a 10% em mulheres de meia idade, enquanto que os homens possuem somente um décimo dessa predominância (HASHAM; TOMER, 2012; PYZIK et al, 2015; SILVA, 2018).
A glândula tireoide é representada por um pequeno órgão em formato de borboleta, situada na base do pescoço e diante da traqueia. É considerada o “controlador chef” no organismo por ser capaz de liberar hormônios tireoidianos na corrente sanguínea e influenciar no comportamento metabólico, com significante desempenho para o funcionamento de tecidos e órgãos. Quando há o descontrole dessa glândula, todo um mecanismo patológico é acionado, culminando em uma cascata inflamatória como pode ser vista, dentre as patologias derivadas da tireoide, a tireoidite de Hashimoto (BAHN et al., 2011; ASSOCIAÇÃO AMERICANA DE TIREOIDE – ATA, 2017).
3.1 FISIOPATOLOGIA DA TIREOIDITE DE HASHIMOTO
A fisiopatologia inicia-se com a elevação do número de células apresentadoras de antigênicos (CAA) em resposta a sinais inflamatórios que são desenvolvidos por dano ou necrose das células tireóideas. Essas CAA permitem a ativação subsequente de células T auto reativas que vão influenciar na polarização de células T helper (Th) dos tipos 1, 2 e 17, responsáveis pela expressão aumentada de citocinas como IFN-γ, TNF-α, TGFβ, interleucinas (1, 4, 5, 6, 10, 12, 13, 17, 21, 22), além da predominância de mecanismos imunológicos com infiltração linfocitária elevada da tireoide e citotoxicidade mediada por linfócitos T CD4 e CD8 citotóxicos e pelo complemento (MELO, 2006; HORIE et al., 2009; PYZIK et al, 2015; VASCONCELOS, 2017; RALLI et al., 2020).
As células tireóideas do tipo B, apesar de resolutas às ações líticas do complemento, ainda permitem que anticorpos anti-tireoperoxidade (anti-TPO) se prendam ao complemento e junto a anticorpos anti-tiroglobulina (anti-TG) e anti-receptor do hormônio estimulante da tireoide (TSH), viabilizam a ativação de citocinas, prostaglandinas e produtos reativos de oxigênio, que irão refletir na lesão sub-letal das células. Esse dano é influenciado tanto pelo aumento do receptor Fas nas células foliculares da tireoide, como pelos ligantes de Fas em células T que culminará em atrofia e/ou destruição da glândula. Essa destruição também pode sofrer influência de células T citotóxicas, natural killer (NK), T reguladoras (Treg) ou T supressoras (AKAMISU; AMINO; DEGROOT, 2017; VASCONCELOS, 2017; SILVA, 2018).
Outro marcador importante na tireoidite de Hashimoto é a imunoglobulina 4 (IgG4), reconhecida como uma doença sistêmica em múltiplos órgãos e responsável pela elevação do tamanho tumefativo de órgãos afetados e aumento das concentrações séricas e teciduais de IgG4. Esse transtorno possui um único subtipo, chamado tireoidite IgG4, e é caracterizado por infiltração linfoplasmocitária, fibrose, aumento das células plasmáticas positivas para IgG4 na tireoide e altas concentrações séricas de IgG4 (KAKUDO et al., 2012; LUIZ et al., 2014; RODRIGUES JUNIOR et al., 2017).
Histopatologicamente, na HT ocorre alteração por presença de infiltração linfoplasmocitária difusa, geração de folículos linfoides com germinação central, níveis variáveis de fibrose, atrofia parenquimatosa e surgimento elevado de células foliculares com abundante citoplasma eosinofílico granular, chamadas células Hürthle, oxifilicas ou Askanazy (HIROMATSU; SATOH; AMINO, 2013; SILVA, 2018; RALLI et al., 2020).
Indivíduos suscetíveis em apresentar HT podem sofrer influências externas que acarretarão para o aumento do risco de contraí-la e para aqueles que já possuem a patologia, podem agravar suas condições clínicas. Essa influência é prevista em casos como: ingestão elevada de iodo e de alimentos contendo glúten; microbiota intestinal, deficiência de selênio e vitamina D; tabagismo; estresse; doenças infecciosas como hepatite C crônica e rubéola, exposição à radiação, poluentes ambientais a citar fumaça, bifenilos policlorados, solventes e metais pesados (DUNTAS, 2008; PYZIK et al., 2015; LIONTIRIS; MAZOKOPAKIS, 2017; SILVA, 2018).
3.2 DIAGNÓSTICO CLÍNICO DA TIREOIDITE DE HASHIMOTO
A HT não possui aspectos clínicos exclusivos, principalmente porque sua condição avança lentamente ao longo do tempo e fazendo com que muitos pacientes acabem não demonstrando nenhum sintoma, só detectando algum transtorno através de exames sanguíneos. Entretanto, em alguns anos a tireoidite provoca danos crônicos às células, culminando em alargamento indolor, difuso e gradual da glândula tireoidiana, representada pelo bócio. A partir daí os pacientes predispostos podem começar ou não (sintomáticos/assintomáticos) a desenvolver sinais e sintomas diversos, sendo citados na figura 5 (IMAM; AHAMAD, 2016; ASSOCIAÇÃO AMERICANA DA TIREOIDE – ATA, 2017).
Figura 4. Achados clínicos em pacientes com tireoidite de Hashimoto.
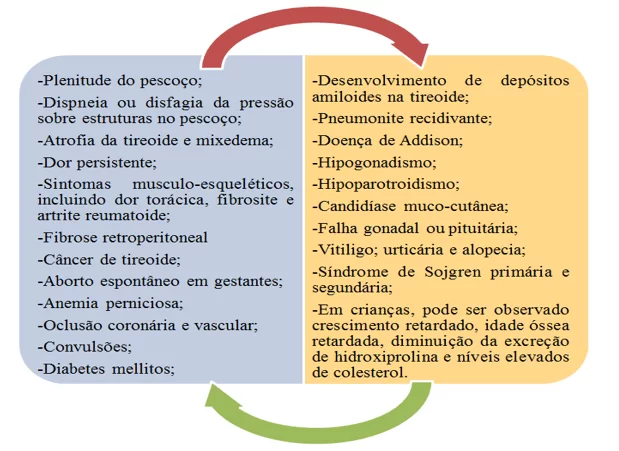
A investigação da HT fundamenta-se através de duas considerações: diagnóstico diferencial da tireoide lesionada e a delimitação da avaliação do perfil metabólico do paciente. A presença de bócio difuso e rígido com engrandecimento do lóbulo piramidal e sem sinais de tireotoxicose permite diagnosticar a fisiopatologia e vários cursos clínicos como eutireoidismo com bócio, hipotireoidismo subclínico com bócio, hipotireoidismo, bócio adolescente, tireoidite indolor (tireoidite silenciosa), tireoidite indolor pós-parto, hipo e hipertireoidismo alternados, doença de Graves e outras doenças autoimunes acompanhantes (HIROMATSU; SATOH; AMINO, 2013; IMAM; AHAMAD, 2016).
Os exames citológicos imprescindíveis para o diagnóstico permeiam na avaliação da concentração de triiodotironina (T3), tiroxina 4 (T4), fator tecidual (FT), níveis de gamaglobulina, taxa de sedimentação de eritrócitos, e proteína C reativa (PCR), além da positividade para anti-TPO, anti-TG e anti-receptor TSH (RODRIGUES JUNIOR et al., 2017; SILVA, 2018).
Outras apurações importantes que possibilitem mais transparência, podem ser feitas através de exames por ultrassonografia cervical, que averigua a presença aumentada da glândula com baixa ecogenicidade ou múltiplos nódulos deformados; teste de absorção de iodo radioativo (RAIU), que apesar de ser raramente necessário, induz uma varredura da tireoide para captação e análise da glândula alterada; punção aspirativa por agulha fina (PAAF), adequada para pacientes com doença nodular, em que expõe taxas elevadas de linfócitos, macrófagos, coloides escassos e células epiteliais que demonstram células do tipo Hürthle e análise histológica. A estratégia para o diagnóstico pode esquematicamente ser vista na figura 6 (IMAM; AHAMAD, 2016; AKAMISU; AMINO; DEGROOT, 2017).
Figura 5. Esquema para diagnóstico da tireoidite de Hashimoto.
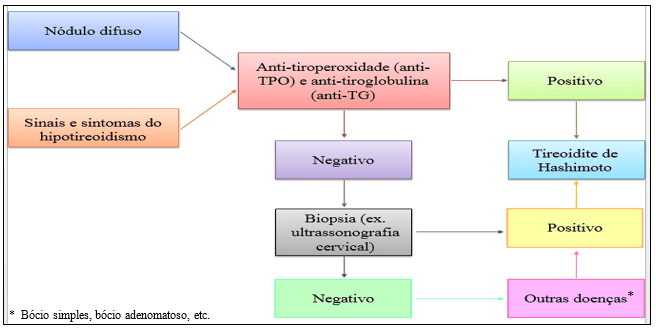
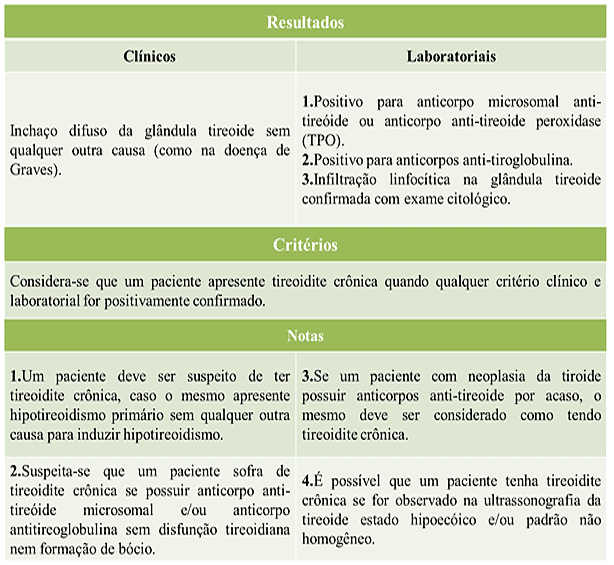
A Associação Japonesa da Tireoide – JAT (2010), destaca alguns parâmetros imprescindíveis para análise diagnóstica em pacientes acometidos com HT, que serão destacados no quadro 5. Na maioria dos casos, os responsáveis clínicos não denominam HT se os pacientes não apresentarem bócio, mesmo que se tenha associação positiva para anticorpos e infiltração linfocitária na glândula, identificados por testes histológicos.
Quadro 5. Diretrizes para o diagnóstico de tireoidite crônica.
3.3 TRATAMENTO DA TIREOIDITE DE HASHIMOTO
O tratamento para HT baseia-se na administração de tiroxina se o paciente externar taxas alteradas de TSH, T3 e T4 livres, porém, caso apresente normalizados, aconselha-se sua reavaliação periódica. Na eventualidade de apresentar bócio intenso, utiliza-se de tratamentos com doses supressoras de tiroxina por um período de seis meses e sendo futuramente reexaminado, com o objetivo de reduzir cerca de 30% do volume. Quando isso não acontece, a terapia deve ser suspensa ou retomada em doses de substituição (MELO, 2006; AKAMISU; AMINO; DEGROOT, 2017; RALLI et al., 2020).
Outra forma terapêutica que tem sido utilizada é o método cirúrgico chamado tireoidectomia, que realiza a retirada da glândula quando a mesma se encontra aumentada devido ao bócio, ou em casos em que há nódulos difíceis de diagnosticar como benignos ou malignos (RODRIGUES JUNIOR et al., 2017). O problema desse tratamento é que a pessoa deixa de produzir hormônios tireoidianos e passa a necessitar de medicamentos, refletindo assim em um quadro de hipotireoidismo. Essa técnica só é indicada quando há dor significativamente presente e o uso de glicocorticoides não são suficientes para diminuir esse desconforto (AKAMISU; AMINO; DEGROOT, 2017).
Estudos mostram que a retirada do glúten na dieta pode beneficiar o tratamento da HT, já que esse nutriente, ao entrar em contato com TGI, rompe a barreira de proteção do intestino e entra na corrente sanguínea. Esse processo gera toda uma cascata inflamatória com geração de anticorpos que irão influenciar, consequentemente, no estado evolutivo da tireoidite. Uma dieta isenta de glúten não anula a patologia presente, porém, permite certo retrocesso dos transtornos causados e proporciona melhora absortiva dos medicamentos (SATEGNA-GUIDETTI et al., 2001; CH’NG; JONES; KINGHAM, 2007; PEREZ et al., 2010).
Quaisquer métodos terapêuticos têm suas vantagens e desvantagens, porém, nenhum deles permitem um tratamento definitivo para regredir completamente o processo autoimune da doença. Para tanto, tem-se realizado estudos direcionados para outras possibilidades de tratamento, sem que haja a destruição e/ou remoção da glândula tireoidiana. O foco principal é elaborar um fator inibitório contra o anticorpo estimulante do TSH, a partir de agentes biológicos com atividade imunomoduladora que irão agir como antagonistas seletivos de receptores de TSH. Essa técnica ainda possui muitas limitações como custo-benefício, efeitos adversos e retrocesso após a descontinuação destes fármacos, no entanto, ainda é evidente seu potencial como nova estratégia de tratamento (YOO; CHUNG, 2016).
4. CORRELAÇÃO ENTRE A SENSIBILIDADE AO GLÚTEN E A TIREOIDITE DE HASHIMOTO
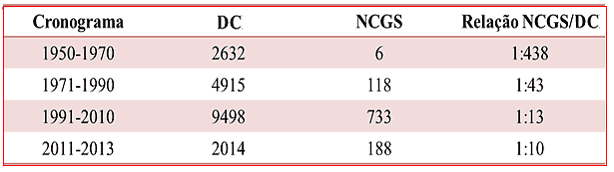
A doença celíaca por muitas vezes foi considerada uma enteropatia sensível ao glúten, entretanto, com o surgimento de uma nova entidade relacionada ao glúten, a NCGS passou a se caracterizar como uma das desordens relacionada a este nutriente e não mais como sinônimo de DC. Sequencialmente, vários estudos abordando suas manifestações clínicas e de diagnóstico foram sendo propostos, como mostra na tabela 1 abaixo (HOLMES, 2013; CATASSI et al., 2013).
Tabela1. Tendências na publicação sobre a doença celíaca e sensibilidade ao glúten não celíaco nas últimas décadas.
Por representar uma doença autoimune, tem-se evidências de que a DC coexiste com outras patologias autoimunes, como no caso da tireoidite de Hashimoto, já que possuem alterações genotípicas, antigênicas e deficiências nutricionais semelhantes – como selênio e vitamina D (HADITHI et al., 2007; PEREZ et al., 2010; LIONTIRIS; MAZOKOPAKIS, 2017). Entretanto, no caso da NCGS, uma possível relação com doenças autoimunes também poderia ser concebida, uma vez que tem relação com o sistema imunológico, com ativação importante do sistema imune inato (LOSURDO et al., 2018; KNEZEVIC et al, 2020).
A relação entre sensibilidade ao glúten não celíaco e conformidades autoimunes da tireoide, como a tireoidite de Hashimoto, ainda precisa de maiores esclarecimentos, porém, essa conexão pode ser vista em algumas abordagens científicas (tabela 2).
Tabela 2. Correlação entre desordens relacionadas ao glúten e doenças autoimunes.
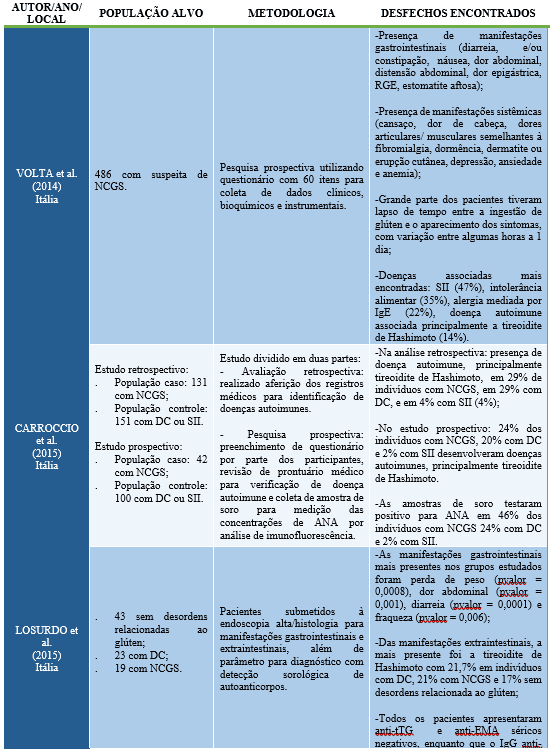
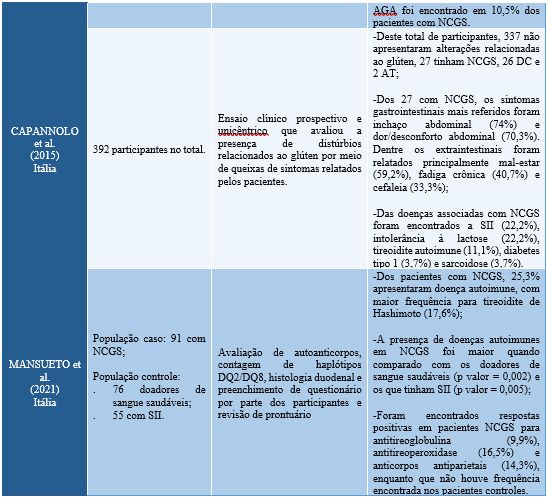
Diante do exposto, os estudos citados mostraram que além dos sintomas gastrointestinais, houve a constatação de sintomas extraintestinais e da ocorrência de doenças associadas que, dentre as desordens autoimunes encontradas, a presença de tireoidite de Hashimoto não foi vista somente na DC como também em boa parte dos indivíduos diagnosticados com NCGS.
Esses achados, apesar de ainda serem observados em poucos estudos e com a necessidade de um número amostral maior, já podem ser considerados promissores para tal associação e para a possibilidade de verificação de diversas hipóteses, como relatado por Knezevic et al (2020), em que dizem que a relação entre NCGS e doenças autoimunes da tireoide podem estar associadas devido à manifestação das mesmas citocinas em ambas as doenças, reação cruzada de anticorpos, má absorção de micronutrientes fundamentais para a tireoide e maior permeabilidade intestinal devido a danos importantes nas junções apertadas, com consequente inflamação e autoimunogênese.
Além disso, foi constatado no trabalho de Valentino et al (2002) que, do seu grupo de casos com tireoidite de Hashimoto, 43% desses indivíduos apresentavam marcadores de sensibilidade ao glúten sem ter diagnóstico confirmado para DC e ademais, seus dados sugerem que pessoas que apresentem teste sorológico negativo podem vir a desencadear no futuro disfunção tireoidiana.
Para tanto, também foi observado no estudo de Virili et al (2012) que pessoas com sensibilidade ao glúten que insistem em continuar consumindo glúten, acabam requirindo ainda mais a síntese de hormônios tireoidianos quando comparado com aqueles que efetivamente pararam de consumir glúten.
Esses resultados gerais possibilitam evidenciar não só uma propícia e crescente associação entre a sensibilidade ao glúten não celíaco e a tireoidite de Hashimoto, como também evidenciar a importância de intervenções dietoterápicas com a isenção de glúten para melhora/minimização do quadro clínico.
5. CONSIDERAÇÕES FINAIS
Os transtornos associados ao glúten estão afetando cada vez mais a sociedade devido ao seu vasto conjunto de sintomas e alterações clínicas que vão muito além de uma única patologia. A causa de uma sensibilidade está comumente relacionada a problemas de intolerância ou alergias à proteína presente no trigo, mais precisamente a gliadina e glutenina.
Dentre os distúrbios amplamente conhecidos que são a doença celíaca e a alergia ao trigo, uma nova nomenclatura chamada sensibilidade ao glúten não celíaco foi tomando espaço, com necessidade de maiores estudos sobre seus achados clínicos, sintomatologia, exames serológicos e histológicos para melhor precisão de diagnóstico.
Até onde se sabe, a NCGS corresponde a uma alteração imunológica após consumo de alimento contendo glúten, sem que tenha apresentado critérios positivos para a DC e AT. Nessa fisiopatologia é possível observar problemas gastrointestinais e extraintestinais que são semelhantes aos sintomas presentes da SII, elevação na contagem de células epiteliais e presença de anti-gliadina, além da associação com outros distúrbios importantes como as doenças autoimunes.
A correlação entre a NCGS e tireoidites autoimunes como no caso do Hashimoto, tem sido questionada em alguns estudos com relação ao seu grau de prevalência. Existem ainda poucas pesquisas que façam análise de ambas, entretanto, já pode ser percebida uma conexão entre algumas de suas manifestações clínicas a citar: elevações na taxa de IgG 4 AGA, presença da PCR, ativação de células T que são responsáveis pela resposta imune inata, produção de citocinas e de anticorpos antinucleares, com consequente formação de cascata inflamatória.
Conclui-se portanto, que a presença da NCGS poderia influenciar negativamente na resposta da tireoidite de Hashimoto e por isso, a recomendação de uma dieta isenta de glúten seria considerada uma possibilidade efetiva para reduzir os danos causados por essa associação e fornecer melhor qualidade de vida ao indivíduo. Para tanto, faz-se necessário maiores pesquisas sobre essa temática, com o intuito de ampliar o conhecimento científico dessa interação.
REFERÊNCIAS
AKAMISU, Takashi; AMINO, Nobuyuki; DEGROOT, Leslie Jacob. Hashimoto’s Thyroiditis. Sul de Dartmouth, Endotext (internet), Jul, 2017. Disponível em: <https://www.ncbi.nlm.nih.gov/books/NBK285557/> Acesso em: 05 de agosto de 2019.
ARAÚJO, Halina Mayer Chaves et al. Doença celíaca, hábitos e práticas alimentares e qualidade de vida. Revista de Nutrição, Campinas, v; 23, n. 3, p. 467-74, Jun., 2010.
ASSOCIAÇÃO AMERICANA DA TIREOIDE – ATA, 1923. Disponível em: <https://www.thyroid.org/>. Acesso em: 12 de abril de 2019.
ASSOCIAÇÃO DOS CELÍACOS DO BRASIL, 2004. Disponível em: <http://www.acelbra.org.br/2004/>. Acesso em: 23 de abril de 2019.
BAHARVAND, Parastoo; HORMOZI, Maryam; ALIEHPOUR, Asghar. Comparison of thyroid disease prevalence in patients with celiac disease and controls. Gastroenterology Hepatology from Bed to Bench, Irã, v. 13, n. 1, p. 44-9, Winter, 2020.
BAHN, Rebeca S. et al. Hyperthyroidism and Other Causes of Thyrotoxicosis: Management Guidelines of the American Thyroid Association and American Association of Clinical Endocrinologists. Thyroid, Estados Unidos, v. 21, n. 6, p. 593-646, Jun., 2011.
BAI, Julio C. et al. Doença Celíaca. World Gastroenterology Organisation Global Guidelines, p. 2-35, Jul. 2016. Disponível em: <https://www.worldgastroenterology.org/UserFiles/file/guidelines/celiac-disease-portuguese-2016.pdf> Acesso em: 05 de setembro de 2019.
BALAKIREVA, Anastasia V.; ZAMYATNIN, Andrey A. Properties of Gluten Intolerance: Gluten Structure, Evolution, Pathogenicity and Detoxification Capabilities. Nutrients, Russia v. 8, n. 10, p. 644, Out., 2016.
BIESIEKIERSKI, Jessica R. et al. No Effects of Gluten in Patients with Self-Reported Non-Celiac Gluten Sensitivity after Dietary Reduction of Fermentable, Poorly Absorbed, Short-Chain Carbohydrates. Gastroenterology, Australia, v. 145, n. 2, p. 320-8, Ago., 2013.
BOYCE, Joshua A. et al. Guidelines for the Diagnosis and Management of Food Allergy in the United States: Summary of the NIAID-Sponsored Expert Panel Report. Nutrition Research, Estados Unidos, v. 31, n. 1, p. 61-75, Jan., 2011.
BROWN, Amy C. Gluten sensitivity: problems of an emerging condition separate from celiac disease. Expert Review of Gastroenterology and Hepatology, v. 6, n. 1 p. 43-55, Fev. 2012.
BUCCI, Cristina et al. Gliadin does not induce mucosal inflammation or basophil activation in 679 patients with nonceliac gluten sensitivity. Clinical Gastroenterology and Hepatology, Italia, v. 11, n. 10, p. 1294-99, Out., 2013.
CAPANNOLO, Annalisa et al. Non-Celiac Gluten Sensitivity among Patients Perceiving Gluten-Related Symptoms. Digestion, Italia, v. 92, n. 1, p. 8-13, Ago., 2015.
CAPILI, Bernadette; CHANG, Michelle; ANASTASI, Joyce. Nonceliac gluten sensitivity—is it really the gluten? Journal for Nurse Practitioners, Hawaii, v. 10, n. 9, p. 666-73, Out. 2014.
CARROCCIO, Antonio et al. High proportions of people with non-celiac wheat sensitivity have autoimmune disease or anti-nuclear antibodies. Gastroenterology, Italia v. 149, n. 3, p. 596-603, Maio, 2015.
CASTILLO, Natalia E.; THEETHIRA, Thimmaiah G.; LEFFLER, Daniel A. The present and the future in the diagnosis and management of celiac disease. Gastroenterology Report, Boston, v. 3, n. 1, p. 3-11, Fev., 2015.
CATASSI, Carlo et al. Diagnosis of Non-Celiac Gluten Sensitivity (NCGS): The Salerno Experts’ Criteria. Nutrients, Italia, v. 7, n. 6, p. 4966-77, Jun., 2015.
CATASSI, Carlo et al. Non-Celiac Gluten Sensitivity: The New Frontier of Gluten Related Disorders. Nutrients v. 5 n. 10 p. 3839–53 Set. 2013.
CATASSI, Carlo. Gluten sensitivity. Annals of Nutrition and Metabolism, Italia, v. 67, n. 2, p. 16-26, Nov. 2015.
CH’NG, Chin L.; JONES, Keston M.; KINGHAM, Jeremy. G. C. Celiac Disease and Autoimmune Thyroid Disease. Clinical Medicine and Research, Reino Unido, v. 5, n. 3, p. 184-92, Out., 2007.
CIANFERONI, Antonella. Wheat allergy: diagnosis and management. Journal of Asthma and Allergy, Filadelfia, v. 9, p. 13-25, Jan., 2016.
COBOS-QUEVEDO, Orestes de Jesús; HERNÁNDEZ-HERNÁNDEZ, Alejandro J.; REMES-TROCHE, Jose Maria. Trastornos relacionados con el gluten: panorama actual. Medicina Interna de México, México, v. 33, n. 4, p. 487-502, Jul. 2017.
CZAJA-BULSA, Grazyna. Non coeliac gluten sensitivity – A new disease with gluten intolerance. Clinical Nutrition, Polonia, v. 34, n. 2, p.189-94, Abr., 2015.
DI SABATINO, Antonio et al. Innate and adaptive immunity in self-reported non celiac glúten sensitivity versus celiac disease. Digestive and Liver Disease, Italia, v. 48, n. 7, p. 745-52, Jul., 2016.
DUNTAS, Leonidas H. Environmental factors and autoimmune thyroiditis. Natural Clinical Practice Endocrinology and Metabolism, Grecia, v. 4, n. 8, p. 454-60, Ago., 2008.
ELLI, Lucca; RONCORONI, Leda; BARDELLA, Maria Teresa. Non-celiac sensitivity: Time for sifting the grain. World Journal Gastroenterology, Italia, v. 21, n. 27, p. 8221-26, Jul. 2015.
FASANO, Alessio et al. Nonceliac gluten and wheat sensitivity. Gastroenterology, Massachusetts, v. 148, n. 6, p. 1195-204, Maio, 2015.
FERREIRA, Fatima; INÁCIO, Filipe. Patologia associada ao trigo: Alergia IgE e não IgE mediada, doença celíaca, hipersensibilidade não celíaca, FODMAP. Revista Portuguesa de Imunoalergologia, Portugal, v. 26, n. 3, p. 171-87, Jun., 2018.
FRANCAVILLA, Ruggiero et al. Randomized Double-Blind Placebo-Controlled Crossover Trial for the Diagnosis of Non-Celiac Gluten Sensitivity in Children. American Journal of Gastroenterology, Italia, v. 113, p. 421-30, Jan., 2018.
GREUTER, Thomas et al. The perspective of celiac disease patients on emerging treatment options and non-celiac gluten sensitivity. Digestive and Liver Disease, Suíça, v. 49, n. 3, p. 268-72, Mar., 2017.
GUANDALINI, Stefano.; ASSIRI, Asaad. Celiac disease: a review. JAMA Pediatrics, Arábia Saudita, v. 168, n. 3, p. 272-78, Mar., 2014.
GUANDALINI, Stefano; POLANCO, Isabel. Nonceliac gluten sensitivity or wheat intolerance syndrome? Journal of Pediatrics, v. 166, n. 4, p. 805-811, Abr., 2015.
GUEDIN, Aline et al. Prevalência de doenças de autoimunidade em pacientes com tireoidite de Hashimoto. Revista Médica do Paraná, Curitiba, v. 73, n. 2, p. 46-50, Maio, 2015.
HADITHI, Muhammed et al. Coeliac disease in Dutch patients with Hashimoto’s thyroiditis and vice versa. World Journal of Gastroenterology, Países Baixos, v. 13, n. 11, p. 1715-22, Mar., 2007.
HASHAN, Alia; TOMER, Yaron. Genetic and epigenetic mechanisms in thyroid autoimmunity. Immunologic Research, Nova Iorque, v. 54, n. 1-3, p. 204-213, Dez., 2012.
HENGGELER, Joana Clímaco; VERÍSSIMO, Manuel; RAMOS, Fernando. Non-coeliac gluten sensitivity: A review of the literature. Trends in Food Science and Technology, Coimbra, v. 66, p. 84-92, Ago., 2017.
HIROMATSU, Yuji; SATOH, Hiroshi; AMINO, Noboyuki. Hashimoto’s Thyroiditis: History and Future Outlook. Hormones, Japão, v. 12, n. 1, p. 12-8, Mar., 2013.
HOLMES, Geoffrey. Non coeliac gluten sensitivity. Gastroenterology and Hepatology from bed to bench, Reino Unido, v. 6, n. 3, p. 115-9, Summer, 2013.
HORIE, Ichiro et al. T helper type 17 immune response plays an indispensable role for development of iodine-induced autoimmune thyroiditis in nonobese diabetic-H2h4 mice. Endocrinology, Japão, v. 150, n. 11, p. 5135-42, Set., 2009.
HUSBBY, Steffen; MURRAY, Joseph. Non-celiac gluten hypersensitivity: What is all the fuss about? F1000Prime Reports, v. 7, p 54, Maio, 2015.
IMAM, Syed K.; AHMAD, Shamim I. Thyroid Disorders: Basic Science and Clinical Practice, 1ª ed. Suíça, Springer International Publishing, XVI, p. 320, 2016.
INFANTINO, Maria et al. Diagnostic accuracy of anti-gliadin antibodies in Non-Celiac Gluten Sensitivity (NCGS) patients. Minerva Gastroenterologica e Dietologica, Italia, v. 63, n. 1, p. 1-4, Mar., 2017.
JABRI, Bana; SOLLID. Ludvig M. Mechanisms of disease: immunopathogenesis of celiac disease. Nature Clinical Practice Gastroenterology and Hepatology, Chicago, v. 3, n. 9, p. 516-25, Set. 2006.
JERICHO, Hilary; ASSIRI, Assad; GUANDALINE, Stefano.Celiac Disease and Wheat Intolerance Syndrome: A Critical Update and Reappraisal. Journal of Pediatric Gastroenterology and Nutrition, Arábia Saudita, v. 64, n.1, p. 15-21, Jan., 2017.
KAKUDO, Kennichi et al. IgG4-related disease of the thyroid glands. Endocrine Journal, Japão, v. 59, n. 4, p. 273-281, Dez., 2012.
KESSLER, Christine. Gut Grief: The Truth About Gluten Sensitivity. Clinician Reviews, Estados Unidos, v. 25, n. 12, p. S30-4, Dez. 2015.
KNEZEVIC, Jovana et al. Thyroid-Gut-Axis: how does the microbiota influence thyroid function? Nutrients, Austria, v. 12, n. 6, 1769, p. 1-16 Jun., 2020.
LACK, Gideon. Update on risk factors for food allergy. Journal of Allergy and Clinical Immunology, Londres, v. 129, n. 5, p. 1187–1197, Maio, 2012.
LIONTIRIS, Michael I.; MAZOKOPAKIS, Elias E. A concise review of Hashimoto thyroiditis (HT) and the importance of iodine, selenium, vitamin D and gluten on the autoimmunity and dietary management of HT patients. Points that need more investigation. Hellenic Journal of Nuclear Medicine, Grecia, v. 20, n. 1, p. 51-6, Abr., 2017.
LOSURDO, Giuseppe et al. Evolution of nonspecific duodenal lymphocytosis over 2 years of follow-up. World Journal of Gastroenterology, Italia, v. 21, n. 24, 7545-52, Jun., 2015.
LOSURDO, Giuseppe et al. Extra-intestinal manifestations of non-celiac gluten sensitivity: An expanding paradigm. World Journal of Gastroenterology, Italia, v. 24, n. 14, 1521-30, Abr., 2018.
LUIZ, Henrique Varas et al. IgG4-related Hashimoto’s thyroiditis – A new variant of a well known disease. Arquivos Brasileiros de Endocrinologia e Metabologia, Portugal, v. 58, n. 8, p. 862-868, Nov., 2014.
LUNDIN, Knut E. A. Non-celiac gluten sensitivity – why worry? Biomedical Central, Noruega, v. 12, n. 86, Maio, 2014.
LUNDIN, Knut E. A.; SOLLID, Ludvig M. Advances in coeliac disease. Current Opinion in Gastroenterology, v. 30, n. 2, p. 154-62, Mar., 2014.
MAINARDI, Elsa et al. Thyroid-Related Autoantibodies and Celiac Disease. Journal of Clinical Gastroenterology, Italia, v. 35, n. 3, p, 245-8, Mar. 2002.
MAIURI, Luigi et al. Association between innate response to gliadin and activation of pathogenic T cells in coeliac disease. The Lancet, Londres, v 362, n. 9377, p. 30-7, Jul., 2003.
MAJSIAK, Emilia et al. Celiac disease – disease of children and adults: symptoms, disease complications, risk groups and comorbidities. Polski Merkuriusz Lekarski, Polonia, v. 44, n. 259, p. 31-5, Jan., 2018.
MÄKELÄ, Mika Juhani et al. Wheat allergy in children: new tools for diagnostics. Clinical and Experimental Allergy, Finlandia, v. 44, p. 1420-1430, Out., 2014.
MANSUETO, Pasquale et al. Autoimmunity features in patients with non-celiac wheat sensitivity. American Journal of Gastroenterology, Italia, v. 116, n. 5, p. 1015-23, Maio, 2021.
MELO, Miguel. Tiroidites Autoimunes. Acta Médica Portuguesa, Portugal, v. 19, p. 387-94, Mar., 2006.
METSO, Saara et al. Gluten-free diet and autoimmune thyroiditis in patients with celiac disease. A prospective controlled study. Scandinavian Journal of Gastroenterology, Finlandia, v. 47, n. 1, p. 43-8, Nov. 2011.
MOLINA-INFANTE, Javier; CARROCCIO, Antonio. Suspected nonceliac gluten sensitivity confirmed in few patients after gluten challenge in double-blind, placebo-controlled trials. Clinical Gastroenterology and Hepatology, v. 15, n. 3, p. 339-48, Mar., 2017..
NASCIMENTO, Kamila de Oliveira; TAKEITI, Cristina Yoshie; BARBOSA, Maria Ivone Martins Jacintho. Doença Celíaca: Sintomas, Diagnóstico e Tratamento Nutricional. Saúde em Revista, Piracicaba, v. 12, n. 30, p. 53-63, Abr., 2012.
NAVARRO, Elizabeth; ARAYA, Magdalena. Sensibilidad no celíaca al gluten: Una patología más que responde al gluten. Revista Médica de Chile, Chile, v. 143, n. 5, p. 619-626, Maio, 2015.
NIGGEMANN, Bodo et al. Predictors of positive food challenge outcome in non-IgE-mediated reactions to food in children with atopic dermatitis. The Journal of Allergy and Clinical Immunology, Alemanha, v. 108, n. 6, p. 1053-1058, Dez., 2001.
NIJEBOER, Petula et al. Non-celiac Gluten Sensitivity. Is it in the Gluten or the Grain? Journal of Gastrointestinal and Liver Diseases, Países Baixos, v. 22, n. 4, p. 435-440, Dez., 2013.
NYLUND, Lotta; KAUKINEN, Katri; LINDFORS, Katri. The microbiota as a component of the celiac disease and non-celiac gluten sensitivity. Clinical Nutrition Experimental, Finlandia, v. 6, p. 17-24, Abr., 2016.
OBERHUBER, Georg; GRANDITSCH, Gerhard; VOGELSANG, Harald. The histopathology of coeliac disease: time for a standardized report scheme for pathologists. European Journal of Gastroenterology and Hepatology, Austria, v. 11, n. 10, p. 1185-94, Out. 1999.
ORTIZ, Catalina; VALENZUELA, Romina; LUCERO Yalda A. Enfermedad celíaca, sensibilidad no celíaca al gluten y alergia al trigo: comparación de patologías diferentes gatilladas por un mismo alimento. Revista Chilena de Pediatría, Chile, v. 88, n. 3, p. 417-23, Jun., 2017 .
PASHA, Imran et al. Wheat Allergy and Intolerence; Recent Updates and Perspectives. Critical Reviews in Food Science and Nutrition, Paquistão, v. 56, n.1, p. 13-24, Set., 2013.
PEREZ, Marina Ortega et al. Doença celíaca associada à tireoidite de Hashimoto e síndrome de Noonan. Revista Paulista de Pediatria, Sorocaba, v. 28, n. 4, p. 398-404, Dez., 2010.
PRESCOTT, Susan; ALLEN, Katrina J. Food allergy: riding the second wave of the allergy epidemic. Pediatric Allergy and Immunology, Australia, v. 22, n. 2, p. 155-60, Mar., 2011.
PYZIK, Aleksandra et al. Immune Disorders in Hashimoto’s Thyroiditis: What Do We Know So Far? Journal of Immunology Research, Polonia, v. 2015, p. 1-8, Abr., 2015.
QUIRCE, Santiago; BOYANO-MARTÍNEZ, Teresa; DÍAZ-PERALES, Araceli. Clinical presentation, allergens, and management of wheat allergy. Expert Review of Clinical Immunology, Madri, v. 12, n. 5, p. 563-572, Jan., 2016.
RALLI, Massimo et al. Hashimoto’s thyroiditis: An update on pathogenic mechanisms, diagnostic protocols, therapeutic strategies, and potential malignant transformation. Autoimmunity Reviews, Italia, v. 19, n. 10, p. 1-9, Out., 2020.
RASHID, Mohsin; LEE, Jennie. Serologic testing in celiac disease. Canadian Family Physician, Canada, v. 62, n. 1, p. 38-43, Jan., 2016.
RIBEIRO, Priscila Vaz de Melo et al. Nutritional status variation and intestinal and extra intestinal symptomatology in patients with celiac disease and non-celiac gluten sensitivity given specialized dietary advice. Revista de Nutrição, Campinas, v. 30, n.1, p, 57-67, Fev., 2017.
RODRIGUES JUNIOR, Carlos Alberto et al. Síndrome de Turner, tireoidite de Hashimoto e doença de Crohn em irmãs: relato de caso. Revista de Patologia do Tocantins, Tocantins, v. 4, n. 4, p. 29-33, Dez., 2017.
ROSZKOWSKA, Anna et al. Non-Celiac Gluten Sensitivity: A Review. Medicina, Polonia, v. 55, n. 6, p. 2-19, Maio, 2019.
SAMPSON, Hugh A. Food allergy. The Journal of Allergy and Clinical Immunology, v. 111, n. 2, p. S540-47, Fev., 2003.
SAPONE, Anna et al. Divergence of gut permeability and mucosal immune gene expression in two gluten-associated conditions: celiac disease and gluten sensitivity. Biomedical Central, Italia, v. 152, n 1, p. 75-80, Abr., 2010.
SAPONE, Anna et al. Spectrum of gluten-related disorders: consensus on new nomenclature and classification. Biomedical Central, v. 10, p. 13, Fev. 2012.
SATEGNA-GUIDETTI Carla et al. Prevalence of thyroid disorders in untreated adult celiac disease patients and effect of gluten withdrawal: an Italian multicenter study. American Journal of Gastroenterology, Italia, v. 96, n. 3, p. 751-757, Mar., 2001.
SCHERF, Katharina Anne et al. Wheat-dependent exercise-induced anaphylaxis. Clinical and Experimental Allergy, Alemanha, v. 46, n. 1, p. 10-20, Jan., 2016a.
SCHERF, Katharina Anne.; KOEHLER, Peter; WIESER, Herbert. Gluten and wheat sensitivities – An overview. Journal of Cereal Science, Alemanha, v. 67, p. 2-11, Jan., 2016b.
SCHUPPAN, Detlef; ZIMMER, Klaus-Peter. The Diagnosis and Treatment of Celiac Disease. Deutsches Ärzteblatt International, v. 110, n. 49, p. 835-846, 2013.
SCIARINI, Lorena Jurietti.; STEFFOLANI, María Eugenia; LEON, Alberto Edel. El rol del gluten en la panificación y el desafío de prescindir de su aporte en la elaboración de pan. Agriscientia, Argentina, v. 33, n. 2, p. 61-74, Dez., 2016.
SERGI, Consolato; VILLANACCI, Vincenzo; CARROCCIO, Antonio. Non-celiac wheat sensitivity: rationality and irrationality of a gluten-free diet in individuals affected with non-celiac disease: a review. BMC Gastroenterology, Italia, v. 21, n. 5, p. 2-12, Jan., 2021.
SHEWRY, Peter R.; HEY, Sandra J. (2016), Do we need to worry about eating wheat? Nutrition Bulletin, Reino Unido, v. 41, n. 1, p. 6–13, Mar., 2016.
SICHERER, Scott H.; SAMPSON, HUGH A. Food allergy: Epidemiology, pathogenesis, diagnosis, and treatment. Journal of Allergy and Clinical Immunology, Argentina, v. 133, n. 2, p. 291-307, Fev., 2014.
SILVA, Eduardo Just d Costa; SILVA, Giselia Alves Pontes. Contribuição da ultrassonografia abdominal para o diagnóstico da doença celíaca em crianças e adolescentes. Revista Brasileira de Saúde Materno Infantil, Recife, v. 14, n. 1, p. 47-52, Mar., 2014.
SILVA, Julia Gabriela Effting. Revisão bibliográfica: tireoidite de Hashimoto. Revista UNIPLAC, Santa Catarina, v. 6, n. 1, 2018.
SILVA, Lara Caroline. O glúten: mocinho ou vilão? Dissertação de Monografia – Faculdade de Pindamonhangaba, Pindamonhangaba, São Paulo, p. 36, 2015.
SOARES-WEISER, Karla et al. The diagnosis of food allergy: a systematic review and meta-analysis. Allergy, Reino Unido, v. 69, p. 76–86, Out., 2013.
SPAENIJ–DEKKING Liesbeth et al. Natural Variation in Toxicity of Wheat: Potential for Selection of Nontoxic Varieties for Celiac Disease Patients. Gastroenterology, Países Baixos, v. 129, n. 3, p. 797-806, Set. 2005.
TONUTTI, Elio; BIZZARO, Nicola. Diagnosis and classification of celiac disease and gluten sensitivity. Autoimmunity Reviews, Italia, v. 13, n. 4–5, p. 472-476, Maio, 2014.
TORDESILLAS, Leticia; BERIN, M. Cecilia.; SAMPSON, Hugh A. Immunology of Food Allergy. Immunity, v. 18, n. 1, p. 32-50, Jul., 2017.
UNIVERSIDADE AMERICANA DE ALERGIA, ASMA E IMUNOLOGIA, 2014. Disponível em: <https://acaai.org/allergies/types/food-allergies/types-food-allergy/wheat-gluten-allergy>. Acesso em: 23 de junho de 2017.
UNTERSMAYR, Eva; JENSEN-JAROLIM, Erika. The role of protein digestibility and antacids on food allergy outcome. Journal of Allergy and Clinical Immunology, Austria, v. 121, n. 6, p. 1301-8, Jun., 2008.
USAI-SATTA, Paolo et al. Motility Disorders in Celiac Disease and Non-Celiac Gluten Sensitivity: The Impact of a Gluten-Free Diet. Nutrients, Italia, v. 10, n. 11, p. 2-7, Nov., 2018.
VALENTINO, Rossella et al. (2002). Markers of potential coeliac disease in patients with Hashimoto’s thyroiditis. European Journal of Endocrinology, Italia, v. 146, n. 4, p. 479-83, Abr., 2002.
VAQUERO, Luis et al. Revisión de las patologías relacionadas con la ingesta de gluten. Nutrición Hospitalaria, Espanha, v. 31, n. 6, p. 2359-71, Jun., 2015.
VASCONCELOS, Jessica Castro. Doença autoimune da tireoide (doença de graves e tireoidite de hashimoto): estudo de marcadores celulares de apoptose e proliferação celular e a relação com características clínicas, laboratoriais e anatomopatológicas. Dissertação de mestrado, Universidade Estadual de Campinas, Campinas- São Paulo, p. 75, Ago., 2017.
VAZQUEZ-ROQUE, Maria; OXENTENKO, Amy S. Nonceliac Gluten Sensitivity. Mayo Clinic Proceedings, v. 90, n. 9, p. 1272-1277, Set., 2015.
VIRILI, Camila et al. Atypical Celiac Disease as Cause of Increased Need for Thyroxine: A Systematic Study. Journal of Clinical Endocrinology and Metabolism, Italia, v. 97, n. 3, p. E419-22, Mar., 2012.
VOLTA, Umberto et al. An Italian prospective multicenter survey on patients suspected of having non-celiac gluten sensitivity. Biomedical Central, Italia, v. 12, n. 85, p. 1-8, Maio, 2014.
VOLTA, Umberto et al. Serological tests in gluten sensitivity (nonceliac gluten intolerance). Journal of Clinical Gastroenterology, Italia, v. 46, n. 8, p. 680-85, Set., 2012.
WATKINS, Runa D.; ZAWAHIR, Shamila. Celiac Disease and Nonceliac Gluten Sensitivity. Pediatric Clinics of North America, Baltimore, v. 64, n. 3, p. 563-576, Jun. 2017.
YOO, Won Sang; CHUNG, Hyun Kyung. Recent Advances in Autoimmune Thyroid Diseases. Endocrinology and Metabolism, Corea, v. 31, n. 3, p. 379-385, Set., 2016.
ZINGONE, Fabiana et al. Alterations in Diets of Patients with Nonceliac Gluten Sensitivity Compared With Healthy Individuals. Clinical Gastroenterology and Hepatology, Italia, v. 15, n. 1, p. 63-8, Jan., 2017.
[1] Mestre em Nutrição, especialista em Nutrição Clínica.
[2] Coorientadora. Mestrado em Ciências Médicas pela UFF, pós-graduação em Nutrição Clínica Funcional (UniCSul), pós-graduação em Fitoterapia Funcional (UniCSul), pós-graduação em: Nutrição Clínica pela UNI-RIO, Nutrição e Atividade Física pela UERJ, Terapia Nutricional Enteral e Parenteral pelo CESANTA.
[3] Orientadora. Doutora e mestre em Ciências Nutricionais pelo Instituto de Nutrição Josué de Castro – UFRJ.
Enviado: Julho, 2021.
Aprovado: Julho, 2021.


3 respostas
Excelente artigo. Tenho HT e venho pesquisando sobre essa relação, pois a tempos tenho me sentido mal ao ingerir alimentos com glúten. Obrigada por seu estudo!
Boa noite Ana Paula! Que felicidade em saber que meu estudo te auxiliou de alguma forma. Essa situação ocorreu em minha familia diretamente e foi um gatilho que me impulsionou a procurar saber mais sobre essa interação.
A alimentação é um ponto crucial principalmente quando se tem uma doença associada. Espero que você esteja se sentindo muito melhor agora.
Um grande abraço!
Que artigo maravilhoso!