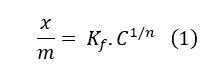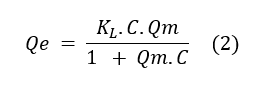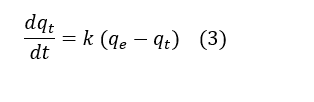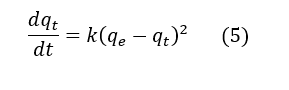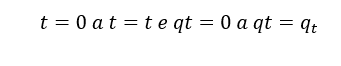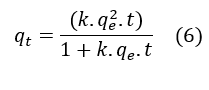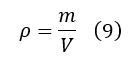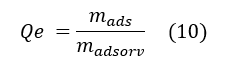ARTIGO ORIGINAL
FICHES, Iago Seginardi [1], OLIVEIRA, Kelly Regina [2], FELIPPE, Monica Tais Siqueira D’Amelio [3]
FICHES, Iago Seginardi. OLIVEIRA, Kelly Regina. FELIPPE, Monica Tais Siqueira D’Amelio. Estudo da bucha vegetal como material bioadsorvente para remoção de corante azul marinho. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano. 07, Ed. 09, Vol. 08, pp. 58-86. Setembro de 2022. ISSN: 2448-0959, Link de acesso: https://www.nucleodoconhecimento.com.br/engenharia-quimica/bucha-vegetal, DOI: 10.32749/nucleodoconhecimento.com.br/engenharia-quimica/bucha-vegetal
RESUMO
O aumento populacional ocasionou uma demanda de produção industrial que aumenta o descarte de efluentes contaminados, como os corantes, principalmente de indústrias têxteis e alimentícias. Este fato implica em aplicação métodos de remoção dos corantes, sendo que o mais indicado continua sendo o processo de adsorção devido à sua facilidade de manuseio, baixo custo e alta eficiência. Esse processo é realizado por adsorventes minerais e, portanto, faz-se necessário o desenvolvimento de novos materiais renováveis para este processo, de custo baixo e fácil acesso. O material estudado para a adsorção foi a bucha vegetal também conhecida como Luffa cylindrica, assim respondendo a seguinte questão: “O processo de adsorção seria realmente eficaz com o adsorvente Luffa cylindrica? ”. O objetivo foi avaliar a Luffa cylindrica , como bioadsorvente de corantes devido às suas características e abundância na natureza. Para tal, realizaram-se pré-tratamento de limpeza com água sanitária e tratamentos ácidos e básicos e construídas isotermas e de cinética de adsorção para verificar sua eficiência. Os resultados das isotermas mostraram que a bucha limpa com água sanitária ativada com HCl apresentou a maior capacidade adsortiva e o estudo cinético mostrou que a difusão intrapartícula pode ser a responsável pelo sistema estudado devido à transferência de massa ser um fator determinante. Desta forma, pode-se concluir que a bucha vegetal é eficiente como bioadsorvente e é um potencial material a ser aplicado industrialmente.
Palavras-chave: Adsorção, Bucha vegetal, Corante.
1. INTRODUÇÃO
A população cresce de forma exponencial, o que implica no aumento de suprir as necessidades básicas, como alimentos e roupas e, portanto, a produção industrial. Entretanto, há a geração de efluentes industriais com alto índice de contaminantes como os corantes na produção têxtil. (ALMEIDA; CORSO, 2014).
Os corantes são pequenas moléculas caracterizadas por apresentar alta estabilidade e baixa degradação em soluções aquosas. Altas concentrações desse poluente diminui a luminosidade dos corpos hídricos prejudicando a vida aquosa, podendo até ser fatal para muitos organismos aquáticos (ALMEIDA; CORSO, 2014).
Desta forma, surge a necessidade de desenvolver técnicas para a remoção desses compostos. A adsorção é uma técnica muito utilizada por ser de baixo custo e muito eficiente para a remoção de corantes. É uma operação unitária de transferência de massa que utiliza um material sólido como adsorvente para a remoção dos corantes. (ALVES; SILVA; COELHO, 2001).
O carvão ativado de origem mineral é o adsorvente mais utilizado para o tratamento de efluentes por apresentar alta capacidade de adsorção e afinidade com os corantes (ALVES; SILVA; COELHO, 2001). Entretanto, por ser um material não renovável e pelo alto custo de descarte após seu uso, precisa ser substituído (ALVES; SILVA; COELHO, 2001).
Com isso, existe um alto interesse na busca de produtos alternativos de baixo custo que possa substituir o carvão ativado como adsorventes para eliminação de corantes têxteis, sendo os seguintes: argilas ativadas, bagaço de cana, algas marinhas, madeiras e entre outros materiais celulósicos. A remoção de corantes do meio hídrico industrial envolve duas vertentes: limpeza para descarte do efluente de acordo com as normas legislativas ou recuperação do soluto para reinserção no processo. Em ambos os casos, quando utilizada a adsorção, faz-se necessário o estudo do material adsorvente e das condições de operação (ALVES; SILVA; COELHO, 2001).
Analisando este contexto, este trabalho propõe o desenvolvimento de um novo material adsorvente: a bucha vegetal (Luffa cylindrica). Além de ser um material orgânico e, portanto, renovável, é um material de baixo custo. Apresenta as características necessárias para ser utilizada como material adsorvente, como propriedades físicas estáveis que possuem fibras, lignina e polissacarídeos, totalmente renovável, não polui, e é de fácil produção e baixo custo, além do fato de conter alto grau de porosidade (ANTUNES, et al., 2016).
Neste trabalho foram comparados materiais pré-tratados em água sanitária com materiais sem o pré-tratamento, ambos ativados com ácido clorídrico ou com hidróxido de sódio. Após, foi verificada a eficiência da adsorção com estudos de comportamento por isotermas de adsorção e de cinética de adsorção (ANTUNES, et al., 2016).
1.1 A INDÚSTRIA TÊXTIL
A tecelagem é o ato de tecer por meio do entrelaçamento dos fios que vai originar o tecido plano. E devido ao movimento dos teares é necessário aumentar a resistência dos fios que estão no sentido do comprimento. Para isso, utilizam-se gomas, as quais podem ser de origem natural, como amido de milho, amido de batata, entre outros amidos. Como pode ser também goma artificial ou sintética. Então dependendo da composição do material trabalhado, utiliza-se uma goma diferente (PONNUSAMI; VIKRAM; SRIVASTAVA, 2008).
Após esse processo de tecelagem que ocorre no tear, tem-se a formação dos efluentes. Pois após a goma passar pelo processo de tecelagem, ela precisa ser removida do tecido. (PONNUSAMI; VIKRAM; SRIVASTAVA, 2008).
O beneficiamento é dividido em três etapas diferentes: o beneficiamento primário, onde tem a preparação do substrato têxtil para o tingimento, acabamento, ou até mesmo a obtenção de artigos da cor branca. O beneficiamento secundário, que são as etapas de tingimento e estamparia dos artigos têxteis. E o beneficiamento terciário que engloba a lavanderia de jeans e acabamentos funcionais (PONNUSAMI, V.; VIKRAM, S.; SRIVASTAVA, S. N., 2008).
Atualmente, a indústria têxtil é imprescindível para a sociedade, pois, em quase tudo se tem substrato têxtil, como por exemplo: vestuário, em alguns pisos, caixas de som, nos automóveis, higiene pessoal, filtro de café, e em diversas outras situações. Então, a indústria têxtil está presente em toda a vida humana (PONNUSAMI; VIKRAM; SRIVASTAVA, 2008).
Para a produção dos têxteis, a água é utilizada como solvente e como meio de transporte de auxiliares químicos e corantes. Como o consumo de água é elevado, consequentemente a quantidade de efluente gerado é um problema (ARSLAN-ALATON; GURSOY; SCHMIDT, 2008).
1.2 OS EFLUENTES DA INDÚSTRIA TÊXTIL
Os efluentes são gerados em alguns segmentos industriais. Na indústria têxtil o processo de tecelagem traz consequentemente o problema de grande geração de efluentes. Além disso, existe mais uma etapa, que envolve o consumidor final, no qual o mesmo produz o efluente doméstico que é gerado a partir das lavagens (ARSLAN-ALATON; GURSOY; SCHMIDT, 2008).
Então, no segmento de beneficiamento têxtil que ocorre a maior geração de efluentes, sendo considerado que cerca de 90% de toda a água utilizada na indústria têxtil vem dessa etapa de beneficiamento de artigos têxteis. Para o tratamento dos efluentes têxteis, existem basicamente três etapas: tratamento primário, tratando-se da remoção dos sólidos em suspensão, o secundário utilizando-se microrganismos, o terciário que faz o uso de eletrodiálise (processos oxidativos avançados) e a adsorção (ALVES; SILVA.; COELHO, 2001).
A substância que se acumula ou que fica retida na superfície de um sólido é determinado adsorvato e a substância sólida que promove a retenção de outras substâncias ou a superfície onde foi acumulado é denominado adsorvente (JIMÉNEZ-BARRIONUEVO; GARCIA-MORALES; MOLINA, 2011).
Em muitos processos de separação, depende exclusivamente de adsorção física em vez de adsorção química, considerando que pode existir a possibilidade de inúmeras camadas de moléculas a serem adsorvidas (JIMÉNEZ-BARRIONUEVO; GARCIA-MORALES; MOLINA, 2011).
A cor é o primeiro parâmetro considerado em tratamento de efluentes. Ainda não existe um método geral para descoloração de efluentes aquosos da indústria têxtil, ou seja, não existe um processo padrão bem definido pelo meio industrial. Assim atualmente a maior parte das indústrias realiza processos de tratamentos fundamentados na operação de precipitação/coagulação, seguida de oxidação biológica, principalmente com lodos ativados porém isso muitas vezes acaba não sendo o procedimento com maior viabilidade (ARSLAN-ALATON; GURSOY; SCHMIDT, 2008).
1.3 OS CORANTES
Um corante é uma substância que ao ser adicionada à outra, altera a cor da mesma. Podendo ser um composto químico, pigmento, tinta ou tintura. São substâncias compostas e compostos químicos, sintéticos ou naturais. Podem ser aplicados na forma de suas soluções, tanto em água quanto em outros solventes, como exemplo o etanol, que se fixam por escala molecular a um substrato, que pode ser um tecido (têxtil), papel e outros derivados de celulose, cabelo humano e pelos de animais, couro e diversos materiais. As substâncias corantes devem ser estáveis à luz, especialmente a ultravioleta e aos processos de lavagem e à ação da água, como da chuva. Também devem proporcionar fixação uniforme com as fibras do substrato (ALMEIDA; CORSO, 2014).
Há várias classes de corantes que são classificadas segundo sua fixação. A parte da molécula do corante que se liga ao grupo cromóforo, é responsável pela fixação do corante à fibra. Entre essas várias classes, destacam-se os reativos, que são utilizados no tingimento de fibras têxteis, por se ligarem de forma covalente proporcionando solidez e estabilidade química. Os corantes reativos são compostos que contém um ou mais grupos químicos capazes de formar ligações covalentes com um oxigênio, nitrogênio ou enxofre de substratos como fibras celulósicas (grupo hidroxila), fibras proteicas (grupos amino, hidroxila e mercaptano) e poliamidas (grupo amino). Cerca de 80% dos corantes reativos pertencem à classe dos azocorantes (KIMURA, 2001).
Os efluentes têxteis possuem individualidades próprias que vêm sendo estudadas ao longo dos anos a fim de obter métodos de eliminação em águas residuais. Os tratamentos são simples, porém, quando se encontram com efluentes tóxicos, faz-se necessário o uso de técnicas de remoção mais complexas para abdicar da poluição. O que diferencia o tratamento específico de cada substância é o fato de alguns dos corantes terem alta intensidade na cor, alguns agentes contaminantes e presença de outras diferentes substâncias que as tornam tóxicas (PERUZZO, 2003).
Existem vários métodos que são possíveis utilizar na remoção desses efluentes, como o reagente de Fenton[4], que é usado no tratamento da água residual por quebrar compostos orgânicos, o percloroetileno[5], que é muito utilizado em produtos de limpeza. Outro método químico empregado é por ozonização, uma vez que este método possui alto nível oxidante, destruindo hidrocarbonetos, coagulando e precipitando compostos orgânicos como, por exemplo, o rompimento das duplas ligações dos grupos cromóforos pelo ozônio (ALMEIDA; CORSO, 2014).
1.4 ADSORÇÃO
Adsorção é um fenômeno de transporte de transferência de massa, no qual os componentes que estão presentes em um fluido acumulam-se espontaneamente sob uma superfície sólida. Esse fluido pode ser tanto líquido como gasoso. Em contrapartida, a remoção das substâncias a partir da superfície é chamada dessorção. Os componentes que se unem à superfície são chamados de adsorvatos, enquanto que a fase sólida que retém o adsorvato é chamada de adsorvente. A ocorrência desse fenômeno se dá em virtude do resultado de forças que não se encontram de forma balanceada na superfície do sólido e por isso atraem as moléculas do fluido em contato por um tempo determinado (ALVES; SILVA.; COELHO, 2001).
Existem dois tipos de adsorção, a química, denominada de quimissorção, e a física, denominada de fisissorção (ALVES; SILVA.; COELHO, 2001).
1.4.1 ISOTERMAS
As isotermas de adsorção representam a relação de equilíbrio entre a concentração na fase fluida e a quantidade de material adsorvido por grama de material adsorventes a uma dada temperatura (ALVES; SILVA; COELHO, 2001).
Em alguns sistemas simples pode-se traçar uma curva de concentração do soluto na fase sólida em função de concentração do soluto na fase fluida. Essas curvas, por serem construídas em uma determinada temperatura, são denominadas de isotermas de adsorção. A adsorção ocorre por colisão e atração de moléculas com sítios ativos vazios (ALVES; SILVA; COELHO, 2001).
Os pesquisadores das isotermas, nomearam as quatro principais classes como sendo: S e L Isotermas do tipo Langmuir; H de alta afinidade e; C constante de partição conforme apresenta a Figura 1.
Figura 1. Tipos de isotermas de adsorção representados pela quantidade de adsorvente utilizada versus a concentração. Sendo as curvas: S e L Isotermas do tipo Langmuir; H de alta afinidade e; C constante de partição
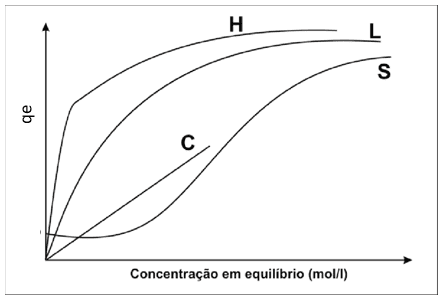
A isoterma linear passa pela origem e a quantidade adsorvida é proporcional à concentração no fluído. Isotermas convexas são favoráveis, pois grandes quantidades adsorvidas podem ser obtidas com baixas concentrações de soluto (BARROS, 1992).
As isotermas do tipo S têm inclinação linear e são convexas em relação à abscissa, sendo que no início apresentam baixa adsorção, a qual aumenta à medida que cresce o número de moléculas adsorvidas. São isotermas que aparecem quando as seguintes condições são atendidas:
- Adsorvente microporoso;
- Soluto apresenta maior afinidade pelo adsorvente do que pelo solvente;
- Regiões de diferentes graus de solubilidade para o soluto.
As isotermas do tipo H são um caso especial das curvas do tipo L. Uma característica marcante é uma parte vertical no início da curva. histerese (ALVES; SILVA; COELHO, 2001).
Por fim, as isotermas tipo C ou “Constant partition” (partição constante), apresentam-se em um aspecto retilíneo indicando partição constante do soluto entre a solução e a superfície do adsorvente. histerese (ALVES; SILVA; COELHO, 2001).
A primeira classificação de isotermas foi proposta por Brunauer (1940), que as dividiu em cinco tipos. O sexto tipo, foi identificado muito adiante por Sing (1982), o mesmo foi inserido às isotermas, sendo reconhecida hoje pela IUPAC – International Union of Pure and Applied Chemistry. Sendo a pressão relativa, na abscissa, e a quantidade de massa adsorvida, na ordenada. A Figura 2 a seguir representa as isotermas descritas anteriormente conforme IUPAC: histerese (ALVES; SILVA; COELHO, 2001).
Figura 2. Classificação das isotermas de acordo com a IUPAC
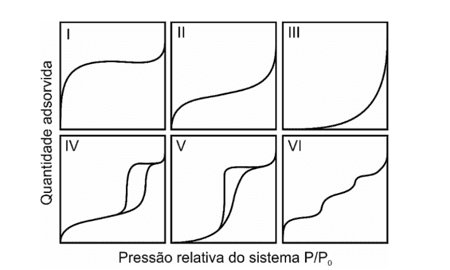
As isotermas do tipo I caracterizam-se pela elevada taxa de adsorção considerando a baixa pressão relativa. O calor de adsorção varia com a superfície coberta, fato que ocorre muito em casos de isotermas do tipo I. Caracterizadas, normalmente por sólidos microporosos com superfície externa pequena. O acesso ao microporo é o que limita a adsorção, não sendo sua superfície interna. Essas isotermas são representadas pela equação de Langmuir (1918) (ALVES; SILVA; COELHO 2001).
Para isotermas do tipo II, ao invés de se estabilizar, como a do tipo I, logo após o crescimento à baixa pressão relativa, ele continua a crescer, criando nele próprio as multicamadas. Quando os poros já se encontram saturados, a condensação capilar se inicia, incrementando, por sua vez, novamente a taxa de adsorção. Adsorventes dessa isoterma são considerados macroporosos, em muitas das vezes (DO NASCIMENTO, et al., 2014).
Isotermas do tipo III apresentam determinado formato convexo por toda sua faixa de pressão relativa. Esse tipo de isotermas são comuns, como por exemplo, a adsorção de vapor d’água em carvão não poroso, definido como sendo macroporoso. A forma convexa, dá-se porque as interações entre o adsorvato e o adsorvente são menos significativas do que a interação entre as partículas do próprio adsorvato. Caracterizando-se por baixa taxa de adsorção e baixas pressões e relativo aumento, conforme a pressão aumenta, por conta do início da interação com o sólido. A equação de Freundlich (1930) se aplica para este tipo de isoterma histerese (ALVES; SILVA; COELHO, 2001).
Isotermas do tipo IV tem por principal característica a histerese, associada à condensação capilar em mesoporos. Este, possui a mesma performance da isoterma do tipo II, antes de iniciar a histerese. São obtidas por adsorventes industriais mesoporosos, como as sílicas histerese (ALVES; SILVA; COELHO, 2001).
As isotermas do tipo V não são muito comuns. Tem comportamento como combinação da isoterma do tipo I e III. Comparando-se com tipo III, é um adsorvente mais poroso, sendo que o par adsortivo possui interação fraca. Essa isoterma também apresenta histerese (ALVES; SILVA; COELHO, 2001).
As isoterma do tipo VI, são consideradas de adsorção em multicamadas de gases nobres sobre sólidos uniformes. As camadas são adsorvidas em determinada faixa de pressão relativa (ALVES; SILVA; COELHO, 2001).
1.5 MODELO DE FREUNDLICH
Freundlich escreveu um modelo que apresenta as isotermas de adsorção, o qual pode ser aplicado a sistemas não ideais, adsorventes de superfície heterogênea e, além de a adsorção ocorrer em multicamadas, isto é, fisissorção (interação fraca entre o adsorvato e o adsorvente). A Equação 1 apresenta este modelo (DO NASCIMENTO, et al., 2014).
Em que, x é a massa do soluto, m é a unidade de massa do adsorvente, Kf é a constante empírica que está sujeita da natureza dos sólidos e gás e da temperatura, C é a concentração de estabilidade do soluto, n representa o efeito da concentração na capacidade de adsorção (DO NASCIMENTO, et al., 2014).
1.6 MODELO DE LANGMUIR
Outro modelo de adsorção bastante utilizado para representar isotermas é o de Langmuir. O modelo, que considera a adsorção química, considera que a adsorção acontece em uma única camada, monocamada, que os sítios são limitados e que cada sítio adsorve apenas uma única molécula de adsorvato e que elas não reagem entre si. Este tipo de interação é uma interação química. A Equação 2 apresenta o modelo de Langmuir (HO E MCKAY, 1999; FEBRIANTO et al, 2009).
Em que, Qe é a quantidade adsortiva por gramas de reagente ![]() , KL é a constante conexão com energia de ligação entre soluto e superfície adsorvente, C é a concentração de estabilidade do soluto, Qm é a quantidade máxima de soluto que pode ser adsortiva ocorrendo esse fator após formar-se camada monomolecular completa (HO E MCKAY, 1999; FEBRIANTO, et al., 2009).
, KL é a constante conexão com energia de ligação entre soluto e superfície adsorvente, C é a concentração de estabilidade do soluto, Qm é a quantidade máxima de soluto que pode ser adsortiva ocorrendo esse fator após formar-se camada monomolecular completa (HO E MCKAY, 1999; FEBRIANTO, et al., 2009).
1.7 CINÉTICA DE ADSORÇÃO
A velocidade com que ocorre a adsorção de um soluto em um adsorvente é representada pela cinética de adsorção. Através dela é possível identificar qual mecanismo controla esse processo. Existem diversos modelos cinéticos para representar a cinética de adsorção. Além do mecanismo de adsorção, a cinética permite que sejam determinados o tempo e a quantidade que será adsorvida. Esses dados permitem projetar um equipamento industrial (HO E MCKAY, 1999; FEBRIANTO, et al., 2009).
Os modelos cinéticos lineares são aqueles que representam a transferência de massa externa, além de representar a difusão do soluto no poro e na superfície do adsorvente. Entretanto, os modelos cinéticos de pseudo-primeira ordem e de pseudo-segunda ordem são aqueles que mais representam as cinéticas de adsorção reais (HO E MCKAY, 1999; FEBRIANTO, et al., 2009).
A equação de Lagergren (Equação 3), a qual representa o modelo de pseudo-primeira ordem em um sistema sólido – líquido, foi proposta em 1898. A motivação foi a necessidade de determinar a capacidade adsortiva de um sólido (HO E MCKAY, 1999; FEBRIANTO, et al., 2009):
Em que, ? é a constante da taxa de adsorção de pseudo-primeira ordem ![]() são as quantidades adsorvidas por grama de adsorvente no equilíbrio e no tempo t, respectivamente
são as quantidades adsorvidas por grama de adsorvente no equilíbrio e no tempo t, respectivamente ![]() (HO E MCKAY, 1999; FEBRIANTO, et al., 2009).
(HO E MCKAY, 1999; FEBRIANTO, et al., 2009).
Para integrar a equação 3, foram consideradas as seguintes condições de contorno:
![]() O resultado está representado pela Equação 4 (HO E MCKAY, 1999; FEBRIANTO, et al., 2009):
O resultado está representado pela Equação 4 (HO E MCKAY, 1999; FEBRIANTO, et al., 2009):
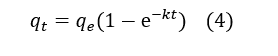 Ho e McKay (1999) propuseram outro modelo, o qual representa uma cinética de pseudo-segunda ordem, a qual está representada pela Equação 5:
Ho e McKay (1999) propuseram outro modelo, o qual representa uma cinética de pseudo-segunda ordem, a qual está representada pela Equação 5:
Em que, ? é a constante da taxa de adsorção de pseudo-segunda ordem ![]() são as quantidades adsorvidas por grama de adsorvente no equilíbrio e no tempo t, respectivamente (mg g-1) (HO E MCKAY, 1999; FEBRIANTO, et al., 2009).
são as quantidades adsorvidas por grama de adsorvente no equilíbrio e no tempo t, respectivamente (mg g-1) (HO E MCKAY, 1999; FEBRIANTO, et al., 2009).
As condições de contorno utilizadas na integral da Equação 5 são:
A integral com essas condições de contorno resulta na Equação 6:
De forma geral, a cinética de adsorção é rápida inicialmente, devido à adsorção ocorrer principalmente na superfície externa, prosseguindo de forma lenta na superfície interna do adsorvente, devido ao fenômeno de difusividade. Esse comportamento é citado por diversos autores (BARROS, 1992).
O mecanismo do processo de adsorção definitivo que pode não ser obtido pelos modelos cinéticos descritos acima pode ser representado pelo modelo da difusão intrapartícula. Esse modelo baseia-se no fato de que se a difusão intrapartícula é o fator determinante da velocidade (FEBRIANTO et al, 2009).
1.8 BIOADSORVENTES
Os bioadsorventes são materiais orgânicos com habilidade adsortiva, ou seja, são biomassas que apresentam características que permite ocorrer a adsorção. O uso de resíduos vegetais como adsorvente tem sido bastante estudado, pois estes materiais representam recursos não aproveitados e, em muitos casos, representam também poluentes importantes, por causa dos problemas com sua disposição final. Sabendo assim que um adsorvente é uma superfície sólida insolúvel, habitualmente porosa e com área de superfície, capaz de efetuar em sua superfície a adesão de moléculas insolúveis dispersas em um meio líquido ou gasoso (FEBRIANTO, et al., 2009).
1.8.1 BUCHA VEGETAL
A Luffa cylindrica, conhecida popularmente como bucha vegetal, é uma fibra vegetal lignocelulósica proveniente de fonte renovável extremamente barata e abundante na natureza. É uma fibra forte, apresenta baixa densidade, alta porosidade, volume específico dos poros bastante alto, estabilidade em uma ampla faixa de pH e resistência a autoclavagens sem a ocorrência de danos, mudanças de formas, estrutura e textura, além de estar dotada de um intrincado conjunto de fibras finas lignocelulósicas hidrofílicas, resistentes, elásticas e suaves, sendo também biodegradável e de baixo custo. Devido a isso, é um bioadsorvente promissor de acordo com estudos de Altınışık; Gür e Seki (2010) e Demir; Balköse e Ulku (2008).
De maneira geral, a bucha é considerada uma planta de ampla adaptabilidade em clima subtropical ao equatorial, em regiões úmidas até áridas podem apresentar condições agroclimáticas favoráveis à sua produção (SILVA; QUEIROZ, 2012). Entretanto, é passível de haver variações em suas características, nas taxas de crescimento, nos níveis de produtividade e na qualidade das buchas.
É leve e apresenta naturalmente uma arquitetura entrelaçada e altamente porosa. Essas características conferem a esse material um potencial de uso como suporte em imobilização de biomassa. As flores femininas são solitárias, e se diferenciam pela presença de delicado ovário alongado, como um pequeno fruto. As flores masculinas são maiores, mais numerosas e surgem em grupos. A polinização é feita por abelhas. Seu fruto, de até 50 cm de comprimento, é cilíndrico e prefere solo argiloso, bem drenado e com acidez fraca. Deve ser plantada na primavera, exige fertilidade do solo e apresenta boa resposta à adubação orgânica (SOUSA NETO, 2016).
Este trabalho teve como foco o estudo da bucha vegetal como potencial adsorvente para a remoção de corante no meio aquoso.
2. MATERIAIS E MÉTODOS
Com estudo teórico realizado, iniciou-se a etapa experimental totalizando aproximadamente 500 dias de pesquisa (JUL/2020-NOV/2021).
2.1 OBTENÇÃO DA ESPONJA VEGETAL
A esponja vegetal Luffa cylindrica, empregada neste estudo, foi colhida naturalmente do pé, de plantação própria, na zona rural da cidade de Socorro-SP.
2.2 CORANTE
O corante utilizado foi o Guarany cor de nº16 – azul marinho; segundo especificações do fabricante. O comprimento de onda do azul marinho está entre 440nm 485nm nas cores do espectro visível, e o aparelho foi ajustado para fazer a leitura em 480nm por influência da forte tonalidade atingida.
2.3 PREPARAÇÃO DA ESPONJA
A preparação da esponja consistiu em dois métodos. No primeiro, após coletada, a amostra foi lavada com água e sabão e seca no sol. Em seguida foi triturada em um moinho de facas e acondicionada em recipiente vedado, para efeito da reprodutibilidade dos resultados.
O segundo consistiu em realizar a limpeza com água sanitária pura comercial (concentração de cloro ativo de 2% e o hipoclorito de sódio com uma concentração entre 12 a 15% de cloro ativo). A esponja ficou submersa por quatro horas e depois lavada e seca sob exposição ao sol. Em seguida, as esponjas foram secas em estufa a 100°C por 24h para remoção da umidade ainda presente.
2.4 DISTRIBUIÇÃO GRANULOMÉTRICA
Antes da ativação, a esponja triturada foi submetida à distribuição granulométrica com peneiras mesh, com Tyler 4, 10, 16, 30, 50 e 200, respectivamente. Após a separação nas peneiras, foi aferida a massa em cada peneira e determinada a porcentagem correspondente. Em seguida, determinou-se a porcentagem acumulada retida em cada peneira e a sua complementar, a porcentagem que passou por cada peneira e os respectivos diâmetros.
2.5 DETERMINAÇÃO DA MASSA DE ÁGUA DO PROCESSO
Antes de ser levada para estufa, aferiu-se a massa de cada amostra para determinar a quantidade de água presente no processo (processo de perda por secagem).
A preparação da amostra consistiu na secagem em estufa a 105°C por 24 horas. Para verificar a quantidade de água que cada material pode absorver, aferiram-se as massas de cada amostra seca, submeteram-se as amostras em recipiente com água por 5 minutos, retirou-se o excesso e novamente aferiram-se as massas. As três amostras foram então submetidas ao processo de secagem e estufa por 24h a 100°C. O procedimento foi realizado em triplicata.
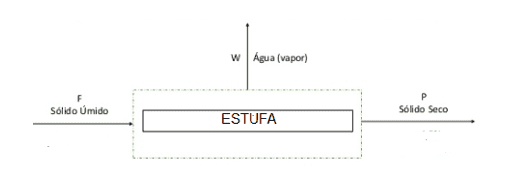
A Figura 3 e a Equação 7 apresentam o esquema do balanço de massa utilizado para esse cálculo o qual E é a variação da massa representado por F (massa do sólido úmido que entra no sistema) menos P (massa do sólido seco que sai do sistema). A Equação 8 apresenta o cálculo da porcentagem de água removida.
Figura 3. Representação do balanço do processo de secagem
2.6 DETERMINAÇÃO DA MASSA ESPECÍFICA
A massa específica do material foi determinada colocando 0,42 g de bucha em uma proveta de 40 mL. Em seguida foi utilizada a Equação 9.
Em que, m é a massa da bucha e V o volume medido na proveta.
2.7 TESTE DE DISPERSÃO
O teste de dispersão consistiu em colocar as amostras de adsorvente (natural e ativado em ácido clorídrico) em meio aquoso por 24 horas. Entendendo como que o adsorvente se comporta em meio aquoso.
2.8 IDENTIFICAÇÃO VISUAL
Para verificar o quanto a ativação influenciou nas fibras da bucha, foram fotografadas amostras em um microscópio biológico com resolução 1000x.Com isso é possível entender se com material ativado houve alguma mudança em sua estrutura física.
2.9 ATIVAÇÃO DA BUCHA
A ativação do material adsorvente foi realizada em meio ácido com HCl 0,1 molar e em meio básico com NaOH 0,1 molar. Para 0,2 g de material foram utilizados 50 ml de solução que permaneceu por uma hora em contato com o adsorvente. O material foi filtrado a vácuo e seco em estufa por 24h a 108ºC. Concentrações baseadas no estudo de Antunes et al. realizado em 2016 que obteve bons resultados com o material adsorvente.
2.10 ISOTERMAS
Para a construção das isotermas, 0,1 g de adsorvente ativado foi colocado em 20 mL de solução de corante, à temperatura ambiente por 1 hora. Foram mantidas constantes a quantidade de amostra utilizada, agitação (50 rpm) e o volume de solução. As concentrações de corante utilizadas foram de 500 mg/L; 250 mg/L; 125 mg; 72,5 mg/L; 31,25 mg/L. Assim além dos testes realizados na bucha vegetal foram realizados os mesmos testes nas mesmas condições para o carvão ativado comercial afim de comparar resultados.
A quantidade adsorvida foi determinada mediante análise das soluções resultantes, por um espectrofotômetro (espectrofotometria UV-Vis), em 480 nm o qual foi determinado pelo comprimento de onda da cor azul marinho utilizada para realização do experimento. A capacidade adsortiva foi avaliada, empregando um planejamento experimental, considerando a influência dos fatores temperatura, pH e limpidez do material. Assim realizando obtenção das isotermas de adsorção com o adsorvente em contato com o adsorbato no período de 1 hora.
Para a montagem da isoterma de adsorção em sólidos foi usada a Equação 10 para obtenção de quantidade adsorvida.
Em que, ![]() é a massa de material adsorvido e
é a massa de material adsorvido e ![]() é a massa de material adsorvente.
é a massa de material adsorvente.
Sendo assim o gráfico montado foi referente à quantidade adsorvida x concentração. Com os testes citados anteriormente foi possível definir qual meio (ácido ou básico) apresentou a melhor adsorção. Assim, com a melhor condição, foi realizado o experimento para determinar a cinética de adsorção.
2.11 CINÉTICA QUÍMICA
Para obtenção do gráfico da cinética de adsorção, foi necessário saber o quanto material foi capaz de adsorver do corante de maior concentração no período de 1 hora. Aferindo a absorbância de 40 mL de 6 soluções, cada uma em contato com 0,20 g do material e agitação constante em um intervalo de tempo. Os experimentos foram interrompidos em intervalos de 10 minutos no período de uma hora (10min; 20min; 30min; 40min; 50min; 60min). Sendo assim foi possível gerar um gráfico relacionando absorbância e tempo, e testando os ajustes do modelo de pseudo-primeira e segunda ordem para relacionar com a curva experimental.
A curva da cinética química foi construída a partir dos dados da concentração pelo tempo que cada amostra ficou em agitação. E como resultado final, foi comparada com as amostras de diferentes situações obtidas.
3. RESULTADOS E DISCUSSÃO
O resultado foi dividido em caracterização do material, limpeza e ativação para posteriormente início dos testes de adsorção.
3.1 DETERMINAÇÃO DA QUANTIDADE DE ÁGUA ABSORVIDA PELA BUCHA VEGETAL
Na primeira etapa de caracterização, o material passou por uma etapa de lavagem, isso ocasionou maior umidade no material em questão. Nesta etapa foi necessário o uso da estufa para secagem do adsorvente in natura, e assim foi possível realizar um estudo de perda de água por secagem/balanço de massa como apresenta a Tabela 1. A quantidade de água removida foi determinada pela Equação (8) fórmula relacionada ao balanço de massa. Primeiro calculou-se a massa de água removida conforme apresentado na Tabela 1 em 3 amostras e na amostra da casca que também foi analisada.
Tabela 1. Massa da bucha vegetal com água, seca (pós estufa) e água removida
| Amostra | Massa pré estufa | Massa pós estufa | Massa água removida | Água removida (%) |
| Bucha 1 | 17,89g | 3,26g | 14,63g | 81.77 |
| Bucha 2 | 14,18g | 2,87g | 11,31g | 79.77 |
| Bucha 3 | 12,72g | 2,02g | 10,7g | 84.11 |
| Casca da bucha | 36,8g | 8,95g | 27,85g | 75.67 |
Fonte: do autor.
A bucha vegetal absorveu 0,82 ± 0,02 g de água por g de material. Já a casca, absorveu aproximadamente 0,76 g de água por g de material, cerca de 9% a menos que a bucha. A bucha possui maior capacidade de reter a água em relação a sua casca, devido à sua estrutura. Entretanto, quando desidratada, a casca ficou ainda mais úmida em relação à bucha. Sua estrutura possui paredes mais finas e frágeis com a função de transportar e proteger a bucha, que tem o papel de reter água/nutrientes. Percebe-se que pelos resultados obtidos a casca se sobressaiu na coluna de massa de água removida mostrando que a bucha tem maior capacidade de reter água.
A variação presente em cada uma, se deve à diferença de trituração de cada amostra que não é totalmente uniforme. Pelos resultados obtidos, a amostra da bucha que obteve maior eficiência na secagem é a amostra que estava com maior mesh (mais triturada). Assim foi possível verificar a alta importância da análise granulométrica para o processo, sendo necessária a padronização de mesh da amostra ao longo do experimento, diminuindo variações de dados.
3.2 DISTRIBUIÇÃO GRANULOMÉTRICA
A análise granulométrica foi realizada com o uso de seis peneiras de mesh diferentes e foi realizado as análises separando as amostras em questão, conforme apresenta a Tabela 2.
Tabela 2. Representação dos dados da análise granulométrica
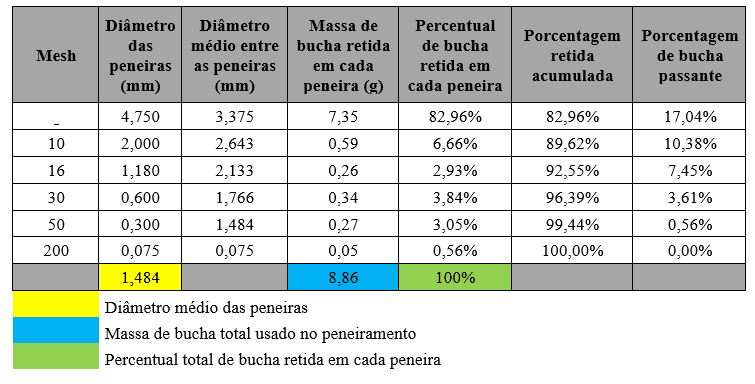
Pela Tabela 2, é possível concluir que as amostras ficaram retidas, a maior parte na primeira peneira, a de mesh 4. Então nas outras seguintes houve uma retenção menor de massa da bucha.
Foi possível determinar o diâmetro médio, diâmetro em 83% da distribuição da amostra acumulada. O valor médio das peneiras utilizadas foi de 1,484mm.
3.3 CARACTERÍSTICAS VISUAIS APÓS A ATIVAÇÃO
As amostras de bucha vegetal foram divididas, sendo que cada metade passou por um processo de limpeza distinto. O primeiro processo com água sanitária e o segundo apenas com água e sabão. Com esse processo, observou-se que o material limpo com a água sanitária apresentou coloração mais clara e límpida que a amostra lavada com água e sabão.
Em seguida, o material foi ativado em meio ácido com HCl e meio básico com NaOH. Desta forma, obtiveram-se quatro amostras, sendo duas limpas com água sanitária e ativadas com HCl e NaOH; e duas naturais, limpas apenas com água e sabão, ativadas com HCl e NaOH conforme mostra figura 5.
Figura 5. Material a: limpeza com água sanitária e ativada com HCl (0,1 mol/l), b: limpeza com água sanitária e ativada com NaOH(0,1 mol/l), c:limpeza somente com água e sabão neutro ativada com NaOH (0,1 mol/l) e d: limpa somente com água e sabão neutro ativada com NaOH( 0,1 mol/l)

Observa-se que a ativação com HCl ( 0,1 mol/l) deixou o material mais claro em relação à ativação com NaOH( 0,1 mol/l). Este último ataca material orgânico destruindo as fibras. Em relação à ativação com HCl( 0,1 mol/l), a limpeza com água sanitária deixou o material mais claro, indicando maior remoção das impurezas, o que contribuiu para a maior eficiência do preparo da bucha vegetal.
Assim, após a ativação ainda foi possível realizar a checagem pelo ponto de vista microscópico, onde percebe-se diferença nos filamentos do material conforme mostra Figura 6. Os filamentos tornaram-se lineares.
Figura 6. Visão microscópica do adsorvente: em a bucha antes de ser ativada em meio ácido, em b representação de bucha ativada com HCl e seca em estufa por 24 horas

3.4 CARACTERIZAÇÕES DAS AMOSTRAS NATURAIS E ATIVADAS COM HCL
Ainda no fator caracterização, os testes de dispersão apresentaram resultados positivos tanto no material natural quanto no ativado. Isso se deve pelo fato do adsorvente ter se separado em água, não ficando disperso, conforme mostra a Figura 7.
Figura 7. Teste de dispersão: a) bucha antes de ser ativada em meio ácido, b) representação de bucha ativada com HCl e seca em estufa por 24 horas

Por fim realizou-se mais uma análise comparativa entre material ativado e natural, a densidade. Com o uso da relação de massa e volume foi possível obter os valores de 0,42g/ml (adsorvente natural) e 0,28gl/ml (adsorvente ativado). Com isso nota-se que a diferença entre as densidades é dada devido à ativação, concluindo que esse processo influenciou na formação de porosidade no material o tornando mais leve em relação ao natural.
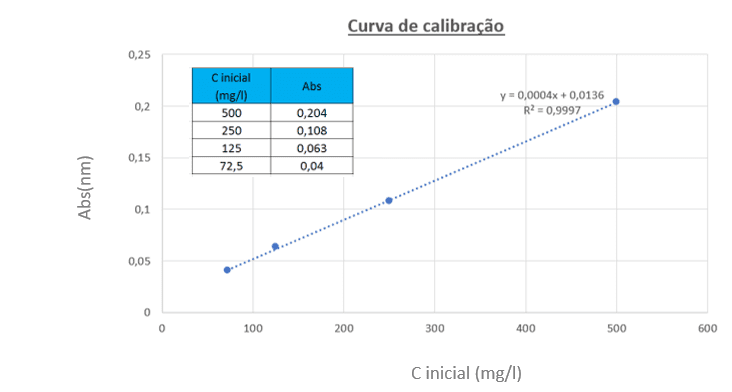
3.5 CURVA DE CALIBRAÇÃO
A curva de calibração foi construída com 4 concentrações distintas e está apresentada no gráfico da Figura 8. Eixo x e y representam absorbância e concentração do corante. A curva foi construída para análise de concentração do corante antes de passar pelo processo de adsorção, e com esses parâmetros posteriormente foi possível construir a curva experimental para saber a aproximação dos valores pós adsorção nas isotermas
Percebe-se que a equação obtida pela reta é uma equação com alto grau de linearidade, além disso se apresentou muito bem ajustada à curva com o valor do coeficiente de determinação, sendo assim, apresentou um resultado satisfatório.
Figura 8. Obtenção de curva da calibração com os valores de concentração e absorbância obtidos nas soluções de corante por meio do espectrofotômetro
3.6 ISOTERMAS
O primeiro estudo realizado, foi a obtenção das isotermas. A Figura 9 apresenta o resultado visual de alguns pontos obtidos com a bucha vegetal limpa com água sanitária e ativada com HCl. Da direita para a esquerda observam-se as soluções na concentração inicial
para o resultado final obtido.
Figura 9. Aspecto visual após o experimento da isoterma para a concentração inicial de 500 ppm de azul com a bucha vegetal limpa com água sanitária e ativada com HCl

Os gráficos apresentados na Figura 10 apresentam as isotermas obtidas com o corante azul com o bioadsorvente preparado pelas quatro variações: bucha vegetal limpa ativada com HCl (Figura 10a), outra limpa ativada com NaOH (Figura 10c), natural ativada com HCl (Figura 10b) e natural com NaOH (Figura 10d).
Observa-se que as isotermas obtidas com a bucha limpa em água sanitária, apresentaram cerca de 40% mais adsorção, isto é, mais material adsorvido por grama de adsorvente utilizado. Ademais, quando ativado em meio ácido, o resultado foi cerca de 15% maior que a ativada com NaOH.
Figura 10. Isotermas de adsorção das diferentes condições testadas. A qual representam as amostras limpas com água sanitária e as naturais que não passaram pelo mesmo processo
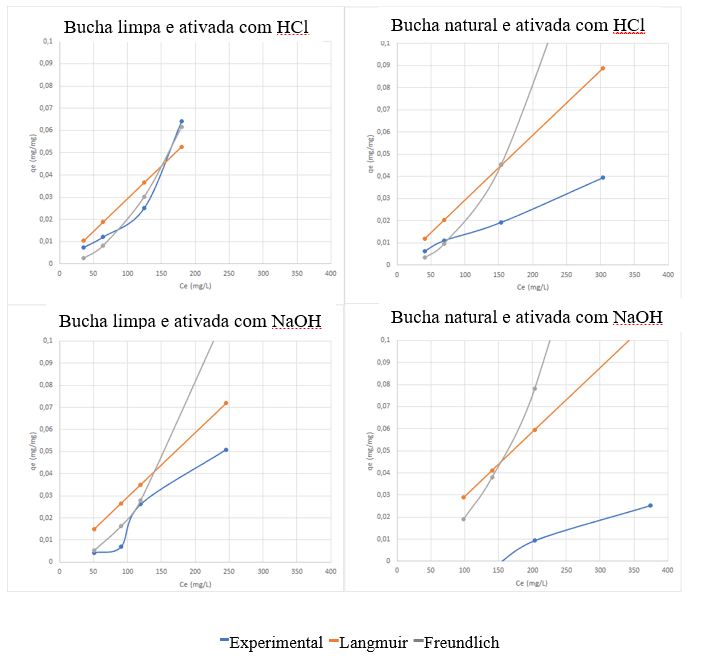
Sem a limpeza com a água sanitária, as impurezas contidas na estrutura podem ter influenciado tanto a ativação (formação de poros) como o contato do adsorvente com o soluto, o que explica a baixa quantidade de material adsorvido por grama de adsorvente, cerca de 33% menor quando ativada com HCl e 44% menor quando ativada com NaOH.
Para identificar as condições de adsorção, foram ajustados os modelos de Langmuir e Freundlich às isotermas. O meio de maior adsorção, bucha limpa com água sanitária e ativação em meio ácido foi o único que pode ser ajustado a um modelo, o de Freundlich, o que indica adsorção física. Os valores ajustados pelo modelo foram:
- Kf = 2,61.10-6 mg de material adsorvido/mg de adsorvente
- n = 0,52
O valor de Kf é um valor baixo, indicando baixa capacidade de adsorção. O valor de n, que deveria ser maior do que 1, indica que a adsorção não foi favorável. Este fato foi observado no comportamento da isoterma. A Figura 11 apresenta a comparação entre as isotermas obtidas com as isotermas da IUPAC (Figura 2) e as isotermas apresentadas pela literatura (Figura 1).
Figura 11. Comparativo entre isoterma obtida e literatura
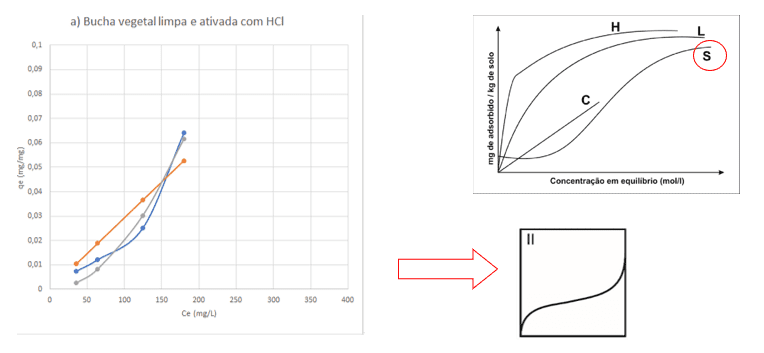
Em análise comparativa entre a isoterma obtida na amostra limpa com água sanitária e ativada com HCl e as isotermas da IUPAC, as que mais se aproximaram da curva experimental, foram as curvas S e II. Os microporos do material são conhecidos pelo fato de o soluto apresentar maior afinidade pelo adsorvente do que pelo solvente, e de suas regiões possuírem diferentes graus de solubilidade para o soluto, conforme citado anteriormente no estudo bibliográfico da curva S por Alves; Silva Junior e Coelho (2001).
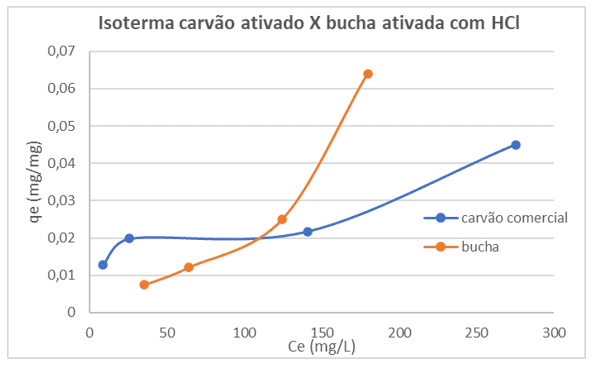
Foi realizada uma comparação da isoterma da bucha vegetal limpa e ativada com HCl com o carvão ativado comercial. Como é possível observar nas isotermas obtidas nas mesmas condições apresentadas no gráfico (Figura 12), nas soluções com maior quantidade de carvão (dois primeiros pontos do gráfico), o carvão apresentou melhor adsorção, porém com menores quantidades de carvão, a bucha vegetal apresentou melhor adsorção. Este fato é positivo para a bucha vegetal, pois é possível adsorver mais com menos. Assim também é importante ressaltar que isso não significa que o carvão não é um bom adsorvente, apenas que nas mesmas condições experimentais não superou a capacidade adsortiva da bucha vegetal.
Figura 12. Comparativo entre isoterma obtida com o carvão ativado comercial e bucha ativada com HCl
3.7 CINÉTICA DE ADSORÇÃO
Para entender melhor o processo de adsorção do corante azul na bucha vegetal, fez-se o estudo da cinética de adsorção. O experimento teve duração de uma hora e está apresentado na Figura 13.
Figura 13. Gráfico obtido na cinética de adsorção no período de 1 hora de testes
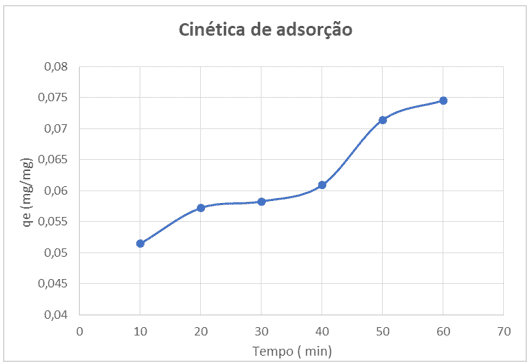
A cinética de adsorção apresentou comportamento crescente, isto é, há apenas o processo de adsorção durante o tempo estudado. Observa-se que não foi atingida a estabilidade de adsorção, isto é, poder-se-ia ter tido mais adsorção em maior tempo de contato. Entretanto, nota-se que na isoterma de bucha vegetal limpa com água sanitária e ativada com HCl, o valor máximo de qe obtido foi de 0,065 mg/mg. O tempo de contato de 1h poderia ter sido maior.
Para a determinação dos parâmetros cinéticos, ajustaram-se dois modelos de adsorção, de pseudo-primeira ordem e pseudo-segunda ordem. O resultado está apresentado na Figura 14.
Figura 14. Gráfico de modelos cinéticos ajustados aos dados experimentais
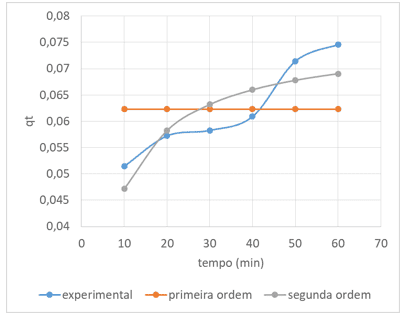
Observa-se que nenhum dos dois modelos apresentou resultado ajustado, entretanto, foram calculados os parâmetros cinéticos para pseudo-segunda ordem. Os parâmetros obtidos de constante cinética foram de 2,13 mg material adsorvido/mg de adsorvente por minuto, o que indica uma velocidade de adsorção boa e o valor da capacidade de equilíbrio em 0,076 mg material adsorvido/mg adsorvente. Esse valor foi próximo do obtido experimentalmente. Quando os modelos cinéticos não determinam a cinética de adsorção, é a difusão intrapartícula o fator determinante da velocidade (FEBRIANTO et al, 2009).
Estudos de Demir; Balköse e Ulku (2008) mostram que o processo de adsorção depende de alguns fatores, como estrutura do adsorvente e do adsorvato; condições do experimento, como o pH do meio que interfere na carga superficial do adsorvente em questão, além de afetar o grau de ionização dos corantes. A esponja vegetal, utilizada neste experimento, possui porosidade, como observado no cálculo de balanceamento na secagem. No experimento foi possível perceber que com a variação no valor do pH entre ácido e básico afetou-se o processo de adsorção pela dissociação de grupos funcionais de sítios ativos na superfície do adsorvente. Assim conduz modificação na reação e nas características de equilíbrio do processo de adsorção, assim o pH ácido foi a condição que mais se ajustou aos dados obtidos da curva, combinado com a bucha que passou pela etapa de limpeza.
Então a bucha apresentou resultados positivos após a realização dos experimentos, mostrando que quando ativada em meio ácido apresenta melhor performance e eficiência no processo de adsorção, o que a torna viável devido ao fácil acesso que o material apresenta.
4. CONCLUSÃO
A bucha vegetal mostrou-se eficiente na adsorção de corante azul quando pré-tratada e ativada com ácido sulfúrico. As análises realizadas mostraram que é um material poroso, comprovado por sua capacidade de absorver 0,82 ± 0,02 g de água por g de bucha. A casca da bucha absorveu menos água devido à sua estrutura.
A alta porosidade da bucha vegetal foi um dos fatores que contribuiu para a boa capacidade de adsorção do corante azul ao longo de seus filamentos.
A separação pelas peneiras granulométricas permitiu reter a maior quantidade na peneira superior, pois, apesar de o material apresentar tamanho e diâmetro das fibras diferentes, a maioria apresentou maior diâmetro. Os diferentes tratamentos proporcionaram não apenas diferentes aparências nos adsorventes obtidos, mas também capacidade de adsorção diferentes.
O pré-tratamento foi importante na capacidade adsortiva. A bucha vegetal limpa com água sanitária apresentou maior capacidade de adsorção, cerca de 40%, que a limpa com água e sabão. Este fenômeno pode ser explicado pela maior remoção de impurezas microscópicas retiradas da bucha vegetal com a água sanitária.
O tipo de ativação também influenciou os resultados, sendo a melhor aquelas ativadas com HCl. O hidróxido de sódio é um material básico que possui a característica de destruir as fibras de materiais orgânicos, o que pode explicar a menor adsorção neste caso.
A cinética de adsorção mostrou que o equilíbrio desta adsorção acontecerá depois dos 60 min. Nenhuma das equações cinéticas foi ajustada corretamente na curva, o que indica o efeito de difusividade muito acentuado no processo. Assim, neste contexto o presente artigo visou responder: “a utilização do processo de adsorção seria realmente eficaz, e com o adsorvente Luffa cylindrica?’’.
As análises comparativas com o carvão ativado mostraram que a bucha se sobressaiu mostrando bom rendimento, fato que para a indústria é importante, pois por ser um material orgânico a bucha pode ter diferentes usos em seu descarte. A geração de energia por pirólise gerará menos gases poluentes, os quais podem ainda ser amenizados por filtros.
Desta forma, concluiu-se que a bucha vegetal é um potencial material para adsorver corante azul além de ser biodegradável e de baixo custo.
REFERÊNCIAS
ALMEIDA, Erica Janaina Rodrigues.; CORSO, Carlos. Renato. Comparative study of toxicity of azo dye Procion Red MX-5B following biosorption and biodegradation treatments with the fungi Aspergillus niger and Aspergillus terreus. Chemosphere, v. 112, p.317–322, 2014. Disponível em : <https://doi.org/10.1016/j.chemosphere.2014.04.060>.Acesso em: 18/07/2019 .
ALTINIŞIK, Aylin; GÜR, Emel; SEKI, Yoldas. A natural sorbent, Luffa cylindrica for the removal of a model basic dye. Journal of Hazardous Materials. 2010. P.658-664. Disponível em : <https://doi.org/10.1016/j.jhazmat.2010.03.053>.Acesso em: 04/07/2019.
ALVES, Alfredo Augusto Cunha; SILVA, José Fransmir Santos; COELHO, Eugênio Ferreira. Estimation of banana leaf area by simple and non-destructive methods. In: VIII Congresso Brasileiro de Fisiologia Vegetal, 2001, Ilhéus. Anais. Ilhéus: Sociedade Brasileira de Fisiologia Vegetal, 2001. p. 3p.
ANTUNES, Angela; MELLO, Francine Todescato; ARPINI, Cézar Augusto de Aguiar; PIASSON, Janaína; MOREIRA, Aline Matuella; DALLAGO, Rogério Marcos; VENQUIARUTO, Luciana Dornelles. Avaliação da potencialidade de adsorção da bucha vegetal (Luffa cylindrica) para remoção de corantes de meios aquosos. Revista TECNO-LOGICA Vol 20 nº2 p 72-79 Santa Cruz do Sul,2016. Disponível em: <https://online.unisc.br/seer/index.php/tecnologica/article/view/6397> Acesso em: 20/08/2019.
ARSLAN-ALATON, Idil; GURSOY, Betul Hande; SCHMIDT, Jens-Ejbye. Advanced oxidation of acid and reactive dyes: Effect of Fenton treatment on aerobic, anoxic and anaerobic processes. Dyes and Pigments, v. 78, p. 117-130, 2008. Disponível em: <https://doi.org/10.1016/j.dyepig.2007.11.001> Acesso em: 14/08/2019.
BARROS, Haroldo Lúcio de Castro. Química Inorgânica – Uma Introdução. Ed.1 Belo Horizonte: Editora da UFMG. 518p,1992.
DEMIR, Hasan; BALKÖSE, Devrim.; ULKU, Semra. Dye adsorption behaviour of Luffa cylindrica fibers. Journal of Hazardous Materials. 2008. P. 389-394. Disponível em: <https://doi.org/10.1016/j.jhazmat.2007.08.070> Acesso em: 11/01/2020.
DO NASCIMENTO, Ronaldo Ferreira; LIMA, Ari Clecius Alves; VIDAL, Carla Bastos; MELO, Diego de Quadros; RAULINO, Giselle Santiago Cabral. Adsorção: aspectos teóricos e aplicações ambientais. E-book. Fortaleza: Imprensa Universitária, 2014. 256 p. Disponível em: <http://www.repositorio.ufc.br/handle/riufc/10267> Acesso em: 03/08/2019.
FEBRIANTO, Jonathan; KOSASIH, Aline Natasia; SUNARSO, Jaka; JU, Yi-Hsu; INDRASWATI, Nani; ISMADJI, Suryadi. Equilibrium and kinetic studies in adsorption of heavy metals using biosorbent: summary of recent studies. Journal of Hazardous Materials. v.162, p.616–645, 2009. Disponível em: < https://doi.org/10.1016/j.jhazmat.2008.06.042> Acesso em: 13/03/2020.
HO, Yuh Shan; MCKAY, Gordon. A kinetic study of dye sorption by biosorbent waste product pith. Resources, conservation and recycling, v. 25, n. 3, p. 171-193, 1999. Disponível em: < https://doi.org/10.1016/S0921-3449(98)00053-6> Acesso em: 09/08/2019.
JIMÉNEZ-BARRIONUEVO, Maria Magdalena; GARCÍA -MORALES, Victor; MOLINA, Luis Miguel (2011). Validation of an instrument to measure absorptive capacity. Technovation v. 31 (5/6), 190-202. Disponível em: < https://doi.org/10.1016/j.technovation.2010.12.002> Acesso em: 29/07/2019.
KIMURA, Mieko. Prestação de serviços na área de análises físico-química e sensorial de alimentos. Universidade Estadual Paulista (UNESP), 2001. Disponível em: <http://hdl.handle.net/11449/148100> Acesso em: 05/02/2020.
PERUZZO, Lucile Cecília. Influência de agentes auxiliares na adsorção de corantes de efluentes da indústria têxtil em colunas de leito fixo. Dissertação (mestrado) – Universidade 37 Federal de Santa Catarina, Centro Tecnológico. Programa de Pós-Graduação em Engenharia Química. 2003. Disponível em: <http://repositorio.ufsc.br/xmlui/handle/123456789/85622> Acesso em: 02/09/2019.
PONNUSAMI, Venkatachalam; VIKRAM, Surendra; SRIVASTAVA, Sanjay. Guava (Psidium guajava) leaf powder: Novel adsorbent for removal of methylene blue from aqueous solutions. Journal of Hazardous Materials Volume 152, Issue 1, 21 March 2008, Pages 276-286. Disponível em: <https://doi.org/10.1016/j.jhazmat.2007.06.107> Acesso em: 15/09/2019.
SILVA, Dirceu Jorge; QUEIROZ, Augusto César. Análise de Alimentos Métodos Químicos e Biológicos. 3a edição ed. Viçosa: Editora UFV,235p, 2012.
SOUSA NETO, José Alistor. Avaliação e desenvolvimento de um método para extração seletiva de cromo utilizando a luffa cylindrica como bioadsorvente, 2016. Disponível em: <https://repositorio.bc.ufg.br/tede/handle/tede/6485> Acesso em: 13/01/2020.
APÊNDICE – REFERÊNCIA NOTA DE RODAPÉ
4. O método Fenton é o processo que ocorre a oxidação catalítica de compostos orgânicos na presença de sais de ferro e peróxido de hidrogênio em pH próximo a 3.
5. O percloroetileno é um composto orgânico halogenado onde o cloro presente substitui o hidrogênio em hidrocarbonetos de cadeia aberta.
[1] Graduado em Engenharia Química pela Universidade São Francisco (USF) – Bragança Paulista. ORCID: 0000-0003-2591-9067.
[2] Graduanda de Engenharia Química, Técnica em Química pela Universidade São Francisco (USF) – Bragança Paulista. ORCID: 0000-0001-5031-5631.
[3] Docente na Universidade São Francisco. Engenheira química pela Ufscar. Mestre e doutora pela USP. ORCID: 0000-0002-7652-9045.
Enviado: Fevereiro, 2022.
Aprovado: Setembro, 2022.