ARTIGO ORIGINAL
SILVA, Maria Goretti Varejão da [1], ANDRADE, Jéssica Martins de [2], MOURA, Fernanda Maria de Lino [3], MEDEIROS, Anna Karolyne de Araujo [4], CORDEIRO, Geovania de Souza [5], MELO, Nataly Sayonara da Silva [6], ROLIM, Maria Betânia Queiroz [7], MOURA, Vilton Edson Figueirôa de [8], SILVA, Daniel Dias da [9], SOARES, Anísio Francisco [10], MEDEIROS, Elizabeth Sampaio de [11]
SILVA, Maria Goretti Varejão da. et al. Enterococcus spp. resistente a antimicrobianos e formadores de biofilme em queijo de coalho. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano. 08, Ed. 06, vol. 01, pp. 05-31. Junho de 2023. ISSN: 2448-0959, Link de acesso: https://www.nucleodoconhecimento.com.br/biologia/resistente-a-antimicrobianos, DOI: 10.32749/nucleodoconhecimento.com.br/biologia/resistente-a-antimicrobianos
RESUMO
O objetivo deste estudo foi realizar uma revisão da literatura sobre Enterococcus spp. resistente a antimicrobianos e cepas formadoras de biofilme em queijo de coalho originário do Nordeste brasileiro. Foi observado o impacto da presença de bactérias enterocócicas formadoras de biofilme no queijo de coalho e seus impactos na saúde pública dos consumidores desse tipo de alimento. No entanto, mais estudos microbiológicos sobre o queijo de coalho devem ser realizados devido à sua importância para a economia e saúde pública.
Palavras-chave: Enterococcus spp, Microrganismos, Queijos, Resistência a Medicamentos, Saúde Pública.
INTRODUÇÃO
O queijo de coalho é um alimento típico brasileiro, presente na região Nordeste há mais de 150 anos e muito consumido nesta região, é elaborado a partir de leite cru ou pasteurizado. Estados como Pernambuco, Ceará, Rio Grande do Norte e Paraíba são os principais produtores desse tipo de queijo. Sua importância na economia é considerável e significativa para os fornecedores de leite, principalmente aqueles que não têm acesso às unidades de processamento de leite (SILVA et al., 2012).
Os enterococos, bactérias Gram-positivas isoladas do solo, águas superficiais e do mar, também em associação com plantas, estão presentes em produtos alimentícios fermentados. São Bactérias Ácido Lácticas (BAL) amplamente utilizadas como culturas iniciadoras na indústria de laticínios para a produção de queijo, iogurte e leite fermentado (GIRAFFA, 2003; GIRAFFA e ROSSETTI, 2004). Geralmente, não causam efeitos adversos em indivíduos saudáveis, porém, também podem se apresentar como patógenos oportunistas relacionados a infecções nosocomiais, principalmente em pacientes imunocomprometidos (LOSSOUARN et al., 2019).
As infecções nosocomiais, causadas pela microbiota intra-hospitalar e por vezes condicionadas pela microbiota dos profissionais de saúde e do próprio doente, constituem um problema de grande importância clínica e epidemiológica. Por causarem altas taxas de morbidade e mortalidade, além de longos dias de internação e desperdício de recursos econômicos, são considerados uma situação emergente em todo o mundo (MONTOYA et al., 2015).
Além disso, a resistência intrínseca de Enterococcus spp. a vários antimicrobianos e a aquisição de resistência a outros, como a vancomicina, frequentemente utilizada no tratamento de pacientes com infecções graves causadas por bactérias Gram-positivas, levou ao surgimento de E. faecalis como um patógeno hospitalar relevante (ANDRADE, 2018).
Enterococcus spp. é descrito como a causa de pelo menos 10% das infecções hospitalares, segundo Hollenbeck e Rice (2012), e as principais espécies associadas a essas infecções, E. faecalis (85-90%) e E. faecium, apresentam resistência intrínseca a vários antimicrobianos, como β-lactâmicos (penicilina e cefalosporinas), aminoglicosídeos (estreptomicina), lincosamidas (clindamicina em E. faecalis), estreptograminas (o combinação quinupristina-dalfopristina em E. faecalis) e sulfametoxazol-trimetoprima. O uso descontrolado de antimicrobianos tem desencadeado um aumento de cepas resistentes aos tratamentos, e esse cenário torna-se mais preocupante quando os microrganismos se apresentam na forma de biofilme. Estruturas complexas de aglomerados microbianos protegidos por uma camada de exopolissacarídeos (EPS), os biofilmes impedem a penetração de drogas e dificultam o tratamento de infecções (COSTERTON et al. 1999; URQUHART et al. 2019).
Apesar do exposto, ainda há carência de registros na literatura sobre Enterococcus spp. e cepas formadoras de biofilme isoladas de alimentos de origem animal. Portanto, pesquisar esses microrganismos com tais características em alimentos de origem animal torna-se relevante.
METODOLOGIA
O presente estudo descreve uma revisão de literatura qualitativa, narrativa, na qual 90 artigos foram finalmente selecionados para inclusão e leitura na íntegra. A base de dados foi a seleção de artigos disponíveis no Google Acadêmico, Scielo e PubMed, onde 34, 14 e 42 artigos respectivamente foram selecionados para possível inserção final na revisão. A seleção dos artigos ocorreu durante o ano de 2020 e levou em consideração artigos publicados em espanhol, inglês e português. Foram selecionados artigos que apresentassem o tema proposto pela presente pesquisa. Durante a busca do material bibliográfico foram utilizadas as palavras-chave: enterococcus, enterococcus durans, enterococcus faecalis, enterococcus faecium, queijo, queijo de coalho, queijo tipo coalho, resistência, resistência antimicrobiana, infecção hospitalar, infecção nosocomial, biofilme, formação de biofilme.
A revisão foi produzida com base na leitura, análise, interpretação e síntese das informações adquiridas em obras selecionadas que foram consideradas relevantes para o tema abordado no projeto. Os critérios de exclusão do material bibliográfico foram: trabalhos publicados cujos resultados não se aplicassem aos objetivos desta revisão e artigos cujo tema de estudo não estivesse relacionado ao tema. Os critérios de inclusão levaram em consideração artigos que contemplassem a especificidade do tema em questão e artigos e dissertações publicados nos idiomas espanhol, inglês e português. Não houve restrições quanto ao ano de publicação dos estudos.
REVISÃO DE LITERATURA
A IMPORTÂNCIA DO LEITE E DO QUEIJO NO BRASIL
Segundo dados do Instituto Brasileiro de Geografia e Estatística (IBGE,2018), a produção de leite no Brasil tem grande impacto no cenário mundial, sendo o quinto país com maior produção do mundo, perdendo posição apenas para União Europeia, Estados Unidos, Índia e China.
Os produtos lácteos sob inspeção sanitária no Brasil captaram 24,45 bilhões de litros de leite em 2018, um aumento de 0,5% em relação a 2017 (IBGE, 2019), sendo um fator muito importante, pois o leite é um produto rico em constituintes nutricionais e energéticos, é considerado um alimento completo e seu consumo é recomendado para pessoas de todas as idades. Produzido mundialmente, o leite é amplamente utilizado na alimentação infantil e é um alimento de primeira linha no combate à mortalidade infantil em países em desenvolvimento (LUNA, 2012).
Queijo é um produto que pode ser maturado ou in natura, obtido pelo isolamento parcial ou total do soro do leite, leite reconstituído ou soro lácteo, que são coagulados com o auxílio de enzimas, coalho, bactérias, ácidos orgânicos isolados ou combinados (BRASIL, 1996).
Devido às suas propriedades sensoriais e nutricionais, o queijo é um produto lácteo tradicional com grande aceitação no mercado, apresentado para consumo em diversas variedades que diferem quanto ao tipo, sabor, cor, forma e aroma, buscando agradar aos múltiplos paladares de seus consumidores (NOGUEIRA, 2006).
Os queijos são alimentos de alto valor biológico, ricos em proteínas, cálcio, fósforo, zinco, iodo, selênio, vitaminas e oligoelementos. Existem no mundo mais de 1.000 tipos de queijos produzidos a partir de diferentes tipos de leite e processos produtivos diferenciados (LÁCTEA BRASIL, 2006).
Com o desenvolvimento tecnológico, muitas variedades surgiram em nível nacional, algumas delas de expressão regional, como o queijo de coalho (BORGES et al., 2003). Segundo Andrade (2006), o nome deriva do processo de coagulação, observado pela primeira vez devido à ação de enzimas coagulantes encontradas no estômago de animais herbívoros. Um dos produtos típicos da região Nordeste, o queijo de coalho, possui significativo valor cultural e socioeconômico, faz parte da alimentação diária e é comumente consumido como aperitivo ou como acompanhamento de outros alimentos. Sua produção é passada de geração em geração, principalmente por meio de métodos artesanais, utilizando conhecimentos práticos tradicionais transmitidos no ambiente familiar (SOUZA et al., 2014). Quando feito de forma artesanal, sua produção sofre algum tipo de adaptação de acordo com a habilidade, estrutura física e econômica do fabricante. Como resultado, os queijos produzidos possuem características organolépticas que lhes conferem uma identidade regional e cultural própria de cada região (MENEZES, 2013).
O queijo de coalho, tanto artesanal quanto industrializado, pode não apresentar segurança e padronização microbiológica por ser um produto muitas vezes manipulado e elaborado em condições higiênico-sanitárias insatisfatórias (ANDRADE, 2006), sendo considerado um alimento altamente suscetível à contaminação (SANTANA et al., 2008).
Para regulamentar sua produção, existem algumas regulamentações, tais como: o Regulamento Técnico de Identidade e Qualidade de Produtos Lácteos, que estabelece os padrões de identidade e os requisitos mínimos de qualidade que o queijo de coalho deve atender para ser destinado ao consumo humano (FREITAS FILHO et al., 2009). A Lei Federal nº 13.860 de 18/07/2019 sancionada pelo Presidente da República do Brasil dispõe sobre a produção e comercialização de queijo artesanal, e laticínios correlatos, enquanto a Portaria ADAGRO nº 007 de 04/01/2018 aprova o Regulamento Técnico de Identidade e Qualidade do Queijo de Coalho Artesanal em Pernambuco (Imprensa Nacional, 2019; DOE Pernambuco, 2018).
O queijo industrializado (tipo A) segue as normas do MAPA como a Instrução Normativa nº 5 de 14/02/2017, que estabelece requisitos para avaliação de equivalência ao Sistema Único de Atenção Sanitária Agropecuária quanto à estrutura física, dependência e equipamentos dos estabelecimentos agroindustriais de pequeno porte produtores de produtos de origem animal. Por fim, a Portaria MAPA 368/97 dispõe sobre o regulamento técnico sobre as condições higiênico-sanitárias e Boas Práticas de Fabricação para estabelecimentos de processamento/industrialização de alimentos.
ENTEROCOCUS SPP.
Enterococcus spp. bactérias são cocos Gram-positivos, de formato oval, que formam cadeias curtas, pertencentes à família Enterococcaceae e possuem 58 espécies descritas (PARTE, 2014). Eles crescem facultativamente em ambientes ricos em oxigênio e com pouco oxigênio. São microrganismos extremamente resistentes a diferentes condições ambientais, suportando temperaturas variáveis de 10°C a 45°C, tanto em ambientes hipotônicos de até 6,5% de cloreto de sódio, quanto em ambientes hipertônicos com pH variando de ácido (pH entre 4 e 9,6), podendo suportar até 60°C por até 30 minutos (KONEMAN et al., 2014).
O termo Enterococcus foi descrito pela primeira vez por Thiercelin em 1899, quando descreveu bactérias comensais com capacidade de se tornarem patogênicas. Devido à sua morfologia e algumas semelhanças bioquímicas, os enterococos foram inicialmente considerados pertencentes ao gênero Streptococcus (SOLACHE, 2019). São cocos anaeróbios facultativos, formando cadeias de vários comprimentos. São habitantes comensais do trato gastrointestinal de humanos e outros mamíferos com capacidade de sobreviver em ambientes como hospitais (ARIAS e MURRAY, 2012).
O Enterococcus spp. e suas espécies provêm de diversas origens, como meio ambiente, origem animal e humana. Esses microrganismos são de grande importância, pois fazem parte da microbiota normal de animais e humanos, tendo uma distribuição semelhante em ambos (FISCHER e PHILLIPS, 2009), constituem um grupo complexo de bactérias que desempenham um duplo papel nos alimentos, pois enquanto algumas cepas são utilizadas como culturas iniciadoras em queijos e alimentos enlatados, conferindo sabor, odor e textura a esses produtos, outras cepas estão relacionadas à deterioração de alimentos como potenciais reservatórios de enterococos que abrigam determinantes de virulência e resistência (TERRA et al., 2018).
A partir de contaminação fecal, pele animal, água, equipamentos de ordenha e tanques de expansão, Enterococcus spp. pode contaminar o leite e seus derivados. As bactérias Enterococcus são frequentemente encontradas em leite e derivados, principalmente em queijos, devido a características como resistência à pasteurização por serem termorresistentes e à refrigeração por serem psicrotróficas (PORTO et al., 2016).
Enterococcus spp. fazem parte da microbiota envolvida em diversos processos fermentativos em alimentos, como os que envolvem leite, carnes e vegetais. Eles são componentes naturais dos alimentos e desempenham um papel importante no amadurecimento do queijo e na melhoria do sabor. Esses microrganismos possuem uma ampla adaptabilidade para resistir a condições adversas, como temperatura, pH, hiperosmolaridade e dessecação prolongada (ALI et al., 2014).
Sua presença em alimentos tem sido motivo de preocupação dos órgãos de saúde pública, principalmente por suas características ambíguas (MORAES et al., 2012). Do lado positivo, há o desenvolvimento de propriedades sensoriais por meio de reações bioquímicas durante a maturação: proteólise, lipólise, uso de citrato e produção de compostos aromáticos voláteis (HUGAS et al., 2003; JAMET et al., 2012), por outro lado, tornaram-se importantes patógenos humanos entre pacientes hospitalizados e idosos com doenças graves subjacentes (LECLERQ, 2009; ROSENTHAL et al., 2015; SIEVERT et al., 2013; ARCHAMBAUD et al., 2019). Nos últimos anos, tem sido associada a bacteremia, sepse e endocardite bacteriana (HEIDARI et al., 2017), essas infecções podem se originar da microbiota normal ou também podem ser transmitidas de paciente para paciente ou adquiridas através do consumo de água ou alimentos contaminados (MURRAY et al., 2004).
Enterococcus spp. foram inicialmente classificados como Streptococcus do grupo D por suas espécies possuírem o antígeno de parede celular do grupo D associado à sua membrana citoplasmática (TEIXEIRA e MERQUIOR, 2013). Dentre as mais de 50 espécies do gênero Enterococcus spp., E. faecalis e faecium são as mais freqüentemente isoladas de humanos,
animais e amostras de alimentos. De 80 a 90% de Enterococcus spp. isolados de amostras clínicas em humanos são da espécie E. faecalis, 5 a 15% são E. faecium, mas outras espécies também podem ocasionalmente ser identificadas nestes isolados como E. hirae, E. durans, E. gallinarum ou E. casseliflavus (SILVA et al. No entanto, ao contrário de E. faecalis ou E. faecium, E. durans não é um patógeno comum em humanos (BYUNG et al., 2019).
RESISTÊNCIA ANTIMICROBIANA E ENTEROCOCCUS SPP.
O surgimento de resistência antimicrobiana em enterococos e sua disseminação em alimentos sugerem um risco à saúde pública, devendo ser considerada uma possível correlação entre cepas presentes em hospitais com aquelas isoladas de alimentos (RIBOLDI et al., 2009). O aparecimento da multirresistência bacteriana no ambiente hospitalar vem aumentando nas últimas décadas, aumentando a morbimortalidade, o tempo de internação, consequentemente os custos com saúde, desafiando a saúde pública e elevando cada vez mais as prescrições de antibióticos (LÍRIO et al., 2019). Dentre os principais patógenos bacterianos hospitalares resistentes aos antibióticos disponíveis está o gênero Enterococcus, cujas infecções representam reais dificuldades terapêuticas (BLANCO et al., 2016).
A resistência antimicrobiana (RAM) está crescendo em todo o mundo e ameaça a prevenção e a cura de infecções. Em 2016, a resistência antimicrobiana foi responsável por 70.000 mortes e estima-se que até 2050 causará até 10 milhões de mortes anuais. Essa estimativa é baseada na realidade atual de uso excessivo de antibióticos, tratamentos incompletos, negligência no controle de infecções, saneamento precário em países em desenvolvimento e globalização que permite a fácil distribuição de microrganismos pelo mundo. Esses fatores contribuem para a RAM, que aliada aos poucos antibióticos em desenvolvimento, resultam em infecções sem tratamento (BELLO e DINGLE, 2018).
Sabe-se que Enterococcus spp. tendem a sofrer seleção natural a cada aplicação de antimicrobiano, levando à formação de um reservatório animal de Enterococcus spp.
A resistência genética a substâncias nocivas é um processo protetor natural em algumas espécies bacterianas que, em alguns casos, foi predeterminado há milhões de anos (BARLOW e HALL, 2002; LEBRETON et al., 2017). No entanto, o uso excessivo e indiscriminado de antibióticos, tanto no tratamento de infecções humanas quanto na pecuária, resultou em um aumento exponencial das taxas de resistência. Atualmente, a resistência bacteriana é considerada um dos maiores problemas relacionados à saúde pública associada à morbimortalidade (OLIVEIRA, 2019).
Sugere-se que o uso de antimicrobianos na alimentação animal como promotores de crescimento tenha criado grandes reservatórios de genes transferíveis de resistência a antibióticos em vários ecossistemas e, conseqüentemente, uma possível rota de transmissão de Enterococcus spp. via cadeia alimentar (SHEPARD e GILMORE, 2002).
O Enterococcus spp. O gênero tem relevância clínica baseada não apenas em sua prevalência crescente nas últimas décadas, mas também no alto índice de cepas resistentes a antibióticos (MEDEIROS, 2011). Riboldi et al. (2009), ao analisar alimentos e laticínios “naturais” obtidos em Porto Alegre/RS, Brasil, observaram alta frequência de resistência a antimicrobianos utilizados na agricultura, também encontraram incidência de resistência à nitrofurantoína, antimicrobiano utilizado no tratamento de infecções geniturinárias, em isolados de queijo e repolho.
Apesar de revolucionar as práticas médicas e estar entre os maiores avanços do último século, os agentes antimicrobianos têm um período limitado de utilidade clínica devido ao surgimento de resistência (LUO et al., 2019).
O aumento da resistência antimicrobiana é um problema crescente, não só no ambiente hospitalar, mas também para pacientes não internados (PÓVOA et al., 2019), pois afeta sobremaneira a prevenção e o tratamento satisfatório de um número significativo de infecções causadas por bactérias, parasitas, vírus e fungos (CAMACHO et al., 2018).
O uso inadequado de antimicrobianos pode agravar uma infecção e levar ao desenvolvimento de resistência bacteriana em seu tratamento (OLIVEIRA e OLIVEIRA, 2014). Tendo uma reflexão mais profunda sobre o assunto, sabe-se que existe resistência natural, o que é importante, mas a atitude humana de usar antimicrobianos de forma racional pode resultar na reversão desse aspecto da resistência, ganhando principalmente a saúde pública (CAMACHO et al., 2018).
Um dos maiores problemas de saúde pública, que é a resistência antimicrobiana, tem grande relevância clínica, pois dificulta o controle de doenças infecciosas quando a eficácia terapêutica diminui, levando ao aumento das taxas de morbimortalidade. Sem contar que traz altos custos em saúde e também pode promover a transmissão de infecções para outros indivíduos (MONTEMAYOR et al., 2014). Nos serviços hospitalares, principalmente nos países em desenvolvimento, existe um grave problema de saúde que é o surgimento de resistência bacteriana aos antibióticos (PEREIRA et al., 2013).
No campo da saúde, desde 1944 quando foram identificados os primeiros casos de resistência bacteriana, foi possível observar a rápida evolução desse episódio. Após 38 anos desde a criação da vancomicina para uso clínico na Europa em 1988, foram detectados enterococos resistentes a este antimicrobiano. Nos Estados Unidos, em 2002, o Staphylococcus aureus apresentava o mesmo perfil de resistência dos enterococos, tendo como agravante o uso da vancomicina como antibiótico de escolha para o tratamento do Staphylococcus aureus na maioria das infecções causadas por esse microrganismo (DERDE et al., 2012). No Brasil, o panorama da resistência bacteriana é preocupante, e o crescente surgimento de novas cepas de bactérias multirresistentes em hospitais preocupa os profissionais de saúde (COSTA, 2013).
Os mecanismos de resistência de muitos microrganismos aos antibióticos são variáveis, com diversos aspectos fisiopatológicos como os de enzimas como as β-lactamases que destroem as penicilinas e algumas cefalosporinas, outras enzimas modificadoras inativam o cloranfenicol e os aminoglicosídeos como a estreptomicina e a gentamicina. Outro mecanismo de resistência é direcionado para a forma de transporte do antibiótico, como a resistência às tetraciclinas, cloranfenicol e fluoroquinolonas. Um terceiro tipo de mecanismo altera o fármaco intracelularmente, por exemplo, o ribossomo, enzimas metabólicas ou proteínas envolvidas na replicação do ácido desoxirribonucléico (DNA) ou na síntese da parede celular, fazendo com que o antibiótico não iniba uma função vital na célula microbiana. Mais de um tipo de mecanismo pode proporcionar resistência ao mesmo antibiótico (NIKAIDO, 1996; LEVY e MARSHALL, 2004).
O crescimento de Enterococcus spp. Resistentes à Vancomicina (ERV) em ambientes hospitalares é uma grande preocupação, pois o ERV tem a capacidade de transmitir sua resistência a outros microrganismos, incluindo o Staphylococcus aureus resistente à meticilina. (MRSA), por isso é monitorado e investigado de perto nas unidades hospitalares (FARON et al., 2016).
Segundo Terra et al. (2018), resistência antimicrobiana em Enterococcus spp. ocorre principalmente através de alterações no sítio-alvo antimicrobiano e pode ocorrer por diferentes mecanismos: alteração da parede celular, alteração da membrana celular, alteração da síntese de proteínas, inibição da síntese de DNA, inibição competitiva da síntese de ácido fólico e inibição da síntese de ácido ribonucléico (RNA).
De acordo com o Center for Disease Control and Prevention CDC (2019), por muitos anos, a única opção terapêutica para tratar infecções causadas por Staphylococcus aureus resistente à meticilina era a vancomicina. O gene de resistência à vancomicina mediado pelo plasmídeo, vanA, é regularmente encontrado em isolados resistentes à vancomicina associados a cuidados médicos para enterococos. Portanto, há uma grande oportunidade para a transferência de genes de resistência à vancomicina para S. aureus em pacientes ou locais onde os organismos coexistem. No ultimo
15 anos, novas drogas como daptomicina, linezolida e oritavancina chegaram para o tratamento da resistência a infecções por Gram-positivos. Embora a resistência a estes tenha sido confirmada em alguns casos, eles têm atividade consideravelmente alta contra
resistente à meticilina e têm o potencial de tratar S. aureus resistente à vancomicina.
Sistemas padronizados para monitorar o uso de antibióticos são um requisito essencial como parte de uma estratégia de controle de resistência a antibióticos. O uso de antibióticos pode ser quantificado em ambiente hospitalar para entender os custos, a sensibilidade e a suscetibilidade rotineira aos antibióticos em cada serviço de saúde (TERÁN et al., 2018). Três aspectos importantes para o sucesso no combate à resistência antimicrobiana, segundo a literatura, seriam otimizar a administração dos agentes antimicrobianos existentes, prevenir a transmissão de organismos resistentes a medicamentos por meio do controle de infecções e reduzir a contaminação ambiental (DAVEY et al., 2017).
INFECÇÃO NOSOCOMIAL E ENTEROCOCCUS SPP.
Segundo a Portaria nº 2616/1998 do Ministério da Saúde (MS) (BRASIL, 1998), infecção hospitalar é aquela adquirida após a admissão do paciente e que se manifesta durante a internação ou após a alta, quando pode estar relacionada à internação ou a procedimentos. Segundo Monteiro (1993), esta infecção pode ser definida como qualquer infecção relacionada à internação em estabelecimentos de saúde, onde o paciente não apresentou a patologia durante a incubação no momento da admissão no hospital, a menos que tenha havido uma internação prévia relacionada a ela.
As Infecções Hospitalares (IHs) são um problema de saúde pública devido à morbimortalidade que podem causar, bem como aos custos sociais e econômicos a elas associados. Podem ser definidas como doenças que acometem os pacientes durante a internação ou após a alta. O Center for Disease Control and Prevention (CDC) enfatiza que a infecção não deve estar presente durante o período de incubação durante a internação ou relacionada a internações anteriores (COSTA et al., 2019).
A presença de determinantes genéticos que codificam mecanismos de resistência aos antimicrobianos utilizados na clínica médica é a base para a capacidade de colonizar e persistir em ambientes hospitalares (TERRA et al., 2017). Apesar de fazerem parte do trato gastrointestinal, Enterococcus spp. são considerados agentes oportunistas que freqüentemente causam infecções hospitalares.
Entre as espécies que mais causam patogênese estão o Enterococcus faecalis com taxa de 90% e o Enterococcus faecium com 10% (KRAHN e FACHINETTO, 2019). Os enterococos são considerados patógenos oportunistas que frequentemente causam infecções em pacientes internados por longo período de tempo e/ou tratados com diversos antibióticos (REIS et al., 2001), podendo essas infecções ocorrer no trato gastrointestinal, trato urinário, lesões cutâneas, coração e sangue (KAO e KLINE, 2019).
Enterococcus spp. as espécies possuem ampla capacidade de adaptação, facilitando sua colonização em ambientes hospitalares, podendo levar à contaminação do paciente (LEBRETON et al., 2014). Por ser um microrganismo oportunista, é preocupante que nos últimos anos estudos tenham mostrado um aumento gradual na detecção de fatores de virulência em Enterococcus spp. cepas isoladas de fontes clínicas, o que também levou à observação desses genes de virulência em cepas isoladas de amostras de alimentos (OMS, 2017).
Segundo Teixeira (2019), a formação de biofilme nos dispositivos hospitalares, como consequência da capacidade de adesão dos microorganismos às superfícies, tem levado a um crescente desenvolvimento de infecções nosocomiais que representam um problema de saúde pública. Ainda, de acordo com Fleming et al. (2016) e Omar et al. (2017), a resistência antimicrobiana pode possivelmente aumentar em biofilmes como resultado da disseminação de genes de resistência entre as células por meio de transferência horizontal de genes facilitada pela proximidade das células do biofilme.
BIOFILME – FORMAÇÃO
Biofilme é uma estrutura composta por um agregado de microorganismos envoltos por uma matriz extracelular de exopolissacarídeos poliméricos que aderem a uma superfície sólida (SHIRTLIFF et al., 2002; COSTERTON et al., 1999). O termo biofilme surgiu para descrever a forma de vida microbiana séssil, definida pela adesão de microrganismos a superfícies sólidas, com consequente produção de substâncias poliméricas extracelulares, formando uma rede gelatinosa que imobiliza e protege as células. A formação de biofilmes causa alterações fenotípicas nas células planctônicas, que podem ser descritas como estratégias de sobrevivência dos microrganismos em ambientes com condições adversas (COSTERTON et al. 1999).
Microrganismos em ambientes naturais que existem na forma de biofilmes podem ser detectados na grande maioria dos substratos que possuem umidade suficiente para suportar seu crescimento, com uma taxa de detecção entre 95% e 99%. Com relação à composição do biofilme, observa-se que a água é a fração mais significativa, chegando a representar até 97% da matriz do biofilme (OLIVEIRA et al., 2010). Eles são intensamente estudados não apenas por seus efeitos na saúde e no meio ambiente, mas também porque possuem um enorme potencial como ferramentas para processos biotecnológicos (HANSEN et al., 2019).
A capacidade de formar biofilme é uma importante característica de virulência das bactérias (DONELLI e GUAGLIANONE, 2004). Assim, a detecção de cepas produtoras de biofilme é de grande importância para o estabelecimento de políticas de controle, pois falhas no processo de limpeza permitem que resíduos aderidos a equipamentos e superfícies se tornem uma fonte potencial de contaminação na indústria de alimentos e ambientes hospitalares (CASSENEGO et al., 2013).
A formação do biofilme bacteriano pode ser dividida em quatro etapas. Primeiro, há a adesão inicial das células bacterianas, seguida pela agregação e formação de múltiplas camadas de células, depois a maturação do biofilme e, finalmente, o desprendimento das células do biofilme para iniciar um novo ciclo de formação de biofilme em outro lugar (Figura 01). As interações iniciais que ocorrem entre as bactérias e a superfície são inespecíficas e impulsionadas por diferentes forças: forças hidrofóbicas, eletrostáticas, forças de Lifshitz-Van Der Waals, entre outras (GUTIÉRREZ et al., 2012; SÁNCHEZ et al., 2014).
Com o início da maturação celular, as células começam a se dividir e formar pequenos agregados celulares caracterizados pela ocorrência do Quorum Sensing (QS) (FONSECA, 2011), que é um mecanismo de comunicação entre bactérias por meio da produção e difusão de pequenas moléculas químicas ou sinalizadoras. O QS permite a coordenação do comportamento bacteriano em relação ao ambiente por meio da regulação da expressão de genes especializados em resposta à densidade populacional (LAZAR, 2011; PINTO e FONSECA, 2018).
Figura 01. As quatro etapas da formação do biofilme bacteriano em superfícies
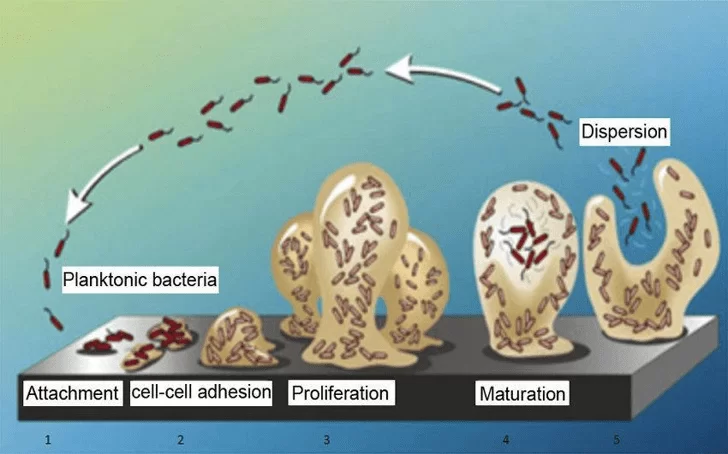
Segundo Costa et al. (2018), a indústria de processamento de alimentos lácteos tem um grande problema com a formação de biofilme, que geralmente está associado a sérios problemas de higiene que podem causar deterioração e recontaminação do produto. Por outro lado, segundo Bosman et al. (2014), uma das principais preocupações da medicina moderna é a infecção associada ao biofilme dentro do ambiente hospitalar, pois tem aumentado sua incidência devido ao aumento do uso de dispositivos médicos implantáveis, que têm contribuído diretamente para altas taxas de morbimortalidade em indivíduos hospitalizados.
FORMAÇÃO DE BIOFILME POR ENTEROCOCCUS SPP.
Enterococcus spp. associados a surtos de origem alimentar possuem fatores de virulência, como a capacidade de formar biofilmes. A agregação microbiana por essa espécie bacteriana é aparentemente influenciada por vários aspectos, como temperatura, exposição a nutrientes e sanitizantes e características de superfície (COSTA et al., 2018).
Enterococos isolados de alimentos que demonstram capacidade de formar biofilmes são alarmantes, pois essa capacidade contribui para a sobrevivência, persistência e disseminação de enterococos resistentes e/ou genes de resistência em diversas condições ambientais (MEDEIROS et al., 2014).
Segundo Estrela et al. (2009), as fases de organização estrutural do biofilme, a composição e as atividades dos microrganismos colonizadores em vários ambientes podem diferir, embora o estabelecimento de uma microcomunidade em uma superfície pareça seguir essencialmente a mesma série de estágios de desenvolvimento.
Segundo Medeiros (2011), estudos têm demonstrado que diversos fatores podem influenciar na formação de biofilme em Enterococcus spp., além de condições que geralmente afetam a formação de biofilme entre diversos microrganismos, como pH, concentração de CO2, temperatura, entre outros. Ainda não há consenso sobre a influência da concentração de glicose na formação de biofilme por Enterococcus spp., mas alguns pesquisadores acreditam que a glicose aumenta a produção de biofilme por Enterococcus spp.
Entre as espécies deste gênero, Enterococcus faecalis é um patógeno oportunista que causa a maioria das infecções enterocócicas com capacidade de aderir a superfícies bióticas e abióticas, promovendo a formação de um biofilme que lhe permite crescer e sobreviver em ambientes agressivos (CÂNDIDO et al., 2010).
Dentre os diversos fatores envolvidos na patogênese desses organismos, a formação de biofilme e a resistência a antibióticos são os mais importantes. A capacidade de formar biofilme tem sido atribuída à presença de alguns genes de virulência (SAFFARI et al., 2017), portanto, outros mecanismos de controle da infecção também são observados, como a prevenção da formação de biofilme por Enterococcus spp. ou inibindo a ação de outros fatores de virulência, o que poderia fornecer um método alternativo de terapia, especialmente considerando que o tratamento antimicrobiano é um desafio para esse gênero (COMERLATO et al., 2013). A formação robusta de biofilme e resistência inerente a múltiplas drogas em enterococos o tornaram um patógeno nosocomial desafiador (SURYALETHA et al., 2019).
CONCLUSÃO
Enterococcus são microrganismos versáteis que podem ser encontrados como contaminantes no queijo de coalho e causar intoxicação alimentar. Emergiu como uma das bactérias Gram-positivas mais prevalentes em infecções nosocomiais, principalmente devido à multirresistência a antimicrobianos. Os estudos sugerem sérios problemas de saúde pública, pois esses microrganismos podem ter a capacidade de transferir genes de resistência antimicrobiana para outros microrganismos presentes na microbiota intestinal humana e animal, impossibilitando o uso dos medicamentos para o tratamento clínico padrão mencionado no artigo. Mais estudos e análises de Enterococcus em alimentos e sua capacidade de resistir a agentes antimicrobianos são necessários para elucidar os mecanismos de transferência de resistência entre esses microrganismos.
REFERÊNCIAS
ALI, S. A. et al. Environmental Enterococci: I. Prevalence of virulence, antibiotic resistance and species distribution in poultry and its related environment in Karachi, Pakistan. Letters in Applied Microbiology. v. 58, n. 5, p. 423-432, 2014. Disponível em: <10.1111/lam.12208>. Acesso em: 2 jun. 2023.
ANDRADE, A. A. Estudo do perfil sensorial, físico-químico e aceitação de queijo de coalho produzido no estado do Ceará. 2006. Dissertação (Mestrado em Tecnologia de Alimentos) – Centro de Ciências Agrárias, Universidade Federal do Ceará, Fortaleza. Disponível em: <http://www.repositorio.ufc.br/handle/riufc/17217>. Acesso em: 2 jun. 2023.
ANDRADE, S. D. E. Caracterização fenotípica e genotípica de amostras clínicas e indígenas de Enterococcus isoladas de seres humanos: diversidade, virulência e resistência a drogas antimicrobiana. 2018. Tese (Doutorado em Ciências Biológicas (Microbiologia)) – Universidade Federal de Minas Gerais, Belo Horizonte – MG. Disponível em: <http://hdl.handle.net/1843/BUOS-B76JMH>. Acesso em: 2 jun. 2023.
ARCHAMBAUD, C. et al. Intestinal translocation of enterococci requires a threshold level of enterococcal overgrowth in the lumen. Scientific Reports. v. 9, n. 8926, pp. 1-12, 2019. Disponível em: <https://doi.org/10.1038/s41598-019-45441-3>. Acesso em: 2 jun. 2023.
ARIAS, C. A.; MURRAY, B. E. The rise of the Enterococcus: Beyond vancomycin resistance. Nature Reviews Microbiology. v. 10, n. 4, pp. 266-278, 2012. Disponível em: <10.1038/nrmicro2761>. Acesso em: 6 jun. 2023.
BARLOW, M.; HALL, B. G. Phylogenetic analysis shows that the OXA beta-lactamase genes have been on plasmids for millions of years. Journal of Molecular Evolution. v. 55, n. 3, pp. 314-321, 2002. Disponível em: <10.1007/s00239-002-2328-y>. Acesso em: 6 jun. 2023.
BELLO, A.; DINGLE, T. C. What’s that resistance mechanism? Understanding genetic determinants of gram-negative bacterial resistance. Clinical Microbiology Newsletter. v. 40, n. 20, pp 165-174, 2018. Disponível em: <10.1016/j.clinmicnews.2018.10.001>. Acesso em: 6 jun. 2023.
BLANCO, A. L.; FREITAS, L. M.; FONTANA, C. R. ACT. Avaliação de resistência à Terapia Fotodinâmica em Enterococcus faecalis. Revista de Ciências Farmacêuticas Básica e Aplicada. v. 37, n. 1, pp. 1-165, 2016. Disponível em: <file:///C:/Users/Workstation%20Video%20B/Downloads/618-Article%20Text-1879-2-10-20200221.pdf>. Acesso em: 6 jun. 2023.
BYUNG-HAN, R. et al. Clinical characteristics and treatment outcomes of Enterococcus durans bacteremia: a 20-year experience in a tertiary care hospital. European Journal of Clinical Microbiology & Infectious Diseases. v. 38, n. 9, pp. 1743-1751, 2019. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/31243595/>. Acesso em: 6 jun. 2023.
BORGES, M. F. et al. Microrganismos patogênicos e indicadores em queijo de coalho produzido no Estado do Ceará, Brasil. Boletim do Centro de Pesquisa de Processamento de Alimentos. v. 21, n. 1, pp. 31- 40, 2003. Disponível em: <10.5380/cep.v21i1.1146>. Acesso em: 6 jun. 2023.
BOSMAN, W. M. P. F. et al. Infections of intravascular bare metal stents: a case report and review of literature. European Journal of Vascular and Endovascular Surgery. v. 47, n. 1, pp. 87-99, 2014. Disponível em: < https://pubmed.ncbi.nlm.nih.gov/24239103/>. Acesso em: 6 jun. 2023.
BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária – ANVISA. Portaria n. 2616 de 12 de maio de 1998. Brasília. Disponível em <https://bvsms.saude.gov.br/bvs/saudelegis/gm/1998/prt2616_12_05_1998.html>. Acesso em 19/07/2019.
BRASIL. Ministério da Agricultura. Secretaria de Defesa Agropecuária. Departamento de Inspeção de Produtos de Origem Animal DIPOA. Portaria n. 146 de 7 de março de 1996. Aprova os Regulamentos Técnicos de Identidade e Qualidade de Produtos Lácteos. Diário Oficial da União, Brasília, 11 de março de 1996.
CAMACHO, J. O. I. et al. Prescripción racional de antibióticos: una conducta urgente. Medicina Interna de México. v. 34, n. 5, pp. 762-770, 2018. Disponível em: <https://pesquisa.bvsalud.org/portal/resource/pt/biblio-984739>. Acesso em: 7 Jun. 2023.
CÂNDIDO, C. S. et al. Effects of Myrcia ovata Cambess. Essential oil on planktonic growth of gastrointestinal microorganisms and biofilm formation of Enterococcus faecalis. Brazilian Journal of Microbiology. v. 41, n. 3, pp. 621-627, 2010. Disponível em: <https://pesquisa.bvsalud.org/portal/resource/pt/lil-549403>. Acesso em: 7 Jun. 2023.
CASSENEGO, A. P. V.; ELLWANGER, J.; PEDRO, A.; AZEVEDO, A.; RIBEIRO, M.L.; FRAZZON, A. P. G. Virulência e formação de biofilme microbiano por Enterococcus faecalis isolados de swabs cloacais de frangos de corte infectados com Eimeria spp. Pesquisa Veterinária Brasileira. v. 33, n. 12, pp. 1433-1440 2013. Disponível em: <https://www.scielo.br/j/pvb/a/PsDXt5fJyrS6gjZ9xCtFqfw/?lang=pt>. Acesso em: 7 Jun. 2023.
CENTERS FOR DISEASE CONTROL AND PREVENTION, C.D.C. (online). Antibiotic resistance threats in the United States. 2019. Disponível em:
<https://www.cdc.gov/drugresistance/pdf/threats-report/2019-ar-threats-report-508.pdf>. Acesso em: 22 jul. 2019.
COMERLATO, C. B. et al. Presence of virulence factors in Enterococcus faecalis and Enterococcus faecium susceptible and resistant to vancomycin. Memória do Instituto Oswaldo Cruz. v. 108, n. 5, pp. 590-595, 2013. Disponível em: <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3970601/>. Acesso em: 7 Jun. 2023.
COSTA, F. T. Síntese, caracterização e o estudo do efeito de nano-partículas de CoFe2O4-YFe2O3 em bactérias patogênicas. 2013. Dissertação (Mestrado em Ciências de Materiais) – Universidade de Brasília, Brasília. Disponível em: <https://repositorio.unb.br/handle/10482/14397>. Acesso em: 7 Jun. 2023.
COSTA, G. A. et al. Evaluation antibacterial and antibiofilm activity of the antimicrobial peptide P34 against Staphylococcus aureus and Enterococcus faecalis. Anais Academia Brasileira de Ciências. v. 90, n. 1, pp. 1-12, 2018. Disponível em: <https://doi.org/10.1590/0001-3765201820160131>. Acesso em: 7 Jun. 2023.
COSTA, M. C. P. et al. Micro-Organismos isolados a partir de espécimes clínicos de centro cirúrgico. Revista Saúde e Desenvolvimento. v. 13, n. 14, pp. 1-21, 2019. Disponível em: <https://www.revistasuninter.com/revistasaude/index.php/saudeDesenvolvimento/article/view/1013>. Acesso em: 7 Jun. 2023.
COSTERTON, J. W.; STEWART, P. S.; GREENBERG, E. P. Bacterial biofilms: a common cause of persistent infections. Science. v. 284, n. 5418, p. 1318-1322, 1999. Disponível em: <https://www.science.org/doi/10.1126/science.284.5418.1318>. Acesso em: 7 Jun. 2023.
DAVEY, P. et al. Interventions to improve antibiotic prescribing practices for hospital inpatients. Cochrane Database of Systematic Reviews. v. 2, n. 2, pp. 1-326, 2017. Disponível em: <https://doi.org/10.1002/14651858.CD003543.pub4>. Acesso em: 7 Jun. 2023.
DERDE, L. P.; DAUTZENBERG, M. J.; BONTEN, M. J. Chlorhexidine body wasshing to control antimicrobial-resistant bacteria in intensive care units: a systematic review. Intensive Care Medicine. v. 38, n. 6, pp. 931-939, 2012. Disponível em: <10.1007/s00134-012-2542-z>. Acesso em: 7 Jun. 2023.
DONELLI, G.; GUAGLIANONE, E. Emerging role of Enterococcus spp. In catheter related infections: biofilm formation and novel mechanisms of antibiotic resistance. The Journal of Vascular. v. 5, n. 1, pp. 3-9, 2004. Disponível em: <10.1177/112972980400500101>. Acesso em: 7 Jun. 2023.
ESTRELA, C. R. A. et al. model system to study antimicrobial strategies in endodontic biofilms. Journal of Applied Oral Science. v. 17, n. 2, 2009. Disponível em: <https://www.scielo.br/j/jaos/a/rzGrQDfDvY7RJMJkMwfJPTx/?lang=en>. Acesso em: 7 Jun. 2023.
FARON, M. L.; LEDEBOER, N. A.; BUCHAN, B. W. Resistance mechanisms, epidemiology, and approaches to screening for vancomycin-resistant Enterococcus in the health care setting. Journal of Clinical Microbiology. v. 54, n. 10, pp. 2436- 2447, 2016. Disponível em: <10.1128/JCM.00211-16>. Acesso em: 7 Jun. 2023.
FISHER, K.; PHILLIPS, C. The ecology, epidemiology and virulence of Enterococcus. Microbiology. v. 155, n. 6, pp. 1749-1757, 2009. Disponível em: <10.1099/mic.0.026385-0>. Acesso em: 7 Jun. 2023.
FLEMMING, H. C. et al. Biofilms: an emergent form of bacterial life. Nature Reviews Microbiology. v. 14, n. 9, pp. 563-575, 2016. Disponível em: <https://www.nature.com/articles/nrmicro.2016.94>. Acesso em: 7 Jun. 2023.
FONSECA, A. P. Biofilms in wounds: An unsolved problem? Working together to ensure better patient outcomes. EWMA Journal. V. 11, n. 2, p. 10- 23, 2011.
FREITAS FILHO, J. R. et al. Avaliação da qualidade do queijo “coalho” artesanal fabricado em Jucati-PE. Revista Eletrônica de Extensão – Extensio. v. 6, n. 8, p. 35-49, 2009. Disponível em: <https://periodicos.ufsc.br/index.php/extensio/article/view/1807-0221.2009v6n8p35/11446>. Acesso em: 7 Jun. 2023.
GIRAFFA, G. Functionality of enterococci in dairy products. International Journal of Food Microbiology. v. 88, n. 2-3, p. 215-222, 2003. Disponível em: <10.1016/s0168-1605(03)00183-1>. Acesso em: 7 Jun. 2023.
GIRAFFA, G; ROSSETTI, L. Monitoring of the bacterial composition of dairy starter cultures by RAPD-PCR. FEMS Microbiology Letters. v. 237, n. 1, p. 133-138, 2004. Disponível em: <https://doi.org/10.1111/j.1574-6968.2004.tb09688.x>. Acesso em: 7 Jun. 2023.
GUTIÉRREZ, D. et al. Incidence of Sthapylococcus aureus and analysis of associated bacterial communities on food industry surfaces. Applied and Environmental Microbiology. v. 78, n. 24, p. 8547-8554, 2012. Disponível em: <10.1128/AEM.02045-12>. Acesso em: 7 Jun. 2023.
HANSEN, S. H. et al. Machine-assisted cultivation and analysis of biofilms. Scientific Reports. v. 9, n. 8933, pp. 1-10, 2019. Disponível em: <file:///C:/Users/Workstation%20Video%20B/Downloads/s41598-019-45414-6.pdf>. Acesso em: 7 Jun. 2023.
HEIDARI, H. et al. High Incidence of Virulence Factors among Clinical Enterococcus faecalis Isolates In Southwestern Iran. Infect Chemother. v. 49, n. 1, p. 51-56, 2017. Disponível em: <10.3947/ic.2017.49.1.51>. Acesso em: 7 Jun. 2023.
HOLLENBECK, B. L.; RICE, L. B. Intrinsic and acquired resistance mechanisms in Enterococcus. Virulence. v. 3, n. 5, p. 421-433, 2012. Disponível em: <10.4161/viru.21282>. Acesso em: 7 Jun. 2023.
HUGAS, M.; GARRIGA, M. M.; AYMERICH, M. T.; Functionality of enterococci in meat products. International Journal of Food Microbiology. v. 88, n. 2, p. 223-233, 2003. Disponível em: <10.1016/s0168-1605(03)00184-3>. Acesso em: 9 Jun. 2023.
IBGE – INSTITUTO BRASILEIRO DE GEOGRAFIA E ESTATÍSTICA. Censo Agropecuário 2017. Rio de Janeiro: IBGE, 2017. Disponível em: <https://sidra.ibge.gov.br/pesquisa/censo-agropecuario/censo-agropecuario-2017/resultados-definitivos>. Acesso em: 22 jun. 2019.
IBGE – INSTITUTO BRASILEIRO DE GEOGRAFIA E ESTATÍSTICA. Produção da Pecuária Municipal 2018. Rio de Janeiro: IBGE, v. 46, p. 1-8, 2018. Disponível em: <https://biblioteca.ibge.gov.br/visualizacao/periodicos/84/ppm_2018_v46_br_informativo.pdf>. Acesso em: 9 fev. 2020.
JAMET, E. et al. Prevalence and characterization of antibiotic resistant Enterococcus faecalis in French cheeses. Food Microbiology. v. 31, n. 2, p.191-198, 2012. Disponível em: <10.1016/j.fm.2012.03.009>. Acesso em: 7 Jun. 2023.
KAO, P. H. N.; KLINE, K. A. Dr. Jekyll and Mr. Hide: How Enterococcus faecalis Subverts the Host Immune Response to Cause Infection. Journal of Molecular Biology. v. 431, n. 16, p. 2932- 2945, 2019. Disponível em: <10.1016/j.jmb.2019.05.030>. Acesso em: 9 Jun. 2023.
KARAGULER, T. KAHRAMAN, H. TUTER, M. Analyzing effects of ELF electromagnetic fields on removing bacterial biofilm. Biocybernetics and Biomedical Engineering. v. 37, n. 2, p. 336-340, 2017. Disponível em: <10.1016/j.bbe.2016.11.005>. Acesso em: 01 maio 2023.
KASZANYITZKY, E. J.; TENK, M.; GHIDÁN, A.; FEHÉVÁRI, G. Y.; PAPP, M. Antimicrobial susceptibility of enterococci strains isolated from slaughter animals on the data of Hungarian resistance monitoring system from 2001 to 2004. International Journal of food microbiology. v.115, n. 1, p. 119-123, 2007. Disponível em: <10.1016/j.ijfoodmicro.2006.10.004>. Acesso em: 7 Jun. 2023.
KONEMAN, E. W. et al. Enterococcus. In: KONEMAN, Elmer W. (Ed.). Diagnóstico microbiológico. 7. ed. Rio de Janeiro: Guanabara Koogan. p. 589-659, 2014.
KRAHN, C. O.; FACHINETTO, J. M. Enterococcus spp.: Características gerais e considerações médicas, uma revisão. 6º Congresso Internacional em Saúde. 2019. Disponível em: <file:///C:/Users/Workstation%20Video%20B/Downloads/10765-Texto%20do%20artigo-41799-1-10-20190424.pdf>. Acesso em: 7 Jun. 2023.
LÁCTEA BRASIL. Queijo – Alimento nobre e saudável. [S. l.: s. n.], 2006. Disponível em: <https://www.yumpu.com/pt/document/read/13019755/queijo-alimento-nobre-e-saudavel-nobre-e-saudavel-capril-virtual>. Acesso em 30 jul. 2019.
LAZAR, V. Quorum sensing in biofilms – how to destroy the bacterial citadels or their cohesion/power? Anaerobe. v.17, n. 6, p. 280-285, 2011. Disponível em: <10.1016/j.anaerobe.2011.03.023>. Acesso em: 7 Jun. 2023.
LEBRETON, F. et al. Tracing the Enterococci from Paleozoic Origins to the Hospital. Cell. v. 169, n. 5, p. 849-861, 2017. Disponível em: <10.1016/j.cell.2017.04.027>. Acesso em: 7 Jun. 2023.
LEBRETON, F. et al. Enterococcus diversity, origins in nature, and gut colonization/ Enterococci: from commensals to leading causes of drug resistant infection. Boston: Massachusetts Eye and Ear Infirmary. p.1-59, 2014. Disponível em: <https://www.ncbi.nlm.nih.gov/books/NBK190427/>. Acesso em: 7 Jun. 2023.
LECLERCQ, R. Epidemiological and resistance issues in multidrug-resistant staphylococci and enterococci. Clinical Microbiology and Infection. v. 15, n. 3, p. 224-231, 2009. Disponível em: <10.1111/j.1469-0691.2009.02739.x>. Acesso em: 7 Jun. 2023.
LEVY, S.; MARSHALL, B. Antimicrobial resistance worlwide: causes, challenges and responses. Nature medicine supplement. v. 10, n. 12, p. 122-129, 2004. Disponível em: <https://www.nature.com/articles/nm1145>. Acesso em: 9 Jun. 2023.
LÍRIO, M.; ANDRADE, T.; MENDES, A. V.; BARBERINO, M. G. Avaliação da colonização por bactérias multirresistentes em pacientes admitidos via central de regulação do estado em um hospital filantrópico em Salvador, Bahia. Revista de Epidemiologia e Controle de Infecção. v. 9, n. 1, 2019. Disponível em: <https://online.unisc.br/seer/index.php/epidemiologia/article/view/11595>. Acesso em: 9 Jun. 2023.
LOSSOUARN, J. et al. Enterococcus faecalis Countermeasures Defeat a Virulent Picovirinae Bacteriophage. Journal viruses. v. 11, n. 1, p. 48, 2019. Disponível em: <https://doi.org/10.3390/v11010048>. Acesso em: 9 Jun. 2023.
LUNA, R. O. Identificação, perfil de resistência a antimicrobianos e caracterização molecular de Aeromonas spp. isoladas de queijos coalho tipo A, comercializados na cidade de Recife PE. 2012. Dissertação (Mestrado em Ciência Veterinária). UFRPE, Pernambuco – Recife.
LUO, X. et al. A diversity-oriented rhodamine library for wide-spectrum bactericidal agents with low inducible against resistant pathogens. Nature Communications. v. 10, n. 258, 2019. Disponível em: <https://www.nature.com/articles/s41467-018-08241-3>. Acesso em: 9 Jun. 2023.
MEDEIROS, A. W. Avaliação dos fatores de virulência e a capacidade de formação de biofilme in vitro em isolados alimentares e clínicos de Enterococcus spp. e utilização de PCR-RFLP para a identificação de Enterococcus casseliflavus e Enterococcus gallinarum. 2011 Dissertação (Mestrado). Universidade Feevale, Rio Grande do Sul.
MEDEIROS, A. W.; PEREIRA, R. I.; OLIVEIRA, D. V.; MARTINA, P. D.; AZEVEDO, P. A.; VAN DER SAND, S.; FRAZZON, J.; FRAZZON, A. P. G. Molecular detection of virulence factors among food and clinical Enterococcus faecalis strains in South Brazil; Brazilian Journal of Microbiology. vol. 45, n.1, 2014. Disponível em: <http://dx.doi.org/10.1590/S1517- 83822014005000031>. Acesso em 22 Jul. 2019.
MENEZES, S. S. M. “Queijo de coalho-rei do balcão”: Expansão da produção alicerçada pela demanda dos migrantes sertanejos. Habitus. v. 11, n. 2, p. 143-158, 2013. Disponível em: <https://doi.org/10.18224/hab.v11.2.2013.143-158>. Acesso em: 7 Jun. 2023.
MONTEIRO, J. A. INFECÇÕES NOSOCOMIAIS. Alguns Aspectos. ACTA Médica Portuguesa. v. 6, p. 135-140, 1993. Disponível em: <https://silo.tips/download/infecoes-nosocomiais-alguns-aspectos>. Acesso em: 7 Jun. 2023.
MONTEMAYOR, J. C. G.; BOFARULL, A. M.; MOCHALES, F. B. Impacto de los movimientos migratorios en la resistencia bacteriana a los antibióticos. Revista Española de Salud Pública. v. 88, n. 6, 2014. Disponível em: <https://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S1135-57272014000600014>. Acesso em: 7 Jun. 2023.
MONTOYA, R. R. et al. Variables associadas a costos em cuidados intensivos. Revista de la Asociación Mexicana de Medicina Crítica y Terapia Intensiva. v. 29, n. 3, p. 138-144, 2015. Disponível em: <https://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0187-84332015000300003>. Acesso em: 7 Jun. 2023.
MORAES, P. M. et al. Bacteriocinogenic and virulence potential of Enterococcus isolates obtained from raw milk and cheese. Journal of Applied Microbiology. v. 113, p. 318-328, 2012. Disponível em: <https://www.locus.ufv.br/bitstream/123456789/13991/1/Moraes_et_al-2012-Journal_of_Applied_Microbiology.pdf>. Acesso em: 9 Jun. 2023.
MURRAY, P. et al. Microbiologia Médica. 4 ed. Rio de Janeiro: Guanabara Koogan, p. 220-223, 2004. Disponível em: <https://eu-ireland-custom-media-prod.s3-eu-west-1.amazonaws.com/Brasil/Downloads/03-12/ESAMPLE-9788535290363.pdf>. Acesso em: 9 Jun. 2023.
NIKAIDO, H. Multidrug efflux pumps of gram-negative bacteria. Journal of bacteriology. v. 178, n. 20, p. 5853-5859, 1996. Disponível em: <10.1128/jb.178.20.5853-5859.1996>. Acesso em: 7 Jun. 2023.
NOGUEIRA, J. G. A embalagem como fator de agregação de valor ao produto: Um estudo do segmento de queijos em Juiz de Fora. 2006. Dissertação (Mestrado Profissional em Sistemas de Gestão) – Centro Tecnológico, Universidade Federal Fluminense, Niterói.
OLIVEIRA, A. F.; OLIVEIRA FILHO, H. Perfil microbiológico e de resistência antimicrobiana no pé diabético infectado. Jornal Vascular Brasileiro. v. 13, n. 4, p. 289-293, 2014. Disponível em: <https://www.scielo.br/j/rcbc/a/rPHTb6ZvfYkgd9rcczXdYjf/?lang=pt>. Acesso em: 7 Jun. 2023.
OLIVEIRA, E. S. Emergência de Enterococcus spp. resistentes à vancomicina na cidade do Natal – RN. 2019. Dissertação (Mestrado em Ciências Biológicas), Universidade Federal do Rio Grande do Norte. Natal – RN.
OLIVEIRA, M. M. M.; BRUGNETA, D. F.; PICCOLI, R. H. Biofilmes microbianos na indústria de alimentos: uma revisão. Revista do Instituto Adolfo Lutz. v. 69, n. 3, p. 277-284, 2010. Disponível em: <http://www.ial.sp.gov.br/resources/insituto-adolfo-lutz/publicacoes/rial/10/rial69_3_completa/1289.pdf>. Acesso em: 7 Jun. 2023.
OLIVEIRA, M. et al. Antimicrobial resistance and in vitro biofilm-forming ability of enterococci from intensive and extensive farming broilers. Poultry Science. v. 89, n. 5, p. 1065- 1069, 2010. Disponível em: <10.3382/ps.2008-00436>. Acesso em: 7 Jun. 2023.
OMAR, A. et al. Microbial Biofilms and Chronic Wounds. Journal Microorganisms. v. 5, n. 1, pp. 1-15, 2017. Disponível em: <10.3390/microorganisms5010009>. Acesso em: 7 Jun. 2023.
PARTE, A. C. LPSN-list of prokaryotic names with standing in nomenclature. Nucleic Acids Research. v. 42, n. 1, p. 613-616, 2014. Disponível em: <10.1093/nar/gkt1111>. Acesso em: 7 Jun. 2023.
PEREIRA, F. G. F. et al. Characterization of infections related to health care in a neonatal intensive care unit. Enfermagem UERJ. v. 21, n. 1, 2013. Disponível em: <https://www.e-publicacoes.uerj.br/index.php/enfermagemuerj/article/view/6370/5899>. Acesso em: 7 Jun. 2023.
PINTO, G.; FONSECA, A. F. Biofilmes e Feridas Crônicas: Um potencial algoritmo. Journal of tissue regeneration & healing. 2018. Disponível em: <https://bdigital.ufp.pt/bitstream/10284/5816/1/PPG_25983.pdf>. Acesso em: 9 Jun. 2023.
PORTO, B. C et al. Determinantes de virulência em Enterococcus endógenos de queijo artesanal. Revista Ciência Agronômica. v. 47, n. 1, p. 69-76, 2016. Disponível em: <http://ccarevista.ufc.br/seer/index.php/ccarevista/article/view/4297>. Acesso em: 9 Jun. 2023.
PÓVOA, A. C. et al. J. R. Evolução da resistência bacteriana em infecção comunitária do trato urinário em idosos. Revista de Epidemiologia e Controle de Infecção. v. 9, n. 1, p. 08-14, 2019. Disponível em: <https://online.unisc.br/seer/index.php/epidemiologia/article/view/10468>. Acesso em: 9 Jun. 2023.
REIS, A. O.; CORDEIRO, J. C. R.; MACHADO, A. M. O.; SADER, H. S. In vitro antimicrobial activity of linezolid tested against vancomycin-resistant enterococci isolated in Brazilian hospitals. Brazilian Journal of Infectious Diseases. v. 5, n. 5, 2001. Disponível em: <https://www.scielo.br/j/bjid/a/rNpQ6tBdzyFHjVLktGDt6SK/?lang=en>. Acesso em: 9 Jun. 2023.
RIBOLDI, G. P.; FRAZZON, J.; AZEVEDO, P. A.; Antimicrobial resistance profile of Enterococcus spp. isolated from food in Southern Brazil. Brazilian Journal of Microbiology. v. 40, p. 125-128, 2009. Disponível em: <https://www.scielo.br/j/bjm/a/fzR4WH7LGmKh3QRwk8fW3HH/?lang=en>. Acesso em: 9 Jun. 2023.
ROSENTHAL, V. D. et al. International nosocomial infection control consortium (INICC) report, data summary of 43 countries for 2007-2012. Device-associated module. American Journal of Infection Control. v. 43, n. 7, pp. 779-781, 2015. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/25179325/>. Acesso em: 9 Jun. 2023.
SAFFARI, F.; DALFARDI, M. F.; MANSOURI, S.; AHMADRAJABI, R. Survey for Correlation between Biofilm Formation and Virulence Determinants in a Collection of Pathogenic and Fecal Enterococcus faecalis Isolates. Infection & chemotherapy. v. 49, n. 3, p. 176-183, 2017. Disponível em: <10.3947/ic.2017.49.3.176>. Acesso em: 9 Jun. 2023.
SÁNCHEZ, D. V.; CABO, M. L.; IBUSQUIZA, P. S.; HERRERA, J. J. R. Biofilm forming abilityand resistance to industrial disinfectants of Staphylococcus aureus isolated from fishery products. Food Control. v. 39, n. 1, p. 8-16, 2014. Disponível em: <https://doi.org/10.1016/j.foodcont.2013.09.029>. Acesso em: 9 Jun. 2023.
SANTANA, R. F. et al. Qualidade microbiológica de queijo coalho comercializado na cidade de Aracaju, SE. Arquivo Brasileiro de Medicina Veterinária e Zootecnia. v. 60, n. 6, p. 1517-1522, 2008. Disponível em: <https://doi.org/10.1590/S0102-09352008000600031>. Acesso em: 9 Jun. 2023.
SHEPARD, B. D.; GILMORE, M. S. Antibiotic-resistant enterococci: the mechanisms and dynamics of drug introduction and resistance. Microbes and Infection. v. 4, n. 2, p. 215-224, 2002. Disponível em: <10.1016/s1286-4579(01)01530-1>. Acesso em: 9 Jun. 2023.
SHIRTLIFF, M. E.; MADER, J. T.; CAMPER, A. K. Molecular interactions in Biofilms. Chemistry & biology. v. 9, n. 8, p. 859-871, 2002. Disponível em: <https://doi.org/10.1016/S1074-5521(02)00198-9>. Acesso em: 9 Jun. 2023.
SIEVERT, D. M. et al. Antimicrobial-Resistant Pathogens Associated with Healthcare Associated Infections: Summary of Data Reported to the National Healthcare Safety Network at the Centers for Disease Control and Prevention, 2009–2010. Infection Control and Hospital Epidemiology. v. 34, n. 1, p. 1-14, 2013. Disponível em: <10.1086/668770.>. Acesso em: 9 Jun. 2023.
SILVA, A. S.; FURTADO, S. C.; VARGAS, B. L. Avaliação microbiológica do queijo coalho produzido com leite pasteurizado sob refrigeração. Revista Nanbiquara. [s.l.], v. 6, n. 1, p. 118-133, 2017.
SILVA, N.; IGREJAS, G.; GONÇALVES, A.; POETA, P. Commensal gut bacteria: distribution of Enterococcus species and prevalence of Escherichia coli phylogenetic groups in animals and humans in Portugal. Annals of Microbiology. v. 62, pp. 449-459, 2012. Disponível em: <https://doi.org/10.1016/S1074-5521(02)00198-9>. Acesso em: 9 Jun. 2023.
SILVA, R. A. et al. Can artesanal “coalho” cheese from Northeastern Brazil be used as a functional food? Food Chemistry. v. 135, n. 3, pp. 1533-1538, 2012. Disponível em: <10.1016/j.foodchem.2012.06.058>. Acesso em: 9 Jun. 2023.
SOLACHE, M. G.; RICE, L. B. The Enterococcus: a model of Adaptability to Its Environment. Clinical Microbiology Reviews. v. 32, n. 2, 2019. Disponível em: <10.1128/CMR.00058-18>. Acesso em: 9 Jun. 2023.
SOUZA, A. Z. B. et al. Aspectos físico-químicos e microbiológicos do queijo tipo coalho comercializado em estados do nordeste do Brasil. Arquivos do Instituto Biológico. v. 81, n. 1, p. 30-35, 2014. Disponível em: <10.1590/S1808-16572014000100006>. Acesso em: 9 Jun. 2023.
SURYALETHA, K. et al. Decoding the proteomic changes involved in the biofilm formation of Enterococcus faecalis SK460 to elucidate potential biofilm determinants. BMC Microbiology. v. 19, n. 146, 2019. Disponível em: <https://doi.org/10.1186/s12866-019-1527-2>. Acesso em: 9 Jun. 2023.
TEIXEIRA, I. M. S. Biofilmes e infecções associadas a dispositivos médicos. 2019. Dissertação (Mestrado em Ciências Farmacêuticas), Universidade Fernando Pessoa. Portugal.
TEIXEIRA, L.; MERQUIOR, V. L. Molecular typing in bacterial infections. Humana Press. v. 1, n. 12, p. 17-27, 2013. Disponível em: <10.1007/978-1-62703-185-1_2>. Acesso em: 9 Jun. 2023.
TERÁN, C. G.; RODRÍGUEZ, V. R.; RANGEL, A. C. Analysis of antibiotic uses and resistance in an ICU from Monteria, Colombia. Revista médica Risaralda. v. 24, n. 2, pp. 75-80, 2018. Disponível em: <https://dialnet.unirioja.es/servlet/articulo?codigo=6708347>. Acesso em: 9 Jun. 2023.
TERRA, M. R.; FURLANETO, M. C.; MAIA, L. F. Enterococcus multirresistente a antimicrobianos: um importante patógeno nosocomial. Revista Uningá Review. v. 29, n. 3, p. 94- 102, 2017. Disponível em: <https://www.mastereditora.com.br/periodico/20170304_121005.pdf>. Acesso em: 9 Jun. 2023.
TERRA, M. R.; FURLANETO, M. C.; MAIA, L. FOOD AS A POTENTIAL RESERVOIR OF ENTEROCOCCUS THAT HOST DETERMINANTS OF VIRULENCE AND RESISTANCE. Brazilian Journal of Surgery and Clinical Research. v. 22, n. 1, p. 86-93, 2018. Disponível em: <https://www.mastereditora.com.br/periodico/20180303_175405.pdf>. Acesso em: 9 Jun. 2023.
URQUHART, C. et al. Atividade antibiofilme da cumarina frente à Pseudomonas aeruginosa. Anais do 10º Salão Internacional de Ensino, Pesquisa e Extensão, Brazilian Journal of Development. v. 6, n. 10, pp. 77261–77268, 2019. Disponível em: <https://doi.org/10.34117/bjdv6n10-231>. Acesso em: 9 Jun. 2023.
VALLEJO, M.; PARADA, R. B.; MARGUET, E. R. Aislamiento de cepas de Enterococcus hirae productoras de enterocinas a partir del contenido intestinal de mejillón patagônico (Mytilus edulis platensis). Revista Argentina de Microbiologia. v. 52, n. 2, pp. 136-144, 2019. Disponível em: <https://doi.org/10.1016/j.ram.2019.06.001>. Acesso em: 9 Jun. 2023.
VIGNAROLI, C. et al. Multidrug- resistant Enterococci in meat and faeces and co-transfer of resistance from an Enterococcus durans to a human Enterococcus faecium. Current Microbiology. v. 62, n. 5, p. 1438-1447, 2011. Disponível em: <10.1007/s00284-011-9880-x>. Acesso em: 9 Jun. 2023.
WHO – WORLD HEALTH ORGANIZATION. Zoonoses and the Human-Animal-Ecosystems Interface. [S. l.] WHO, 2017.
[1] Doutoranda do Programa de Pós-Graduação em Biociência Animal. ORCID: 0000-0001-9410-7631. Currículo Lattes: http://lattes.cnpq.br/4532231119888940.
[2] Doutor em Biociência Animal. ORCID: 0000-0002-2871-6655. Currículo Lattes: http://lattes.cnpq.br/3276511555193502.
[3] Doutor em Biociência Animal. ORCID: 0000-0002-1982-7142. Currículo Lattes:http://lattes.cnpq.br/5753018560783714.
[4] Graduada em Medicina Veterinária. ORCID:0000-0001-9273-5204. Currículo Lattes: http://lattes.cnpq.br/8329028352662293.
[5] Graduada em Medicina Veterinária. ORCID: 0000-0001-5584-9464. Currículo Lattes:http://lattes.cnpq.br/1495170820726310.
[6] Doutoranda do Programa de Pós-Graduação em Biociência Animal. ORCID: 0000-0003-0698-6125. Currículo Lattes: http://lattes.cnpq.br/5170743479462841.
[7] Doutora em Ciências Veterinárias. ORCID: 0000-0002-0072-5103. Currículo Lattes: http://lattes.cnpq.br/5676854885081836.
[8] Graduação em Ciências Biológicas. ORCID: 0000-0001-7149-4931. Currículo Lattes: https://lattes.cnpq.br/2928291078391850.
[9] M.Sc. em Biociência Animal. ORCID: 0000-0002-4913-8313. Currículo Lattes: http://lattes.cnpq.br/4967459162060058.
[10] Doutor em Bioquímica e Fisiologia, Mestre em Fisiologia, Biólogo. ORCID: 0000-0003-1493-7964. Currículo Lattes: http://lattes.cnpq.br/9044747136928972.
[11] Orientador. Doutora do Programa de Pós-Graduação em Biociência Animal. ORCID: 0000-0002-1289-2902. Currículo Lattes: http://lattes.cnpq.br/5998863169551704.
Enviado: 24 de abril, 2023.
Aprovado: 01 de junho, 2023.

