ARTIGO ORIGINAL
PETERSEN, Thiago Alexandre [1], OLIVEIRA, Hebe Souza de [2]
PETERSEN, Thiago Alexandre. OLIVEIRA, Hebe Souza de. Uso de peixes elétricos neotropicais (ordem: Gymnotiformes) como organismos modelo em estudos comportamentais e comunicativos. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano. 08, Ed. 02, Vol. 01, pp. 115-136. Fevereiro de 2023. ISSN: 2448-0959, Link de acesso: https://www.nucleodoconhecimento.com.br/biologia/peixes-eletricos, DOI: 10.32749/nucleodoconhecimento.com.br/biologia/peixes-eletricos
RESUMO
Gymnotiformes é uma ordem de peixes elétricos neotropicais composta por 270 espécies. Apresentam uma típica anatomia externa: corpo alongado, ausência de algumas nadadeiras e nadadeira anal bem desenvolvida. A característica mais marcante deste grupo é a capacidade de produção e detecção de campos elétricos. Usando essa habilidade, eles podem se orientar e se comunicar. As descargas de Órgão Elétrico (DOE) são coordenadas por um núcleo cerebral do peixe que, por sua vez, recebe informações para aumentar ou diminuir seu ritmo de outras regiões cerebrais. As DOEs podem ser classificadas como do tipo pulso (famílias Gymnotidae, Hypopomidae e Rhamphichthyidae) e do tipo onda (famílias Apteronotidae e Sternopygidae). As modulações de DOEs podem ser usadas com a finalidade comportamental, inclusive como mecanismo comportamental para evitar a interferência de outros sinais. Estudos laboratoriais possibilitam compreender que estes comportamentos sejam explorados por meio de respostas à estimulação elétrica, usando como base o playback de DOEs, que pode ser controlado em questão de tempo, intensidade etc. O presente trabalho tem por objetivo fazer uma revisão de estudos comportamentais e comunicativos já realizados com peixes elétricos neotropicais. Usando mecanismos de busca online, foram selecionados os artigos que usaram peixes elétricos neotropicais em perspectivas comportamentais. Foram contabilizados 55 estudos, sendo quase todos realizados em laboratório, tendo sido apenas 14,5% realizados totalmente ou em parte em campo. Foram contabilizados os estudos de acordo com os comportamentos elétricos encontrados: JAR, Jamming, Sincronização, Chirps, mudanças de frequência e interrupções de DOEs. Os dados demonstraram que há grande lacuna de conhecimento em alguns grupos, para peixes elétricos com DOEs do tipo onda, 40% dos trabalhos envolveram o gênero Apteronotus, enquanto para peixes elétricos com DOEs do tipo pulso, 27% dos trabalhos envolveram o gênero Gymnotus. Menos de 15% dos trabalhos publicados envolveram campo ou observações não controladas. Todas as famílias da Ordem Gymnotiformes apresentam a capacidade de mudança de frequência e de produção de chirps. O comportamento Jamming foi apenas descrito para peixes elétricos com DOEs do tipo pulso, enquanto interrupções de DOE ainda não foram descritas para a família Apteronotidae e nem para a família Rhamphichthyidae.
Palavras-chave: Modulações de DOE, Mecanismos busca, Chirps, DOE, JAR.
1. INTRODUÇÃO
O bioma Amazônico apresenta uma enorme diversidade de habitats aquáticos que apresenta grande diversidade de peixes, contendo mais de 2700 espécies (DAGOSTA e PINNA, 2019). Essa ictiofauna é dominada pela Série Otophysi, da Superordem Ostariophysi, que representa cerca de 80% das espécies dispostas em quatro Ordens (DAGOSTA e PINNA, 2019). Fazendo parte desta ictiofauna, a Ordem Gymnotiformes é relativamente diversa, sendo composta por 270 espécies (FRICKE; ESCHMEYER e FONG, 2022).
Peixes da Ordem Gymnotiformes são diferenciados de peixes de outros grupos por apresentarem várias peculiaridades na morfologia externa, que incluem: corpo alongado e comprimido, em formato de “faca”, ausência das nadadeiras dorsal e pélvica, nadadeira caudal pouco desenvolvida ou ausente e nadadeira anal bem desenvolvida, sendo ela a principal responsável pela locomoção destes organismos (MAGO-LECCIA, 1994; ALBERT, 2001). Além dessa típica anatomia externa, provavelmente a característica mais marcante desta ordem é a presença de órgãos elétricos que geram descargas elétricas espécie-específicas, chamadas Descargas do Órgão Elétrico (DOE) (BENNETT, 1971; HOPKINS, 1974a).
Os peixes elétricos neotropicais também possuem órgãos eletroreceptores que se desenvolveram para detectar gradientes de voltagem no meio onde vivem, incluindo aqueles gerados pelos seus próprios órgãos elétricos. Esta modalidade sensorial é denominada eletrorrecepção ativa e permite que o indivíduo perceba, no ambiente, objetos com propriedades elétricas diferentes da água e se comuniquem com coespecíficos, por exemplo, para fins de reprodução (LISSMANN, 1958; HOPKINS, 1974a; KRAHE, 2019).
As DOEs são descargas rítmicas e podem ser categorizadas, do ponto de vista temporal, como do tipo onda (ocorre quando a duração da descarga é maior ou, no mínimo, do mesmo tamanho do que o intervalo entre duas descargas consecutivas) ou do tipo pulso (quando a duração da descarga é menor que o intervalo entre duas descargas consecutivas) (MOLLER, 1995; ALVES-GOMES, 2014). A eletrorrecepção é uma modalidade sensorial, viabilizada por meio de órgãos eletroreceptores especializados, que se localizam na pele, são utilizados para detectar gradientes de voltagem no ambiente onde o peixe habita (BENNETT, 1971).
Existem dois tipos de eletrolocalização: a eletrolocalização passiva, que ocorre quando um indivíduo eletroreceptivo detecta campos elétricos de fontes eletrogênicas externas; e a eletrolocalização ativa, em que os peixes detectam distorções do campo gerado pelas suas próprias DOEs, causados por objetos ou organismos com condutividade elétrica diferente da água onde se encontram (LISSMANN, 1958; BASTIAN, 1986). A outra forma de uso desse sistema é a eletrocomunicação, numa modalidade em que um peixe elétrico envia informações ao outro em contexto de reprodução, alarme, agressão e outras formas de interações comportamentais (CARLSON, 2006).
A interação entre peixes elétricos e consequente mistura de sinais podem ocasionar interferências que diminuem a eficiência da eletrorecepção dos indivíduos envolvidos, o que, por sua vez, pode levar a um comportamento conhecido como “Jamming Avoidance Response” (JAR), que consiste em uma mudança na frequência (taxa) da DOE quando um indivíduo é exposto a um sinal interferente, no sentido de minimizar a chance de interferência (WATANABE e TAKEDA, 1963; BULLOCK; HAMSTRA e SCHEICH, 1972; HEILIGENBERG, 1986).
Estudos comportamentais com peixes elétricos neotropicais ocorrem desde a década de 70, com experimentos laboratoriais e de campo, que envolveram pesquisas de diferentes aspectos comportamentais em diversas espécies (WATANABE e TAKEDA, 1963; BULLOCK, 1969; BLACK-CLEWORTH, 1970; WESTBY, 1975a; HAGEDORN e HEILIGENBERG, 1985; HAGEDORN, 1988; KAWASAKI; PRATHER e GUO, 1996; PERRONE; MACADAR e SILVA, 2009; SMITH, 2013; FIELD et al., 2019; RAAB et al., 2021; FREILER; PROFFITT e SMITH, 2022). Estes estudos descreveram diversos comportamentos eletromotores que envolvem mudanças no ritmo e amplitude da DOE, tais como os chirps e interrupções de DOE (HAGEDORN, 1988; PERRONE; MACADAR e SILVA, 2009).
Os comportamentos eletromotores são usados em uma ampla variedade de contextos comunicativos, sendo que, entre os mais estudados, encontra-se o chirp, que consiste em uma modulação abrupta da DOE, com uma alta e transitória aceleração na taxa de repetição (HOPKINS, 1974b; HAGEDORN, 1988; KAWASAKI e HEILIGENBERG, 1989). Os chirps já foram registrados durante encontros agonísticos e reprodutivos (BULLOCK, 1969; HAGEDORN e HEILIGENBERG, 1985; HAGEDORN, 1988; PERRONE; MACADAR e SILVA, 2009). Em um estudo clássico com o peixe elétrico pulsador do gênero Gymnotus, Westby (1975a), mostrou que o chirp é um sinal usado, principalmente, pelo indivíduo dominante e parece, frequentemente, ser utilizado antes de agressões, provocando respostas submissas do receptor. Perrone; Macadar e Silva (2009), relataram o uso de chirps em contexto reprodutivo e agressividade em Brachyhypopomus, um gênero de peixe elétrico pulsador que habita o Sul do Brasil e Uruguai. Os aspectos temporais dos chirps, descritos nas espécies mencionadas, são consistentes com a literatura sobre chirps em peixes elétricos com DOE do tipo onda, apresentando uma grande variação da sua estrutura e funções comunicativas, estando presentes na grande maioria dos gêneros já estudados (SMITH, 2013).
Já os comportamentos de interrupções de DOE foram, primeiramente, registrados em momentos de acasalamento, sendo estes produzidos por fêmeas (HAGEDORN, 1988), e em contexto submissivo durante encontros agonísticos (BLACK-CLEWORTH, 1970; WESTBY, 1975b). Neste último contexto, o peixe elétrico de DOE do tipo pulso Gymnotus carapo (Linnaeus, 1758), usa as interrupções de DOE frequentemente quando quer demonstrar submissão a um peixe mais agressivo, por exemplo, para se “esconder eletricamente”, com interrupções que podem passar de 30 minutos de duração (BLACK-CLEWORTH, 1970; WESTBY, 1975a). Perrone; Macadar e Silva (2009), também, relataram o uso de interrupções das DOEs com função de submissão em interações de pares de machos em indivíduos do gênero Brachyhypopomus. Com esta mesma função, interrupções de DOE também foram registradas para os peixes elétricos africanos (Ordem Mormyriformes), sendo evocadas até mesmo por estímulos elétricos artificiais (ZHANG e KAWASAKI, 2006).
Nos peixes elétricos neotropicais, a DOE tem seu início em um núcleo cerebral chamado núcleo marca-passo. Este núcleo é constituído pelas Células Marca-passo (CM), que possuem um ritmo intrínseco constante, e Células Relé (CR), que ativam os neurônios eletromotores na coluna espinhal (DYE e MEYER, 1986). Apesar do núcleo marca-passo ser o grupo de neurônios que geram e mantêm a taxa de repetição das DOEs, ele recebe múltiplas entradas de outros núcleos cerebrais que são responsáveis pelas modulações na frequência da DOE. Neste sentido, destacam-se as conexões do núcleo pré-marca-passo (PPn) diencefálico, que permite modulações graduais, acelerações momentâneas e, até mesmo, interrupções, e o núcleo pré-marca-passo sub-lemniscal (SPPn), que pode induzir interrupções abruptas das DOEs (KAWASAKI e HEILIGENBERG, 1989; METZNER, 1999). Desta forma, a informação necessária para interromper a DOE pode ter origem do PPn, levando à inibição das CM, ou do SPPn, que causa a despolarização contínua das CR e, assim, impedem que a informação do núcleo marca-passo chegue aos neurônios eletromotores (KAWASAKI e HEILIGENBERG, 1989; SPIRO, 1997).
Tendo em consideração essas informações, o presente trabalho tem por objetivo fazer uma revisão de estudos comportamentais e comunicativos já realizados com peixes elétricos neotropicais, como organismos modelo.
2. MATERIAL E MÉTODOS
Uma pesquisa de publicações foi realizada utilizando as bases de dados: Google Scholar, Scielo, PubMed, Plataforma Lattes, Research Gate e websites do Portal Capes. Foram usadas diversas palavras-chaves para a pesquisa (traduzidas para inglês também), tais como: “Peixe elétrico Neotropical”, “Gymnotiformes”, “Comportamento”, “Chirps”, “Interrupções de DOE”, “DOE”, “Jamming Avoidance Response (JAR)”. Assim, foram selecionados artigos que estudaram peixes elétricos neotropicais em alguma perspectiva comportamental com o uso de suas descargas. Só foram considerados os trabalhos publicados, sendo excluídas teses, dissertações etc. Não foi estabelecido um intervalo de tempo para a busca de artigos.
3. RESULTADOS
Foram contabilizados 55 estudos que abordaram diretamente aspectos comportamentais da DOE e comunicativos de peixes elétricos neotropicais, de 1963 a 2022. A maioria dos estudos foram realizados em laboratório, tendo apenas 8 estudos (14,5%) realizados totalmente ou em parte em campo, concentrando, assim, 47 trabalhos (85,5%) focados em laboratório (Tabela 1).
Tabela 1. Estudos revisados com a identificação das espécies, tipos de experimentos e comportamentos de Descargas de Órgão Elétrico (DOE) registrados
| Espécie | Tipos de experimentos | Comportamentos de DOE observados | Referências |
| Eigenmannia sp. | Estímulos elétricos | Aumento/Diminuição de frequência de DOE e JAR
|
Watanabe e Takeda, 1963 |
| Eigenmannia sp., Hypopomus sp., Apteronotus leptorhynchus |
Estímulos elétricos | Aumento/Diminuição de frequência de DOE, chirps e JAR | Larimer e MacDonald, 1968 |
| Sternopygus sp., Steatogenys sp., Apteronotus sp. |
Estímulos mecânicos e elétricos | Aumento/Diminuição de frequência de DOE, chirps, interrupção de DOE e JAR
|
Bullock, 1969; Bullock; Hamstra e Scheich, 1972 |
| Gymnotus carapo
|
Estímulos elétricos e Interações intraespecíficas
|
Aumento de frequência de DOE, interrupção de DOE e sincronização | Black-Cleworth, 1970; Box e Westby, 1970; Valone, 1970 |
| Hypopygus lepturus, Hypopomus artedi, Brachyhypopomus occidentalis, Gymnorhamphichthys hypostomus |
Estímulos elétricos | Aumento/Diminuição de frequência de DOE e JAR | Heiligenberg, 1974; Heiligenberg; Baker e Bastian 1978 |
| Sternopygus sp. e Eigenmannia virescens |
Estímulos elétricos e Interações intraespecíficas * | Aumento de frequência de DOE, interrupção de DOE e chirps
|
Hopkins, 1974a; 1974b; 1974c |
| Gymnotus carapo e Hypopomus artedi |
Estímulos elétricos e Interações intraespecíficas | Aumento/Diminuição de frequência de DOE, interrupção de DOE, sincronização, JAR e jamming
|
Westby, 1975a;
1975b; 1979 |
| Rhamphichthys rostratus,
Eigenmannia humboldtii, Apteronotus leptorhynchus, A. hasemani e Sternopygus sp.
|
Estímulos elétricos | Aumento/Diminuição de frequência de DOE, sincronização e JAR | Scheich; Gottschalk e Nickel, 1977;
Gottschalk e Scheich, 1979 |
| Eigenmannia virescens e Apteronotus leptorhynchus
|
Estímulos elétricos e Interações intraespecíficas | Aumento/Diminuição de frequência de DOE, chirps e interrupção de DOE | Hagedorn e Heiligenberg, 1985; Dye, 1987; Kawasaki et al., 1988
|
| Brachyhypopomus occidentalis | Estímulos elétricos e Interações intraespecíficas **
|
Chirps, interrupção de DOE e jamming | Hagedorn, 1988; Shumway e Zelick, 1988 |
| Brachyhypopomus brevirostris | Estímulos elétricos (iontoforese) e interações intraespecíficas
|
Aumento/Diminuição de frequência de DOE, chirps e interrupção de DOE | Kawasaki e Heiligenberg, 1989 |
| Sternopygus macrurus | Estímulos elétricos (iontoforese) | Aumento de frequência de DOE e interrupção de DOE
|
Keller; Kawasaki e Heiligenberg, 1991 |
| Eigenmannia virescens | Estímulos elétricos (iontoforese) | Aumento de frequência de DOE, chirps, interrupção de DOE e JAR |
Metzner e Heiligenberg, 1991; Metzner e Heiligenberg, 1993 |
| Apteronotus leptorhynchus e A. albifrons |
Estímulos elétricos e hormônios | Aumento de frequência de DOE, chirps e JAR | Zupanc e Maler, 1993; Dulka e Maler, 1994; Dunlap; Thomas e Zakon, 1998 |
| Rhamphichthys rostratus | Estímulos elétricos | Aumento/Diminuição de frequência de DOE e JAR
|
Kawasaki; Prather e Guo, 1996 |
| Brachyhypopomus gauderio e Gymnotus omarorum
|
Estímulos elétricos | JAR | Capurro et al., 1997; Capurro et al., 1998 |
| Apteronotus leptorhynchus | Estímulos elétricos | Aumento de frequência de DOE e chirps | Engler et al., 2000; |
| Gymnotus carapo | Estímulos elétricos | Aumento de frequência de DOE e interrupção de DOE
|
Schuster, 2002 |
| Apteronotus leptorhynchus | Estímulos elétricos
e Interações intraespecíficas
|
Aumento de frequência de DOE, chirps e JAR | Tallarovic e Zakon, 2002; 2005. |
| Apteronotus albifrons | Interações intraespecíficas | Aumento da frequência da DOE
|
Serrano-Fernandez, 2003 |
| Apteronotus leptorhynchus e A. albifrons |
Estímulos elétricos | Chirps | Dunlap e Larkins-Ford, 2003 |
| Brachyhypopomus gauderio e Gymnotus omarorum | Interações intraespecíficas * | Aumento/Diminuição de frequência de DOE, chirps, interrupção de DOE e JAR | Capurro e Pakdaman, 2004; Silva; Perrone e Macadar, 2007; Perrone; Macadar e Silva, 2009; Batista et al., 2012; Zubizarreta et al., 2012 |
| Adontosternarchus devenanzii | Estímulos elétricos | Aumento de frequência de DOE e chirps
|
Zhou e Smith, 2006 |
| Apteronotus albifrons e Eigenmannia lineata | Estímulos elétricos e Interações intraespecíficas
|
Chirps | Fugère e Krahe, 2009 |
| Apteronotus bonaparti | Estímulos elétricos | Aumento de frequência de DOE e chirps
|
Ho et al., 2010 |
| Apteronotus leptorhynchus | Estímulos elétricos | Aumento de frequência de DOE e chirps
|
Cuddy; Aubin-Horth; Krahe, 2012 |
| Sternarchogiton nattereri | Estímulos elétricos | Aumento de frequência de DOE e chirps
|
Ho et al., 2013 |
| Eigenmannia virescens | Estímulos elétricos | Aumento/Diminuição de frequência de DOE, chirps e interrupção de DOE
|
Stöckl; Benda e Grewe, 2014 |
| Apteronotus hasemani | Estímulos elétricos | Aumento de frequência de DOE e chirps | Petzold e Smith, 2016 |
| Gymnotus omarorum | Interações intraespecíficas | Interrupção de DOE e chirps
|
Perrone e Silva, 2018 |
| Microsternarchus bilineatus, Brachyhypopomus sullivani e Steatogenys elegans
|
Estímulos elétricos e hormônios | Aumento/Diminuição de frequência de DOE, chirps, interrupção de DOE, jamming e JAR | Field et al., 2019 |
| Apteronotus leptorhynchus | Interações intraespecíficas | Aumento de frequência de DOE e chirps | Raab et al., 2021
|
| Compsaraia samueli | Estímulos elétricos e Interações intraespecíficas
|
Aumento de frequência de DOE e chirps | Freiler; Proffitt e Smith, 2022 |
Trabalhos que envolveram observações de campo e laboratório estão identificados por *, enquanto trabalhos que envolveram apenas observações de campo estão identificados por **. Todos os outros trabalhos envolveram apenas experimentos de laboratório. Fonte: autores.
Tabela 2: Peixes da Ordem Gymnotiformes identificados por tipo de descargas de órgão elétrico (DOE), família, gênero, espécie e seus respectivos comportamentos de DOE já observados e descritos
| Gimnotiformes com DOE tipo onda | ||||||
| Família | Gênero | Epíteto
específico |
Comportamentos de DOE observados |
|||
| Apteronotidae | Adontosternarchus | devenanzii | 1, 6 | |||
| Apteronotidae | Apteronotus | albifrons | 1, 3, 6 | |||
| Apteronotidae | Apteronotus | bonaparti | 1, 6 | |||
| Apteronotidae | Apteronotus | hasemani | 1, 2, 3, 5, 6 | |||
| Apteronotidae | Apteronotus | leptorhynchus | 1, 2, 3, 5, 6 | |||
| Apteronotidae | Compsaraia | samueli | 1, 6 | |||
| Apteronotidae | Sternarchogiton | nattereri | 1, 6 | |||
| Sternopygidae | Eigenmannia | humboldt | 1, 2, 3, 5 | |||
| Sternopygidae | Eigenmannia | lineata | 6 | |||
| Sternopygidae | Eigenmannia | virescens | 1, 2, 3, 6, 7 | |||
| Sternopygidae | Sternopygus | macrurus | 1, 2, 5, 6, 7 | |||
| Gimnotiformes com DOE tipo pulso | ||||||
| Família | Gênero | Epítetos específico | Comportamentos de DOE observados |
|||
| Hypopomidae | Brachyhypopomus | brevirostris | 1, 2, 6, 7 | |||
| Hypopomidae | Brachyhypopomus | gauderio | 1, 2, 3, 6, 7 | |||
| Hypopomidae | Brachyhypopomus | occidentalis | 1, 2, 3, 4, 6, 7 | |||
| Hypopomidae | Brachyhypopomus | sullivani | 1, 2, 3, 6 | |||
| Hypopomidae | Hypopomus | artedi | 1, 2, 3, 4, 5, 6, 7 | |||
| Hypopomidae | Microsternarchus | bilineatus | 1, 2, 3, 4, 5, 6, 7 | |||
| Rhamphichthyidae | Gymnorhamphichthys | hypostomus | 1, 2, 3 | |||
| Rhamphichthyidae | Hypopygus | lepturus | 1, 2, 3 | |||
| Rhamphichthyidae | Rhamphichthys | rostratus | 1, 2, 3, 5 | |||
| Rhamphichthyidae | Steatogenys | elegans | 1, 2, 3, 4, 6 | |||
| Gymnotidae | Gymnotus | carapo | 1, 2, 3, 4, 5, 6, 7 | |||
| Gymnotidae | Gymnotus | omarorum | 1, 2, 3, 6, 7 | |||
Legenda: * Os números dos comportamentos se referem a: 1 – Elevação de Frequência da DOE; 2 – Diminuição da frequência de DOE; 3 – Jamming Avoidance Response (JAR); 4 – Jamming; 5 – Sincronização; 6 – Chirps; 7 – Interrupção da DOE. Fonte: autores.
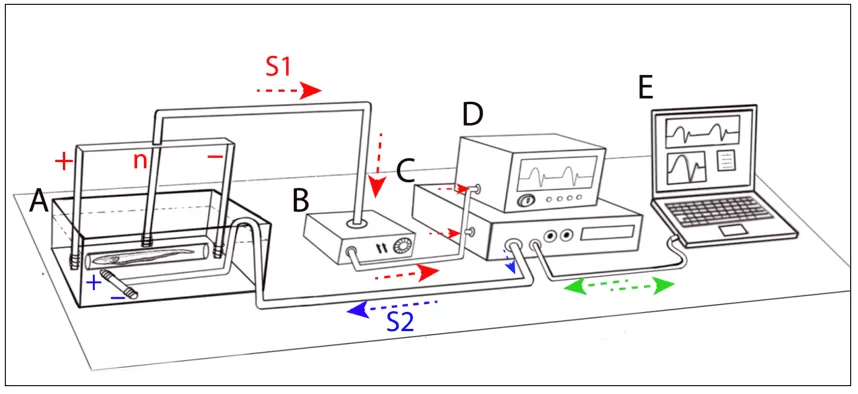
O mesmo percentual foi observado em relação ao uso de estimulação artificial para a obtenção dos comportamentos, em que apenas 8 estudos (14,5%) foram unicamente focados em interações intraespecíficas. Comumente, para trabalhos de laboratório são usados setups experimentais similares aos de Petersen (2021) (Figura 1).
Figura 1: Representação esquemática de um arranjo experimental para experimentos comportamentais e de estimulação em peixes elétricos
3.1 COMPORTAMENTOS DESCRITOS: JAR, JAMMING E SINCRONIZAÇÃO
Os primeiros trabalhos que abordaram comportamento e DOEs foram também os que descreveram os eventos comportamentais como: o Jamming Avoidance Response (JAR). O JAR é um tipo especial de modulação da DOE e ocorre quando dois peixes elétricos com DOEs de frequências parecidas se aproximam. É um comportamento voltado a evitar interferência. Ele foi primeiramente notado por Watanabe e Takeda (1963), e nomeado por Bullock; Hamstra, e Scheich (1972). Este comportamento para “evitar interferência de DOE” foi observado em 25 dos estudados analisados, ou seja, em quase 50% dos trabalhos com DOE.
As estratégias de JAR podem variar segundo a espécie e o tipo de DOE (HEILIGENBERG, 1986). Peixes elétricos com descargas do tipo onda são os que apresentam os JARs mais conspícuos e bem descritos (WATANABE e TAKEDA, 1963; HEILIGENBERG, 1986; METZNER, 1999; TALLAROVIC e ZAKON, 2005; FREILER; PROFFITT e SMITH, 2022). Nestes grupos, para evitar a interferência, o peixe que apresenta a maior frequência de DOE aumenta a sua taxa de descarga, enquanto o peixe com a menor frequência tende a diminuir. Isso aumenta a diferença nas taxas de descarga, minimizando as interferências e mantendo a eletrolocalização e eletrocomunicação funcional (HEILIGENBERG, 1986; ZAKON et al., 2002; ZUPANC e BULLOCK, 2005). Dos estudos analisados sobre JAR, 12 deles trataram de gimnotiformes com DOEs do tipo onda, registrando esse comportamento para as famílias Apteronotidae: Apteronotus leptorhynchus (Eingenmann, 1912) e A. albifrons (Linnaeus, 1766); e Sternopygidae: Eigenmannia virescens (Valenciennes, 1836) e E. humboldtii (Steindachner, 1878).
Em peixes elétricos com descarga do tipo pulso, a funcionalidade de sua eletrolocalização diminui quando duas DOEs ocorrem sobrepostas uma à outra. Assim, o JAR nestas espécies consiste em modificações nos períodos/frequência de descarga de emissão de sua DOE de forma a diminuir a probabilidade de que ocorram pulsos simultâneos entre as DOEs dos dois peixes (HEILIGENBERG, 1974; HEILIGENBERG; BAKER e BASTIAN, 1978; ZUPANC e BULLOCK, 2005; FIELD et al., 2019). Exemplo deste comportamento foram notados em experimentos nos quais ocorreram breves desacelerações das DOEs quando o sinal interferente tem uma taxa de repetição mais alta, acompanhado de breves acelerações, quando a interferência tem taxa de repetição mais baixa (HEILIGENBERG; BAKER e BASTIAN, 1978; FIELD et al., 2019).
Dos estudos analisados sobre JAR, 19 deles trataram de Gymnotiformes com DOEs do tipo pulso, registrando esse comportamento para as famílias Gymnotidae (Gymnotus carapo (Linnaeus, 1758) e G. omarorum (Richer-de-Forges, 2009)); Hypopomidae [Hypopomus artedi (Kaup, 1856), Brachyhypopomus gauderio (Gloria e Malarba, 2009), B. occidentalis (Regan, 1914), B. sullivani (Crampton et al., 2017) e Microsternarchus bilineatus (Fernández-Yépez, 1968)]; e Rhamphichthyidae [Hypopygus lepturus (Hoedeman, 1962); Steatogenys elegans (Steindachner, 1880); Gymnorhamphichthys hypostomus (Ellis, 1912) e Rhamphichthys rostratus (Linnaeus, 1766)].
Outros dois comportamentos diretamente relacionados ao JAR também foram registrados para espécies de Gymnotiformes: o Jamming e a sincronização. O Jamming consiste em um comportamento em que um indivíduo mantém por um tempo o pulso de sua DOE sobre a DOE de outro indivíduo, interferindo, assim, intencionalmente, na outra DOE. O Jamming foi observado em 9 estudos nas famílias Gymnotidae (Gymnotus carapo), Hypopomidae (Hypopomus artedi, Brachyhypopomus occidentalis, B. sullivani e Microsternarchus bilineatus) e Rhamphichthyidae (Steatogenys elegans), sendo todas as espécies com DOE do tipo pulso.
O comportamento de sincronização (também referido como phase-locking e phase-coupling) é um comportamento em que o indivíduo mantém por um tempo o pulso de sua DOE “fase-travado” sobre a DOE de outro indivíduo, em uma relação contínua de fase. Esse comportamento já foi descrito em 8 estudos, para as famílias Gymnotidae (Gymnotus carapo); Hypopomidae (Hypopomus artedi); Rhamphichthyidae (Rhamphichthys rostratus); Apteronotidae (Apteronotus leptorhynchus e A. hasemani (Ellis, 1913)); e Sternopygidae (Eigenmannia humboldtii e Sternopygus sp.).
3.1.1 COMPORTAMENTOS DESCRITOS: MUDANÇAS DE FREQUÊNCIA DE DOE E CHIRPS
As frequências das DOEs dos gimnotiformes são muito estáveis e, por isso, mudanças de frequência (elevações ou diminuições) podem indicar comportamentos eletromotores. Junto ao JAR, as mudanças de frequência foram os primeiros comportamentos descritos para a Ordem Gymnotiformes (WATANABE e TAKEDA, 1963; LARIMER e MACDONALD, 1968). Este comportamento foi observado em 48 dos estudados analisados, ou seja, em quase 90% dos trabalhos. Outro ponto a se levar em consideração é que é mais comum observar as “elevações de frequência”, comportamento em que a frequência DOE é elevada gradualmente, do que as “diminuições de frequência”, comportamento em que a frequência da DOE é diminuída gradualmente. De forma que, em todos os estudos com mudanças de frequência, foram observadas as “elevações de frequência”, enquanto em 23 trabalhos (48%) foram observadas as “diminuições de frequência”.
Comportamentos de mudanças de frequência já foram registrados para Gymnotiformes com DOEs do tipo pulso e onda, com funções comunicativas e eletromotoras (LARIMER e MACDONALD, 1968; GOTTSCHALK e SCHEICH, 1979; ZUPANC e MALER, 1993; BATISTA et al., 2012; FIELD et al., 2019). Dos estudos analisados sobre essas mudanças de frequência, 34 deles trataram de Gymnotiformes com DOEs do tipo onda, registrando esse comportamento para as famílias Apteronotidae [Apteronotus albifrons, A. leptorhynchus, A. bonaparti, A. hasemani, Adontosternarchus devenanzii (Mago-Leccia et al., 1985), Compsaraia samueli (Albert e Crampton, 2009) e Sternarchogiton nattereri (Steindachner, 1868)] e Sternopygidae (Eigenmannia virescens, E. humboldtii e Sternopygus macrurus (Bloch e Schneider, 1801)). Enquanto 28 deles trataram de gimnotiformes com DOEs do tipo pulsos, registrando o comportamento para as famílias Gymnotidae (Gymnotus carapo e G. omarorum); Hypopomidae (Hypopomusartedi, Brachyhypopomus brevirostris (Steindachner, 1868), B. gauderio, B.sullivani e Microsternarchus bilineatus); e Rhamphichthyidae (Hypopygus lepturus, Steatogenys elegans, Gymnorhamphichthys hypostomus e Rhamphichthys rostratus).
Os chirps são comportamentos que consistem numa modulação abrupta da DOE, com uma alta e transitória aceleração na frequência (HOPKINS, 1974a; KAWASAKI e HEILIGENBERG, 1989). As primeiras observações de chirps foram registradas durante encontros agonísticos, mas observações subsequentes mostraram que eles também ocorrem em comportamentos reprodutivos (LARIMER e MACDONALD, 1968; BULLOCK, 1969; HAGEDORN e HEILIGENBERG, 1985; HAGEDORN, 1988). Este comportamento foi observado em 37 dos estudados analisados, ou seja, em quase 70% dos trabalhos, sendo registrado, tanto para Gymnotiformes com DOE do tipo pulso, quanto onda.
Dos estudos analisados sobre os chirps, 28 deles trataram de Gymnotiformes com DOEs do tipo onda, registrando esse comportamento para as famílias Apteronotidae (Apteronotus albifrons, A. leptorhynchus, A. bonaparti, A. hasemani, Adontosternarchus devenanzii, Compsaraia samueli e Sternarchogiton nattereri) e Sternopygidae [Eigenmannia virescens e E. lineata (Muller e Troschel, 1849)]. Enquanto 18 deles trataram de peixes elétricos neotropicais com DOEs do tipo pulsos, registrando o comportamento para as famílias Gymnotidae (Gymnotus omarorum); Hypopomidae (Hypopomus sp., Brachyhypopomus brevirostris, B. gauderio, B. occidentalis, B. sullivani e Microsternarchus bilineatus); e Rhamphichthyidae (Steatogenys elegans). Todas as famílias estudadas demonstraram ter a capacidade de produzir mudanças de frequência e chirps.
3.2 COMPORTAMENTOS DESCRITOS: INTERRUPÇÕES DE DOE
Como normalmente as DOEs são descargas elétricas contínuas e rítmicas, interrupções da DOE, são comportamentos que consistem numa parada completa do sinal elétrico por períodos de milissegundos a minutos (BULLOCK, 1969; KAWASAKI e HEILIGENBERG, 1989; PERRONE; MACADAR e SILVA, 2009; FIELD et al., 2019). Estes comportamentos são característicos em momentos de acasalamento e também em contexto submissivo, durante encontros agonísticos (BLACK-CLEWORTH, 1970; HAGEDORN, 1988; PERRONE; MACADAR e SILVA, 2009). Interrupções foram observados em 29 dos estudados analisados (53% dos trabalhos analisados) para as famílias Gymnotidae (Gymnotus carapo e G. omarorum), Hypopomidae (Hypopomus artedi, Brachyhypopomus brevirostris, B. gauderio, B. occidentalis, Microsternarchus bilineatus), Apteronotidae (Apteronotus leptorhynchus) e Sternopygidae (Eigenmannia virescens e Sternopygus macrurus). O comportamento interrupção de DOE ainda não foi descrito para as famílias Rhamphichthyidae e Apteronotidae.
4. DISCUSSÃO
Peixes da ordem Gymnotiformes são vantajosos como modelos para estudos de neurofisiologia, evolução, comportamento e como bioindicadores. Entre os aspectos positivos para se estudar as DOEs está o fato de que elas refletem mudanças no funcionamento que podem ser gravadas e analisadas de forma qualitativa e quantitativa (FIELD et al., 2019). Adicionalmente, as DOEs das diferentes espécies podem ser replicadas e/ou modificadas sinteticamente e usadas na forma de “playback”, como estímulo interferente em estudos comunicativos.
Como os peixes da ordem Gymnotiformes são sensíveis à estimulação elétrica, esses experimentos permitem a caracterização e descrição de repertórios comportamentais elétricos, que estão intimamente relacionados com as propriedades anatômicas e fisiológicas de seus órgãos elétricos, da história evolutiva do grupo e, portanto, de fundamental importância para o avanço dos estudos etológicos em geral. Apesar disso, ainda há muitas lacunas de conhecimento neste grupo, especialmente em questão comportamental, pois, apesar de existirem mais de 270 espécies descritas, apenas 23 espécies (11 DOEs tipo onda e 12 DOEs tipo pulso) foram exploradas em estudos comportamentais com as devidas descrições das DOEs.
Quaisquer modulações na DOE dos peixes elétricos são reflexos de estímulos inibitórios ou excitatórios nas células que compõem o núcleo marca-passo destes animais (SPIRO, 1997). Já existem modelos neurofisiológicos propostos para estes animais para famílias específicas, o que torna possível inferir que várias características neurofisiológicas são compartilhadas entre as espécies da Ordem. Estas comparações podem ser feitas, tanto com peixes de DOEs do tipo onda, quanto com peixes com DOEs do tipo pulso.
Apesar de muitas espécies compartilharem comportamentos de modulações de DOE, o levantamento da bibliografia demonstrou que muitos gêneros ainda não foram bem explorados, enquanto outros já estão com seus comportamentos de DOE bem descritos.
Para peixes elétricos com DOEs do tipo onda, 40% dos trabalhos envolveram o gênero Apteronotus, enquanto para peixes elétricos com DOEs do tipo pulso, 27% dos trabalhos envolveram o gênero Gymnotus. Isso provavelmente se deve ao fato desses peixes serem facilmente comercializados fora do Brasil (DUNLAP; THOMAS e ZAKON, 1998; SCHUSTER, 2002; RAAB et al., 2021). O levantamento, também, permitiu perceber que menos de 15% dos trabalhos publicados envolveram campo ou observações não controladas, o que sugere que ainda há muito o que entender desses organismos em campo.
O comportamento de Jamming ainda não foi observado para peixes elétricos de DOE tipo onda. Isso sugere que é um comportamento raro ou ausente nestes indivíduos, já que está presente em diversos peixes elétricos com DOE do tipo pulso (WESTBY, 1975b; FIELD et al., 2019). A natureza desse comportamento é característica de JAR para peixe elétrico com DOE do tipo pulso, uma vez que consiste em interferir sobre um outro pulso de DOE (FIELD et al., 2019). Ressalta-se, também, a ausência do comportamento interrupção de DOE em peixes elétricos das famílias Apteronotidae e Rhamphichthyidae.
Para a família Apteronotidae já era esperado a não ocorrência de Jamming, uma vez que estes peixes têm seus órgãos elétricos neurogênicos (KIRSCHABAUM, 1983). Já para os peixes elétricos com DOE do tipo pulso, esse comportamento nunca foi registrado para a família Rhamphichthyidae, embora as descrições de diversos comportamentos em comum com a família Hypopomidae sugerem a capacidade desse grupo apresentar interrupções de DOE (SCHEICH; GOTTSCHALK e NICKEL, 1977; KAWASAKI e HEILIGENBERG, 1989; FIELD et al., 2019).
Os estudos com peixes elétricos atingem diversas áreas de conhecimento, exigindo abordagens interdisciplinares. Isso leva a uma integração de pesquisas em diferentes níveis, que vão desde o controle de comportamentos elétricos, hormônios e neurotransmissores (SMITH, 2013; FIELD et al., 2019; SÎRBULESCU et al., 2022), ontogenia (ILHAM et al., 2020; BRAY; ILHAM e KUDOH, 2022) e regeneração de tecidos (UNGUEZ, 2013). Desta forma, possivelmente, futuros estudos experimentais explorem questões de funções cerebrais superiores, como as relacionadas à cognição e no reconhecimento de coespecíficos.
REFERÊNCIAS
ALBERT, J. S. Species diversity and phylogenetic systematics of American knifefish (Gymnotiformes, Teleostei). Miscell. Pub. Mus. Zool., v. 190, p. 1-127, 2001.
ALVES-GOMES, J. A. Evolução e Fisiologia de Eletroreceptores e Órgãos Elétricos em Peixes Neotropicais. In: BALDISSEROTTO, B.; CYRINO, J.E.P.; URBINATI, E.C. (Eds.) Biologia e Fisiologia de Peixes Neotropicais de Água Doce. Jaboticabal: FUNEP, 2014. p. 107-139.
BASTIAN, J. Electrolocation: behavior, anatomy and physiology. In: BULLOCK, T. H.; HEILIGENBERG, W. (Eds). Electroreception. New York: Wiley-Interscience publication, 1986. p. 577-612.
BATISTA, G.; ZUBIZARRETA, L.; PERRONE, R.; SILVA, A. Non-sex-biased dominance in a sexually monomorphic electric fish: fight structure and submissive signalling. Ethol., v. 118, p. 398-410, 2012. Disponível em: https://doi.org/10.1111/j.1439-0310.2012.02022.x. Acesso em: 06 fev. 2023.
BENNETT, M. V. L. Electric organs. In: HOAR, W. S.; RANDAL, D. J. (Eds.) F. physiol. New York: Academic Press, 1971. p. 346-491.
BLACK-CLEWORTH, P. The role of electrical discharge in the nonreproductive social behavior of Gymnotus carapo (Gymnotidae, Pisces). Anim. Behav. Monogr., v. 3, p.1-77, 1970.
BOX, H. O.; WESTBY, G. W. M. Behaviour of electric fish (Gymnotus carapo) in a group membership experiment. Psychon. Sci., v. 21, p. 27-28, 1970.
BRAY, I. E.; ILHAM, A. J. J.; KUDOH, T. The diversity and evolution of electric organs in Neotropical knifefishes. EvoDevo, p. 13-19, 2022. Disponível em: https://evodevojournal.biomedcentral.com/articles/10.1186/s13227-022-00194-5. Acesso em: 06 fev. 2023.
BULLOCK, T. H. Species differences in effect of electroreceptor input on electric organ pacemakers and other aspects of behavior in gymnotid fish. Brain Behav. Evd., v. 2, p. 85-118, 1969.
BULLOCK, T. H.; HAMSTRA, R. H.; SCHEICH, H. The jamming avoidance response of high frequency electric fish. J. Comp. Physiol. A, v. 77, p. 1-48, 1972.
CARLSON, B. A. A neuroethology of electrocommunication: senders, receivers and everything in between. In: LADISH, F.; COLLIN, S. P.; MOLLER, P.; KAPOOR, B. G. (Eds.) Communication in Fishes. New Jersey: Enfield, Science Publishers, 2006. p. 805-848.
CAPURRO, A.; MACADAR, O.; PERRONE, R.; PAKDAMAN, K. Computational model of the jamming avoidance response in the electric fish Gymnotus carapo. BioSystems, v. 48, p. 21-27, 1998. Disponível em: DOI: 10.1016/s0303-2647(98)00046-x. Acesso em: 06 fev. 2023.
CAPURRO, A.; PAKDAMAN, K. The electric fish Brachyhypopomus pinnicaudatus produces jamming avoidance responses to signals that are harmonically related to its own discharges. J. Exp. Biol., v. 207, p. 2907-2916, 2004. Disponível em: https://doi.org/10.1242/jeb.01126. Acesso em: 06 fev. 2023.
CAPURRO, A.; REYES-PARADA, M.; OLAZABAL, D.; PERRONE, R.; SILVEIRA, R. MACADAR, O. Aggressive Behavior and Jamming Avoidance Response in the Weakly Electric Fish Gymnotus carapo: Effects of 3,4 Methylenedioxymethamphetamine (MDMA). Comp. Biochem. Physiol., v. 118, p. 831-840, 1997.
CUDDY, M.; AUBIN-HORTH, N.; KRAHE, R. Electrocommunication behaviour and non invasively-measured androgen changes following induced seasonal breeding in the weakly electric fish, Apteronotus leptorhynchus. Horm. behav., v. 61, p. 4–11, 2012. Disponível em: DOI: 10.1016/j.yhbeh.2011.09.003. Acesso em: 06 fev. 2023.
DAGOSTA, F. C. P.; PINNA, M. C. C. The fishes of the Amazon: Distribution and biogeographical patterns, with a comprehensive list of species. Bull. Am. Mus. Nat. Hist., v. 431, p. 1-163, 2019. Disponível em: https://digitallibrary.amnh.org/handle/2246/6940. Acesso em: 06 fev. 2023.
DULKA, J. G.; MALER, L. Testosterone modulates female chirping behavior in the weakly electric fish, Apteronotus leptorhynchus. J. Comp. Physiol. A, v. 174, p. 331-343, 1994.
DUNLAP, K. D.; LARKINS-FORD, J. Diversity in the structure of electrocommunication signals within a genus of electric fish, Apteronotus. J. Comp. Physiol. A, v. 189, p. 153-161, 2003. Disponível em: DOI: 10.1007/s00359-003-0393-3. Acesso em: 06 fev. 2023.
DUNLAP, K. D.; THOMAS, P.; ZAKON, H. Diversity of sexual dimorphism in electrocommunication signals and its androgen regulation in a genus of electric fish, Apteronotus. J. Comp. Physiol. A, v. 183, p. 77-86, 1998. Disponível em: DOI: 10.1007/s003590050236. Acesso em: 06 fev. 2023.
DYE, J. Dynamics and stimulus-dependence of pacemaker control during behavioral modulations in the weakly electric fish, Apteronotus. J. Comp. Physiol. A, v. 161, p. 175-185, 1987. Disponível em: DOI: 10.1007/BF00615239. Acesso em: 06 fev. 2023.
DYE, J.; MEYER, J. H. Central control of the electric organ discharge in weakly electric fish. In: BULLOCK T. H.; HEILIGENBERG W. (Eds.) Electroreception. New York: John Wiley & Sons, 1986. p. 71-102.
ENGLER, G.; FOGARTY, C. M.; BANKS, J. R.; ZUPANC, G. K. H. Spontaneous modulations of the electric organ discharge in the weakly electric fish, Apteronotus leptorhynchus: a biophysical and behavioral analysis. J. Comp. Physiol. A, v. 186, p. 645-660, 2000. Disponível em: DOI: 10.1007/s003590000118. Acesso em: 06 fev. 2023.
FIELD, C. E.; PETERSEN, T. A.; ALVES-GOMES, J. A.; BRAUN, C. B. A JAR of Chirps: The Gymnotiform Chirp Can Function as Both a Communication Signal and a Jamming Avoidance Response. Front. Int. Neur., v. 13, p. 1-20, 2019. Disponível em: DOI: 10.3389/fnint.2019.00055. Acesso em: 06 fev. 2023.
FREILER, M. K.; PROFFITT, M. R.; SMITH, G. T. Electrocommunication signals and aggressive behavior vary among male morphs in an apteronotid fish, Compsaraia samueli. J. Exp. Biol., v.12, p. 225, 2022. Disponível em: DOI: 10.1242/jeb.243452. Acesso em: 06 fev. 2023.
FRICKE, R.; ESCHMEYER, W.; FONG, J. D. Catalog of Fish: Genera, Species, References. Institute for Biodiversity Science and Sustainability, 2022. Disponível em: http://researcharchive.calacademy.org/research/ichthyology/catalog/SpeciesByFamily.asp. Acesso em: 21 nov. 2022.
FUGÈRE, V.; KRAHE, R. Electric signals and species recognition in the wave-type gymnotiform fish Apteronotus leptorhynchus. J. Exp. Biol., v. 213, p. 225-236, 2009. Disponível em: https://doi.org/10.1242/jeb.034751. Acesso em: 06 fev. 2023.
GOTTSCHALK, B.; SCHEICH, H. Phase Sensitivity and Phase Coupling: Common Mechanisms for Communication Behaviors in Gymnotid Wave and Pulse Species. Beh. Ecol. Soc., v. 4, p. 395-408, 1979.
HAGEDORN, M. Ecology and behavior of a pulse-type electric fish, Hypopomus occidentalis (Gymnotiformes, Hypopomidae), in a fresh-water stream in Panama. Copeia, v. 1988, p. 324-335, 1988. Disponível em: https://doi.org/10.2307/1445872. Acesso em: 06 fev. 2023.
HAGEDORN, M.; HEILIGENBERG, W. Court and spark: electric signals in the courtship and mating of gymnotid fish. Anim. Behav., v. 33, p. 254-265, 1985. Disponível em: 10.1016/s0003-3472(85)80139-1. Acesso em: 06 fev. 2023.
HEILIGENBERG, W. Electrolocation and jamming avoidance in a Hypopygus (Rhamphichthyidae, Gymnotoidei), an electric fish with pulse-type discharges. Comp. Physio., v. 91, p. 223–240, 1974.
HEILIGENBERG, W. Jamming avoidance responses: Model systems for neuroethology. In: BULLOCK T. H.; HEILIGENBERG, W. (Eds.) Electroreception. New York: John Wiley & Sons, 1986. p. 613-650.
HEILIGENBERG, W.; BAKER, C.; BASTIAN, J. The jamming avoidance response in gymnotoid pulse-species: a mechanism to minimize the probability of pulse-train coincidence. J. Comp. Physiol. A, v. 124, p. 211-224, 1978.
HO, W. W.; FERNANDES, C. C.; ALVES-GOMES, J. A.; SMITH, G. T. Sex differences in the electrocommunication signals of the electric fish Apteronotusbonapartii. Ethol., v. 116, p. 1050-1064, 2010. Disponível em: DOI: 10.1111/j.1439-0310.2010.01823.x. Acesso em: 06 fev. 2023.
HO, W. W.; TURNER, C. R.; FORMBY, K. J.; SMITH, G. T. Sex differences in the electrocommunication signals of Sternarchogiton nattereri (Gymnotiformes: Apteronotidae). J. Ethol., v. 31, p. 335-340, 2013.
HOPKINS, C. D. Electric communication in fish. Am. Sci., v. 62, p. 426-437, 1974a.
HOPKINS, C. D. Electric Communication in the Reproductive Behavior of Sternopygusmacrurus (Gymnotoidei). Z. Tierpsychol., v. 35, p. 518-535, 1974b.
HOPKINS, C. D. Electric communication: Functions in the social behavior of Eigenmannia virescens. Beh.. v. 50, p. 270-305, 1974c.
ILHAM, J. J. A.; ONO, Y.; CORREIA, A; HACKER, C.; LANGE, A.; SCHOLPP, S.; KAWASAKI, M. INGHAM, P. W.; KUDOH, T. Development of the electric organ in embryos and larvae of the knifefish, Brachyhypopomusgauderio. Develop. Biol., v. 466, p. 99-108, 2020. Disponível em: DOI: 10.1016/j.ydbio.2020.06.010. Acesso em: 06 fev. 2023.
KAWASAKI, M.; MALER, L.; ROSE, G. J.; HEILIGENBERG, W. Anatomical and functional organization of the prepacemaker nucleus in gymnotiform electric fish: the accommodation of two behaviors in one nucleus. J. Comp. Neurol., v. 276, p. 113-131, 1988.
KAWASAKI, M.; HEILIGENBERG, W. Distinct mechanisms of modulation in a neuronal oscillator generate different social signals in the electric fishHypopomus. J. Comp. Physiol. A, v. 165, p. 731-741, 1989.
KAWASAKI, M.; PRATHER, J.; GUO, Y-X. Sensory cues for the gradual frequency fall responses of the gymnotiform electric fish, Rhamphichthys rostratus. J. Comp. Physiol. A, v. 178, p. 453-462, 1996. Disponível em: DOI: 10.1007/BF00190176. Acesso em: 06 fev. 2023.
KELLER, C. H.; KAWASAKI, M.; HEILIGENBERG, W. The control of pacemaker modulations for social communication in the weakly electric fish Sternopygus. J. Comp. Physiol. A, v. 169, p. 441-450, 1991. Disponível em: DOI: 10.1007/BF00197656. Acesso em: 06 fev. 2023.
KIRSCHABAUM, F. Myogenic electric organ precedes the neurogenic organ in apteronotid fish. Naturwissenschaften, v. 70, p. 205-207, 1983. Disponível em: DOI: 10.1007/BF01047569. Acesso em: 06 fev. 2023.
KRAHE, R. Evolutionary Drivers of Electric Signal Diversity. In: CARLSON, B. A.; SISNEROS, J. A.; POPPER, A. N.; FAY, R. R. (Eds.) Electroreception: Fundamental Insights from Comparative Approaches. ASA Press, 2019. p. 191-226.
LISSMANN, H. W. On the function and evolution of electric organs in fish. J. Exp. Biol., v. 35, p. 156-191, 1958.
LARIMER, J. L.; MACDONALD, J. A. Sensory feedback from electroreceptors to electromotor centers in gymnotids. Am. J. Physiol., v. 214, p. 1253-1261, 1968. Disponível em: DOI: 10.1152/ajplegacy.1968.214.6.1253. Acesso em: 06 fev. 2023.
MAGO-LECCIA, F. Electric Fishes of the Continental Waters of America. Venezuela: Biblioteca de la Academia de Ciencias Fisicas Matematicas, y Naturales, Caracas, 1994. p. 206.
METZNER, W. Neural circuitry for communication and jamming avoidance in gymnotiform electric fish. J. Exp. Biol., v. 202, p. 1365-1375, 1999. Disponível em: DOI: 10.1242/jeb.202.10.1365. Acesso em: 06 fev. 2023.
METZNER, W.; HEILIGENBERG, W. The coding of signals in the electric communication of the gymnotiform fish Eigenmannia: from electroreceptors to neurons in the torus semicircularis of the midbrain. J. Comp. Physiol. A, v. 169, p. 135-150, 1991. Disponível em: DOI: 10.1007/BF00215861. Acesso em: 06 fev. 2023.
METZNER, W.; HEILIGENBERG, W. The neuronal processing of communicatory signals in Eigenmannia. J. Comp. Physiol. A, v. 173, p. 722-726, 1993.
MOLLER, P. Electric Fishes – History and Behavior. 1a Ed. London: Chapman & Hall, 1995. p. 584.
PERRONE, R.; MACADAR, O.; SILVA, A. Social electric signals in freely moving dyads of Brachyhypopomus pinnicaudatus. J. Comp. Physiol. A, v. 195, p. 501-514, 2009. Disponível em: DOI:10.1007/s00359-009-0427-6. Acesso em: 06 fev. 2023.
PERRONE, R.; SILVA, A. C. Status-Dependent Vasotocin Modulation of Dominance and Subordination in the Weakly Electric Fish Gymnotus omarorum. Front. Behav. Neur., v. 12, p. 1-10, 2018. Disponível em: https://doi.org/10.3389/fnbeh.2018.00001. Acesso em: 06 fev. 2023.
PETERSEN, T. A. Respostas comportamentais (modulações das Descargas do Órgão Elétrico – DOEs) de peixes elétricos pulsadores (famílias Hypopomidae e Rhamphichthyidae, Ordem Gymnotiformes) quando expostos a sinais elétricos interferentes. Tese (Doutorado em Biologia de Água Doce e Pesca Interior) – Instituto Nacional de Pesquisas da Amazônia. Manaus, Amazonas, 2021. 184 f.
PETZOLD, J. M.; SMITH, G. T. Androgens regulate sex differences in signaling but are not associated with male variation in morphology in the weakly electric fish Parapteronotushasemani. Horm. Behav., v. 78, p. 67-71, 2016. Disponível em: DOI: 10.1016/j.yhbeh.2015.10.014. Acesso em: 06 fev. 2023.
RAAB, T.; BAYEZIT, S.; ERDLE, S.; BENDA, J. Electrocommunication signals indicate motivation to compete during dyadic interactions of na electric fish. J. Exp. Biol., v. 224, p. 1-12, 2021. Disponível em: https://doi.org/10.1242/jeb.242905. Acesso em: 06 fev. 2023.
SCHEICH, H.; GOTTSCHALK, B.; NICKEL, B. The jamming avoidance response in Rhamphichthys rostratus: An alternative principle of time domain analysis in electric fish. Exp. Brain Res., v. 28, p. 229-233, 1977. Disponível em: DOI: 10.1007/BF00235705. Acesso em: 06 fev. 2023.
SCHUSTER, S. Behavioral evidence for post-pause reduced responsiveness in the electrosensory system of Gymnotus carapo. J. Exp. Biol., v. 205, p. 2525-2533, 2002. Disponível em: DOI: 10.1242/jeb.205.16.2525. Acesso em: 06 fev. 2023.
SERRANO-FERNANDEZ, P. Gradual frequency rises in interacting black ghost knifefish, Apteronotus albifrons. J. Comp. Physiol. A, v. 189, p. 685-692, 2003. Disponível em: DOI: 10.1007/s00359-003-0445-8. Acesso em: 06 fev. 2023.
SHUMWAY, C. A.; ZELICK, R. D. Sex recognition and neuronal coding of electric organ discharge waveform in the pulse-type weakly electric fish, Hypopomus occidentalis. J. Comp. Physiol. A, v. 163, 465-478, 1988. Disponível em: DOI: 10.1007/BF00604901. Acesso em: 06 fev. 2023.
SILVA, A.; PERRONE, R.; MACADAR, O. Environmental, seasonal, and social modulations of basal activity in a weakly electric fish. Physiol. & Behav., v. 90, p.525-536, 2007.
SÎRBULESCU, R. F.; ILIEŞ, I.; AMELUNG, L.; ZUPANC, G. K. H. Proteomic characterization of spontaneously regrowing spinal cord following injury in the teleost fish Apteronotus leptorhynchus, a regeneration-competent vertebrate. J. Comp. Physiol. A, v. 208, 671-706, 2022. Disponível em: DOI: 10.1007/s00359-022-01591-w. Acesso em: 06 fev. 2023.
SMITH, G. T. Evolution and hormonal regulation of sex differences in the electrocommunication behavior of ghost knifefishes (Apteronotidae). J. Exp. Biol., v. 216, p. 2421–2433, 2013. Disponível em: https://doi.org/10.1242/jeb.082933. Acesso em: 06 fev. 2023.
SPIRO, J. E. Differential activation of glutamate receptor subtypes on a single class of cells enables a neural oscillator to produce distinct behaviors. J. Neurophysiol., 78, p. 835-847, 1997. Disponível em: DOI: 10.1152/jn.1997.78.2.835. Acesso em: 06 fev. 2023.
STÖCKL, A. F.; BENDA, J; GREWE, J. Encoding of social signals in all three electrosensory pathways of Eigenmannia virescens. J. Neurophysiol., v. 112, p. 2076-2091, 2014. Disponível em: https://doi.org/10.1152/jn.00116.2014. Acesso em: 06 fev. 2023.
TALLAROVIC, S. K.; ZAKON, H. H. Electrocommunication signals in female brown ghost electric knife fish, Apteronotus leptorhynchus. J. Comp. Physiol. A, v. 188, p. 649-657, 2002. Disponível em: DOI: 10.1007/s00359-002-0344-4. Acesso em: 06 fev. 2023.
TALLAROVIC, S.; ZAKON, H. H. Electric organ discharge frequency jamming during social interactions in brown ghost knifefish, Apteronotus leptorhynchus. Ani. Beh., v. 70, p. 1355-1365, 2005.
UNGUEZ, G. A. Electric fish: new insights into conserved processes of adult tissue regeneration. J. Exp. Biol., v. 216, p. 2478–2486, 2013. Disponível em: doi: 10.1242/jeb.082396. Acesso em: 06 fev. 2023.
VALONE, J. A. Electrical emissions in Gymnotus carapo and their relation to social behavior. Behav., v. 37, p. 1-14, 1970.
WATANABE, A.; TAKEDA, K. The change of discharge frequency by A.C. stimulus in a weakly electric fish. J. Exp. Biol. v. 40, p. 57-66, 1963. Disponível em: https://doi.org/10.1242/jeb.40.1.57. Acesso em: 06 fev. 2023.
WESTBY, G. W. M. Has the latency dependent response of Gymnotus carapo to discharge-triggered stimuli a bearing on electric fish communication. J. Comp. Physiol. A, v. 96, p. 307-341, 1975a.
WESTBY, G. W. M. Comparative studies of the aggressive behaviour of two gymnotid electric fish (Gymnotus carapo and Hypopomus artedi). Anim. Behav., v. 23, p. 192-213, 1975b. Disponível em: DOI: 10.1016/0003-3472(75)90065-2. Acesso em: 06 fev. 2023.
WESTBY, G. W. M. Electrical communication and jamming avoidance between resting Gymnotus carapo. Beh. Ecol. Sociob., v. 4, p. 381-393, 1979. Disponível em: https://www.jstor.org/stable/4599209. Acesso em: 06 fev. 2023.
ZAKON, H. H.; OESTREICH, J.; TALLAROVIC, S. K; TRIEFENBACH, F. EOD modulations of brown ghost electric fish: JARs, chirps, rises and dips. J. Physiol., v. 96, p. 451-458, 2002. Disponível em: DOI: 10.1016/S0928-4257(03)00012-3. Acesso em: 06 fev. 2023.
ZHANG, Y.; KAWASAKI, M. Interruption of pacemaker signals by a diencephalic nucleus in the African electric fish, Gymnarchusniloticus. J. Comp. Physiol. A, v. 192, p. 509-521, 2006. Disponível em: DOI: 10.1007/s00359-005-0089-y. Acesso em: 06 fev. 2023.
ZHOU, M.; SMITH, G. T. Structure and sexual dimorphism of the electrocommunication signals of the weakly electric fish, Adontosternarchus devenanzii. J. Exp. Biol., v. 209, p. 4809-4818, 2006. Disponível em: https://doi.org/10.1242/jeb.02579. Acesso em: 06 fev. 2023
ZUBIZARRETA, L.; PERRONE, R.; STODDARD, P. K.; COSTA, G.; SILVA, A. Differential serotonergic modulation of two types of aggression in weakly electric fish. Front. Beh. Neur., v. 6, p. 1-10, 2012. Disponível em: doi: 10.3389/fnbeh.2012.00077. Acesso em: 06 fev. 2023
ZUPANC, G. K. H.; BULLOCK, T. H. From electrogenesis to electroreception: an overview. In: BULLOCK, T. H.; HOPKINS, C. D.; POPPER, A. N.; FAY, R. R. (Eds.) Electroreception. New York: Springer Handbook of Auditory Research, Springer-Verlag, 2005. v. 21, p. 5-46.
ZUPANC, G. K. H.; MALER, L. Evoked chirping in the weakly electric fish Apteronotus leptorhynchus: a quantitative biophysical analysis. Can. J. Zool., v. 12, p. 1-22, 1993.
[1] Doutorado em Ciências Biológicas; Mestrado em Ciências Biológicas; Graduação em Ciências Biológicas. ORCID: 0000-0002-8855-0247. CURRÍCULO LATTES: http://lattes.cnpq.br/5279716269937041.
[2] Mestrado em Gestão e Regulação de Recursos Hídricos, Graduação em Ciências Contábeis. ORCID: 0000-0002-4817-8882. CURRÍCULO LATTES: http://lattes.cnpq.br/0836443117670723.
Enviado: Janeiro, 2023.
Aprovado: Fevereiro, 2023.