ARTICLE ORIGINAL
OLIVEIRA, Leandro José Dias Gonçalves de [1]
OLIVEIRA, Leandro José Dias Gonçalves de. Synthèse d’un monohydrate complexe de glycinate de cuivre (II). Revista Científica Multidisciplinar Núcleo do Conhecimento. 04 année, Ed. 07, vol. 10, pp. 87-96. juillet 2019. ISSN: 2448-0959
RÉSUMÉ
Les composés de coordination sont essentiellement caractérisés par un ion d’un métal De-bloc, appelé acide Lewis entouré par des ligants appelés bases Lewis, et généralement leurs sels ont une coloration intense lorsqu’ils sont en solution. Le monohydrate de glycinate de cuivre (II) est un solide bleu-vert et a des formes iomériques cis/trans. Le présent travail vise à rendre compte du processus de synthèse et de caractérisation au niveau qualitatif de ce complexe dans le laboratoire chimique de l’école municipale Governador Israel Pinheiro, Joo Monlevade, MG. Les résultats de l’expérience ont révélé des cristaux de couleur caractéristiques du composé prévu et un rendement en pourcentage favorable.
Mots-clés: synthèse chimique, glycinate de cuivre, complexe, composé de coordination.
1. INTRODUCTION
La synthèse chimique nous permet d’obtenir des produits plus complexes d’intérêt pour la société à partir de substances plus simples. La plupart des progrès technologiques ont été possibles grâce à ces études. Les processus de synthèse sont présents dans les industries chimiques et pharmaceutiques, dans le domaine de la biologie et de la biotechnologie, entre autres. Les processus de synthèse chimique visent non seulement à créer de nouvelles substances, mais aussi à développer des méthodes réactionnaires d’une plus grande viabilité économique.
Isenmann (2013) apud Oliveira et al (2018) dit qu’avant de penser à la planification de synthèse, nous devrions chercher des informations de base, telles que la compréhension des mécanismes de réactions, la connaissance des réactions classiques, les notions de stoichiométrie, les méthodes de Purification et quels composés sont facilement disponibles.
Parmi les milliers de composés synthétisés par l’homme sont les complexes. Dans la définition de Russell (1994), un complexe est constitué d’un atome central ou principal, entouré et lié à un ou plusieurs ligands, qui peuvent être des atomes, des ions ou des molécules. Atkins et Jones (2012) complètent, en disant que les liants sont orientés vers le métal par des liaisons coordonnées.
Il est courant d’avoir une formation complexe avec des éléments de blocs D et f avec des orbitales disponibles pour les nouveaux électrons. Le glycinate de cuivre (II) [Cu(gly)2]est un sel qui a différentes voies à synthétiser, et la méthode et les réactifs influencent quand on veut obtenir distinctement les formes de CEI et trans du composé. Pour Shriver et Atkins (2003), les complexes métalliques ont un rôle important dans la chimie inorganique, en particulier ceux formés par les métaux D-Block.
Figure 01 – Trans-bis-et cis-bis[Cu(gly)2]-structures[Cu(gly)2].
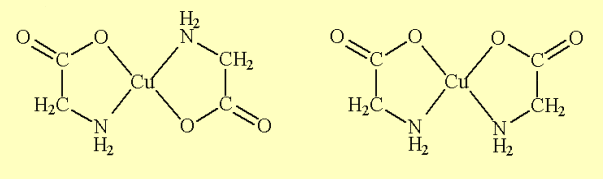
Les complexes métalliques sont des composés intéressants, car ils présentent de nombreuses propriétés particulières en termes de: structures, couleurs, propriétés optiques et magnétiques, par exemple. Une autre caractéristique qui peut être mentionnée se réfère au fait qu’ils forment des sels qui ne libèrent pas leurs ions dans le milieu aqueux, en maintenant leur intégrité chimique. Les composés de coordination sont divisés en deux groupes : les doubles sels, ceux qui perdent leur identité, et les complexes, qui sont ceux qui maintiennent l’identité. (Hoehne e Dall’Oglio, 2013).
Ce travail vise à décrire la méthode utilisée pour obtenir l’un des isomères de glycinate de cuivre (II) à partir de l’acide aminoacétique et l’acétate de cuivre (II) monohydrate, réalisée dans le laboratoire d’une école technique de Joo Monlevade, MG, et de faire un Simple analyse qualitative du composé formé.
2. MÉTHODE
À l’aide d’un lit de 50 ml dissous 2,0 g d’acétate de cuivre (II) Monohydrate dans 25 ml d’eau désionisée chauffée, procédant au réchauffement progressif subséquent à l’aide de l’appareil monté sur Bunsen. Un P.A. de 25 ml d’éthanol précédemment chauffé a été ajouté à cette solution. Il a continué à maintenir le mélange sous le chauffage. Dans un autre léquement, 1,5 g d’acide aminoacétique a été dissous dans 25 ml d’eau déionisée chaude. Les deux bébés ont été maintenus sous chauffage jusqu’à ce qu’ils atteignent 70 oC (un thermomètre a été utilisé pour surveiller la température). La solution de l’acide aminoacétique a été ajoutée au mélange de l’acétate de cuivre (II) monohydrate. Le mélange a été laissé au repos jusqu’à ce qu’il atteigne la température ambiante. Puis le léquement a été immergé dans le bain de glace. Après quelques minutes, le contenu du Bequer a été filtré à l’aide du papier de filtre de masse qualitatif précédemment déterminé. Le contenu de l’entonnoir a été lavé à l’éthanol. Après la filtration complète, le papier filtre a été retiré de l’entonnoir, qui a été ouvert sur le comptoir jusqu’à l’évaporation complète de l’alcool. La masse du contenu sur le papier filtre a été mesurée et le rendement de réaction a été calculé.
3. RÉSULTATS ET DISCUSSIONS
Nous avons mesuré les masses d’acide aminoacétique et d’acétate de cuivre (II) Monohydrate, dont les valeurs étaient respectivement 1.5009 G et 2.0036 G. Après cela, la masse du papier filtre qualitatif a été mesurée et la valeur de 1,1609 G a été trouvée. Il a été observé inexactitude de la mesure de masse dans la quatrième décimale endroit pour l’acide aminoacétique et pour le papier filtre qualitatif et dans les troisième et quatrième décimales endroits pour l’acétate de cuivre (II) monohydrate.
L’acétate de cuivre est un sel bleu-vert tandis que l’acide aminoacétique est l’acide organique incolore. Pendant la phase de chauffage, il n’y a pas eu de modifications notables dans le contenu des Bédouins, et ils ont clairement présenté les couleurs des réactifs respectifs utilisés.
Figure 02 – Phase de chauffage des réactifs.

Le changement notoire s’est produit quand la solution de l’acide aminoacétique a été placée dans le bequer contenant le mélange de l’acétate de cuivre (II) monohydrate et éthanol. Il a révélé une couleur bleue. Le lit a été retiré de l’appareil de chauffage et placé sur le comptoir jusqu’à ce qu’il atteigne la température ambiante.
Figure 03 – Mélange résultant du mélange entre les réactifs.

La coloration observée est due à l’ion de cuivre CU2 – hydraté, métal responsable de la formation de plusieurs complexes d’intérêt scientifique, parmi eux, le glycinate de cuivre (II) monohydrate, qui a suscité le plus grand intérêt des étudiants en révélant leur intense Coloration. De nombreux éléments des solutions de forme de bloc D avec des couleurs caractéristiques dans l’eau (ATKINS et JONES, 2012). D’autres caractéristiques, telles que la conductivité, la couleur, les composés avec la même composition moléculaire, mais la couleur différente et le moment de dipole ont été observés dans cette nouvelle classe de composés (COELHO, 2010).
La couleur qu’une substance affiche correspondant, par conséquent, à la fraction de la lumière visible qu’elle n’absorbe pas. L’absorption des rayons ultraviolets inférieurs à 400 n’est pas détectée par l’œil humain, et nous percevons le rayonnement infrarouge comme de la chaleur (SOUZA, S.D.).
En chimie, la variété des couleurs enchante tout le monde et, en fait, le changement de couleur est une indication de la réaction chimique. Les couleurs sont importantes car elles peuvent révéler plus de détails sur un composite dans l’analyse. Basé sur le glycinate de cuivre (II) monohydrate, le sel a indiqué la coloration caractéristique de l’ion complexe. Selon Atkins et Jones (2012), si le complexe est bleu, c’est parce qu’il absorbe la lumière orange (580-620 nm). L’orange et le bleu sont des couleurs complémentaires.
Figures 04 – Cercle chromatique.

Pour qu’un composé ait de la couleur, il doit absorber la lumière visible. Un composé absorbera le rayonnement visible quand ce rayonnement a l’énergie nécessaire pour déplacer un électron de son état d’énergie (fondamental) inférieur à un état excité (BROWN, 2003).
Après que le mélange de bécher a atteint la température ambiante, mesurée avec un thermomètre, le lit a été immergé dans le bain de glace. Des cristaux trop lumineux d’une coloration bleue, légèrement moins intenses, se sont avérés plus grands et plus définis. Les cristaux de sel ont montré peu de solubilité dans le milieu aqueux lorsqu’ils sont soumis à basse température.
Figures 05/06-cuivre cristaux de glycinate (II).

Figure 07 – Appareil de filtration.

Après quelques minutes, l’appareil de filtration a été assemblé afin de conserver la partie solide qui a été formée à mesure que la température diminuait. Comme le volume du filtrate a augmenté dans le calice, en raison d’un lavage continu à l’éthanol, nous avons pu voir les cristaux de cuivre Glycinus (II), très unis, apparemment macéré, de coloration bleue intense. La couleur du complexe dépend du métal, mais aussi du ligand, ce qui signifie que les changements de substitutions peuvent provoquer des changements de couleur. Après le filtrage, le papier filtre a été enlevé et ouvert sur le comptoir, de sorte qu’il passerait au-dessus d’un flux d’air.
La réaction qui s’est produite pour la formation du composé de coordination est donnée par l’équation
Cu (CH3COO)2 + 2 NH2CH2COOH + H2O [Cu (NH2CH2COO)2]. H2O + 2 CH3COOH
Après l’évaporation complète de l’éthanol qui a mortaissait le papier filtre, il ne restait plus que les cristaux. La masse des cristaux avec le papier filtre était de 2,9385 G. Par conséquent, la masse des cristaux isolés correspond à 1,7776 g.
Pour calculer le rendement de la réaction de synthèse du glycinate de cuivre, il était nécessaire de déterminer les masses molaires des réactifs impliqués, étant
Cu (CH3COO)2 = 181,62982 g.mol-1, NH2CH2COOH = 75,42662 g.mol-1 e
[Cu (NH2CH2COO)2]. H2O = 229,67450 g.mol-1. Les calculs effectués suivent ci-dessous, en utilisant tous les endroits décimals dans le but de laisser le résultat plus précis:
1 mol NH2CH2COOH __________ 75,42662 g
2 mol NH2CH2COOH __________ m1 = 150,85324 g
La vérification a été faite pour vérifier s’il y avait un réactif excédentaire, dont le calcul suit :
1 mol Cu (CH3COO)2 __________ 2 mol NH2CH2COOH
181,62982 g __________ 150,85324 g
2,0036 g __________ m2 = 1,6640965215 g NH2CH2COOH
181,62982 g __________ 150,85324 g
m3 __________ 1,5009 g m3 = 1,8071086629 g Cu (CH3COO)2
Il a été remarqué, par les calculs, que l’excédent de réactif est Cu (CH3COO) 2, bientôt parti du réactif limitant, NH2CH2COOH, pour effectuer le calcul du rendement.
2 mol NH2CH2COOH __________ 1 mol [Cu (NH2CH2COO)2]. H2O
150,85324 g __________ 229,6745 g
1,5009 g __________ m4 = 2,2851246486 g
2,2851246486 g __________ 100%
1,7776 g __________ R = 77,790067211%
Les calculs ont montré que le rendement de réaction était d’environ 77,8 %. Nous pouvons considérer à quel point les rendements de réaction sont favorables à 60 %.
Il ya un grand intérêt parmi les professionnels dans les structures, les propriétés et les utilisations des complexes, selon Atkins et Jones (2012), en partie parce qu’ils participent à de nombreuses réactions biologiques.
Les couleurs des composés de coordination sont généralement déterminées par les atomes centraux, bien qu’elles puissent également être dues à d’autres chromophores (ou pigments) qui font partie de leur composition. Les complexes métalliques de transition sont fascinants par les variétés de couleurs qu’ils exposent. Pour un métal particulier, ce changement de couleur peut également être observé en fonction du ligand (SOUZA, S.D.).
Les complexes de métaux du groupe D sont souvent magnétiques et de couleurs vives et sont utilisés en chimie pour l’analyse, la dissolution des ions, l’électrodéposition des métaux et la catalyse. Ils font également l’objet de recherches sur la conservation de l’énergie solaire, dans la fixation de l’azote atmosphérique et de nouveaux médicaments (ATKINS et JONES, 2012).
De nombreux complexes sont importants pour nos vies, et leur manque dans notre organisme peut causer des maladies graves. Selon Brown (2003), des éléments tels que V, Cr, Mn, Fe, Co, Ni, Cu, Zn, Mo et Cd forment des complexes avec une variété de groupes de donneurs présents dans les systèmes biologiques tels que les enzymes. Le glycinate de cuivre (II) est également employé couramment pour la supplémentation parentérale chez les animaux, étant une source de remplacement de cuivre.
Il ya aussi des complexes qui sont utilisés dans les pigments de peinture, la production de couleur dans le verre et les pierres précieuses. Des exemples d’autres complexes importants pour le maintien de la vie sont l’hémoglobine, responsable du transport de l’oxygène dans le sang, dont l’atome central est Fe2 et la chlorophylle, responsable de la photosynthèse, dont l’atome central est Mg2.
Il existe de nombreux métaux qui forment des complexes indispensables à plusieurs fonctions biologiques des êtres vivants, contribuant au maintien des besoins cellulaires de base. Ces composés sont capables d’interagir avec de nombreux sites récepteurs, ce qui représente un gain potentiel dans la formulation d’agents thérapeutiques sélectifs.
Les activités menées par les ions métalliques dans les milieuis biologiques ont stimulé la recherche et le développement de composés inorganiques en tant qu’agents thérapeutiques. L’implication de ces composés dans la médecine, en particulier ceux contenant des métaux de transition, a été très limitée jusqu’en 1965, quand il y avait une démonstration classique de l’activité antitumorale du complexe appelé cisplatin[PtCl2(NH3)2]e, (COHEN, 2007 apud GUERRA et al, 2011 ).
4. CONCLUSION
La synthèse proposée du composé prévu a été réalisée avec succès. L’utilisation de stratégies telles que l’expérimentation contribue grandement à la formation des étudiants, en plus de pouvoir être utilisé comme une première étape pour l’introduction d’un contenu. On croit que les erreurs d’analyse et l’équipement sans étalonnage approprié peuvent avoir contribué à la perte du rendement réactionnaire. Il n’est pas possible de déterminer seulement qualitativement quelle forme isomerique a été synthétisée ou s’il existe la possibilité d’un mélange racemic. Pour cela, des méthodes d’analyse instrumentales plus sélectives, capables de déterminer la structure des composés, seraient nécessaires. La formation de cis-bis-a été spécu[Cu(gly)2]lée. H2O basé sur des informations provenant d’autres expériences, en disant que par le mélange de glycine au filtrate restant, il est possible d’obtenir la forme trans du complexe d’intérêt. L’étude de la synthèse chimique est relativement complexe, mais importante pour le développement de nouveaux produits et de principes actifs d’intérêt non seulement dans l’environnement académique, mais dans différents domaines de connaissances, tels que les secteurs pharmaceutique et agrovétérinaire, pour échantillon.
5. RÉFÉRENCES
ATKINS, Peter; JONES, Loretta. Princípios de química: questionando a vida moderna e o meio ambiente, 5° ed. Bookman, 2012, 922 p.
BROWN, Theodore. Química: a ciência central, 9° ed. São Paulo, Pearson, 2003.
Círculo cromático. Disponível em < http://www.elgin.com.br/blog/2017/04/18/cores-voce-sabe-como-combina-las-na-hora-de-decorar/>; 2017. Acesso em 30/10/2018.
COELHO, Augusto Leite. Química Inorgânica, Ceará, Núcleo Gráfico da UECE, 2010, 132 p.
COTTON, Simon. Uppingham Scholl, Rutland, UK Molecule od the Month April, 2010. Disponível em <http://www.chm.bris.ac.uk/motm/glycine/Glycine%20-%20Molecule%20of%20the%20Month%20-%20April%202010.pdf>. Acesso em 30/10/2018.
GUERRA, Wendell; et al. Coordenação de metais a antibióticos como uma estratégia de combate à resistência bacteriana. Revista Química Nova, 34(1); 2011: 111-118.
HOEHNE, Lucélia; DALL’OGLIO, Camila. Compostos de coordenação e a química orgânica. Revista Destaques Acadêmicos, 5(4); 2013: 79-83.
ISENMANN, Armin Franz. Princípios da Síntese Orgânica. 2ª ed. Timóteo, 2013.
OLIVEIRA, Leandro José Dias Gonçalves de.; et al. Rotas de síntese do antibiótico Linezolida e correlação entre sua estrutura química e bioatividade. Revista Eletrônica Acervo em Saúde, Vol. Sup. 13, 2018; p. 1557-1566.
RUSSEL, John. Química Geral, 2ª ed. Pearson, 1994, vol.1, 662 p.
SHRIVER, Duward; ATKINS, Peter. Química Inorgânica, 3ª ed. Bookman, 2003, 816 p.
SOUZA, Anne. Compostos de coordenação: cor e propriedades magnéticas, s.d.; p. 152-160.
[1] Produits chimiques (UNIUBE). Spécialiste en enseignement de la chimie (UCAM). Académique du Cours de spécialisation en éducation scientifique (UFMG).
Soumis : juillet 2019.
Approuvé : juillet 2019.


