REVISÃO INTEGRATIVA
COSTA, Cirlene Cardoso Monteiro [1], FATAL, Lílian Brito da Silva [2]
COSTA, Cirlene Cardoso Monteiro. FATAL, Lílian Brito da Silva. Probióticos na terapia de manutenção em pacientes com retocolite ulcerativa: uma revisão integrativa. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano. 07, Ed. 11, Vol. 15, pp. 80-94. Novembro de 2022. ISSN: 2448-0959, Link de acesso: https://www.nucleodoconhecimento.com.br/saude/retocolite-ulcerativa, DOI: 10.32749/nucleodoconhecimento.com.br/saude/retocolite-ulcerativa
RESUMO
Introdução: A Retocolite Ulcerativa – RCU é uma doença inflamatória intestinal crônica caracterizada por episódios recorrentes de inflamação que acomete predominantemente a camada mucosa do cólon. O uso de probióticos pode ser uma forma alternativa de terapia para as DIIs, uma vez que pode auxiliar na alteração da microbiota intestinal, inibição do crescimento de bactérias patogênicas, estimulação da imunidade intestinal e o aumento de ácidos graxos de cadeia curta, que atuam como agentes anti-inflamatórios. Nesse contexto, procura-se investigar se a utilização de probióticos confere manutenção do estado de remissão em pacientes com Retocolite Ulcerativa. Objetivo: Verificar evidências do uso de probióticos para manutenção da remissão em pacientes com RCU, identificando cepas, tempo, dose resposta e os possíveis benefícios da sua utilização. Metodologia: Foi realizada uma revisão do tipo integrativa nas seguintes bases de dados: Pubmed, Lilacs, Scielo e Cochrane, utilizando-se os termos “retocolite ulcerativa”, “probióticos”, “remissão” e a combinação entre “manutenção” e “remissão”. Foram selecionados somente artigos originais, realizados em humanos, do tipo ensaios clínicos randomizados e/ou revisão sistemática com ou sem metanálise e estudos de coorte, publicados entre 2011 e 2021. Resultados: A busca nas bases de dados resultou em um total de 56 publicações, sendo 28 (50%) em inglês, 17 (30%) em português e 11 (20%) em espanhol. Destes, 51 artigos foram excluídos por não terem o delineamento desejado para esta revisão, totalizando 5 artigos finais selecionados. A predominância de artigos foi de estudos randomizados, ensaios estes que se constituem numa ferramenta para avaliação de intervenções para a saúde. Existem várias limitações na busca de encontrar resultados positivos frente a abordagem terapêutica com intenção de manutenção da remissão na RCU, somente dois dos cinco estudos demonstraram benefícios e manutenção de estado de remissão com uso dos probióticos, mas em um desses, o probiótico estava associado ao uso de medicamentos. Outro ponto importante é que a maioria das cepas utilizadas nos estudos foram heterogêneas, assim como o tempo de uso e a dosagem também. Conclusão: Com base na revisão realizada, não foram encontrados dados suficientes para a utilização de probióticos, como terapia de manutenção da remissão em pacientes com RCU.
Palavras-chave: Probióticos, Retocolite Ulcerativa, Remissão, Manutenção da remissão.
INTRODUÇÃO
O sistema gastrointestinal é o segundo maior sistema do corpo, sendo indispensável para oferecer proteção ao organismo contra o meio externo, uma vez que nele habitam um conjunto de microrganismos denominado microbiota intestinal (FLINT et al., 2012; WEISS; HENNET, 2017). Dessa forma, a microbiota intestinal se tornou uma fonte de estudo extremamente importante para o conhecimento e tratamento de determinadas doenças, em especial as Doenças Inflamatórias Intestinais (DII).
As DII incluem duas formas principais, Doença de Crohn (DC) e Retocolite Ulcerativa (RCU), que configuram distintos distúrbios inflamatórios intestinais com risco de recidiva (EVERHOV; OLÉN; LUDVIGSSON, 2017). A terapêutica existente para as DII pode ser farmacológica, nutricional e cirúrgica. O principal objetivo do tratamento é a indução e manutenção do estado de remissão, a correção das deficiências nutricionais e a prevenção das complicações inerentes a estes estados patológicos (WĘDRYCHOWICZ; ZAJĄC; TOMASIK, 2016).
O número de pessoas com DII vem aumentando em todo o mundo, e uma explicação para esse fenômeno pode estar no estilo de vida, na industrialização e no desenvolvimento humano. Dados levantados entre os anos de 1990 e 2016 apontam que vêm aumentando a incidência e a prevalência das DIIs. No Brasil, são poucos os estudos epidemiológicos que permitem conhecer sua incidência e prevalência e estes também são limitados devido a dificuldades diagnósticas e reduzidas amostras populacionais estudadas (NG et al., 2018).
A RCU é uma doença inflamatória intestinal crônica caracterizada por episódios recorrentes de inflamação, que acomete predominantemente a camada mucosa do cólon. A doença usualmente afeta o reto e também variáveis porções proximais do cólon, em geral de forma contínua, ou seja, sem áreas de mucosa normais entre as porções afetadas (SRINIVASAN et al., 2017).
Os suplementos alimentares e, especificamente, os probióticos, têm sido investigados como agentes terapêuticos potenciais nas DII, devido à possibilidade que possuem de modificarem a microbiota intestinal e modularem a resposta inflamatória intestinal (ASTÓ et al., 2019; DURCHSCHEIN; PETRITSCH; HAMMER, 2016). A World Gastroenterology Organisation (2017), define os probióticos como microrganismos vivos que, quando administrados em quantidades adequadas, conferem benefícios à saúde do hospedeiro.
Alguns autores têm descrito o uso de probióticos como uma forma alternativa de terapia para as DIIs, auxiliando, em diversos processos do organismo, dentre eles, a alteração da microbiota intestinal, inibição do crescimento de bactérias patogênicas, estimulação da imunidade intestinal e o aumento da produção de butirato, um ácido graxo de cadeia curta que atua como agente anti-inflamatório (DERIKX et al., 2016). A eficácia dos probióticos é específica para a dose utilizada, doença e espécie bacteriana e, a duração da terapêutica probiótica depende da indicação clínica (WILKINS; SEQUOIA, 2017).
Sendo assim, neste trabalho é investigado se a utilização de probióticos confere a manutenção do estado de remissão em pacientes com Retocolite Ulcerativa (RCU). Partindo desse pressuposto, esta revisão integrativa tem como objetivo verificar evidências do uso de probióticos para manutenção da remissão em pacientes com RCU, identificando cepas, tempo, dose resposta e os possíveis benefícios da sua utilização.
METODOLOGIA
Esta pesquisa é uma revisão integrativa da literatura, de base qualitativa, realizada entre os meses de junho de 2020 a maio de 2021. Após a identificação do tema, o delineamento foi realizado considerando a pergunta clínica (A utilização de probióticos confere benefícios na manutenção do estado de remissão em pacientes com Retocolite Ulcerativa?) em formato PICOT: P (pacientes com Retocolite Ulcerativa em remissão clínica); I (o uso de probióticos); C (comparados aos grupos sem a utilização de probióticos); O (manutenção da remissão da RCU) e T (tempo necessário para estimular a estabilidade da remissão). Sendo essa etapa o alicerce da Prática Baseada em Evidências (PBE).
A pesquisa seguiu os padrões de rigor metodológico propostos para a revisão integrativa da literatura. Percorrendo pelas seis etapas sugeridas para desenvolvimento do método: 1) identificação do tema e definição da questão de pesquisa; 2) estabelecimento de critérios para inclusão e exclusão de estudos; 3) definição das informações a serem extraídas dos estudos selecionados; 4) avaliação dos estudos incluídos na revisão integrativa; 5) interpretação dos resultados; e 6) apresentação da revisão/síntese do conhecimento (WHITTEMORE; KNAFL, 2005).
Foi então realizada a busca de estudos relevantes nas bases de dados: Literatura Latino-Americana e do Caribe em Ciências da Saúde (LILACS), Medical Literature Analysis and Retrieval System Online (Medline) via Pubmed, Scientific Electronic Library Online (SciELO) e a biblioteca Cochrane Library, utilizando os Descritores em Ciências da Saúde (DeCS) e MeSH (Medical Subject Headings), combinando-se os termos “retocolite ulcerativa”, “probióticos”, acompanhados de “remissão” e a combinação entre “manutenção” e “remissão”, cada um associado a “retocolite ulcerativa”, incluindo também os termos relacionados, associados aos operadores booleanos AND ou OR, sendo ajustados de acordo com a base de dados.
Os critérios de inclusão foram os estudos realizados com humanos, publicados em português, inglês ou espanhol, nos últimos 10 anos, com recorte temporal abrangendo 2011-2021, nos quais tenham sido avaliados fatores da modulação na microbiota intestinal com probióticos por estarem interligados a manutenção da fase de remissão da doença e que apresentassem desfechos clínicos associados à Retocolite Ulcerativa com ênfase na remissão, relacionando apenas estudos de ensaio clínico controlado randomizado, revisão sistemática com ou sem meta-análises e estudos de coorte nos idiomas português, inglês ou espanhol.
E quanto aos critérios de exclusão, foram excluídos estudos em crianças, assim como os artigos que abordavam outras síndromes intestinais por não terem o delineamento desejado para esta revisão, caso-controle, transversal, relatos de caso ou estudos pré-clínicos.
Após a seleção dos artigos através da leitura do título e resumo, conforme os critérios apresentados, foi realizada a leitura completa dos artigos triados para confirmação da elegibilidade, representada pelo fluxograma de identificação e seleção dos mesmos (Figura 1).
Para cada estudo, as seguintes informações foram extraídas: nomes dos autores, ano de publicação, país onde foi realizada a pesquisa, tipo de estudo, tipo de probiótico e dose utilizada, número de indivíduos testados, a duração do tratamento e os desfechos de remissão relacionados a RCU associados a remissão. As características gerais dos estudos incluídos foram apresentadas na Tabela 1.
Figura 1 – Fluxograma de identificação e seleção dos artigos
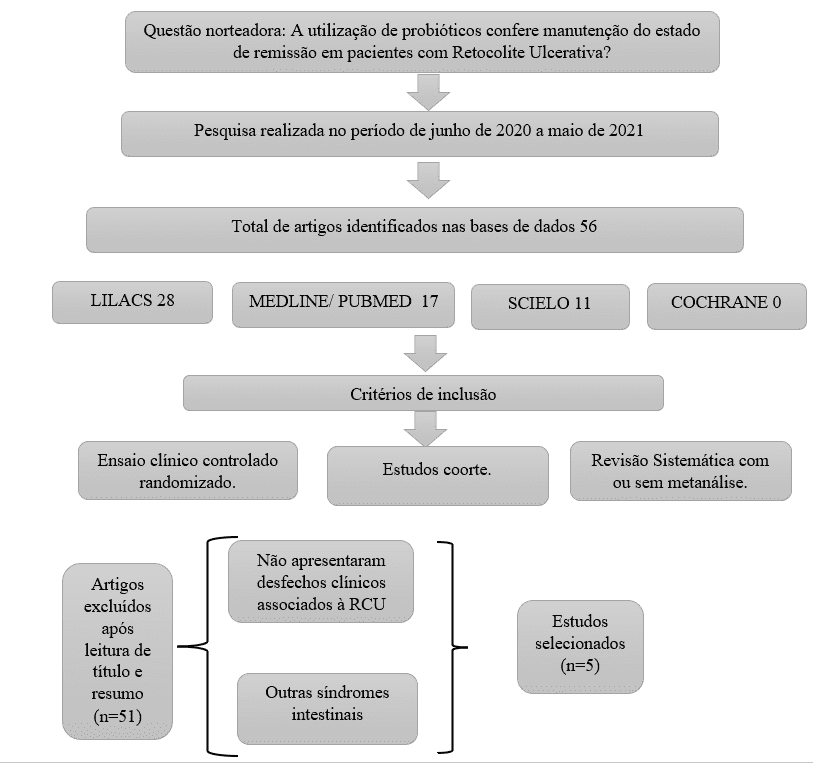
RESULTADOS E DISCUSSÃO
Dada a importância da microbiota na patogênese da DII, o uso de probióticos no tratamento dessas doenças tem sido extensivamente explorado. Nesse sentido, a atividade benéfica dos probióticos na DII foi demonstrado com efeitos promissores em humanos (KASHIMA et al., 2015; LEVIT et al., 2016; ŠTOFILOVÁ et al., 2017).
A busca nas bases de dados, com as associações de palavras-chave, resultou em um total de 5 artigos finais selecionados. Destes, foi verificado que os estudos foram desenvolvidos no continente europeu e asiático, sendo 02 estudos realizados no Japão, 01 no Reino Unido, 01 na Dinamarca e 01 no Irã.
Tabela 1: Características dos estudos incluídos na revisão
| Autor/Ano de Publicação | País de realização da pesquisa | Tipo de estudo | Tipo de Probiótico
e dose utilizada |
Nrº
indivíduos testados |
Duração
do tratamento |
Desfechos relacionados a RCU associados a remissão |
| WILDT
et al., 2011 |
Dinamarca | Randomizado duplo-cego controlado por placebo
|
Probio-Tec AB-25
(L. acidophilus cepa LA-5 e B. animalis subsp. lactis estirpe BB-12). 2 cápsulas – 3x/dia. 1,5 × 10¹¹ UFC. |
32
|
52 semanas | Nenhum benefício clínico significativo pode ser demonstrado em comparação com o placebo. |
| SHADNOUSH et al., 2015 | Irã | Randomizado duplo-cego controlado por placebo. | 250g/dia de Iogurte probiótico (Lactobacillus acidophilus La-5 e Bifidobacterium animalis BB-12 (10⁶ UFC/g).
Placebo: 250g/dia de iogurte sem probióticos. |
260
|
8 semanas | Houve melhora da função intestinal, com aumento do nº de Lactobacillus e Bifidobacterium, e diminuição na concentração de Bacteroides no intestino e cólon no grupo em tratamento com probiótico. |
| MATSUOKA et al., 2018 | Japão | Multicêntrico, randomizado duplo-cego controlado por placebo | Bifidobacterium breve (10 bilhões de bactérias) e Lactobacillus acidophilus (1 bilhão de bactérias)
100 mL – 1x/dia. |
195
|
48 semanas | BFM não teve efeito a tempo de recaída em pacientes da RCU em comparação com o placebo.
|
| BJARNASON et al., 2019 | Reino Unido | Randomizado duplo-cego controlado por placebo | Probiótico Symprove (Symprove Ltd, Farnham, Surrey UK)
1 ml / kg / dia. |
81
|
4 semanas | Não houve mudanças significativas em nenhum dos parâmetros de resultados medidos. |
| CHEN
et al., 2019 |
Japão | Estudo piloto | Probio-Fit – Lactobacillus casei Zhang, Lactobacillus plantarum P-8, e Bifidobacterium animalis ssp. lactis V9.
2×10¹º CFU g 1 por 2 x dia. |
25
|
12 semanas | Maior contagem de bactérias benéficas.
Maior magnitude de no Índice de Atividade da Doença UC (UCDAI) no grupo probiótico em comparação com o grupo placebo (P = 0,043). Aumento na taxa de remissão (91,67% para receptores de probióticos versus 69,23% para receptores de placebo, P = 0,034). |
Fonte: Autores (2021).
Ao todo cinco (5) artigos se encaixaram nos critérios de inclusão para análise da revisão, todos do tipo randomizado duplo-cego controlado por placebo, havendo homogeneidade significativa dos desenhos dos estudos com intervenções que variaram entre 4 a 52 semanas.
Foi possível verificar que os países, nos quais foram realizados os estudos, são dos continentes asiático e europeu. Nesses países observa-se uma alta prevalência e incidência das DII. Esses altos níveis das DII nestes países parecem ser justificados pelo alto índice de desenvolvimento e hábitos dietéticos. A maior prevalência de DII entre pessoas com maior nível socioeconômico tem sido sugerido devido a um atraso ou baixo nível de exposição a agentes infecciosos comuns durante a infância, gerando uma resposta imune alterada geneticamente em indivíduos suscetíveis (KAPLAN, 2015).
A RCU é uma doença inflamatória intestinal crônica caracterizada por episódios recorrentes de inflamação que acomete predominantemente a camada mucosa do cólon (SRINIVASAN et al., 2017). Como característica desta condição clínica, muitos pacientes permanecem em remissão clínica (os sintomas desaparecem ou diminuem) por longos períodos, mas a probabilidade de ausência de recidiva por 2 anos é de apenas 20%. As recidivas geralmente ocorrem na mesma região do cólon afetada em outros períodos de agudização. Entretanto, cerca de 20 a 50% dos pacientes podem apresentar extensão proximal da doença ao longo do seguimento (MAGRO et al., 2017).
A definição de remissão da RCU pode ser baseada no Índice de Atividade da Doença (do inglês Clinical Disease Activity Index – CDAI), este índice pode ser obtido mediante a utilização de indicadores clínicos, laboratoriais ou clínico-laboratoriais. Na RCU é conveniente o uso do número de evacuações e a presença ou não de sangue nas fezes como indicadores clínicos, e os níveis séricos de albumina, a velocidade de hemossedimentação, o nível de hemoglobina e as proteínas de fase aguda, como a Proteína C-reativa, como indicadores laboratoriais, que pode detectar a reativação da doença (GAJOWNIK, 2018).
Nos estudos que entraram nesta revisão foram utilizadas ferramentas para caracterizar a atividade da doença nos pacientes pelo CDAI, porém sua acurácia é comprometida pela substancial subjetividade e pobre correlação com índices endoscópicos (LEWIS, 2011). Nos estudos, as amostras de sangue e de fezes foram os meios mais utilizados para mensurar as respostas aos tratamentos. Marcadores bioquímicos como a proteína C-reativa (PCR) são importantes na prática clínica, mas têm sensibilidade limitada, particularmente na RCU, foi utilizada em quatro estudos (BJARNASON et al., 2019; MATSUOKA et al., 2018; SHADNOUSH et al., 2015; WILDT et al., 2011), e a velocidade de hemossedimentação (VHS) em apenas um estudo (BJARNASON et al., 2019). Exames clínicos, questionários de saúde geral, de sintomas, de qualidade de vida e de hábitos intestinais também foram avaliados (BAMBA et al., 2017; GAJOWNIK, 2018).
A mucosa intestinal inflamada contém neutrófilos em abundância; assim, avaliar os grânulos derivados dos neutrófilos, por meio dos marcadores fecais, como a lactoferrina e calprotectina, parece ser atualmente a melhor maneira não invasiva de acessar a inflamação do intestino (SPOOREN et al., 2019). Os marcadores fecais ajudam na monitorização da atividade inflamatória na DII, nota-se que a calprotectina foi o biomarcador que apresentou valores significativos de especificidade e sensibilidade para o diagnóstico diferencial da DII nos artigos.
A predominância de artigos encontrados foi de estudos randomizados, ensaios estes que se constituem numa poderosa ferramenta para a avaliação de intervenções para a saúde. Apenas dois dos cinco estudos apresentaram resultados positivos utilizando Lactobacillus acidophilus La-5, Bifidobacterium BB-12, Lactobacillus casei Zhang, Lactobacillus plantarum P-8 e Bifidobacterium animalis subsp. lactis V9 (CHEN et al., 2019; SHADNOUSH et al., 2015).
Nos estudos avaliados, todos os probióticos utilizados foram do tipo múltiplas cepas, (Lactobacillus acidophilus cepa LA-5, Bifidobacterium animalis subsp. lactis estirpe BB-12, Bifidobacterium breve cepa Yakult, L. rhamnosus NCIMB 30174, L. plantarum NCIMB 30173, L. acidophilus NCIMB 30175 e Enterococcus faecium NCIMB 30176, L. casei Zhang, L. plantarum P-8 e B. animalis subsp. lactis V9). Na literatura verifica-se os inúmeros benefícios associados à utilização de probióticos para a microbota intestinal, tais como a inibição competitiva da adesão de patógenos e regulação do trato gastrointestinal estimulando a liberação de citocinas anti-inflamatórias, como interleucina 10 (IL-10) (ESAIASSEN et al., 2017; SAEZ-LARA et al., 2015), imunomodulação, capacidade de inibir bactérias patogênicas como Staphylococcus aureus, Escherichia coli 0157:H7, Salmonella typhimurium e rotavírus, além da promoção do equilíbrio da microbiota do TGI humano (BERNINI et al., 2016). Com exceção aos estudos de Chen et al., (2019) e Shadnoush et al., (2015) nos demais estudos avaliados nesta revisão, esses benefícios não foram encontrados (BJARNASON et al., 2019; CHEN et al., 2019; MATSUOKA et al., 2018; SHADNOUSH et al., 2015; WILDT et al., 2011).
Shadnoush et al. (2015) em suas análises demonstram que o número de Lactobacillus, Bifidobacterium, e Bacteroides em pacientes com DII pode não mudar em comparação com indivíduos saudáveis, embora em relação aos efeitos benéficos bem conhecidos de tais microrganismos, o aumento observado em seus números, após o consumo de iogurte probiótico, possa ajudar a melhorar a função intestinal nos pacientes, expandindo significativamente a concentração do número de bactérias úteis, como Lactobacillus e Bifidobacterium no intestino e no cólon, e a diminuição da concentração de fezes de Bacteroides. Tais mudanças dentro do grupo B (placebo) não foram estatisticamente significantes (P>0,05). Vale salientar que este foi o único estudo utilizando um alimento na modulação intestinal para veiculação do probiótico, todos os demais estudos foram empregados suplementação medicamentosa do probiótico (SHADNOUSH et al., 2015).
No estudo de Chen et al., (2019) demonstraram que a aplicação de probióticos em conjunto com mesalazina, indicada como anti-inflamatório de ação local no tratamento de DII na fase aguda e na prevenção ou redução das recidivas, aumentou significativamente a eficácia clínica em comparação com o uso do regime regular sozinho (CHEN et al., 2019). A associação com mesalazina, pode ter permitido a efetivação da ação antibiótica e imunossupressora, mostrando ser superior ao placebo, porém o uso do anti-inflamatório pode ter mascarado o efeito do probiótico, uma vez que esses benefícios não foram encontrados nos outros trabalhos. (WILDT et al., 2011, MATSUOKA et al., 2018 e BJARNASON et al., 2019).
A eficácia do uso de probióticos na manutenção da remissão clínica em pacientes com RCU são muito divergentes mesmo em uso de cepas semelhantes, contrapondo o estudo de Shadnoush et al., (2015) que utilizou L. acidophilus La-5, comparado ao que pode ser mostrado no estudo clínico publicado por Wildt et al., (2011) que não observaram nenhuma diferença significativa na remissão clínica em pacientes recebendo Probio-TecAB-25 (uma mistura probiótica que continha L. acidophilus La-5 e B. animalis subsp. lactis BB-12) ou material placebo. Nenhum benefício clínico significativo do Probio-Tec AB-25 pode ser demonstrado em comparação com o placebo. É provável que o pequeno número de pacientes envolvidos tenha interferido na detecção de uma possível diferença estatística, limitando-o devido ao tamanho do grupo placebo e uma taxa de recaída maior do que o esperado (WILDT et al., 2011).
Estas cepas probióticas têm mostrado efeitos desejáveis em estudos anteriores, a exemplo da cepa L. plantarum P-8 que reduziu a inflamação em adultos de diferentes idades, em desfecho de outra doença intestinal que não a RCU (WANG et al., 2014).
Os artigos que tiveram um efeito positivo na utilização do probiótico para manutenção da remissão apresentaram um intervalo de uso de 8-12 semanas (SHADNOUSH et al., 2015 e CHEN et al., 2019). Esse tempo parece ser viável para o tratamento, visto que a mucosa intestinal se renova a cada três dias, considerando uma aplicabilidade aceitável (ALTOMARE, 2015).
De acordo com Hart et al. (2012) o cólon contém um complexo e eficaz ecossistema microbiótico abrigando grande concentração de bactérias, chegando a atingir mais de 10¹¹ a 10¹² UFC por mililitro, o que foi levado em consideração pelos autores Shadnoush et al. (2015), Chen et al. (2019) e Wildt et al. (2011) nos seus trabalhos, visto que realizaram suas análises dentro da dose necessária para a microbiota. Comparando o tamanho amostral utilizados por ambos, houve uma diferença significativa, porém isso não interferiu nos resultados explanados pelos autores em questão (CHEN et al., 2019; HART et al., 2012; SHADNOUSH et al., 2015; WILDT et al., 2011).
CONSIDERAÇÕES FINAIS
Com base na literatura pesquisada, não existem evidências científicas suficientes para a utilização dos probióticos como terapia de manutenção da remissão em pacientes com retocolite ulcerativa, bem como os tipos de cepas, o tempo que deve utilizado, a dose resposta e os benefícios conferidos pelo seu uso. Isso pode ser justificado pela quantidade limitada de dados existentes, heterogeneidade de estudos e metodologias encontradas na literatura. Sendo assim são necessários mais estudos longitudinais para validar a utilização dos probióticos para manutenção da remissão na RCU.
REFERÊNCIAS
ALTOMARE, Roberta et al. Enteral nutrition support to treat malnutrition in inflammatory bowel disease. Nutrients, v. 7, n. 4, p. 2125-2133, 2015. Disponível em: <https://doi.org/10.3390/nu7042125>. Acesso em 02/04/2020.
ASTÓ, Erola et al. The efficacy of probiotics, prebiotic inulin-type fructans, and synbiotics in human ulcerative colitis: a systematic review and meta-analysis. Nutrients, v. 11, n. 2, p. 293, 2019. Disponível em: <https://doi.org/10.3390/nu11020293>. Acesso em 09/05/2020.
BAMBA, Shigeki et al. Sarcopenia is a predictive factor for intestinal resection in admitted patients with Crohn’s disease. PLoS One, v. 12, n. 6, p. e0180036, 2017. Disponível em: <https://doi.org/10.1371/journal.pone.0180036>. Acesso em 19/10/2020.
BERNINI, Luciana Jesus et al. Beneficial effects of Bifidobacterium lactis on lipid profile and cytokines in patients with metabolic syndrome: A randomized trial. Effects of probiotics on metabolic syndrome. Nutrition, v. 32, n. 6, p. 716-719, 2016. Disponível em: <https://doi.org/10.1016/j.nut.2015.11.001>. Acesso em 27/01/2021.
BJARNASON, Ingvar; SISSION, Guy; HAYEE, Bu’Hussaine. A randomised, double-blind, placebo-controlled trial of a multi-strain probiotic in patients with asymptomatic ulcerative colitis and Crohn’s disease. Inflammopharmacology, v. 27, n. 3, p. 465-473, 2019. Disponível em: <https://link.springer.com/article/10.1007/s10787-019-00595-4>. Acesso em 29/11/2020.
CHEN, Ping et al. Modulation of gut mucosal microbiota as a mechanism of probiotics‐based adjunctive therapy for ulcerative colitis. Microbial biotechnology, v. 13, n. 6, p. 2032-2043, 2020. Disponível em:< https://doi.org/10.1111/1751-7915.13661>. Acesso em 08/12/2020.
DERIKX, Lauranne AAP; DIELEMAN, Levinus Albert.; HOENTJEN, Frank. Probiotics and prebiotics in ulcerative colitis. Best Practice & Research Clinical Gastroenterology, v. 30, n. 1, p. 55-71, 2016. Disponível em: <https://doi.org/10.1016/j.bpg.2016.02.005 >. Acesso em 13/05/2020.
DURCHSCHEIN, Franziska; PETRITSCH, Wolfgang; HAMMER, Heinz F. Diet therapy for inflammatory bowel diseases: The established and the new. World Journal of Gastroenterology, v. 22, n. 7, p. 2179, 2016. Disponível em: <https://doi.org/10.3748/wjg.v22.i7.2179>. Acesso em 24/05/2020.
ESAIASSEN, Eirin et al. Bifidobacterium bacteremia: clinical characteristics and a genomic approach to assess pathogenicity. Journal of clinical microbiology, v. 55, n. 7, p. 2234-2248, 2017. Disponível em: < https://doi.org/10.1128/JCM.00150-17>. Acesso em 08/01/2021.
EVERHOV, Åsa. Hallqvist.; OLÉN, Ola.; LUDVIGSSON, Jonas Filip . importance of definition of inflammatory bowel disease and an increased incidence in children. Alimentary Pharmacology & Therapeutics, v. 45, n. 10, p. 1369-1370, 2017. Disponível em: < https://doi.org/10.1111/apt.14035 >. Acesso em 17/05/2020.
FLINT, Harry James. et al. The role of the gut microbiota in nutrition and health. Nature reviews Gastroenterology & hepatology, v. 9, n. 10, p. 577-589, 2012. Disponível em:< https://www.nature.com/articles/nrgastro.2012.156 >. Acesso em 07/05/2020.
GAJOWNIK, Urszula Ewa. Evaluación de al calprotectina fecal en la detección de la actividad de la enfermedad inflamatoria intestinal del colon. Proyecto de investigación:, 2018. Disponível em: < http://hdl.handle.net/10201/56358 >. Acesso em 16/11/2020.
KAPLAN, Gilaad G. The global burden of IBD: from 2015 to 2025. Nature reviews Gastroenterology & hepatology, v. 12, n. 12, p. 720-727, 2015. Disponível em: < https://www.nature.com/articles/nrgastro.2015.150 >. Acesso em 12/11/2020.
KASHIMA, Shin et al. Polyphosphate, an active molecule derived from probiotic Lactobacillus brevis, improves the fibrosis in murine colitis. Translational Research, v. 166, n. 2, p. 163-175, 2015. Disponível em: < https://doi.org/10.1016/j.trsl.2015.02.002 >. Acesso em 17/12/2020.
LEVIT, Romina et al. Evaluation of the effect of soymilk fermented by a riboflavin-producing Lactobacillus plantarum strain in a murine model of colitis. Beneficial Microbes, v. 8, n. 1, p. 65-72, 2017. Disponível em: < https://doi.org/10.3920/BM2016.0063 >. Acesso em 26/11/2020.
LEWIS, James D. The utility of biomarkers in the diagnosis and therapy of inflammatory bowel disease. Gastroenterology, v. 140, n. 6, p. 1817-1826. e2, 2011. Disponível em: < https://doi.org/10.1053/j.gastro.2010.11.058 >. Acesso em 17/11/2020.
MAGRO, Fernando et al. Third European evidence-based consensus on diagnosis and management of ulcerative colitis. Part 1: definitions, diagnosis, extra-intestinal manifestations, pregnancy, cancer surveillance, surgery, and ileo-anal pouch disorders. Journal of Crohn’s and Colitis, v. 11, n. 6, p. 649-670, 2017. Disponível em: <https://doi:10.1093/ecco-jcc/jjx008>. Acesso em: 03/12/2020.
MATSUOKA, Katsuyoshi et al. Efficacy of Bifidobacterium breve fermented milk in maintaining remission of ulcerative colitis. Digestive diseases and sciences, v. 63, n. 7, p. 1910-1919, 2018. Disponível em: < https://doi.org/10.1007/s10620-018-4946-2 >. Acesso em 18/10/2020.
NG, Siew Chien. et al. Worldwide incidence and prevalence of inflammatory bowel disease in the 21st century: a systematic review of population-based studies. The Lancet, v. 390, n. 10114, p. 2769-2778, 2018. Disponível em: < https://doi.org/10.1016/S0140-6736(17)32448-0>. Acesso em 21/05/2020.
SAEZ-LARA, Maria Jose et al. The role of probiotic lactic acid bacteria and bifidobacteria in the prevention and treatment of inflammatory bowel disease and other related diseases: a systematic review of randomized human clinical trials. BioMed research international, v. 2015, p. 505878, 2015. Disponível em: <https://doi.org/10.1155/2015/505878 >. Acesso em 25/11/2020.
SHADNOUSH, Mahdi et al. Effects of probiotics on gut microbiota in patients with inflammatory bowel disease: a double-blind, placebo-controlled clinical trial. Korean J Gastroenterol, v. 65, n. 4, p. 215-21, 2015. Disponível em: <http://dx.doi.org/10.4166/kjg.2015.65.4.215 >. Acesso em 10/11/2020.
SPOOREN, Corinne EGM et al. Risk of impaired nutritional status and flare occurrence in IBD outpatients. Digestive and Liver Disease, v. 51, n. 9, p. 1265-1269, 2019. Disponível em: < https://doi.org/10.1016/j.dld.2019.05.024 >. Acesso em 04/09/2020.
SRINIVASAN, Shanthi; SHAHNAVAZ, Nikrad. Sleisenger and Fordtran’s Gastrointestinal and Liver Disease Review and Assessment E-Book. Elsevier Health Sciences, 2017. Acesso em 15/05/2020.
ŠTOFILOVÁ, Jana et al. Cytokine production in vitro and in rat model of colitis in response to Lactobacillus plantarum LS/07. Biomedicine & Pharmacotherapy, v. 94, p. 1176-1185, 2017. Disponível em: < https://doi.org/10.1016/j.biopha.2017.07.138 >. Acesso em 15/08/2020.
WANG, Lifeng et al. Effect of oral consumption of probiotic Lactobacillus planatarum P-8 on fecal microbiota, SIgA, SCFAs, and TBAs of adults of different ages. Nutrition, v. 30, n. 7-8, p. 776-783. e1, 2014. Disponível em: < https://doi.org/10.1016/j.nut.2013.11.018 >. Acesso em 05/07/2020.
WĘDRYCHOWICZ, Andrzej; ZAJĄC, Andrzej; TOMASIK, Przemysław. Advances in nutritional therapy in inflammatory bowel diseases. World journal of gastroenterology, v. 22, n. 3, p. 1045, 2016. Disponível em: < https://doi:10.3748/wjg.v22.i3.1045 >. Acesso em 02/08/2020.
WEISS, Gisela. Adrienne; HENNET, Thierry. Mechanisms and consequences of intestinal dysbiosis. Cellular and Molecular Life Sciences, v. 74, n. 16, p. 2959-2977, 2017. Disponível em: < https://doi:10.1007/s00018-017-2509-x >. Acesso em 28/05/2020.
WILDT, Signe et al. A randomised double-blind placebo-controlled trial with Lactobacillus acidophilus La-5 and Bifidobacterium animalis subsp. lactis BB-12 for maintenance of remission in ulcerative colitis. Journal of Crohn’s and Colitis, v. 5, n. 2, p. 115-121, 2011. Disponível em: <https://doi.org/10.1016/j.crohns.2010.11.004 >. Acesso em 27/06/2020.
WILKINS, Thad; SEQUOIA, Jacqueline. Probiotics for gastrointestinal conditions: A summary of the evidence. American family physician, v. 96, n. 3, p. 170-178, 2017. Disponível em: < https://www.aafp.org/dam/brand/aafp/pubs/afp/issues/2017/0801/p170.pdf >. Acesso em 29/05/2020.
[1] Graduada em Nutrição. ORCID: 0000-0002-6636-8903.
[2] Orientadora. Mestra em Medicina e Saúde pela Escola Bahiana de Medicina e Saúde Pública. Docente na Universidade do Estado da Bahia. Doutoranda em Processos Interativos de Órgãos e Sistemas pela Universidade Federal da Bahia (UFBA). ORCID: 0000-0001-7613-4775.
Enviado: Julho, 2022.
Aprovado: Novembro, 2022.


2 respostas
Excelente as informações.
Agradeço o comentário e a leitura do material Laudelino.