ARTIGO DE REVISÃO
SILVA, Isabele Coelho Canha [1], FERNANDES, Archangelo Padreca [2]
SILVA, Isabele Coelho Canha. FERNANDES, Archangelo Padreca. Terapia do receptor de antígeno quimérico de células t: funcionamento, progressos e perspectivas. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano 06, Ed. 08, Vol. 01, pp. 59-87. Julho de 2021. ISSN: 2448-0959, Link de acesso: https://www.nucleodoconhecimento.com.br/saude/progressos-e-perspectivas
RESUMO
Introdução: segunda principal condição causal de óbitos no mundo e caracterizado como um conjunto de doenças que possuem como fator comum o crescimento descontrolado de células anormais, o câncer possui ainda um conjunto limitado de tratamentos disponíveis aos indivíduos acometidos. Assim, partindo do conhecimento de que a condição é inicialmente combatida por uma série de mecanismos imunológicos intrínsecos ao paciente, mas que, contudo, os mesmos tem sua ação impedida por características evasivas tumorais, a recente criação de uma modalidade terapêutica baseada na utilização de linfócitos T geneticamente modificados para potencialização da atividade antitumoral se destaca como uma das vertentes imunoterápicas mais promissoras do meio, esse que busca por vias naturais, e menos lesivas que as técnicas tradicionais, a remissão da condição. Nesse contexto, a seguinte questão torna-se relevante: tal terapia pode ser de fato uma opção viável ao futuro do tratamento oncológico? Objetivo: delinear as particularidades e progressos atuais da “Terapia do Receptor de Antígeno Quimérico de Células T”, de forma a elucidar sua aplicabilidade, limitações e perspectivas futuras no tratamento oncológico. Métodos: estudo descritivo fundamentado em revisão bibliográfica de abordagem qualitativa desenvolvida por meio de artigos, livros e estudos clínicos publicados em periódicos científicos nacionais e internacionais, em base de dados dos últimos 21 anos. Discussão: receptores CAR são moléculas sintéticas, que possuem arquitetura e engenharia de desenvolvimento voltadas à superação da evasão imune tumoral, via reconhecimento de antígenos específicos e sucessiva eliminação da célula afetada por mecanismos celulares e bioquímicos. Considerações finais: de significativa especificidade, sensibilidade e eficácia, a terapia com células CAR-T possui alto potencial terapêutico ao tratamento de malignidades hematológicas e desdobra fortes esperanças para o futuro da imuno-oncologia. Todavia, a fim de promover maior segurança clínica no manejo de suas toxicidades, barateamento e sua ampliação de uso, novos estudos são necessários.
Palavras-Chave: Antígeno quimérico de células T, Câncer, Células T CAR, Imunoterapia, Receptor de antígeno quimérico.
1. INTRODUÇÃO
Segundo o Ministério da Saúde (MS), por meio do Instituto Nacional de Câncer (INCA), mundialmente cerca de 7,6 milhões de indivíduos perdem a vida devido ao câncer a cada ano que se completa (SILVA, 2020). À vista de tais números a condição é demonstrada como a segunda principal causa existente de óbitos na atualidade, ficando atrás somente daqueles ocasionados por doenças cardiovasculares (INCA, 2020). Agravando a situação, o conjunto de mais de 100 patologias ainda é projetado, segundo a Organização Mundial da Saúde (OMS), a sofrer um aumento de cerca de 81% em seus registros até o ano de 2040 (WHO, 2021).
A enfermidade, que se caracteriza como um crescimento exacerbado e descontrolado de células, agressivo ao indivíduo e com potencial de invadir outros tecidos de seu corpo, apresenta, convencionalmente, um conjunto muito limitado de tratamentos (INCA, 2020). Ao longo do que já são décadas, terapias para a condição se dão, principalmente, em torno de técnicas radioterápicas, quimioterápicas e cirúrgicas (HAN et al., 2021). Contudo, apesar de já terem sido responsáveis à defensão de milhares de vidas, essas possuem uma extensa quantidade de efeitos colaterais, diminuindo a qualidade de vida do paciente em tratamento, em virtude do aumento da susceptibilidade ao desenvolvimento de lesões em seu sistema respiratório, cardíaco, nervoso e endócrino (BATISTA; MATTOS; SILVA, 2015).
Para além disso, técnicas clássicas não garantem uma vigilância prolongada contra o retorno da condição inicial podendo, inclusive, serem a causa do aumento das chances de tal reincidência, condição que se tornou comum entre pacientes uma vez já acometidos (TRAVIS et al., 2019). Logo, uma grande responsabilidade se intensifica a cada dia à comunidade científica: a de desenvolver técnicas ao tratamento oncológico que sejam cada vez mais eficazes e menos prejudiciais, de forma a aproximarem-se da solução para este problema mundial em saúde.
Assim, partindo do conhecimento de que o sistema imune naturalmente é capaz de combater células cancerosas (em função da atividade mediada principalmente por meio de linfócitos T), mas tem seu desempenho afetado por mecanismos evasivos apresentados pelo próprio tumor, surge a chamada “imunoterapia” (MILIOTOU; PAPADOPOULOU, 2018; YANG, 2015). A técnica é revolucionária por ter como alvo direto não o tumor em si, mas a potencialização do sistema imunológico humano, a fim de promover o reconhecimento e eliminação tumoral, para remissão durável e com baixa toxicidade associada (HELMY et al., 2013).
Dentre suas numerosas vertentes, e com resultados que podem apresentar, além de um retrocesso completo do tumor, uma também prolongada vigilância contra o retorno da condição, está a “Terapia do Receptor de Antígeno Quimérico de Células T”, ou “CAR-T Cell Therapy” (CRUZ; MATEUS; BORGES, 2019). O princípio conceitual de tal terapia se deu em meados dos anos 80, como resultado de estudos de Zelig Eshhar e companheiros, que manejaram a associação de receptores de células T (TcR) à porção variável de um anticorpo, para o redirecionamento a atividade antitumoral leucocitária (GROSS; WAKS; ESHHAR, 1989). Assim, diferentemente das terapias convencionais, a técnica é específica ao organismo de cada paciente, sendo caracteristicamente um medicamento de caráter vivo e capaz de autoperpetuar-se, criando cópias de si mesmo (REJDAK et al., 2017).
O tratamento fundamenta-se na modificação genética de linfócitos T, com o propósito de promover o reconhecimento de antígenos tumorais e a potencialização da resposta ao alvo via sinais co-estimulatórios intracelulares (CRUZ-RAMOS; GARCÍA-FONCILLAS, 2019). Sua engenharia inicia-se com a transferência por intermédio de métodos virais ou não virais de um gene capaz de codificar o “Receptor de Antígeno Quimérico” (CAR) na superfície das células recolhidas do paciente (SERMER; BRENTJENS, 2019). O sucesso na expressão do mesmo, garante ao linfócito desempenho mais intenso e específico, de forma a sobrepujar mecanismos de evasão tumoral (WALSH; YANG; KOHLER, 2019). Após esse processo, as células modificadas são selecionadas, multiplicadas e, então, reinfundidas ao indivíduo para ação in vivo (CRUZ-RAMOS; GARCÍA-FONCILLAS, 2019).
A particularidade dos receptores CAR estabelece-se no fato de constituírem moléculas sintéticas que possuem como função reconhecer antígenos tumorais específicos, conduzindo a resposta citotóxica de linfócitos T, para a destruição específica de células cancerosas, sem dependência associada ao Complexo de Histocompatibilidade (MHC) (CARTELLIERI et al., 2010; CHOE; WILLIAMS; LIM, 2020). Morfologicamente, o receptor é constituído por um domínio extracelular para o reconhecimento da molécula alvo, formado por um fragmento variável de cadeia simples (scFv) de um anticorpo tumor específico (anti-TAA), uma região espaçadora, uma região transmembranar e um domínio intracelular de sinalização (CRUZ-RAMOS; GARCÍA-FONCILLAS, 2019).
Até o presente momento, foram desenvolvidas quatro gerações de receptores, que se diferenciam por meio de alterações na porção intracelular sinalizadora, para progressivamente intensificar a transdução de sinal, capacidade clonal e a persistência da célula modificada (CARTELLIERI et al., 2010; HAN et al., 2021). O sucesso desta tecnologia vem sendo demonstrado por ensaios clínicos que possibilitaram a aprovação de três terapias CAR-T baseadas pela Food and Drug Administration (FDA), órgão regulador norte-americano, sendo elas: tisagenlecleucel (Kymriah®), axicabtagene ciloleucel (Yescarta®) e brexucabtagene autoleucel (Tecartus®) (BRUDNO; KOCHENDERFER, 2019; HAN et al., 2021).
Os efeitos adversos da técnica CAR-T contemplam sintomas que variam em sua intensidade de acordo com o organismo e a saúde do paciente, o tipo de terapia recebida, bem como a dose da mesma (YÁÑEZ; SÁNCHEZ-ESCAMILLA; PERALES, 2019). Dentre os efeitos, citam-se como principais: síndrome de liberação de citocinas (CRS), neurotoxicidade e aplasia de células B, além de alguns efeitos similares à gripe (CRUZ; MATEUS; BORGES, 2019).
Em síntese, a “Terapia do Receptor de Antígeno Quimérico de Células T” é hoje uma das mais prósperas dentro do meio científico, em vista de seu extenso potencial ao tratamento oncológico e quantidade limitada de efeitos colaterais às células saudáveis do paciente. Logo, considerando a relevância e problemática da patologia, em associação às desvantagens apresentadas pelas técnicas atuais, pergunta-se: a recente tecnologia é competente e viável ao estabelecimento como futura opção terapêutica para os pacientes acometidos pelo câncer? Dessa forma, o presente estudo objetiva evidenciar, analisar e descrever o funcionamento da terapia CAR-T, partindo de seus fundamentos teóricos celulares e moleculares, a fim de elucidar, em dimensão intelectual, suas particularidades e explanar seus progressos no mundo atual, consequentemente avaliando as perspectivas geradas para o futuro do tratamento oncológico.
2. JUSTIFICATIVA
Consolidado como um conjunto de patologias de grande e inegável impacto à sociedade humana, sendo o responsável por elevadas e crescentes taxas de óbito todos os anos, o câncer é um significativo obstáculo a ser ultrapassado pela comunidade científica, tanto no que se refere à sua ocorrência quanto no cerne do tratamento mais adequado para tal. Nesse contexto, e uma vez levada em consideração a agressividade das técnicas tradicionais, o recente surgimento da intitulada “Terapia do Receptor de Antígeno Quimérico de Células T” é revolucionário por constituir um recurso terapêutico mais eficaz e menos nocivo às células sadias do paciente, sendo específico ao mesmo e capaz de oferecer uma vigilância homogênea contra o retorno da condição inicial. O tratamento é, na atualidade internacional, um dos maiores e mais promissores objetos de estudo dentro da imuno-oncologia.
Nesse contexto, o presente artigo justifica-se por via da busca da evidenciação e da elucidação das particularidades e limitações da técnica, especialmente no que tange ao cenário Nacional, em que há uma expressiva escassez de materiais sobre o assunto, ainda que o País seja detentor de uma grande incidência da doença e possua capacidade científica e estrutural para a plena aplicação e contribuição ao desenvolvimento do método a ser discutido. Dessa forma, por meio dos dados e discussões aqui propostas, é esperado levantar o debate acerca da terapia no meio acadêmico, de maneira a contribuir para que sua adoção de forma segura, barata, eficaz e para toda a população possa ser estimulada e em um futuro próximo, atingida.
3. MÉTODOS
Trata-se de um estudo descritivo baseado em pesquisa bibliográfica, desenvolvido por meio de abordagem qualitativa mediante dados coletados utilizando como fontes secundárias artigos, livros e estudos clínicos, publicados nas seguintes bases de dados: Biblioteca Virtual em Saúde (BVS), Clinical Trials, Google Acadêmico, Pubmed e Scielo (Scientific Library Online).
Os descritos utilizados como norteadores do desenvolvimento do assunto foram: CAR; células CAR-T; imunoterapia; neoplasia; receptor de antígeno quimérico; terapia celular adotiva.
O levantamento bibliográfico se deu entre os meses de novembro de 2020 à abril de 2021. Como critérios de inclusão, foram selecionados artigos disponíveis na íntegra, em linguagem inglesa e portuguesa, publicados em base de dados nos últimos 21 anos (2000-2021) e que abordem o tema sob o ponto de vista teórico e contextual. Referente aos critérios de exclusão, estes contemplam: àqueles publicados em período anterior ao ano 2000 e que não sejam de relativa importância para o desenvolvimento do tema, bem como àqueles que não tratem exclusivamente do assunto. A partir dos critérios definidos foram selecionados, e lidos em sua integralidade, 60 artigos.
Por se tratar de uma revisão da literatura não se tornou necessária a aprovação do Comitê de Ética em Pesquisa (CEP). Declara-se também não haver conflito de interesse entre os autores do material.
4. DESENVOLVIMENTO
4.1 O CÂNCER
Atualmente classificado como uma das quatro principais condições causais de óbito antes dos 70 anos de idade, e a segunda principal no mundo, o câncer caracteriza-se como um conjunto de mais de 100 patologias que possuem como fator comum o crescimento exacerbado e não especializado de clones de células mutadas (INCA, 2020). Essas possuem resistência a apoptose e, uma vez que sua multiplicação seja do tipo não controlada, podem evoluir à invasão de diferentes tecidos, incluindo aqueles distantes de seu local de surgimento, processo denominado como metástase (SUHAIL et al., 2019).
Entende-se que a causalidade da condição se dá por uma sequencial e complementar atividade de fatores externos, tais como fumo, agentes químicos e radiação; e internos, como hormônios, condições imunológicas e susceptibilidade genética (ACS, 2021). A exposição a esses fatores de forma prolongada e repetida dá origem ao processo oncogênico, ou seja, a sucessão de eventos causada pelas mutações genéticas em proto-oncogenes (inativos em células saudáveis), transformando-os à sua forma responsável pela malignização celular.
O processo pode ainda ser dividido em três estágios distintos de iniciação, momento no qual os genes são afetados pelos fatores cancerígenos; de promoção, em que oncopromotores afetam a célula em questão; e de progressão, estágio em que é instalada a proliferação celular descontrolada e agressiva (INCA, 2020).
Apesar de possuírem fatores em comum, os tipos de câncer diferem-se pela sua forma de crescimento, local de acometimento e disseminação. De tal forma, eles também respondem de maneira distinta aos diversos tipos de tratamento, dentre os quais se destacam os procedimentos cirúrgicos, quimioterapia, radioterapia e a imunoterapia (DEVITA; LAWRENCE; ROSENBERG, 2005).
4.2 O SISTEMA IMUNOLÓGICO E O CÂNCER
Ainda que originado por células próprias, desencadeando assim baixa imunogenicidade, o crescimento celular maligno pode ser reconhecido e combatido pelo próprio sistema imunológico do paciente (MILIOTOU; PAPADOPOULOU, 2018). Fato este que se dá pela presença de antígenos tumorais, moléculas reconhecidas pelo sistema como não próprias, propícias a desencadear uma reação imune. Atualmente entende-se que os principais leucócitos responsáveis por tal mecanismo são as células natural killer (NK), os macrófagos e linfócitos T (ABBAS; H.LICHMAN; PILLAI, 2012).
Uma vez que tumores apresentam uma expressão abaixo do normal de moléculas MHC, estes se tornam alvo da ação de células NK, pois a presença desta molécula é inibidora à sua ação. Por sua vez, os macrófagos atuam a partir de uma série de mecanismos, destacando-se entre eles a produção da citocina Fator de Necrose Tumoral (TNF), capaz de destruir tumores (ABBAS; H.LICHMAN; PILLAI, 2012). Assim, dentro do que se classifica como uma resposta imunológica inata, tais leucócitos conseguem induzir a destruição de células malignas.
Principal agente da imunidade antitumoral, e apresentando atuação na resposta imunológica adaptativa, linfócitos possuem a característica única de apresentar receptores de antígenos distribuídos de forma clonal em sua superfície, possibilitando que, uma vez diferenciados, sejam capazes de reconhecer e induzir a destruição de células cancerosas (OLIVEIRA; KANASHIRO, 2005).
O processo se dá a partir de linfócitos T citotóxicos de linhagem CD8+ que se diferenciam em células efetoras T CD8+ (CTL CD8+) após a captura, processamento e apresentação de antígenos tumorais por Células Apresentadoras de Antígenos (APC) via MHC-II e atividade de coestimuladores. Por sua vez, células CTL CD8+ produzem citocinas, como granzimas e perforinas, de papel essencial na defesa contra microrganismos e na erradicação de tumores (ABBAS; H.LICHMAN; PILLAI, 2012).
4.3 EVASÃO DA RESPOSTA IMUNE
A fim de consolidar seu crescimento e instalação no organismo, células malignas são capazes de evadir ao sistema imune por uma série de mecanismos distintos que objetivam desabilitar componentes desenvolvidos especificamente para sua erradicação.
Além de seu crescimento exacerbado ter a capacidade de sobrepujar a resposta imune do paciente, necessária a sua eliminação, outros mecanismos tumorais também podem ser citados em tal papel. Como, por exemplo, a propriedade de células cancerosas de secretar produtos imunossupressores, como Interleucina-10 (IL-10), Fas-ligante (FasL) e o Fator Transformador do Crescimento-Beta (TGF-β), esse que atua ativamente no bloqueio à multiplicação e atuação de linfócitos e macrófagos (DEVITA; LAWRENCE; ROSENBERG, 2005). Ademais, alguns tumores passam a expressar em sua superfície moléculas ligantes de morte programada 1 e 2 (PD-L1 e PD-L2) que se ligam à receptores PD-1 e PD-2 presentes em linfócitos T ativados e células B, limitando sua ação em tecidos periféricos (CHAMOTO; HATAE; HONJO, 2020).
Em concomitância, a diminuição ou defeitos na expressão de antígenos tumorais, a quantidade elevada de células T reguladoras imunossupressoras (Treg) em indivíduos acometidos e a produção de fatores pró-inflamatórios, que recrutam células supressoras derivadas de mielóides (MDSC), também restringem a resposta antitumoral naturalmente desenvolvida pelo indivíduo (ABBAS; H.LICHMAN; PILLAI, 2012).
4.4 A IMUNOTERAPIA
Ao promover a potencialização do sistema imunológico do paciente, de forma a transpassar a capacidade evasiva tumoral e permitir o reconhecimento e eliminação de células cancerosas sem a consequente extenuação homeostática, a imunoterapia é hoje uma robusta realidade clínica, mais vantajosa do que as terapêuticas tradicionais (YANG, 2015).
Seu surgimento data por volta dos anos 1800, em Nova York, após o médico cirurgião William Coley constatar que pacientes portadores de câncer simultaneamente acometidos por infecções bacterianas tendiam a apresentar expressiva regressão tumoral (YANG, 2015). Séculos depois do ocorrido, em 2018, os imunologistas James P. Alisson e Tasuku Honjo foram nomeados com o Nobel de Medicina, por uma série de avanços e contribuições na área.
O tratamento imunoterápico pode ser dividido em duas grandes metodologias, de acordo com sua capacidade de reativar leucócitos à atividade antitumoral: (a) ativa, em que se atua diretamente no sistema imunológico como, por exemplo, por meio de vacinas ou a modulação de células T; (b) passiva, em que por mecanismo imuno baseado, como a utilização de anticorpos monoclonais, ataca-se diretamente o tumor existente (GALLUZZI et al, 2014).
4.5 CAR T CELL THERAPY
Vertente imunoterápica passiva, a terapia com células CAR-T revela-se significativamente vantajosa por superar a evasão imune acarretada pela célula cancerosa, a tornando novamente passível de reconhecimento por mecanismos imunológicos do paciente (KLOSS et al., 2013). Não somente, linfócitos T modificados possuem capacidade de diferenciação em células de memória, garantindo uma atividade antitumoral duradoura, potencialmente por toda a vida do paciente (WALSH; YANG; KOHLER, 2019).
Sua metodologia consiste em uma variante da terapia celular adotiva (ACT), baseada na transferência de células geneticamente modificadas em laboratório para o indivíduo portador do tumor. Para tal, inicialmente o sangue periférico do paciente é coletado via leucaférese, procedimento em que o material biológico será separado especificamente para retenção de linfócitos com posterior reinfusão dos componentes remanescentes ao indivíduo (MILIOTOU; PAPADOPOULOU, 2018). A escolha de tais leucócitos a serem separados se dá em virtude de constituírem parte essencial da resposta imunológica adaptativa tumoral (CARTELLIERI et al., 2010).
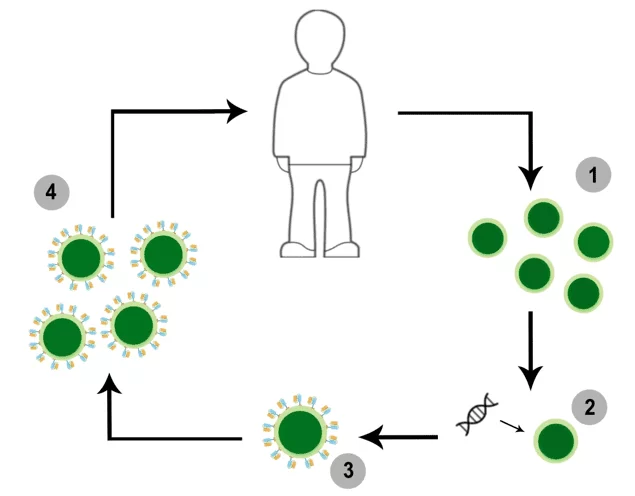
Os linfócitos são modificados in vitro, mais comumente por mecanismos virais que induzem a formação de receptores tumorais específicos em sua superfície. As células então são expandidas e administradas ao paciente (Figura 1) (MILIOTOU; PAPADOPOULOU, 2018; YANG, 2015).
Figura 1: (1) O sangue total do paciente é recolhido e linfócitos T são separados via leucaférese. (2) Células T são geneticamente modificadas por técnicas virais ou não virais. (3) Leucócitos passam a expressar receptor CAR. (4) Células CAR-T são multiplicadas e reinfundidas ao paciente.
4.6 A ARQUITETURA DOS RECEPTORES CAR
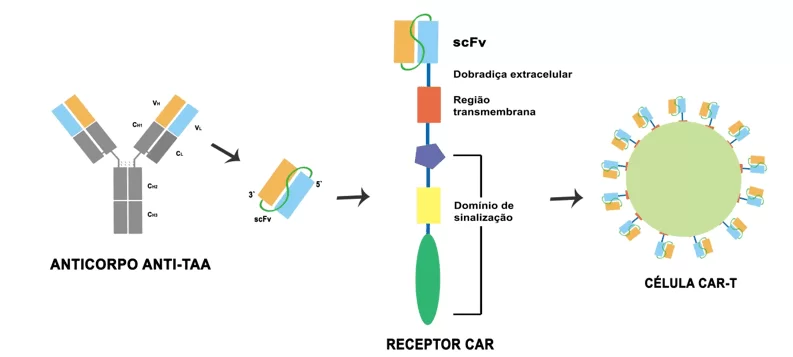
O chamado “Receptor de Antígeno Quimérico” (CAR) é uma molécula sintética, não existente de forma natural. Sua estrutura é primariamente formada por uma porção de ligação específica, uma dobradiça extracelular, uma região transmembranar e o domínio de sinalização interno, esse composto por moléculas coestimuladoras como CD28 e 4-1BB, além de um domínio de ativação de célula T, geralmente derivado da molécula CD3 zeta, essa responsável por transduzir o sinal gerado pela conexão ao antígeno para a objetivada ativação do linfócito T que o receptor integra (Figura 2) (CARTELLIERI et al., 2010). A molécula CD3z possui três domínios formados por sequências de aminoácidos, denominados “immunoreceptor tyrosine-based activation motifs” (ITAMs) que atuam realizando a intermediação do sinal à célula efetora em questão (OLIVEIRA; KANASHIRO, 2005).
A porção externa ligante consiste em um fragmento variado de cadeia simples (scFv) de um anticorpo monoclonal específico à antígenos tumor-associados (TAA) que liga-se à dobradiça flexível (HAN; KWON, 2018). Também chamada de região espaçadora (hinge region), a dobradiça flexível é composta pelas regiões constantes da porção pesada de um anticorpo IgG e conecta-se às demais partes do receptor, que apresentam variações de acordo com as diferentes gerações de células CAR-T, forma como passam a ser chamados os linfócitos modificados (GUEDAN; CALDERON; POSEY; MAUS, 2019).
Figura 2: Estrutura conformacional de um receptor CAR, composto por uma região ligante formada por um fragmento de anticorpo tumoral específico, uma dobradiça extracelular espaçadora, uma região transmembrana e o domínio de sinalização interno constituído de moléculas coestimulatórias e cadeia de sinalização intracelular derivada de CD3z conectada à sequência ITAM.
4.8 GERAÇÕES CAR
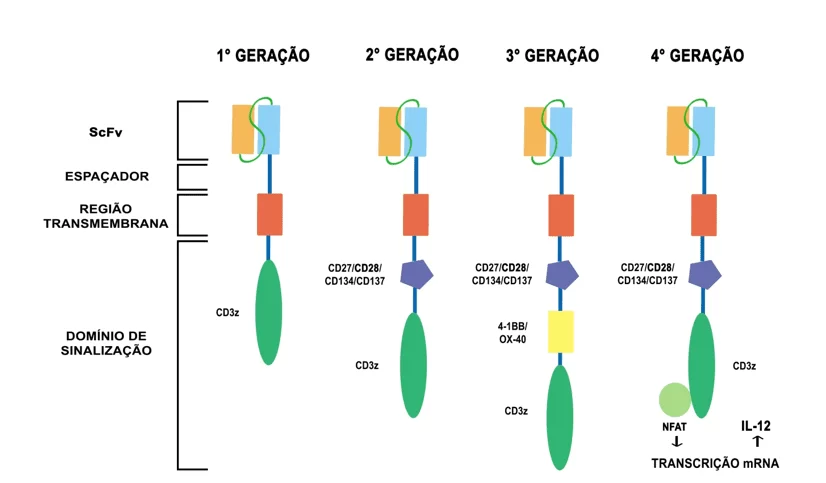
Resultados de estudos e ensaios clínicos, atualmente constata-se a existência de quatro gerações de receptores CAR, que se diferem a partir da evolução em sua capacidade sinalizadora para ativação leucocitária (Figura 3). Tal progresso foi possibilitado a partir do reconhecimento de que o aumento na transdução de sinal é capaz de elevar em níveis proporcionais à capacidade clonal, função efetora e a persistência celular (CARTELLIERI et al., 2010).
As diferenças entre os receptores podem ser sintetizadas por alterações em sua porção intracelular. A primeira geração CAR desencadeia a transdução de sinais ativadores apenas a partir da cadeia CD3z associada à ITAM, o que demonstrou em seus primeiros ensaios clínicos adequada atividade citotóxica, validando sua efetividade antitumoral (ATACA; ARSLAN, 2015). Em contraponto, a mesma também demonstrou necessidade de alterações morfológicas para elevação da eficácia terapêutica referente à sua qualidade de expansão e sobrevivência in vivo, uma vez que apresenta problemas no ultrapasse da fase G-G1 do ciclo mitótico de replicação (CHU; CAO; NEELALPU, 2018).
Assim, partindo do conhecimento de que células T precisam de dois sinais para ativação de sua atividade, um via MHC e outro via moléculas coestimulatórias, a segunda geração de receptores CAR evoluiu a receber um domínio endocelular composto por receptores de proteínas coestimuladoras, sendo a molécula CD28 a de maior incidência em tal utilização (mas podendo também ser utilizadas as moléculas CD27, CD137 (4-1BB), CD134 (OX-40) ou CD244). Assim, manejou-se atingir o aumento de sua resistência, secreção de citocinas, proliferação e persistência in vivo (PEREIRA; OLIVEIRA, 2019).
No que concerne à terceira geração de receptores, essa adiciona anteriormente à cadeia CD3z-ITAM mais um domínio coestimulador, composto principalmente pelas moléculas CD28/CD27/CD134/CD137 e 4-1BB/OX-40. De tal forma, essa geração incrementa a qualidade efetora da célula modificada, contudo, seu benefício clínico ainda é abaixo do esperado (CARTELLIERI et al., 2010).
Logo, passando a empregar também transgenes de citocinas, a arquitetura mais recente de receptores CAR surgiu, trazendo melhorias em eficácia e durabilidade. Também chamado de Célula de Matança para Citocina Universal, CAR T-cells redirected for universal cytokine killing, ou TRUCKs, receptores de quarta geração combinam àqueles de segunda geração com técnicas de inativação de receptores inibitórios e potencialização da eficácia com a liberação de citocinas, possuindo ambos domínio co-estimulatório e fator pró-inflamatório, como a interleucina-12 (IL-12) que aprimora a função de células T e diminui a atividade imunossupressora dos tumores (CHMIELEWSKI; KOPECKY; HOMBACH; ABKEN, 2011).
Figura 3: Gerações de receptores CAR, diferenciáveis por sua porção intracelular. A primeira geração possui apenas uma cadeia CD3z-ITAM. A segunda contendo um domínio de sinalização extra, geralmente composto por moléculas CD28, a mais eficaz, mas podendo também ser CD27/CD134/CD137. O receptor de terceira geração possui uma molécula de sinalização a mais, 4-1BB ou OX-40. Por fim, os receptores CAR de quarta geração são possuidores de um transgene independente (NFAT) enriquecedor da liberação de citocinas.
4.9 A ENGENHARIA DE CÉLULAS CAR-T
A modificação genética da célula efetora pode se dar por diferentes vias, tendo evoluído desde mecanismos físico-químicos simples, até a utilização atual de métodos virais e não virais (CRUZ-RAMOS; GARCÍA-FONCILLAS, 2019). Métodos retro ou lentivirais são os mais utilizados, esses pautam-se na utilização de vírus inermes da família Retroviridae para realizar a transferência de genes codificadores do receptor quimérico ao material genético do linfócito em questão, que passará a traduzir, transcrever e transferi-lo à sua membrana citoplasmática (KALOS et al., 2011).
Técnica não viral, os transposons se caracterizam como componentes genéticos formados por dois plasmídeos: um transportando responsável por transportar o gene CAR e outro transportando o gene que codificará a enzima denominada transposase (MILIOTOU; PAPADOPOULOU, 2018). Tal método integrará o transgene alvo da mesma forma que métodos virais, contudo é tido como uma alternativa menos tóxica mais barata, rápida e eficaz.
Uma vez que a modificação for realizada com sucesso, as células serão expandidas in vitro, e então selecionadas em controle de qualidade. Enquanto tal processo ocorre, o paciente passará por um tratamento condicionante para a linfodepleção, isto é, a eliminação dos demais leucócitos, auxiliando na efetividade da transferência das células CAR-T, que, uma vez infundidas, se multiplicarão internamente ao indivíduo receptor (MILIOTOU; PAPADOPOULOU, 2018).
4.10 MECANISMO CELULAR
Corretamente expresso na membrana dos linfócitos T recolhidos do paciente, o receptor CAR será responsável pela mediação da resposta antitumoral. O processo se inicia a partir da associação entre a porção ligante scFv do receptor sintético ao antígeno tumoral específico apresentado pela célula cancerígena, consequentemente promovendo a multiplicação celular, secreção de citocinas e citólise da célula afetada (CRUZ-RAMOS; GARCÍA-FONCILLAS, 2019).
A referida conexão desencadeará uma cascata de reações, que começam com a sinalização interna da célula CAR-T, possibilitando a resposta citotóxica, de intensidade correspondente à fatores como: (a) afinidade de ligação dos antígenos tumorais (TA) ao receptor em si; (b) densidade de TAAs e (c) a acessibilidade dos mesmos (CHMIELEWSKI et al., 2004; HOMBACH et al., 2007; L; SJ, 1999; TURATTI, 2007; WEIJTENS; HART; BOLHUIS, 2000).
Consoante à composição da região endocelular do receptor CAR, diferentes moléculas serão secretadas pelo leucócito modificado, dentre estas perforinas e granzimas, responsáveis por induzir a apoptose da célula alvo (HAN et al., 2021). Ademais, ocorrerá a também expressão das proteínas transmembranares pertencentes à família de fatores indutores de necrose tumoral, como TRAIL (TNF-Related Apoptosis Inducing Ligand) e Fas Ligante, além da secreção de diversas citocinas, como IL-2, Interferon-gama e Fator de Necrose Tumoral-Alfa, que ativarão outros leucócitos para intensificação da resposta induzida (CARTELLIERI et al., 2010).
Outrossim, devido à sua capacidade de diferenciação em linfócitos de memória, células CAR-T revelam em estudos clínicos atividade antitumoral duradoura, promovendo também uma vigilância uniforme contra possíveis recorrências (DURNING, 2018).
4.11 APLICABILIDADE
O uso de leucócitos geneticamente modificados na transferência de células adotivas (ACT) para tratamento do câncer demonstra resultados clínicos positivos em uma série de histologias tumorais, tais como: melanomas, sarcoma sinovial, carcinoma de células escamosas cervicais, colangiocarcinomas e em uma variedade de cânceres hematológicos como linfomas e leucemias, esta última destacando-se como sua principal e mais eficaz utilização, especialmente para malignidades de células B CD-19 positivas (CRUZ-RAMOS; GARCÍA-FONCILLAS, 2019).
4.11.1 TUMORES SÓLIDOS
Para os denominados “cânceres sólidos”, em que há a existência propriamente dita de um tumor maligno, fatores como: (a) a presença de uma variedade de antígenos não específicos de superfície; (b) barreiras físicas e (c) o microambiente tumoral, impedem a persistência de linfócitos, consolidando-se como barreiras na eficácia terapêutica da técnica (D’ALOIA et al., 2018). No referido caso, a eficiência de células CAR também é influenciada por condições como: (a) a linfodepleção e estado clínico prévio ao tratamento; (b) frequência e dose administrada e (c) a via de administração escolhida (D’ALOIA et al., 2018).
Assim, a fim de superar tais obstáculos, estudos estão sendo desenvolvidos utilizando como alvo diferentes antígenos tumorais, como a proteína mesotelina, expressa em diversos tumores sólidos como os mesotélicos, pancreáticos, pulmonares e ovarianos; a proteína EGFRvIII presente em glioblastomas; a PDL-1 apresentada em carcinomas pulmonares e os antígenos presentes em tumores prostáticos, como o antígeno prostático específico (PSA), antígeno prostático específico de membrana (PSMA), entre outros (D’ALOIA et al., 2018; SCHEPISI et al., 2019).
Recentemente, em uma das pesquisas mais promissoras até o momento, linfócitos T foram modificados para a criação de células CAR que se liguem à proteína alvo B7-H3, essa altamente expressa na superfície de uma série de células cancerosas (MAJZNER et al, 2019). A modificação genética, testada em modelos-animais foi eficaz em diversas neoplasias, incluindo as pediátricas e o câncer cerebral glioblastoma (TANG et al., 2019).
No entanto, ainda que promissor, o uso da terapia dos receptores de antígenos quiméricos em tumores sólidos ainda se encontra no campo experimental e requer, portanto, maior quantidade de testes clínicos.
4.11.2 TUMORES HEMATOLÓGICOS
Para malignidades hematológicas, a FDA até o presente momento aprovou três terapias CAR-T para uso, baseado em estudos clínicos conduzidos em pacientes acometidos por malignidades de característica CD-19 positiva (D’ALOIA et al., 2018). A primeira a ser aprovada, em 2017, é a denominada tisagenlecleucel (Kymriah®) e tem seu uso voltado para o tratamento de Leucemias Linfoblasticas Agudas (LLA) de células B em crianças e jovens adultos que se encontram em estágios avançados da patologia (MEDLINEPLUS, 2021). A aprovação baseou-se em resultados preliminares da fase 2 do estudo clínico multicêntrico ELIANA (SERMER; BRENTJENS, 2019). Em 2018, a FDA aprovou a técnica para o também tratamento do Linfoma Difuso de Grandes Células B (DLBCL) (BOYIADZIS et al., 2018).
Ainda em 2017, após resultados da fase 2 do estudo clínico ZUMA-1, a terapia axicabtagene ciloleucel (Yescarta®) foi a segunda a ser aprovada e a primeira comprovadamente eficaz contra Linfomas de células B não-Hodgkin, como o DLBCL (LOCKE et al., 2019).
Publicada em Julho de 2020, a chamada brexucabtagene autoleucel, Tecartus®, foi a terceira e mais recente aprovação da FDA. A terapia é utilizada para o tratamento de pacientes com Linfoma de Células do Manto (LCM) refratários ao tratamento convencional ou que apresentam recorrência da patologia (MEDLINEPLUS, 2020).
A mais atual aprovação pelo órgão regulador baseou-se em ensaios clínicos realizados em 60 pacientes portadores da doença tratados com dose única, dos quais 93% demonstraram resposta remissiva e 67% dos mesmos apresentaram remissão completa à LCM (WANG et al., 2020). Tal quais ambas as terapias anteriormente aprovadas, a Tecartus® igualmente utiliza como mecanismo-base o reconhecimento da molécula CD-19, significativamente expressas em células B cancerosas (HAN et al., 2021).
Logo, terapias CART-19 são no momento atual as mais reconhecidas e amplamente utilizadas variantes da técnica do receptor de antígeno quimérico de células T, para o tratamento de cânceres hematológicos. Todavia, diversos estudos vêm sendo desenvolvidos com células CART-20, CART-BCMA (B-Cell maturation antigen) promissora para o tratamento de pacientes portadores de Mieloma Múltiplo, e CART-22, essa com resultados clínicos que apresentam remissão de aproximadamente 70% em pacientes tratados com leucemia linfoblástica aguda de células B, favorável para o também tratamento de doenças autoimunes (BERDEJA et al., 2017; FRY et al., 2017; MILIOTOU; PAPADOPOULOU, 2018; WALSH; YANG; KOHLER, 2019).
4.11.3 DOENÇAS AUTOIMUNES
Terceira maior causa de mortalidade em níveis mundiais, as patologias autoimunes englobam um conjunto de doenças em que a autotolerância de antígenos próprios é perdida (YAMAMOTO, 2016). Mediante o conhecimento de que tanto autoanticorpos secretados por linfócitos B e linfócitos T autorreativos são os principais agentes para o desenvolvimento da condição, foram desenvolvidas as células CAAR-T (CHEN et al., 2019).
A modificação dos linfócitos T nesse modelo se refere ao acoplamento de um Receptor Quimérico de Autoantígeno (CAAR) à célula efetora, o que o diferencia da técnica CAR original. A técnica foi estudada primeiro em 2016 para o tratamento do Pênfigo Vulgar (PV), condição marcada pela presença de autoanticorpos contra a proteína de adesão de queratinócitos Desmogleína 3 (Dsg3). De tal forma células CAAR-T expressam o autoantígeno Dsg3, para que linfócitos B reativos ao antígeno se liguem a elas que, em resposta, secretam citocinas para sua eliminação (ELLEBRECHT et al., 2016).
A técnica pode, em teoria, ser estendida também para o tratamento de outras doenças autoimunes, como diabetes do tipo 1, esclerose múltipla e uveíte (CHATENOUD, 2016).
4.12 EFEITOS COLATERAIS
Em razão de serem constituídos por elementos sintéticos, não naturais ao corpo, e de desencadearem forte resposta imune, receptores CAR podem instigar a ocorrência de efeitos colaterais que estão diretamente associados às condições como: o tipo e estadiamento da malignidade e o estado imunológico do indivíduo previamente ao tratamento (HAN; KWON, 2018).
Os efeitos mais reportados da terapia são: síndrome de liberação de citocinas (CRS), neurotoxicidade e aplasia de células B (CRUZ-RAMOS; GARCÍA-FONCILLAS, 2019).
4.12.1 SÍNDROME DE LIBERAÇÃO DE CITOCINAS (CRS)
Com o objetivo de estimular e direcionar a resposta imunológica, linfócitos T possuem a característica de secretar citocinas, moléculas que funcionam como mensageiras de sua ação (ABBAS; H.LICHMAN; PILLAI, 2012). A CRS ocorre quando há uma rápida e intensa liberação de tais substâncias na corrente sanguínea do paciente em tratamento e pode se apresentar de forma leve, moderada ou (em raros casos) fatal, e se desenvolve em até duas semanas após a infusão das células modificadas (CRUZ-RAMOS; GARCÍA-FONCILLAS, 2019). A liberação pode levar a febre, erupção cutânea e possível falha de órgãos e não é descrita em testes para o tratamento de tumores sólidos (LEE et al., 2014). O manejo da condição é feito com terapias de apoio, como o uso de anti-histamínicos, antipiréticos e fluidos intravenosos que bloqueiam a atividade desses mensageiros (SHIMABUKURO-VORNHAGEN et al., 2018).
4.12.2 NEUROTOXICIDADE
Dano no sistema nervoso central ou periférico, que pode alterar a atividade ou causar a morte de nervos, resultando em efeitos como afasia, paralisia facial, confusão e tremores. O mecanismo fisiopatológico que desencadeia a condição durante a terapia imunoterápica ainda não é completamente compreendido, entretanto pesquisadores sugerem ligação à CRS e não à atividade dos linfócitos modificados em si (BELIN et al, 2020).
4.12.3 APLASIA DE CÉLULAS B
A característica de reconhecimento de linfócitos CART-19 ao antígeno CD-19 presente em células B, pode resultar na aplasia de tais células, com consequente hipogamaglobulinemia e aumento de susceptibilidade a infecções oportunistas (BONIFANT; JACKSON; BRENTJENS; CURRAN, 2016). A condição é tratada por meio da administração de anticorpos IgGs ao paciente.
Outros efeitos adversos à técnica CAR-T também são relatados, como sintomas semelhantes à gripe, febre, hipotensão, doença renal aguda e hipóxia (BONIFANT; JACKSON; BRENTJENS; CURRAN, 2016).
4.13 BRASIL
Devido a seu destaque e caráter promissor, a terapia CAR-T é alvo de estudos e testes clínicos em uma série de países, como China, Estados Unidos, Reino Unido e Brasil (WEI et al., 2020).
A técnica brasileira diferencia-se por dois fatores principais, em primeiro lugar pela capacidade dada aos linfócitos modificados de reconhecer o vírus Epstein-Barr (presente na mononucleose e linfomas) e em segundo lugar por ser um dos primeiros protocolos em que o fragmento de DNA, necessário para a modificação genética, é transferido por mecanismo não viral, promovendo a redução do custo do tratamento (CHICAYBAM et al., 2019).
Resultando em uma alta diminuição do tumor, a terapia foi testada em modelo vivo no País pela primeira vez em 2019. O paciente, portador de Linfoma Não-Hodgkin, recebeu o tratamento de forma compassiva por meio do Centro de Terapia Celular (CTC-USP) e do Hospital das Clínicas de Ribeirão Preto, e em aproximadamente um mês o resultado positivo o permitiu abandonar o uso de morfina.
Hoje, investimentos estão sendo feitos para a ampla utilização da técnica de maneira segura no País, com pleno manejo de seus efeitos colaterais, de forma barata e em larga escala, a fim de sua viabilização para o Sistema Único de Saúde (SUS).
4.14 BARREIRAS E PERSPECTIVAS
A terapia de células T tem sido demonstrada como uma efetiva solução para tumores reincidentes ou refratários, especialmente no campo das malignidades hematológicas CD-19 positivas, e é, segundo a Livraria Nacional de Medicina dos Estados Unidos (NIH), por meio da plataforma clinicaltrials.gov, objeto de 1285 estudos em todo mundo (HUANG et al., 2020). Contudo, a terapia ainda enfrenta uma série de barreiras ao seu desenvolvimento, dentre elas: sua aplicação restrita, elevado custo e baixa flexibilidade no reconhecimento antigênico.
Referente à superação da limitação de seu uso a tumores hematológicos, que se dá devido à expressão heterogênea de antígenos na superfície de células cancerosas, é necessária a definição de outros antígenos que sejam tão precisos quanto à molécula CD-19 (CRUZ-RAMOS; GARCÍA-FONCILLAS, 2019). A justificativa da dificuldade no encontro dos mesmos baseia-se no fato de que tumores são primariamente gerados nas próprias células do indivíduo e, para eficácia e segurança clínica, antígenos selecionados devem apresentar alta expressão em células malignas e baixa expressão em tecidos saudáveis (NEWICK; MOON; ALBELDA, 2016).
Em perspectiva futura, antígenos tumorais como PD-L1, PSMA e B7-H3 são exemplos de moléculas estudadas para que o uso do tratamento possa ser expandido (MILIOTOU; PAPADOPOULOU, 2018). Não somente, o desenvolvimento e utilização de linfócitos modificados com a adição de um antígeno-inibitório específico CAR (iCAR) traz um avanço promissor à técnica, pois esses apresentam extensa dinâmica autorregulatória, impedindo o ataque de tecidos saudáveis, promovendo maior segurança clínica (FEDOROV; THEMELI; SADELAIN, 2013).
Sob o ponto de vista da acessibilidade da terapêutica a diferentes classes populacionais, barreiras como a necessidade de mão de obra especializada e o elevado custo demandado pela técnica se destacam. Em julho de 2020, a American Society of Clinical Oncology (ASCO) estabeleceu o custo médio da terapia em cerca de 373 mil dólares, podendo, com custos adicionais, chegar até 420 mil dólares. Assim, esforços em pesquisa Nacional, por meio de variação da técnica de transmissão do gene CAR pela tecnologia não viral Sleeping Beauty, estão sendo desenvolvidos (CHICAYBAM et al., 2019).
A expansão de estudos clínicos também progrediu à combinação da técnica CAR-T à inibidores de checkpoint, esses que se referem à moléculas inibidoras às vias de evasão tumoral (HAN et al., 2021). A terapia CAR baseada em tal princípio permite a perspectiva no sobrepujamento do microambiente tumoral, da exaustão dos leucócitos modificados e na diminuição da toxicidade sistêmica (HUANG et al., 2020). Demais combinações racionais do uso da terapia CAR à outras técnicas, como “switch receptors” e edição genética, a fim de diminuir a capacidade supressora tumoral, estão em estudo (LIM; JUNE, 2017).
Por fim, a necessidade de uma maior especificidade, eficiência e flexibilidade ao reconhecimento de antígenos, bem como o controle dos efeitos colaterais causados pela técnica, fomentou o desenvolvimento recente de uma configuração CAR baseada de caráter universal (Figura 4). A tecnologia denominada Split, universal, programmable chimeric antigen receptor (SUPRA-CAR), possui arquitetura fundamentada em dois componentes: (a) um receptor universal (zipCAR) formado essencialmente por um domínio sinalizador intracelular e um zíper de leucina extracelular, este também chamado de BZip associado a (b) um adaptador de direcionamento tumoral scFv (zipFV) formado por um scFv conectado a um zíper de leucina complementar, ou AZip (CHO; COLLINS; WONG, 2018). Zípers de leucinas são moléculas mediadoras à conexão em sequências específicas de DNA, que atuam mutualmente regulando a expressão gênica e diversos processos celulares (NIKOLAEV et al., 2010).
Figura 4: Arquitetura de um receptor SUPRA-CAR, formado por dois componentes base: um receptor universal ZipCAR associado a um adaptador de direcionamento tumoral ZipFV.
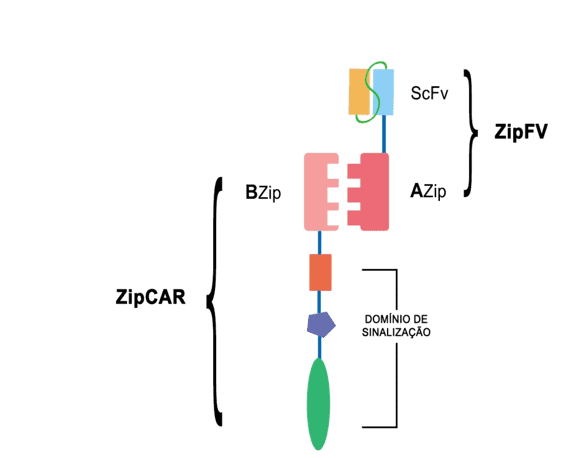
A tecnologia SUPRA-CAR promove o reconhecimento antigênico pelo zipFv, desencadeando a ativação da célula T por meio da ligação da zíper de leucina complementar à zipCAR (CRUZ; MATEUS; BORGES, 2019). Assim, o design permite o reconhecimento de diversos antígenos sem reprogramação da estrutura do receptor, como na técnica CAR-T convencional, que é capaz de reconhecer essencialmente apenas um ou dois antígenos. Ademais, a técnica ainda permite o controle de diferentes leucócitos, como CD4+ e CD8+, e limita a liberação exacerbada de citocinas, garantindo maior segurança clínica (CHO; COLLINS; WONG, 2018).
Assim, a nova evolução viabiliza um futuro ainda mais promissor para a imunoterapia em termos universais, pois sua tecnologia é base comum para o reconhecimento de diversos antígenos, com alto resguardo de ação, e poderá ainda ser usada para o tratamento de diversas outras patologias, como autoimunes e infecciosas.
5. CONSIDERAÇÕES FINAIS
Descrita como uma droga viva, de alta especificidade e sensibilidade, a terapia do receptor de antígeno quimérico é hoje uma das mais vertentes imunoterápicas mais auspiciosas ao tratamento da condição que é caracterizada como a segunda principal causa de óbitos no mundo, o câncer.
A demonstração de sua base teórica, compreendendo particularidades em arquitetura, engenharia e funcionamento, em conjunto com resultados clínicos que demonstram altas e duradouras taxas de remissão, deixam claro o caráter promissor do método. Tais particularidades suscitaram o desenvolvimento de quatro gerações de receptores e a eventual aprovação estadunidense de três medicamentos CAR baseados para uso.
Contudo, em alinhamento a seu sucesso, barreiras e dificuldades ainda são uma significativa realidade, tais como os efeitos colaterais da técnica, custo elevado e aplicabilidade clínica ainda restrita às malignidades hematológicas CD-19 positivas, como LLA e DLBCL. Por conseguinte, a fim de transpassar tais obstáculos, estudos em desenvolvimento instauram a esperançosa perspectiva futura da técnica, com a criação de suas variáveis iCAR, CAAR e SUPRA-CAR, potenciais à autorregulação de ação, tratamento de doenças autoimunes e expansão à malignidades sólidas.
Assim, a tecnologia demonstra-se favorável à consolidação vindoura como principal forma de tratamento oncológico, de maneira a fomentar e a reafirmar a indispensável necessidade de maiores estudos para ultrapasse pleno de seus obstáculos observados.
REFERÊNCIAS
ABBAS, Abul K.; LICHMAN, Andrew H.; PILLAI, Shiv. Imunologia Celular e Molecular, 7 ed. Rio de Janeiro: Elsevier Saunders, 2012, 545 p. Imunidade a Tumores. ISBN:9788535247442.
ALVAREZ-VALLINA, Luis; RUSSEL, Stephen J. Efficient discrimination between different densities of target antigen by tetracycline-regulatable T bodies. Human gene therapy, v.10, n. 4, p. 559-63, 2004. Disponível em: https://pubmed.ncbi.nlm.nih.gov/10094199/. Acesso em: 08/04/2021.
AMERICAN CANCER SOCIETY et.al. Cancer Facts & Figures 2021. Atlanta: American Cancer Society, 2021. 72 p.
ATACA, Pinar; ARSLAN, Önder. Chimeric Antigen Receptor T Cell Therapy in Hematology. Turkish journal of haematology: official journal of Turkish Society of Haematology, v.32, n. 4, p. 285-294, 2015. Disponível em: https://pubmed.ncbi.nlm.nih.gov/26377367/. Acesso em: 07/04/2021.
BATISTA, Delma Riane Rebouças; MATTOS, Magda de; SILVA, Samara Frizzeira da. Convivendo com o câncer: do diagnóstico ao tratamento. Revista de Enfermagem da UFSM, v.5, n. 3, p. 499-510, 2015. Disponível em: https://periodicos.ufsm.br/reufsm/article/view/15709. Acesso em: 25/03/2021.
BELIN, Catherine.; et.al. Description of neurotoxicity in a series of patients treated with CAR T-cell therapy. Scientific Reports, v.10, n. 18997, p. 1-9, 2020. Disponível em: https://www.nature.com/articles/s41598-020-76055-9. Acesso em 13/01/2021.
BERDEJA, Jesus G.; et.al. Durable Clinical Responses in Heavily Pretreated Patients with Relapsed/Refractory Multiple Myeloma: Updated Results from a Multicenter Study of bb2121 Anti-Bcma CAR T Cell Therapy. Blood, v.130 (Suppl_1), p. 740, 2017. Disponível em: https://ashpublications.org/blood/article/130/Suppl_1/740/83633/Durable-Clinical-Responses-in-Heavily-Pretreated. Acesso em 08/04/2021.
BONIFANT, Challice L.; JACKSON, Hollie J.; BRENTJENS, Renier J.; CURRAN, Kevin J. Toxicity and management in CAR T-cell therapy. Molecular Therapy — Oncolytics, v.3, n. 16011, p. 1-7, 2016. Disponível em:https://reader.elsevier.com/reader/sd/pii/S2372770516300353?token=AE3CEDCAF6D92BEE8471DCC4B93F98706A04A97C878777820B3124404DD617CDEE840259FBD4BA1258EC6971DE8A7ED9. Acesso em 27/01/2021
BOYIADZIS, Michael M.; et.al. Chimeric antigen receptor (CAR) T therapies for the treatment of hematologic malignancies: clinical perspective and significance. Journal for Immunotherapy of Cancer, v.6, n. 1, p.137, 2018. Disponível em: https://www.ncbi.nlm.nih.gov/pubmed/30514386. Acesso em: 13/01/2021.
BRUDNO, Jennifer N.; KOCHENDERFER, James N. Recent advances in CAR T-cell toxicity: Mechanisms, manifestations and management. Blood reviews, v.34, p. 45-55, 2019. Disponível em: https://pubmed.ncbi.nlm.nih.gov/30528964/. Acesso em: 22/03/2021.
CARTELLIERI, Marc et al. Chimeric antigen receptor-engineered T cells for immunotherapy of cancer. Journal of biomedicine & biotechnology, v.2010, n. 956304, p. 1-13, 2013. Disponível em: https://www.ncbi.nlm.nih.gov/pubmed/20467460. Acesso em: 05/01/2021.
CHAMOTO, Kenji; HATAE, Ryusuke; HONJO, Tasuku. Current issues and perspectives in PD-1 blockade cancer immunotherapy. International Journal of Clinical Oncology, v.25, n. 5, p. 790-800, 2020. Disponível em: https://pubmed.ncbi.nlm.nih.gov/31900651/. Acesso em: 27/03/2021.
CHATENOUD, Lucienne. Precision medicine for autoimmune disease. Nature Biotechnology, v.34, p. 930-932, 2016. Disponível em: https://www.nature.com/articles/nbt.3670. Acesso em: 12/01/2021.
CHEN, Yuehong. et al. Immunotherapy Deriving from CAR-T Cell Treatment in Autoimmune Diseases. Journal of immunology research, v.2019, p. 1-9, 2019. Disponível em: https://www.researchgate.net/publication/338297739_Immunotherapy_Deriving_from_CAR-T_Cell_Treatment_in_Autoimmune_Diseases. Acesso em: 27/03/2021.
CHICAYBAM, Leonardo.; et.al. CAR T Cells Generated Using Sleeping Beauty Transposon Vectors and Expanded with an EBV-Transformed Lymphoblastoid Cell Line Display Antitumor Activity In Vitro and In Vivo. Human Gene Therapy, v.30, n. 4, p. 511-522, 2019. Disponível em: https://www.liebertpub.com/doi/abs/10.1089/hum.2018.218. Acesso em: 13/01/2021.
CHMIELEWSKI, Markus et al. T cell activation by antibody-like immunoreceptors: increase in affinity of the single-chain fragment domain above threshold does not increase T cell activation against antigen-positive target cells but decreases selectivity. Journal of immunology, Baltimore, v.173, n. 12, p. 7647-7653, 2004. Disponível em: https://pubmed.ncbi.nlm.nih.gov/15585893/. Acesso em: 09/04/2021.
CHMIELEWSKI, Markus; KOPECKY, Caroline.; HOMBACH, Andreas A A.; ABKEN, Hinrich. IL-12 release by engineered T cells expressing chimeric antigen receptors can effectively Muster an antigen-independent macrophage response on tumor cells that have shut down tumor antigen expression. Cancer research, v.71, n. 17, p. 5697-706, 2011. Disponível em: https://pubmed.ncbi.nlm.nih.gov/21742772/. Acesso em: 07/04/2021.
CHO, Jang Hwan.; COLLINS, James J.; WONG, Wilson W. Universal Chimeric Antigen Receptors for Multiplexed and Logical Control of T Cell Responses. Cell, v.173, n. 6, p. 1426-1438, 2018. Disponível em: https://www.ncbi.nlm.nih.gov/pubmed/29706540. Acesso em: 13/02/2021.
CHOE, Joseph H.; WILLIAMS, Jasper Z.; LIM, Wendell A. Engineering T Cells to Treat Cancer: The Convergence of Immuno-Oncology and Synthetic Biology. Annual Review of Cancer Biology, v.4, p. 121-39, 2020. Disponível em: https://www.annualreviews.org/doi/abs/10.1146/annurev-cancerbio-030419-033657. Acesso em: 25/03/2021.
CHU, Fuliang.; CAO, Jingjing.; NEELALPU, Sattva S. Versatile CAR T-cells for cancer immunotherapy. Contemporary oncology (Poznan, Poland), v.22, n. 1A, p. 73-80, 2018. Disponível em: https://pubmed.ncbi.nlm.nih.gov/29628798/. Acesso em: 07/04/2021.
CRUZ, Maria Teresa.; MATEUS, Daniela Marques.; BORGES, Olga. Células T com Recetor de Antigénio Quimérico (CAR): Uma Nova Estratégia Imunoterapêutica. Revista Portuguesa de Farmacoterapia, v. 11, n. 2-3, p. 39-48, 2019. Disponível em: http://revista.farmacoterapia.pt/index.php/rpf/article/view/222. Acesso em: 01/02/2021.
CRUZ-RAMOS, Marlid.; GARCÍA-FONCILLAS, Jesús. CAR-T cell and Personalized Medicine. Advances in experimental medicine and biology, v.1168, p. 131-145, 2019. Disponível em: https://pubmed.ncbi.nlm.nih.gov/31713169/. Acesso em: 25/03/2021.
DEVITA, V. T.; LAWRENCE, T. S.; ROSENBERG, S. A. Cancer: principles and practice of oncology. 10 ed. Filadélfia: Lippincott Williams & Wilkins, 2005. 3151 p. Molecular biology of cancer: cancer immunology. ISBN 978-1451192940.
DURNING, Marijke Vroomen. How Durable Are CAR T-Cell Therapies? OncologyLive, v. 19, n.5, 2018. Disponível em: https://www.onclive.com/view/how-durable-are-car-tcell-therapies. Acesso em: 27/01/2021.
D’ALOIA, Maria Michela. et al. CAR-T cells: the long and winding road to solid tumors. Cell Death & Disease, v.9, p. 282, 2018. Disponível em: https://www.nature.com/articles/s41419-018-0278-6. Acesso em: 27/01/2021.
ELLEBRECHT, Christoph T. et al. Reengineering chimeric antigen receptor T cells for targeted therapy of autoimmune disease. Science, v. 353, n. 6295, p. 179-84, 2016. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5343513/. Acesso em: 12/01/2021.
FEDOROV, Victor D.; THEMELI, Maria.; SADELAIN, Michel. PD-1- and CTLA-4-based inhibitory chimeric antigen receptors (iCARs) divert off-target immunotherapy responses. Science translational medicine, v.5, n. 215, p. 215ra172, 2013. Disponível em: https://pubmed.ncbi.nlm.nih.gov/24337479/. Acesso em: 08/14/2021.
FRY, Terry J. et al. CD22-targeted CAR T cells induce remission in B-ALL that is naive or resistant to CD19-targeted CAR immunotherapy. Nature Medicine, v.24, p. 20-28, 2017. Disponível em: https://www.nature.com/articles/nm.4441. Acesso em: 08/04/2021
GALLUZZI, Lorenzo et.al. Classification of current anticancer immunotherapies. Oncotarget, v.5, n. 24, p. 12472-508, 2014. Disponível em: https://pubmed.ncbi.nlm.nih.gov/25537519/. Acesso em: 27/03/2021.
GROSS, Gideon; WAKS, Tova; ESHHAR, Zelig. Expression of immunoglobulin-T-cell receptor chimeric molecules as functional receptors with antibody-type specificity. Proceedings of the National Academy of Sciences of the United States of America, v.86, n. 24, p. 10024-10028, 1989. Disponível em: https://pubmed.ncbi.nlm.nih.gov/2513569/. Acesso em: 15/04/2021.
GUEDAN, Sonia; CALDERON, Hugo; AVERY D. POSEY, Jr.MAUS, Marcela V. Engineering and Design of Chimeric Antigen Receptors. Molecular therapy. Methods & clinical development, v.12, p. 145-156, 2019. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6330382/. Acesso em 17/04/2021.
HAN, Chungyong.; KWON, Byoung S. Chimeric antigen receptor T-cell therapy for cancer: a basic research-oriented perspective. Immunotherapy, v.10, n. 3, p. 221-234, 2018. Disponível em: https://pubmed.ncbi.nlm.nih.gov/29370727/. Acesso em: 27/03/2021.
HAN, Donglei et al. Current Progress in CAR-T Cell Therapy for Hematological Malignancies. Journal of Cancer, v.12, n. 2, p. 326-334, 2021. Disponível em: https://pubmed.ncbi.nlm.nih.gov/33391429/. Acesso em: 02/04/2021.
HELMY, Karim Y.; PATEL, Shyam A.; NAHAS, George R.; RAMESHWAR, Pranela. Cancer immunotherapy: accomplishments to date and future promise. Therapeutic delivery, v.4, n. 10, p. 1307-20, 2013. Disponível em: https://pubmed.ncbi.nlm.nih.gov/24116914/. Acesso em: 22/03/2021.
HOMBACH, Andreas A. et.al. T cell activation by antibody-like immunoreceptors: the position of the binding epitope within the target molecule determines the efficiency of activation of redirected T cells. Journal of immunology, Baltimore, v.178, n. 7, p. 4650-4657, 2007. Disponível em: https://pubmed.ncbi.nlm.nih.gov/17372024/. Acesso em: 08/04/2021.
HUANG, Ruihao et.al. Recent advances in CAR-T cell engineering. Journal of hematology & oncology, v.13, n. 1, p. 1-19, 2021. Disponível em: https://pubmed.ncbi.nlm.nih.gov/32616000/. Acesso em: 30/03/2021.
INCA. Instituto Nacional de Câncer José Alencar Gomes da Silva. ABC do câncer: abordagens básicas para o controle do câncer. 6 ed. 114 p. Rio de Janeiro: Ministério da Saúde, 2020. ISBN:978-85-7318-394-8.
INCA. Instituto Nacional de Câncer José Alencar Gomes da Silva. Estimativa/2020 – Incidência de Câncer no Brasil. Rio de Janeiro: Ministério da Saúde, 2020. 120 p. ISBN:978-85-7318-389-4.
KALOS, Michael et al. T cells with chimeric antigen receptors have potent antitumor effects and can establish memory in patients with advanced leukemia. Science translational medicine, v.3, n. 95, p. 95ra73, 2011. Disponível em: https://pubmed.ncbi.nlm.nih.gov/21832238/. Acesso em: 08/04/2021.
KLOSS, Christopher C. et al. Combinatorial antigen recognition with balanced signaling promotes selective tumor eradication by engineered T cells eradication by engineered T cells. Nature biotechnology, v.31, n. 1, p. 71-75, 2013. Disponível em: https://pubmed.ncbi.nlm.nih.gov/23242161/. Acesso em: 07/04/2021.
LEE, Daniel W. et.al. Current concepts in the diagnosis and management of cytokine release syndrome Author links open overlay panel. Blood. v.124, n. 2, p. 188-95, 2014. Disponível em: https://www.sciencedirect.com/science/article/pii/S000649712039995X. Acesso em: 08/04/2021.
LIM, Wendell A.; JUNE, Carl H. The Principles of Engineering Immune Cells to Treat Cancer. Cell, v.168, n. 4, p. 724-740, 2017. Disponível em: https://pubmed.ncbi.nlm.nih.gov/28187291/. Acesso em: 08/04/2021.
LOCKE, Frederick L. et.al. Long-term safety and activity of axicabtagene ciloleucel in refractory large B-cell lymphoma (ZUMA-1): a single-arm, multicentre, phase 1-2 trial. The Lancet. Oncology, v.20, n. 1, p. 31-42, 2019. Disponível em: https://pubmed.ncbi.nlm.nih.gov/30518502/. Acesso em: 08/04/2021.
MAJZNER, Robbie G. et.al. CAR T Cells Targeting B7-H3, a Pan-Cancer Antigen, Demonstrate Potent Preclinical Activity Against Pediatric Solid Tumors and Brain Tumors. Clinical Cancer Research, v.25, n. 8, p. 2560-574, 2019. Disponível em: https://www.ncbi.nlm.nih.gov/pubmed/30655315. Acesso em: 12/01/2021.
MEDLINEPLUS. Brexucabtagene Autoleucel Injection: MedlinePlus Drug Information. 2020.
MEDLINEPLUS. Tisagenlecleucel Injection: MedlinePlus Drug Information. 2021.
MILIOTOU, Androulla N.; PAPADOPOULOU, Lefkothea C. CAR T-cell Therapy: A New Era in Cancer Immunotherapy. Current pharmaceutical biotechnology, v.19, n. 1,p. 5-18, 2018. Disponível em: https://pubmed.ncbi.nlm.nih.gov/29667553/. Acesso em: 27/03/2021.
NEWICK, Kheng; MOON, Edmund; ALBELDA, Steven M. Chimeric antigen receptor T-cell therapy for solid tumors. Molecular Therapy — Oncolytics, v. 3, n.16006, p. 1-7, 2016. Disponível em: https://reader.elsevier.com/reader/sd/pii/S2372770516300456?token=0C7C129A599D6B30F842BBCB6C2543264A0DCAB7C4712FE19ACAAB3280E57968420C5DECFF075E6E5273AB6BE5BDCA2B. Acesso em: 03/04/2021.
NIKOLAEV, Nikolaev; et al. The leucine zipper domains of the transcription factors GCN4 and c-Jun have ribonuclease activity. PloS one, v.5, n. 5, p. e10765, 2010. Disponível em: https://pubmed.ncbi.nlm.nih.gov/20505831/. Acesso em: 19/01/2021.
OLIVEIRA, Lílian M. G. Bahia; KANASHIRO, Milton M.. Imunologia. vol.1 . Rio de Janeiro: Fundação CECIERJ, 2005. 248 p.
PEREIRA, Viviane da Costa; OLIVEIRA, Patrícia Aparecida Ferreira de. Definição das terapias celulares com receptores de antígenos quiméricos (CAR), receptores de células t (TCR) e linfócitos infiltrantes de tumor (TIL). Perspectivas futuras para a cura do câncer. Brazilian Journal of Health Review, Curitiba, v.2, n. 2, p. 1105-24, 2019. Disponível em: https://www.brazilianjournals.com/index.php/BJHR/article/viewFile/1307/1186. Acesso em: 08/01/2021.
REJDAK, Robert et al. Intraoperative Macula Protection by Perfluorocarbon Liquid for the Metallic Intraocular Foreign Body Removal during 23-Gauge Vitrectomy. Journal of ophthalmology, v.2017, p. 1-5, 2017. Disponível em: https://pubmed.ncbi.nlm.nih.gov/28553550/. Acesso em: 17/07/2021.
SCHEPISI, Giuseppe. et.al. CAR-T cell therapy: a potential new strategy against prostate cancer. v.7, n. 258, p. 1-11, 2019. Disponível em: https://www.researchgate.net/publication/336593997_CAR-T_cell_therapy_a_potential_new_strategy_against_prostate_cancer. Acesso em: 12/01/2021
SERMER, David ; BRENTJENS, Renier. CAR T-cell therapy: Full speed ahead. Hematological oncology, v.37 (Suppl 1), p. 95-100, 2019. Disponível em: https://pubmed.ncbi.nlm.nih.gov/31187533/. Acesso em: 22/03/2021.
SHIMABUKURO-VORNHAGEN, Alexander; et.al. Cytokine release syndrome. Journal for immunotherapy of cancer, v.6, n. 1, p. 56, 2018. Disponível em: https://pubmed.ncbi.nlm.nih.gov/29907163/. Acesso em: 27/03/2021.
SUHAIL, Yasir et al. Systems Biology of Cancer Metastasis. Cell systems, v.9, n. 2, p. 109-127, 2019. Disponível em: https://pubmed.ncbi.nlm.nih.gov/31465728/. Acesso em:07/04/2021.
TANG, Xin et.al. B7-H3 as a Novel CAR-T Therapeutic Target for Glioblastoma. Molecular Therapy Oncolytics, v.14, p. 279-287, 2019. Disponível em: https://pubmed.ncbi.nlm.nih.gov/31485480/. Acesso em: 02/04/2021.
TRAVIS, Lois B. et.al. Second Cancers. In: DeVita, Hellman, and Rosenberg’s Cancer: Principles and Practice of Oncology. 11 ed. Philadelphia: Lippincott Williams & Wilkins, 2019. p. 2155-73.
TURATTI, Fabio. Redirected activity of human antitumor chimeric immune receptors is governed by antigen and receptor expression levels and affinity of interaction. Journal of immunotherapy. Hagerstown: v.30, n. 7, p. 684-693, 2007. Disponível em: https://pubmed.ncbi.nlm.nih.gov/17893561/. Acesso em: 08/04/2021.
WALSH, Zachary; YANG, Yinmeng; KOHLER, M. Eric. Immunobiology of chimeric antigen receptor T cells and novel designs. Immunological reviews, v.290, n. 1, p. 100-113, 2019. Disponível em: https://onlinelibrary.wiley.com/doi/abs/10.1111/imr.12794. Acesso em: 25/03/2021.
WANG, Michael et.al. KTE-X19 CAR T-Cell Therapy in Relapsed or Refractory Mantle-Cell Lymphoma. The New England Journal of Medicine, v. 382, n.14, p. 1331-1342, 2020. Disponível em: https://pubmed.ncbi.nlm.nih.gov/32242358/. Acesso em: 02/02/2021
WEI, Jianshu et al. Clinical development of CAR T cell therapy in China: 2020 update. Cellular & Molecular Immunology, v. 18, p. 792-804, 2020. Disponível em: https://www.nature.com/articles/s41423-020-00555-x. Acesso em: 11/01/2021.
WEIJTENS, MEM.; HART, EH.; BOLHUIS, RLH. Functional balance between T cell chimeric receptor density and tumor associated antigen density: CTL mediated cytolysis and lymphokine production. Gene therapy, v.7, n. 1, p. 35-42, 2000. Disponível em: https://pubmed.ncbi.nlm.nih.gov/10680014/. Acesso em: 08/04/2021.
WORLD HEALTH ORGANIZATION et.al. WHO report on cancer: setting priorities, investing wisely and providing care for all. Geneva: World Health Organization 2020. 149 p. ISBN:9789240001299.
YAMAMOTO, Kazuhiko. Introduction: Autoimmunity Special Issue. International Immunology, v.28, n. 4, p. 153-154, 2016. Disponível em: https://academic.oup.com/intimm/article-pdf/28/4/153/8145022/dxw010.pdf. Acesso em: 08/04/2021.
YANG, Yiping. Cancer immunotherapy: harnessing the immune system to battle cancer. The Journal of Clinical Investigation, v.125, n. 9, p. 3335-7, 2015. Disponível em: https://pubmed.ncbi.nlm.nih.gov/26325031/. Acesso em: 27/03/2021.
YÁÑEZ, Lucrecia; SÁNCHEZ-ESCAMILLA, Miriam; PERALES, Miguel-Angel. CAR T Cell Toxicity: Current Management and Future Direction. HemaSphere, v.3, n. 2, p. 186, 2019. Disponível em: https://journals.lww.com/hemasphere/Fulltext/2019/04000/CAR_T_Cell_Toxicity__Current_Management_and_Future.5.aspx. Acesso em: 25/03/2021.
[1] Graduanda do curso de Biomedicina na Escola de Ciências da Saúde e Bem-Estar (CISBEM) do Centro Universitário das Faculdades Metropolitanas Unidas (FMU).
[2] Orientador. Mestrado em Saúde Ambiental pelo Centro Universitário das Faculdades Metropolitanas Unidas (FMU). Graduação em Biomedicina pelo Centro Universitário das Faculdades Metropolitanas Unidas (FMU).
Enviado: Abril, 2021.
Aprovado: Agosto, 2021.


Uma resposta
Excelente artigo! Lúcido, claro e objetivo! Parabéns Isabele.