ARTIGO DE REVISÃO
FERREIRA, Rafael André [1], VELLOSO, Ricardo Viana [2]
FERREIRA, Rafael André. VELLOSO, Ricardo Viana. Doença de Chagas: mecanismos de infecção, resposta imune durante o processo patológico induzido pelo parasito e fatores que favorecem a interação parasito-hospedeiro. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano. 07, Ed. 09, Vol. 06, pp. 59-80. Setembro de 2022. ISSN: 2448-0959, Link de acesso: https://www.nucleodoconhecimento.com.br/saude/parasito-hospedeiro
RESUMO
O presente artigo tem como objetivo discutir sobre a Doença de Chagas e os mecanismos de infecção por parte de seu agente etiológico, o Trypanosoma cruzi. O protozoário flagelado Trypanosoma cruzi, da ordem Kinetoplastida, família Trypanosomatidae é o agente etiológico da Doença de Chagas. Foi primeiramente identificado por Carlos Chagas em 1909, que também descreveu seu ciclo de vida, o hospedeiro invertebrado transmissor do parasito, os hospedeiros vertebrados reservatórios e sinais e sintomas da doença. Conhecer os mecanismos do processo de infecção, bem como todas a variáveis implicadas para o norteamento do processo de cura ou cronicidade da doença, é grande importância para compreender a complexidade da interação parasito-hospedeiro, o que torna possível a elucidação de fatores essenciais para o estabelecimento da infecção. A transmissão ocorre principalmente através das fezes e urina de insetos hematófagos infectados, pertencentes a família Reduviidae e subfamília Triatominae. Os insetos hematófagos infectados picam a pele em áreas expostas, defecando no local da picada. Ao coçar o local da picada, o indivíduo provoca o espalhamento dos parasitos, que acabam penetrando no organismo por meio da lesão que a picada do mosquito provocou. A fase aguda da Doença de Chagas se inicia aproximadamente 3 semanas após o início da infecção. Nesse período se pode observar altos níveis de parasitemia a parasitismo. O início da fase crônica da doença se dá à medida em que se observa o decaimento dos níveis de anticorpos contra T. cruzi tipo IgM no soro de pacientes infectados com o consequente aumento dos níveis de IgG. Contudo, a despeito dos grandes avanços nas pesquisas sobre o T. cruzi, ainda não existem vacinas eficazes que possam combater a doença. Assim a melhor forma de prevenção é o combate ao vetor. Os dados relatados foram obtidos por meio de revisões da literatura durante um período compreendido entre o primeiro semestre de 2020 e primeiro semestre de 2022, por meio de pesquisa em livros e revistas científicas, e em sites de busca: www.scielo.com.br e www.pubmed.com.br. Assim, conclui-se que compreender como a resposta imunitária montada na fase aguda pode interferir com o desenvolvimento da patologia na fase crónica, é fundamental para identificar os antígenos que levam à ativação imunitária no início da doença e que podem direcionar a resposta para uma de proteção ou cronicidade da doença.
Palavras-chave: Doença de Chagas, Trypanosoma cruzi, Imunidade.
1. INTRODUÇÃO
O protozoário flagelado Trypanosoma cruzi, da ordem Kinetoplastida, família Trypanosomatidae é o agente etiológico da Doença de Chagas. Foi primeiramente identificado por Carlos Chagas em 1909, que também descreveu seu ciclo de vida, o hospedeiro invertebrado transmissor do parasito, os hospedeiros vertebrados reservatórios e sinais e sintomas da doença (CHAGAS, 1909; BRENER, 1973).
A transmissão ocorre principalmente através das fezes e urina de insetos hematófagos infectados, pertencentes a família Reduviidae e subfamília Triatominae. Ao todo são 130 espécies de insetos triatomíneos identificadas, porém três delas são as mais importantes na transmissão do parasito para o homem: Triatoma infestans, Rhodnius prolixus e Triatoma dimidiata (BRENER, 1973). As áreas rurais e semi-urbanas são os locais de maior probabilidade de encontrar este tipo de inseto. O inseto triatomíneo possui hábitos noturnos, horário em que realiza o repasto sanguíneo. Formas menos comuns de infecção compreendem transfusão sanguínea (YOUNG et al., 2007), transplante de órgãos, transmissão vertical (GÜRTLER et al., 2003) e por ingestão de comida ou bebida contaminada com o parasito (BENCHIMOL et al., 2006; STUART et al., 2008). Conhecer os mecanismos do processo de infecção, bem como todas a variáveis implicadas para o norteamento do processo de cura ou cronicidade da doença, é grande importância para compreender a complexidade da interação parasito-hospedeiro, o que torna possível a elucidação de fatores essenciais para o estabelecimento da infecção. Os dados relatados foram obtidos por meio de revisões da literatura durante um período compreendido entre o primeiro semestre de 2020 e primeiro semestre de 2022, por meio de pesquisa em livros e revistas científicas, e em sites de busca: www.scielo.com.br e www.pubmed.com.br.
2. CARACTERÍSTICAS GERAIS DO PROCESSO DE INFECÇÃO
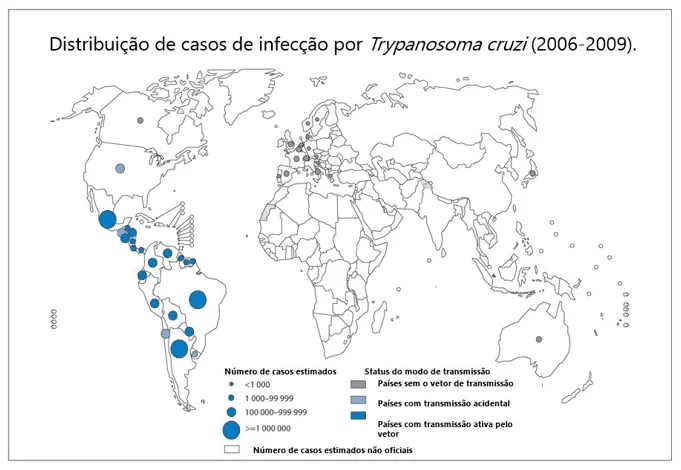
A América Latina é a região de maior endemia para esta doença. Porém, devido às intensas migrações, sua incidência vem aumentando também nos Estados Unidos, países da Europa e alguns países do pacífico ocidental (Figura 1). Atualmente estima-se que cerca de 8 milhões de pessoas estão infectadas pelo parasito em todo o mundo (WHO, 2015). Devido às políticas de controle de vetores iniciadas na década de 1970, o Brasil recebeu, em 2006, a Certificação Internacional pela Interrupção da Transmissão de Doença de Chagas pelo Triatoma infestans. Por outro lado, é estimado que existam cerca de 12 milhões de pessoas com a doença na fase crônica nas Américas, sendo que no Brasil cerca de um milhão de pessoas estejam infectadas por T. cruzi (MS, 2017).
Figura 1: Distribuição de casos de Doenças de Chagas no mundo
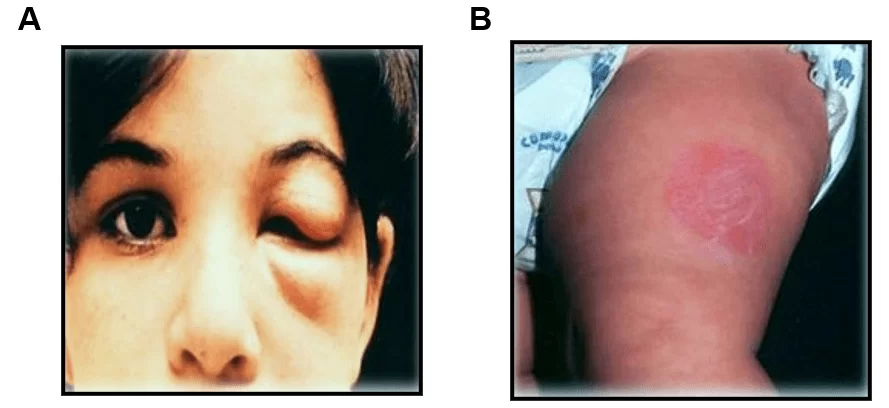
Os insetos hematófagos infectados picam a pele em áreas expostas, defecando no local da picada. Ao coçar o local da picada, o indivíduo provoca o espalhamento dos parasitos, que acabam penetrando no organismo por meio da lesão que a picada do mosquito provocou. A lesão provocada pela picada pode resultar no surgimento dos chamados sinais de porta de entrada que são o chagoma na região da pele ou o sinal de Romaña, na região da mucosa ocular (Figura 2).
A fase aguda da Doença de Chagas se inicia aproximadamente 3 semanas após o início da infecção. Nesse período se pode observar altos níveis de parasitemia a parasitismo. Os sintomas mais típicos neste período são: febre, dor de cabeça, aumento do tamanho dos linfonodos, palidez, fraqueza muscular generalizada, falta de ar e cansaço, surgimento de edema generalizado, dor abdominal ou no peito (BRENER et al., 2000; CANÇADO, 1999; JUNQUEIRA et al. 2010).
O início da fase crônica da doença se dá à medida em que se observa o decaimento dos níveis de anticorpos contra T. cruzi tipo IgM no soro de pacientes infectados com o consequente aumento dos níveis de IgG. A partir de então, a resposta imune atua por controlar a parasitemia e o parasitismo tecidual. Aproximadamente 60-70% dos portadores da Doença de Chagas não vivem a manifestação de sinais clínicos da doença na fase crônica apesar de possuírem anticorpos contra o parasito. Essa característica da doença é típica da fase indeterminada (BRENER et al., 2000).
Figura 2: Principais sinais de porta de entrada para a Doença de Chagas indicando contato entre o vetor e hospedeiro mamífero
Aproximadamente 30% dos indivíduos em fase crônica acabam desenvolvendo algum tipo de anomalia cardíaca, digestiva ou até mesmo neurológica em decorrência das complicações e evolução da doença. Essas anomalias são caracterizadas por cardiomiopatia inflamatória com fibrose do tecido cardíaco, evoluindo para insuficiência cardíaca, comprometimento do sistema mesentérico, causando severo desequilíbrio do sistema peristáltico no esôfago e cólon. Esse desequilíbrio culmina em excessivos movimentos dos músculos lisos, hipertrofiando-os, levando ao surgimento dos megacólon e megaesôfago (JUNQUEIRA et al. 2010; TARLETON, 2007).
Contudo, a despeito dos grandes avanços nas pesquisas sobre o T. cruzi, ainda não existem vacinas eficazes que possam combater a doença. Assim a melhor forma de prevenção é o combate ao vetor. Atualmente existem dois medicamentos para o tratamento da doença, o benzonidazol e o nifurtimox. Porém, além de serem eficazes apenas na fase aguda, período em que raramente o indivíduo será diagnosticado com a doença, eles apresentam severos efeitos colaterais e são contra-indicados em pacientes grávidas ou aqueles portadores de doenças hepáticas ou renais (TARLETON et al. 2007).
3. CICLO DE VIDA DO TRYPANOSOMA CRUZI
O T. cruzi possui três formas de vida durante todo o seu ciclo que se alternam entre o hospedeiro invertebrado e vertebrado: amastigotas, epimastigotas e tripomastigotas. As formas epimastigotas e amastigotas são consideradas replicativas, porém apenas a forma amastigota se replica na célula hospedeira do mamífero (BRENER, 1973). Quando o inseto vetor realiza o repasto sanguíneo em mamíferos infectados por T. cruzi, ele acaba ingerindo as formas tripomastigotas presentes na corrente sanguínea do hospedeiro mamífero. Esses parasitos migram para o estômago do inseto. Nesse local ocorre a lise de muitos parasitos, porém uma pequena parcela de parasitos sobrevive por conseguir se diferenciar na forma epimastigota (CASTRO et al., 2007). No intestino do hospedeiro vetor ocorrem sucessivos processos de divisão binária. Assim, os parasitos migram para a porção posterior do intestino, chegando até o reto. Há um intenso processo de adesão desses parasitos às membranas das perimicrovilosidades das células intestinais (ALVES et al., 2007), que envolve a participação de glicoconjugados e proteínas presentes nestas vilosidades como por exemplo, glicoinositolfosfatidillipídeos (GPIs), induzindo a diferenciação das formas epimastigotas em tripomastigota metacíclicas, que são infectivas para a espécie mamífera (ALVES et al., 2007; NOGUEIRA et al., 2007). Esses parasitos, por sua vez, são liberados junto com a fezes e urina do inseto durante o repasto sanguíneo, ocorrendo assim, a infecção no mamífero (GARCIA et al., 2007). Tripomastigotas do T. cruzi podem infectar qualquer célula nucleada. No interior destas células há a diferenciação dos tripomastigotas em amastigotas, que são as formas replicativas neste caso. Após vários estágios de replicação por modo binário, esses parasitos se diferenciam em tripomastigotas capazes de romper a membrana das células. Assim, eles tomam a corrente sanguínea, infectam outras células e podem ser ingeridos, novamente, por insetos triatomíneos hematófagos no momento do repasto sanguíneo (BRENER et al., 2000; JUNQUEIRA et al. 2010; BUSCAGLIA et al. 2006). O ciclo de vida do Trypanosoma cruzi pode ser observado na figura 3.
Figura 3: Ciclo de vida do protozoário flagelado Trypanosoma cruzi
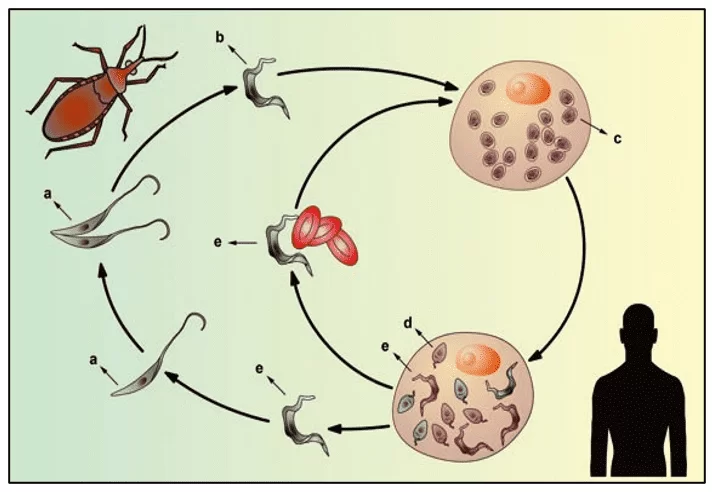
O Trypanosoma cruzi apresenta um complexo ciclo de vida em ambos hospedeiros vertebrados e invertebrados, envolvendo alterações dramáticas em sua forma celular, passando por vários estágios de desenvolvimento que são conhecidos como amastigota, epimastigota e tripomastigota, sendo que nos primeiros dois estágios eles são capazes de se dividir dentro e fora das células hospedeiras. Os tripomastigotas e amastigotas são capazes de infectar células, onde se multiplicam, amplificando o número de parasitos, e liberando milhões de tripomastigotas infecciosos nos espaços intercelulares (RODRIGUES et al., 2014).
A infecção por Trypanosoma cruzi provoca uma série de reações do sistema imune que visam controlar a disseminação e multiplicação do parasito. A resposta imune contra T. cruzi ocorre em três fases, que se compreendem desde antes que seja possível detectar níveis de parasitemia, mas com forte resposta por parte da imunidade inata e seus mediadores inflamatórios, até a parada da elevação da parasitemia, com surgimento de uma resposta imune específica, que se evolui até a fase crônica, sendo possível observar uma forte sorologia positiva e memória imunológica (HOFFLIN et al., 1987; GRAUERT et al., 1993). Do mesmo modo que ocorre na maioria das infecções por patógenos intracelulares, o T. cruzi induz diversos mecanismos do sistema imune, provocando a ativação de mediadores envolvidos tanto na resposta imune inata, quanto na resposta imune adquirida. Assim, há um intenso combate por parte do organismo hospedeiro mamífero para que a proliferação dos parasitos seja eliminada. Esse conjunto de resposta do sistema imune associada a persistência indefinida do parasito, acaba gerando uma série de lesões teciduais que, por sua vez, induz a comprometimentos funcionais, principalmente, nos tecidos musculares e nervosos, que são tipicamente acometidos durante Doença de Chagas (CUERVO et al., 2011).
4. O PAPEL DA IMUNIDADE INATA DURANTE A INFECÇÃO POR T. CRUZI
Em relação ao papel da imunidade inata no combate a infecção pelo T.cruzi, podemos destacar como principais mecanismos a ativação da via alternativa do complemento, por meio da formação da estrutura da C3 convertase (Tambourgi et al., 1993); da via mediada pela proteína ligante de manose e pelo receptor de manose, a qual tem maior eficácia sobre os amastigotas, que possuem capacidade de se ligar à manose sérica (KAHN et al., 1995); a ativação das células NK, com consequente secreção de IFN-γ, que estimula macrófagos a produzirem óxido nítrico, pela indução da expressão da enzima óxido nítrico sintase (SCOTT e TRINCHIERI, 1995); pela ativação de macrófagos com consequente produção de IL-12, e TNF-α que, também, estimula células NK a produzirem IFN-γ (ALIBERTI et al., 1996; GAZZINELLI et al., 1992; SANTOS LIMA et al., 1997). Outras citocinas como IL-17, IL-10 e TGF-β parecem agir como papel regulatório no decorrer da infecção. Estas duas últimas são produzidas por macrófagos e exibem um importante papel na infecção por T. cruzi, inibindo, in vitro, a produção de NO e a atividade tripanocida de macrófagos infectados e ativados por IFN-γ (GAZZINELLI et al., 1992; ROFFÊ et al., 2012; MIYAZAKI et al., 2010).
5. O PAPEL DA IMUNIDADE ADQUIRIDA DURANTE A INFECÇÃO POR T. CRUZI
Em relação a imunidade adquirida, podemos citar o importante papel que a resposta imune humoral representa na Doença de Chagas, por meio de uma intensa e diversificada ativação de linfócitos B, com elevada produção de imunoglobulinas, que se relaciona com a queda da parasitemia (NORRIS et al., 1994). A este tipo de resposta se destacam os isotipos IgG1, IgG2a e IgG2b, que são anticorpos envolvidos na eliminação de formas sanguíneas do parasita. Outros tipos de anticorpos estudados são os anticorpos líticos, que se associam a um estado de proteção do hospedeiro, reagindo com formas vivas do parasita, induzindo neles a lise pelo complemento (KRETTLI & BRENER, 1982). O nível destes anticorpos decai muito em animais na fase crônica da doença, estágio em que se observa uma perda na atividade da resposta imune tipo Th1, com uma substituição para a atividade Th2, conferindo menos efetividade no combate à infecção (ZHANG & TARLETON, 1996; KUMAR & TARLETON, 2001; KUMAR & TARLETON, 1998).
6. DESAFIOS NA ELUCIDAÇÃO DOS FATORES QUE NORTEIAM A INTERAÇÃO PARASITO-HOSPEDEIRO
Um dos mais importantes desafios para se compreender os mecanismos pelos quais se estabelece a Doença de Chagas seria, justamente, no estudo dos fatores envolvidos na interação parasito-hospedeiro. Ao se estudar a interação parasito-hospedeiro durante a infecção por T. cruzi, deve-se levar em consideração que sua população diverge muito nos aspectos bioquímicos, de virulência e de patogênese (YOSHIDA, 2006; ESPINOZA et al., 2010; REVOLLO et al., 1998), e que são geradas diferentes tipos de respostas durante as fases da doença, dados os diferentes backgrounds dos hospedeiros que são estudados tanto na infecção experimental, quanto na infecção humana (MILES et al.,1981; HIGUCHI M.D.E et al., 2003). Estudar a interação do parasito com a célula hospedeira pode ajudar a elucidar questões acerca de reconhecimento, invasão, estabelecimento do ciclo intracelular no hospedeiro, e principalmente, saber sobre fatores que viabilizam a replicação dos amastigotas e das mudanças que ocorrem na célula hospedeira durante este estágio da infecção (ALVES & MORTARA, 2009; SCHETTINO et al., 1995)
A maioria dos mecanismos que o T. cruzi utiliza para evadir a defesa do organismo do mamífero se estabelece a partir de sua interação com proteínas do próprio hospedeiro, permitindo, desta forma, a sua sobrevivência. Esse processo de interação envolve constante renovação de proteínas presentes na superfície do parasito, da grande variabilidade de seus antígenos, da liberação de imunocomplexos ligados à sua membrana pela clivagem de glicoproteínas ancoradas por glicosilfosfatidilinositol (GPI) e da sua resistência ao sistema complemento. Desta forma, o parasito pode se livrar de uma série de processos de defesa do organismo hospedeiro, inclusive aqueles que envolvem sua opsonização mediada por anticorpos (para revisão, veja OUAISSI et al., 2005 e DOS REIS, 2011).
Já foi documentado que três glicoproteínas presentes na membrana do parasito participam e previnem eficientemente a ativação do complemento sobre sua superfície, como por exemplo gp160, gp58/68 e T-DAF. Estas proteínas possuem a capacidade de interagir com as proteínas do sistema complemento, induzindo e acelerando o decaimento da proteína C3 convertase, que é a principal proteína da cascata do complemento. Exemplos destas interações envolvendo a via complemento podem ser observados pela interação que as proteínas gp160 estabelecem com as proteínas C3b e C4b, interferindo na formação das C3 convertases das vias clássica e alternativa, e também na interação que as proteínas gp58/68 estabelecem com o fator B, induzindo a inibição da proteína C3 convertase da via alternativa (KIPNIS et al., 1985; KIPNIS et al., 1987; NORRIS & SCHRIMPF, 1994; NORRIS, 1998; ANSA-ADDO & INAL, 2010; LIDA K., et al., 1989). Apesar de induzir, fortemente, o sistema complemento, as formas amastigotas de T. cruzi conseguem evadir deste pela expressão, em sua superfície, de uma proteína que se liga ao complexo C5b-9, o que interfere no estabelecimento de poros funcionais na membrana do parasito (IIDA et al., 1989).
Dada a importância da expressão destas proteínas de superfície no processo de evasão do hospedeiro em relação à resposta imune é que vários pesquisadores têm tentado entender o papel destas proteínas na viabilidade do parasito durante seu estágio no hospedeiro mamífero.
Já foram descritas algumas proteínas de superfície que são encontradas nas formas tripomastigotas ou amastigotas e que compartilham algumas semelhanças entre si: são frequentemente expressas na membrana do parasito, onde são, na maioria das vezes ancoradas por âncoras de GPI, contendo ainda uma porção glicídica, que na maioria das vezes é responsável pela grande produção de anticorpos gerados pelo sistema imune do hospedeiro, localizando-se voltadas para o citoplasma da célula hospedeira. Dentre estas proteínas podemos citar as mucinas, as proteínas associadas a mucinas (MASPs), a protease gp63 (glicoproteína 63 kDa), DGF-1 (dispersed gene family-1), as trans-sialidases, proteínas presentes em Tripomastigotas ricas em Alanina,Serinas e Valinas (TASVs), as ASP-1 e ASP-2, SSP4 e SA-85, que pertencem à família das trans-sialidases (FRASCH A.C., 2000; YOSHIDA et al., 1989; ACOSTA-SERRANO et al., 2001; BARTHOLOMEU et al., 2009; PARODI et al., 1992; COLLI W., 1993; FRASCH A.C., 2000; GARCÍA et al., 2010; SANTOS et al., 1997; LOW e TARLETON, 1997; KAHN et al., 1990, 1991; ANDREWS et al., 1988; OLIVAS-RUBIO et al., 2009; SIBLEY, 2011).
Estudos envolvendo a proteínas gp63 mostraram que ela participa da clivagem de macromoléculas do hospedeiro, gerando, dessa forma, nutrientes para o parasito. O seu envolvimento no processo de invasão das células do hospedeiro foi demonstrado em trabalhos que utilizaram anticorpos anti-gp63, provocando, assim, uma redução parcial da capacidade dos tripomastigotas em invadir as células do hospedeiro (KULKARNI et al., 2009; CUEVAS et al, 2003; YAO et al., 2003). Por outro lado, foi demonstrado que a proteína DGF-1 exerce um papel importante no mecanismo de invasão das células do hospedeiro, atuando em processos de adesão celular. Foi verificado que esta proteína também possui alta similaridade estrutural com a proteína integrina humana β7, o que justificaria sua capacidade de mediar a adesão celular (KAWASHITA et al., 2009). As mucinas, que tem um papel crucial no recebimento de ácido siálico vindo do hospedeiro, contribuem para que, por meio do estabelecimento de carga negativa na porção exterior da membrana do parasito e consequente indução do aumento do fluxo de cálcio, haja reconhecimento, invasão celular e proteção de tripomastigotas sanguíneos. (ACOSTA-SERRANO et al., 2001; BUSCAGLIA et al., 2006). Além do mais, peptídeos oriundos destas proteínas se mostram fortes indutores na resposta imune do hospedeiro (DOS SANTOS et al., 2012). Semelhantemente às mucinas, alguns membros da família das trans-sialidases também possui membros que atuam na captação de ácido siálico da membrana da célula hospedeira (CROSS E TAKLE, 1993; SCHENKMAN et al., 1994; FREITAS et al., 2011). Além deste papel na retirada de ácido siálico da superfície da célula do hospedeiro, as trans-sialidases se mostraram capazes de serem fosforiladas em experimentos in vitro, o que poderia indicar a sua função na transdução de sinal uma vez fosforilada por quinases presentes no hospedeiro (BAO et al., 2010).
Estudar as proteínas de superfície da forma amastigota seria muito importante para a compreensão da interação parasito-hospedeiro, pois esta é a forma replicativa dentro do hospedeiro, sendo responsável pela progressão clínica da doença (DE SOUZA et al., 2010; SIBLEY L.D., 2011). A identificação destas proteínas, poderia ajudar a elucidar os mecanismos que regem a interação com o hospedeiro, apontando alvos para a formulação de vacinas e novos tratamentos (DAROCHA et al., 2004; EICKHOFF et al., 2004). Um exemplo claro destas proteínas como alvos da resposta imune são as proteínas ASP-1 e ASP-2, que são reconhecidas por linfócitos T CD8+ e ativam resposta imune citotóxica (Santos et al., 1997; LOW E TARLETON, 1997; NOGUEIRA et al., 2011); e SA-85 e SSP4, que foram reconhecidas por anticorpos produzidos contra formas amastigotas (ANDREWS et al., 1988; Kahn et al., 1990 e 1991; OLIVAS-RUBIO et al., 2009).
Analisando genes que eram diferencialmente expressos em uma biblioteca de cDNA das formas amastigotas de T. cruzi, Teixeira e colaboradores (1994) identificaram uma família de glicoproteínas intimamente relacionadas, localizadas na superfície da forma amastigota de T. cruzi, às amastinas. Sua estrutura secundária contém quatro domínios hidrofóbicos, indicando que esta proteína pode se localizar na membrana externa do parasito, apontando que ela possa exercer um papel importante na interação entre amastigotas as proteínas presentes no citoplasma das células do hospedeiro (TEIXEIRA et al., 1995).
Atualmente já se compreende muito bem acerca de como as amastinas são organizadas, os níveis de expressão de mRNA destas proteínas e onde se localizam. Cada vez mais se têm levantado estudos que buscam entender a função destas proteínas. Estudos que envolveram a super-expressão das delta amastinas na cepa G de T. cruzi, uma cepa de baixa virulência, e que expressava níveis muito baixos destas proteínas, apontaram um aumento na taxa de metaciclogênese, diferenciação em tripomastigota de cultura e aparecimento precoce e em altos níveis de ninhos de amastigotas em tecido de fígado de camundongos infectados com estes parasitos (KANGUSSU-MARCOLINO et al., 2013). Isso mostra que estas proteínas exercem papel importante na viabilidade do parasito tanto no hospedeiro vertebrado quanto no hospedeiro invertebrado.
Experimentos evolvendo o knockdown de delta amastinas em L. braziliensis, revelaram uma menor interação da forma amastigota do parasito com a membrana do vacúolo parasitóforo, possivelmente causada pela baixa interação das amastinas de Leishmania com as claudinas humanas, que são pequenas proteínas transmembranares de 20-27 kDa, muito importantes no estabelecimento das junções celulares e da formação da barreira paracelular, controlando o fluxo de moléculas no espaço intercelular entre as células de um epitélio (FURUSE et al., 1998). Além da baixa interação com a membrana do vacúolo parasitóforo, o silenciamento das amastinas em Leishmania causou direta redução na viabilidade do parasito, mostrando, assim, que as amastinas podem exercer um papel na mediação da ligação do parasito com proteínas presentes na membrana do vacúolo ou até mesmo exercer função de sinalização nos parasitos, se relacionando com sua viabilidade (DE PAIVA RMC et al.,2015).
Atualmente existem vários métodos pelos quais se pode estudar a interação entre proteínas e, consequentemente, elucidar o seu papel, que no caso das amastinas, possivelmente seria no estabelecimento da infecção pelo T. cruzi. Esses métodos podem ser classificados em três grupos: in vitro, como por exemplo: purificação por cromatografia de afinidade seguida de espectrometria de massa, que envolve a marcação de proteína de interesse, com etapas de purificação e análise espectroscópicas; co-imunoprecipitação, que testa interações entre complexos de proteínas, baseando em suas formas nativas, utilizando extrato celular total; cristalografia de raios-X, que permite visualização das estruturas das proteínas a nível atômico, aumentando a compreensão da interação entre proteínas e sua função; e espectroscopia de ressonância magnética, que também permite detectar interações entre proteínas, mesmo que esses sejam muito fracas. Em relação aos métodos in vivo, podemos citar a técnica do duplo-híbrido de leveduras, que normalmente utiliza dois híbridos de levedura, para detecção de possíveis interações entre proteína em meio biológico (YOUNG et al., 1998; JOUNG et al., 2000; HURT et al., 2003; BROWN H.F et al, 2011; KEEGAN et al., 1986; MA J. & PTASHNE, 1987; ITO T. et al., 2001).
Em relação às metodologias in silico, como exemplo, temos: a abordagem de sequência baseada em ortólogo, que se baseia na natureza homóloga de proteínas anotadas usando um algoritmo de pareamento local das sequências; a abordagem de sequência baseada em pareamento e domínios, que prevê interações de proteínas domínio-domínio; a abordagem baseada na estrutura, que prevê interações proteína-proteína, levando em consideração suas estruturas primárias, secundárias e terciárias; a abordagem do gene neighborhood, que observa se o gene analisado é conservado em vários genomas, tendo, assim, uma potencial possibilidade de ligação funcional entre as proteínas codificadas por esses genes relacionados; a fusão gênica, que às vezes é chamado como método Rosetta, que se baseia no conceito de que algumas proteínas de apenas um único domínio possa ser fusionadas com proteínas de outros organismos, formando um multi domínio e a árvore filogenética, que prevê a interação proteína-proteína com base na história evolutiva da proteína (RAO et al., 2014).
7. CONCLUSÃO
A infecção por Trypanosoma cruzi induz fortes mudanças no organismo do hospedeiro por diversas vias, especialmente envolvendo mediadores da resposta imune. Vale ressaltar que as interações entre as células do hospedeiro com o parasito desencadearão diversas cascatas de sinalização molecular na célula hospedeira as quais dependerão do tipo celular em particular, e da estirpe de T. cruzi envolvida na infecção.
Outro nível de complexidade da infecção é acrescentado pelo fato de que a manutenção da saúde requer um bom equilíbrio entre uma resposta imune ativada que leva ao controle de parasitas e uma resposta reguladora que evita danos nos tecidos. Abordagens integradas que combinem estudos de fatores parasitários e de fatores do hospedeiro, a partir de pontos de vista clínicos, genéticos e moleculares, serão certamente essenciais para compreender os efeitos da fase aguda no desenvolvimento da doença.
Além disso, a descoberta de biomarcadores celulares, genéticos, e clínicos da progressão e gravidade da doença é um aspecto crítico para orientar novas práticas médicas no sentido da prevenção da patologia. Além disso, a identificação de biomarcadores da eficácia do tratamento é outro aspecto crítico na gestão de pacientes chagásicos. A identificação de biomarcadores confiáveis é, portanto, uma necessidade urgente na Doença de Chagas. Mais do que nunca, são necessários esforços cooperativos entre cientistas de diferentes especialidades e acesso à tecnologia moderna para combater a Doença de Chagas.
REFERÊNCIAS
ACOSTA-SERRANO A., et al. (2001). The mucin-like glycoprotein super-family of Trypanosoma cruzi: structure and biological roles. Molecular and Biochemical parasitology. 114: 143-150.
ALVES C.R., et al. (2007). Trypanosoma cruzi: attachment to perimicrovillar membrane glycoproteins of Rhodnius prolixus. Exp Parasitol.116: 44–52.
ALVES M.J., MORTARA R.A. A century of research: what have we learned about the interaction of Trypanosoma cruzi with host cells? (2009). Mem Inst Oswaldo Cruz. 104 Suppl 1:76-88
ANDREWS N.W., et al. (1988). Developmentally regulated, phospholipase C-mediated release of the major surface glycoprotein of amastigotes of Trypanosoma cruzi. Journal of Experimental Medicine. 167: 300-314.
ANDREWS N.W., et al. (1987). Stage-specific surface antigens expressed during the morphogenesis of vertebrate forms of Trypanosoma cruzi. Exp Parasitol 64: 474-484.
ANDREWS N.W., et al. (1987). Stage-specific surface antigens expressed during the morphogenesis of vertebrate forms of Trypanosoma cruzi. Exp Parasitol 64: 474-484.
ANDREWS, N. W., et al. Stage-specific surface antigens during the morphogenesis of Trypanosoma cruzi: developmentally regulated expression of a glycosyl-phosphatidylinositol anchored glycoprotein of amastigotes. (1988). Memórias do Instuto Oswaldo Cruz. v. 83 Suppl 1, p. 561-562.
ANSA-ADDO EPHRAIM, JAMEEL INAL. Plasma membrane-derived vesicles (PMVs) carry TGF-β and promote adhesion and differentiation of THP-1 monocytes to macrophages (35.15). J Immunol April 1, 2010, 184 (1 Supplement) 35.15.
BAO Y., et al. (2010). Protein kinase A catalytic subunit interacts and phosphorylates members of trans-sialidase super-family in Trypanosoma cruzi. Microbes and Infection. 12: 716-726.
BARTHOLOMEU D.C., et al. (2009). Genomic organization and expression profile of the mucin-associated surface protein (masp) family of the human pathogen Trypanosoma cruzi. Nucleic Acids Res 37: 3407–3417.
BENCHIMOL BARBOSA P.R. (2006). The oral transmission of Chagas’ disease: na acute form of infection responsible for regional outbreaks. Int J Cardiol 112: 132-133.
BOSCARDIN S..B., et al. Chagas’ disease: an update on immune mechanisms and therapeutic strategies. (2010). J. Cell Mol. Med.14(6B):1373–1384.
BRENER Z, et al. (2000) Trypanosoma cruzi e Doença de Chagas. (2000) 2. ed. Rio de Janeiro, Guanabara Koogan. 431p.
BRENER, Z. (1973). Biology of Trypanosoma cruzi. Annu Rev Microbiol, 27: 347-382.
BROWN H.F., et al (2011). A densely overlapping gene fragmentation approach improves yeast two-hybrid screens for Plasmodium falciparum proteins. Mol Biochem Parasitol. 178:56–59.
BUSCAGLIA C. A., et al. (2006). Trypanosoma cruzi surface mucins: host-dependent coat diversity. Nat. Rev. Microbiol. 4(3)229–236.
BUSCAGLIA C.A., et al. (2004) The surface coat of the mammal-dwelling infective trypomastigote stage of Trypanosoma cruzi is formed by highly diverse immunogenic mucins. J Biol Chem. 279:15860-15869.
BUSCAGLIA, C. A. et al. Trypanosoma cruzi surface mucins: host-dependent coat diversity. (2006). Nat. Rev. Microbiology, v.4, n.3, p.229-236.
CANÇADO J.R. (1999). Tratamento etiológico da doença de Chagas pelo benznidazole. In Z Brener & Z Andrade (eds), Trypanosoma cruzi e Doença de Chagas, 2ª edição, Guanabara Koogan, Rio de Janeiro (in press).
CASTRO D.P., et al. (2007). Trypanosoma cruzi: ultrastructural studies of adhesion, lysis and biofilm formation by Serratia marcescens. Exp Parasitol.117:201–207.
CHAGAS. 2 ed. Rio de Janeiro (1909): Guanabara Koogan.
COLLI W. (1993). Trans-sialidase: a unique enzyme activity discovered in the protozoan Trypanosoma cruzi. FASEB Journal. 7: 1257-1264.
CROSS, G. A.; TAKLE, G. B. (1993). The surface trans-sialidase family of Trypanosoma cruzi. Annu Rev. Microbiol. v. 47, p. 385-411.
CUERVO H., et al. Myeloid-derived suppressor cells infiltrate the heart in acute Trypanosoma cruzi infection. J Immunol. 2011;187:2656–65
CUEVAS I.C., et al. (2003) Gp63 homologues in Trypanosoma cruzi: surface antigens with metalloprotease activity and a possible role in host cell infection. Infect Immun 71:5739–5749
DAROCHA W.D., et al. (2004). Tests of cytoplasmic RNA interference (RNAi) and construction of a tetracycline-inducible T7 promoter system in Trypanosoma cruzi. Molecular and Biochemical Parasitology. 133: 175-186.
DOS REIS G.A. (2011). Evasion of immune responses by Trypanosoma cruzi, the etiological agent of Chagas disease. Braz. J. Biol. Res. 44(2): 84-90.
EICKHOFF C.S., et al. (2011). Co-administration of a plasmid DNA encoding IL-15 improves long-term protection of a genetic vaccine against Trypanosoma cruzi. PLoS Negl Trop Dis. 5(3): e983.
ESPINOZA B., et al. (2010). Mexican Trypanosoma cruzi T. cruzi I strains with different degrees of virulence induce diverse humoral and cellular immune responses in a murine experimental infection mode. J Biomed Biotechnol.
FRASCH A.C.C. (2000). Functional diversity in the Trans-sialidase and mucin families in Trypanosoma cruzi. Parasitology today. 16(7): 282-286.
FREITAS L. M., et al. (2011) Genomic analyses, gene expression and antigenic profile of the trans-sialidase superfamily of Trypanosoma cruzi reveal an undetected level of complexity. PLoS ONE. 6(10).
FURUSE M., et al. (1998) Claudin-1 and -2: novel integral membrane proteins localizing at tight junctions with no sequence similarity to occludin. J Cell Biol. 141: 1539–1550.
GARCÍA E.A., et al. (2010). TcTASV: A Novel Protein Family in Trypanosoma cruzi Identified from a Subtractive Trypomastigote cDNA Library. PLOS Negl Trop Dis. 5;4(10).pii: e841.
GARCIA E. S., et al. (2007). Exploring the role of insect host factors in the dynamics of Trypanosoma cruzi-Rhodnius prolixus interactions. Journal of Insect Physiology. 53(1):11–21.
GAZZINELLI R.T., et al. 1992. Simultaneous depletion of CD4+ and CD8+ T lymphocytes in required to reactive chronic infection with Toxoplasma gondii. J Immunol 149: 175-180
GRAUERT, M. R.; et al. Trypanosoma cruzi infection enhances polyreactivity antibody response in an acute case of human Chagas’ disease. Clinical and Experimental Immunology 93:85-92, 1983.
GÜRTLER R.E., et al. (2003) Congenital transmission of Trypanosoma cruzi infection in Argentina. Emerg Infect Dis. 9: 29-32.
HIGUCHI M.D.E L., et al. (2003). Pathophysiology of the heart in Chagas’ disease: current status and new developments. Cardiovascular Research. 60(1):96–107.
HURT J., et al (2003). “Highly specific zinc finger proteins obtained by directed domain shuffling and cell based selection”. Proceedings of the National Academy of Sciences of the United States of America, Washington. v. 100, n. 21, p. 12271- 12276.
IIDA H., et al . 1990. Essential role for induced Ca2+ influx followed by [Ca2+] rise in maintaining viability of yeast cells late in the mating pheromone response pathway. J Biol Chem 265: 13391– 13399.
ITO T., et al. “A comprehensive two-hybrid analysis to explore the yeast protein interactome.” (2001). Proceedings of the National Academy of Sciences of the United States of America. 98:4569–4574.
JUNQUEIRA C., et al . The endless race between Trypanosoma cruzi and host immunity: lessons for and beyond Chagas disease. Expert Rev Mol Med. 2010 Sep 15;12:e29.
JOUNG J., et al. (2000). “A bacterial two-hybrid selection system for studying protein-DNA and protein-protein interactions”. Proceedings of the National Academy of Sciences of the United States of America, Washington. V. 97, n. 13, p. 7382-7387.
LIDA K., et al. (1989). Amastigotes of Trypanosoma cruzi escape destruction by the terminal complement components. J Exp Med. 169:881–891.
LOW H.P., TARLETON R.L. (1997). Molecular cloning of the gene encoding the 83 kDa amastigote surface protein and its identification as a member of the Trypanosoma cruzi sialidase superfamily. Molecular and Biochemical Parasitology. 88: 137-149
HOFFLIN, J. M.; et al. Laboratory-acquired Chagas disease. Transactions of the Royal Society of Tropical Medicine & Hygiene 81:437-440, 1987.
KAHN S., et al. (1991). The major 85-kDa surface antigen of the mammalian-stage forms of Trypanosoma cruzi is a family of sialidases. Proc. Natl. Acad. Sci. 88: 4481-4485.
KAHN S., et al. (1990). The major 85-kD surface antigen of the mammalian form of Trypanosoma cruzi is encoded by a large heterogeneous family of simultaneously expressed genes. Journal of Experimental Medicine. 17: 589-597.
KANGUSSU-MARCOLINO M. M., et al. (2013). Distinct genomic organization, mRNA expression and cellular localization of members of two amastin sub-families present in Trypanosoma cruzi. BMC Microbiology. 17;13:10.
KAWASHITA, S. Y. et al. (2009). Homology, paralogy and function of DGF-1, a highly dispersed Trypanosoma cruzi specific gene family and its implications for information entropy of its encoded proteins. Molecular and Biochemical Parasitology. v. 165, p. 19-31.
KEEGAN L., et al. (1986). Separation of DNA binding from the transcription‐activating function of a eukaryotic regulatory protein. Science. 231, 699–704.
KIPNIS T. L., et al. (1985). Transformation of trypomastigote forms of Trypanosoma cruzi into activators of alternative complement pathway by immune IgG fragments. Scan. J. Immunol. 22(2): 217-226.
KIPNIS T. L., et al. (1986). Effect of membrane components on the formation of the classical path C3 convertase. Brazilian Journal of Medical and Biological Research. v. 19, p. 271-278.
KRETTLI A.U., BRENER Z. Resistance against Trypanosoma cruzi associated to anti-living trypomastigote antibodies. J Immunol. 1982 May;128(5):2009-12. PMID: 6801127.
KULKARNI MM, et al. (2009) Trypanosoma cruzi gp63 proteins undergo stage-specific differential posttranslational modification and are important for host cell infection. Infect Immun 77:2193–2200.
KUMAR S. TARLETON R.L. The relative contribution of antibody production and CD8+ T cell function to immune control of Trypanosoma cruzi. Parasite Immunol. 1998; 20: 207-216
KUMAR S, TARLETON R.L. (2001). Antigen-specific Th1 but not Th2 cells provide protection from lethal Trypanosoma cruzi infection in mice. Journal of Immunology, v. 166,n. 7, p. 4596-4603.
MA J., PTASHNE M. (1987). Detection analysis of GAL4 defines two transcriptional activating segments. Cell, Cambridge. v. 48, p. 847-853.
MILES M.A., et al. (1981). Do radically dissimilar Trypanosoma cruzi strains (zymodemes) cause Venezuelan and Brazilian forms of Chagas’ disease? Lancet (London, England). 1:1338–1340.
MIYAZAKI Y. et al. (2010). IL-17 Is Necessary for Host Protection Against Acute-Phase Trypanosoma Cruzi Infection. J. Immunol. 185 (2), 1150–1157.
MINISTÉRIO DA SAÚDE, GOVERNO FEDERAL. Doença de Chagas. Disponível em http://portalms.saude.gov.br/saude-de-a-z/doenca-de-chagas, último acesso em 17 de junho de 2022.
NORRIS K.A., et al. 1994. Humoral immune response to the Trypanosoma cruzi complement regulatory protein as an indicator of parasitologic clearance in human Chagas’ disease. Infect Immun 62: 4072-4074.
OLIVAS-RUBIO M., et al. (2009). cDNA cloning and partial characterization of amastigote specific surface protein from Trypanosoma cruzi. Infect Genet and Evol. 9: 1083-1091.
OUAISSI, A.; OUAISSI M. (2005). Molecular basis of Trypanosoma cruzi and Leishmania interaction with their host(s): exploitation of immune and defense mechanisms by the parasite leading to persistence and chronicity, features reminiscent of immune system evasion strategies in cancer diseases. Arch Immunol Ther Exp., 53: 102- 114.
PAIVA R.M.C. et al. (2015). Amastin knockdown in Leishmania braziliensis affects parasite-macrophage interaction and results in impaired viability of intracellular amastigotes. PLoS Pathog. 7;11(12):e1005296.
PARODI A. J., et al. (1992). Identification of the gene(s) coding for the trans-sialidase of Trypanosoma cruzi. The EMBO Journal. 11(5): 1705-1710.
RAO V. V. H. G., GOSAVI S . In the Multi-domain Protein Adenylate Kinase, Domain Insertion Facilitates Cooperative Folding while Accommodating Function at Domain Interfaces. Published: November 13, 2014. Plos Comp Bio.
REVOLLO S., et al. (1998). Trypanosoma cruzi: impact of clonal evolution of the parasite on its biological and medical properties. Exp.Parasitol. 89: 30–39.
RODRIGUES J.C., et al. (2014). Biology of human pathogenic try-panosomatids: epidemiology, life cycle and ultrastructure. Subcell Biochem. 74:1–42.
SANTOS M.A.M., et al. (1997). The identification and molecular characterization of Trypanosoma cruzi amastigote surface protein-1, a member of the trans-sialidase gene super-family. Molecular and Biochemical Parasitology. 86: 1-11.
SANTOS S. et al. (2012). The MASP family of Trypanosoma cruzi: changes in gene expression and antigenic profile during the acute phase of experimental infection. PLOS Negl. Trop. Dis. 6:e1779.
SCHETTINO P.M., et al. (1995). Regulatory effect of the level of free Ca2+ of the host cell on the capacity of Trypanosoma cruzi to invade and multiply intracellularly. The Journal of Parasitology. 81:597–602.
TRINCHIERI G, SCOTT P. Interleukin-12: a proinflammatory cytokine with immunoregulatory functions. Res. Immunol. 1995;146:423–431
SIBLEY L. D. (2011). Invasion and intracellular survival by protozoan parasites. Immunol Ver. 240: 72-91
STUART K., et al. (2008) Kinetoplastids: related protozoan pathogens, different diseases. Clin Invest. 118:1301-1310.
TARLETON, R. L. et al. (2007). The challenges of Chagas Disease– grim outlook or glimmer of hope. PLoS Med. 4(12):332.
TARLETON RL, ZHANG L. Chagas disease etiology: autoimmunity or parasite persistence? Parasitol Today. 1999 Mar;15(3):94-9. doi: 10.1016/s0169-4758(99)01398-8. PMID: 10322321.
TEIXEIRA S.M.R., et al. (1995). Pos-transcriptional elements regulating expression of mRNA of the amastin/tuzin gene cluster of Trypanosoma cruzi. J. Biol. Chem. 270(38): 22586-22594.
TEIXEIRA S.M.R., et al. (1994). A differentially expressed gene family encoding “amastin”, a surface protein of Trypanosoma cruzi amastigotes. J. Biol. Chem. 269(32): 20509-20516
WHO (2015). Chagas disease (American trypanosomiasis). World Health Organization. Disponível em: http://www.who.int/chagas/en/
YAO C, et al. (2003) The major surface protease (MSP or GP63) of Leishmania sp. biosynthesis, regulation of expression, and function. Mol Biochem Parasitol 132:1–16
YOSHIDA N. (2006). Molecular basis of mammalian cell invasion by Trypanosoma cruzi. An Acad Bras Cienc. 78:87–111.
YOSHIDA N., et al. (1989). Metacyclic neutralizing effect of monoclonal antibody 10D8 directed to the 35- and 50-kilodalton surface glycoconjugates of Trypanosoma cruzi. Infection and Immunity. 57(6): 1663-1667.
YOUNG C., et al. (2007). Transfusion acquired Trypanosoma cruzi infection. Transfusion 47: 540-544.
Zoonosis y vectores [Zoonosis and vectors]. Instituto de Salud del Estado de México [accessed: 20 June 2022]. Available at: http://salud.edomexico.gob.mx/html/article.php?sid=335.
[1] Mestre em Bioquímica e Imunologia, Especialista em Hematologia e Imuno-hematologia, Especialista em Biomedicina Estética, Graduado em Biomedicina, Graduado em Formação Pedagógica para Graduados Não Licenciados – Biologia e Química. ORCID: 0000-0001-7391-7651.
[2] Doutor em Educação, Mestre em Educação. Especialista em Ensino de Língua Portuguesa. Especialista em Direito Civil. Especialista em Psicopedagogia. Licenciado em Letras. Licenciado em Pedagogia. Bacharel em Direito. ORCID: 0000-0001-9563-1451.
Enviado: Julho, 2022.
Aprovado: Setembro, 2022.


Uma resposta
Olá sou Aparecido Vitorio, graduado em Biologia pela UFSCar. Gosto de ler artigos sobre doenças.
Logo abaixo da figura 1, distribuição da doença vem a seguinte frase:
(a picada do mosquito provocou) mosquito?
Não é pelo barbeiro?
Desculpe se eu estiver sendo ignorante.