ARTIGO DE REVISÃO
MORE, Juan Carlos Roberto Saavedra [1], ALMEIDA, Thamara Venâncio de [2], VERA, Rosângela [3], CASSIMIRO, Priscila Pereira do Nascimento Batista [4], SILVA, Marco Antônio Pereira da [5], NICOLAU, Edmar Soares [6], GEBARA, Clarice [7]
MORE, Juan Carlos Roberto Saavedra. Et al. Benefícios do consumo do kefir. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano 06, Ed. 05, Vol. 06, pp. 22-39. Maio de 2021. ISSN: 2448-0959, Link de acesso: https://www.nucleodoconhecimento.com.br/saude/consumo-do-kefir
RESUMO
O kefir possivelmente é um dos produtos alimentícios probióticos mais antigos do mundo. Diversos estudos têm relatado efeitos benéficos à saúde humana relacionados ao seu consumo. Diante disso, objetivou-se com este trabalho apresentar os principais efeitos benéficos do Kefir à saúde. O Lactobacillus kefiri, normalmente presente na bebida, mostrou forte capacidade de modular a composição da microbiota intestinal, levando a redução de vários gêneros bacterianos diretamente envolvidos no início da resposta pró-inflamatória e doenças gastrointestinais. Diversos autores ressaltaram a atividade antimicrobiana do Kefir sobre patógenos Gram-positivos e Gram-negativos. Estudos sugeriram que o Kefir pode ser considerado alimento promissor em termos de prevenção do câncer e aumento da resistência mucosa a infecções gastrointestinais. No Kefir, a diversa população microbiana possui atividade de β-galactosidase desdobrando a lactose em glicose e galactose, facilitando a sua digestão. Outros benefícios associados ao kefir são relatados na literatura, como controle da glicemia plasmática, efeito anti-hipertensivo, efeito anti-inflamatório, atividade antioxidante, atividade antialérgica e cicatrizante. O Kefir possui uma grande variedade de micro-organismos benéficos e compostos bioativos, sendo considerado um produto com um grande potencial como alimento funcional.
Palavras-chave: alimento funcional, compostos bioativos, probiótico.
1. INTRODUÇÃO
Nos últimos anos tem-se aumentado a demanda por alimentos ricos em nutrientes e com propriedades funcionais que ajudem na prevenção de doenças. Segundo a Portaria n° 398, de 30 de abril de 1999, da Secretaria de Vigilância Sanitária do Ministério da Saúde, alimento funcional é todo aquele alimento ou ingrediente que, além das suas funções nutritivas básicas, quando consumido como parte da dieta usual, produz efeitos metabólicos e/ou fisiológicos benéficos à saúde humana (ANVISA, 1992).
Em 2001, uma consulta de cientistas internacionais que trabalham em nome da Organização das Nações Unidas para Agricultura e Alimentação (FAO) e a Organização Mundial da Saúde (OMS) debateram o campo emergente dos probióticos. Houve uma reformulação da definição de probióticos para “micro-organismos vivos que, quando administrados em quantidades adequadas, conferem um benefício para a saúde do hospedeiro” (FAO, 2001). Esta definição se tornou a versão mais citada e aceita em todo o mundo. Em 2002, um grupo de pesquisadores da FAO e OMS elaborou diretrizes para auxiliar na interpretação do documento original (FAO, 2002). Desde o relatório da consulta de cientistas, a PubMed indexou mais de 8 mil artigos de pesquisa que utilizam o termo probiótico. As evidências científicas e clínicas progrediram rapidamente, assim como o desenvolvimento de uma série de produtos probióticos. Infelizmente, o uso indevido do termo probiótico também se tornou um problema importante, com muitos produtos explorando o termo sem atender aos critérios necessários. Ao mesmo tempo, os produtos probióticos receberam a atenção legítima das autoridades reguladoras com interesse em proteger os consumidores de propagandas enganosas (HILL et al., 2014).
Em geral, aspectos como viabilidade de micro-organismos, administração oral e efeito benéfico demonstrado na saúde após o consumo são critérios permanentes na maioria das definições que foram propostas para probióticos. Embora não seja explicitamente contemplado, a definição implica que os probióticos mantenham ativamente sua capacidade benéfica quando atingem os locais onde interagem com o hospedeiro e que expliquem seus mecanismos de ação. A viabilidade dos probióticos deve ser mantida ao longo da vida de prateleira do produto em que são administrados, que deve conter a quantidade de micro-organismos necessários para proporcionar o benefício (GUARNER et al., 2010).
Os micro-organismos devem estar vivos, porém não é mencionado a quantidade específica dos mesmos. Autores como Ouwehand et al. (2002) recomendam que pelo menos quantidades de 109 UFC precisam ser ingeridas por dia. Tharmaraj e Shah (2003) informam que os alimentos com propriedades probióticas devem conter um número mínimo de população microbiana, sendo estimada em 106 UFC/g do produto para obtenção de efeitos benéficos e colonização do intestino. Outros pesquisadores determinaram que a ingestão desses micro-organismos em quantidades de 108 e 109 UFC/dia devem ser suficientes para que os mesmos apresentem os diferentes efeitos benéficos para quem os consome consumidor (CHAMPAGNE et al., 2011).
A Agencia de Inspeção de Alimentos Canadense aceitou algumas espécies de bactérias como probióticos, quando administradas em alimentos em quantidades de 109 UFC por porção. Estas espécies são Bifidobacterium adolescentis, Bifidobacterium animalis subsp. Animalis, Bifidobacterium animalis subsp. lactis, Bifidobacterium bifidum, Bifidobacterium breve, Bifidobacterium longum subsp. infantis, Bifidobacterium longum subsp. longum, Lactobacillus acidophilus, Lactobacillus casei, Lactobacillus fermentum, Lactobacillus gasseri, Lactobacillus johnsonii, Lactobacillus paracasei, Lactobacillus plantarum, Lactobacillus rhamnosus e Lactobacillus salivarius (CANADA, 2017).
O Kefir é considerado uma bebida com muitos benefícios à saúde e possivelmente é um dos produtos alimentícios probióticos mais antigos do mundo. De acordo com a FAO, os grãos de Kefir são constituídos por bactérias dos gêneros Lactobacillus spp., Leuconostoc spp., Lactococcus spp. e Acetobacter spp., leveduras fermentadoras de lactose (Kluyveromyces marxianus, Kluyveromyces lactis e Torula Kefir) e leveduras não fermentadoras de lactose (Saccharomyces unisporus, Saccharomyces cerevisiae e Saccharomyces exiguus). Esses micro-organismos são responsáveis pela fermentação ácido láctica, ácido acética e ácido alcoólica do leite, produzindo um leite fermentado com propriedades únicas (CODEX, 2011).
No Brasil, a Instrução Normativa nº 46 de 2007, do Ministério da Agricultura Pecuária e Abastecimento, estabelece os padrões de identidade e qualidade dos leites fermentados. A contagem de bactérias láticas totais do Kefir deve ser de no mínimo 107 UFC/g e de leveduras no mínimo 104 UFC/g, durante seu período de validade (BRASIL, 2007).
O Kefir é uma fonte provável de probióticos de interesse, tal fato coloca este produto alimentar na categoria de alimento funcional. Diversos estudos têm relatado efeitos benéficos à saúde humana relacionados ao seu consumo, como propriedades antimicrobiana, anti-inflamatória, cicatrizante, hipocolesterolêmica, anticarcinogênica, regulação do trato gastrointestinal, estimulação do sistema imune, entre outras. Diante disso, objetivou-se com este trabalho apresentar os principais efeitos benéficos do Kefir à saúde.
2. REVISÃO DE LITERATURA
O Kefir é um produto de leite fermentado originário do Cáucaso, cuja denominação é derivada da palavra keyif na língua turca, que significa “bom sentimento”, se referindo ao sentimento vivenciado após bebê-lo. Trata-se de uma bebida fermentada ácida, levemente alcoólica, viscosa e ligeiramente gaseificada. É produzido tradicionalmente utilizando-se grãos de Kefir, que possuem uma coloração branca amarelada em formato de couve-flor, com 0,3 a 3,5 cm de diâmetro (LEITE et al., 2015).
Historicamente, o Kefir foi recomendado para o tratamento de várias condições clínicas, como problemas gastrointestinais, hipertensão, alergias e doenças isquêmicas do coração entre outros benefícios. No entanto, a variabilidade inerente às condições de produção de Kefir em diferentes ensaios torna difícil fazer comparações entre os resultados científicos relatados. Muitas pesquisas feitas com diferentes tipos de fermentações dos grãos de Kefir, utilizando diferentes substratos, confirmando a presença de uma grande variedade de compostos bioativos, como ácidos orgânicos, CO2, peróxido, etanol, peptídeos bioativos, exopolissacarídeo conhecido como Kefiran e bacteriocinas. Esses compostos podem atuar independentemente ou em conjunto para produzir os vários benefícios para a saúde atribuídos ao consumo de Kefir (RATTRAY; O’CONNELL, 2011).
2.1 IMPACTO DO KEFIR NA MICROBIOTA INTESTINAL
Um fator importante dos efeitos probióticos é a capacidade de modular a microbiota intestinal de quem os consume, provocando um aumento de bactérias benéficas, como Bifidobacterium spp. e Lactobacillus spp., e reduzindo a quantidade de micro-organismos indesejáveis. O efeito sobre a microbiota intestinal é possivelmente derivado de uma combinação de fatores, como a inibição direta de patógenos pela produção de ácidos e bacteriocinas pelos micro-organismos probióticos e a exclusão competitiva de agentes patogênicos na mucosa intestinal (RATTRAY; O’CONNELL, 2011).
A microbiota do intestino humano desempenha um papel crucial tanto na manutenção da homeostase gastrointestinal quanto na saúde do hospedeiro. Mudanças na sua composição microbiana podem levar a um desequilíbrio entre a abundância de micro-organismos benéficos e nocivos. Esta condição, definida como a disbiose, pode favorecer a susceptibilidade do hospedeiro a várias doenças, incluindo distúrbios metabólicos, como obesidade e diabetes, doença inflamatória intestinal (DII) e doenças atópicas (TOSCANO et al., 2017).
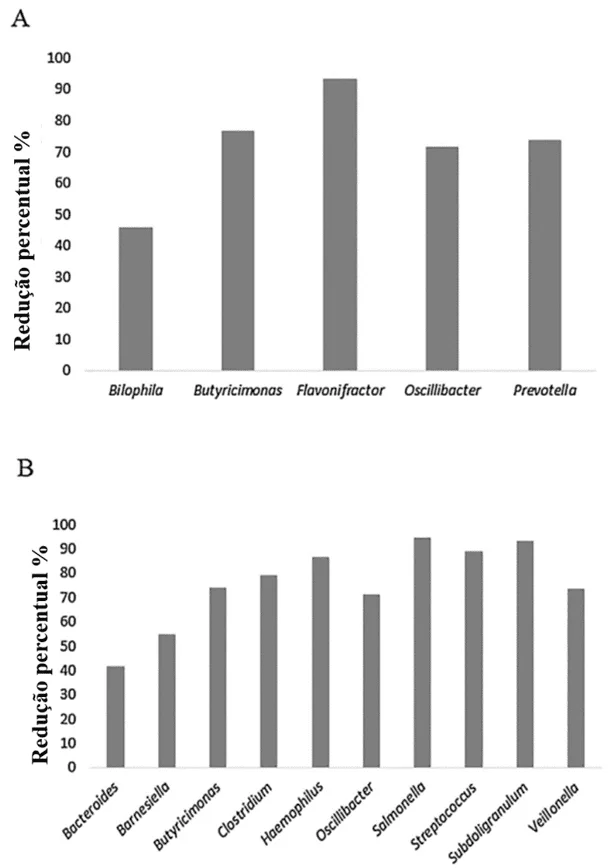
Toscano et al. (2017) avaliaram a capacidade do Lactobacillus Kefiri LKF01 DSM32079 (LKEF) colonizar o ambiente intestinal e modificar a composição da microbiota intestinal de indivíduos saudáveis. Na pesquisa participaram vinte indivíduos italianos saudáveis, quatro homens e dezesseis mulheres, que foram randomizados em dois grupos, dez indivíduos ingeriram cinco gotas de uma suspensão contendo 1010 UFC de L. Kefiri 30 min antes do café da manhã (administração pré-prandial), enquanto dez indivíduos ingeriram cinco gotas da suspensão probiótica 30 minutos após o café da manhã (administração pós-prandial). Após um mês de administração da cepa de Lactobacillus Kefiri LKF01, esta foi recuperada nas fezes de todos os indivíduos participantes do estudo, com uma carga bacteriana de 105-106 UFC/g de fezes, após administração pré- prandial e pós-prandial. Um mês após o término do tratamento probiótico, Lactobacillus Kefiri foi recuperado apenas em três indivíduos pertencentes ao grupo pré-prandial e em dois indivíduos pertencentes ao grupo pós-prandial com carga bacteriana de 103 UFC/g de fezes. Após um mês de administração da cepa observou-se redução de Bilophila, Butyricicomonas, Flavonifractor, Oscillibacter e Prevotella. Um mês após o término da administração da cepa, observou-se redução de Bacteroides, Barnesiella, Butyricicomonas, Clostridium, Haemophilus, Oscillibacter, Salmonella, Streptococcus, Subdoligranolum e Veillonella (Figura 1). Lactobacillus Kefiri LKF01 mostrou uma forte capacidade de modular a composição da microbiota intestinal, levando a uma redução significativa de vários gêneros bacterianos diretamente envolvidos no início da resposta pró-inflamatória e doenças gastrointestinais.
Figura 1 – Redução percentual significativa de vários gêneros bacterianos intestinais após 1 mês de administração de L. Kefiri (A) e 1 mês após o término do tratamento probiótico (B) (p <0,05).
2.2 PROPRIEDADES ANTIMICROBIANAS DO KEFIR
No início dos anos 1900, o imunologista Mechnikov relatou que o consumo permanente de iogurte contento bactérias ácido lácticas influenciava positivamente na expectativa de vida dos consumidores, devido à competição das bactérias ácido lácticas com os micro-organismos prejudiciais à saúde. Desde então, muitas pesquisas têm sido realizadas com a finalidade de demostrar as propriedades antifúngicas e antibacterianas do Kefir (LOPITZ-OTSOA et al., 2006).
Rattray e O’Connell (2011) relataram que o Kefir tem efeito bactericida e bacteriostático sobre patógenos bacterianos Gram-positivos e Gram-negativos, respectivamente. Powell et al. (2007) ressaltaram a atividade antimicrobiana do Kefir sobre variedades de bactérias Gram-positivas, Gram-negativas e fungos. Essa atividade antimicrobiana é atribuída ao ácido lático, ácidos voláteis, peróxido de hidrogênio, dióxido de carbono, diacetil, acetaldeído e bacteriocinas produzidas pela ação das bactérias ácido lácticas presentes no Kefir (HELANDER et al., 1997).
Foi avaliado o efeito antibacteriano do Kefir produzido a partir de uma cultura iniciadora comercial contendo, Lactococcus lactis subsp. lactis, Lactococcus lactis subsp. cremoris, Lactococcus lactis subsp. diacetylactis, Leuconostoc mesenteroides subsp. cremoris, Lactobacillus kefyr, Kluyveromyces marxianus var. marxianus e Saccharomyces unisporus. Foram testadas as atividades antimicrobianas contra Staphylococcus aureus (ATCC 29213), Bacillus cereus (ATCC 11778), Salmonella Enteritidis (ATCC 13076), Listeria monocytogenes (ATCC 7644) e Escherichia coli (ATCC 8739), sendo tais micro-organismos usados por serem os patógenos mais comuns veiculados por alimentos. O efeito antimicrobiano foi avaliado através da metodologia de difusão em disco. A atividade antibiótica do Kefir foi comparada com ampicilina e gentamicina, sendo adicionado 10 μg/ml desses antibióticos em um disco de papel de 5mm de diâmetro. Foram utilizadas amostras de Kefir fermentado por 24 e 48 horas (0,1ml) para comparação. Os discos de papel com antibióticos ou Kefir foram aplicados na superfície de ágar previamente inoculado com 0,1 ml da suspensão de bactérias patogênicas. Após incubação a 37°C por 24 horas os halos de inibição foram medidos. Os diâmetros dos halos de inibição formados pelos antibióticos ou pelas amostras de Kefir obtiveram resultados semelhantes para cada patógeno. O melhor efeito antimicrobiano de Kefir de 24 e 48 horas foi observado contra Staphylococcus aureus, com diâmetros de 21,4 e 21,1 mm, respectivamente, não tendo diferença significativa entre eles. Os diâmetros dos halos de inibição para E. coli foram de 19,5 mm, 18,6 mm, 20,2 mm e 20,8 mm com Kefir fermentado por 24 horas, Kefir fermentado por 48 horas, ampicilina e gentamicina, respectivamente. Concluiu-se que o efeito antimicrobiano do Kefir foi semelhante ao da ampicilina e da gentamicina (ULUSOY et al., 2007).
Yüksekdağ et al. (2004) determinaram a quantidade de peróxido de hidrogênio produzido pelas bactérias Lactococcus cremoris, Lactococcus lactis, Streptococcus thermophilus e Enterococcus durans, isoladas de amostras de Kefir turco. A concentração de peróxido de hidrogênio foi determinada por espectrofotometria, sendo as medidas obtidas após 24 horas de incubação em leite desnatado. Os autores observaram diferentes quantidades de produção de peróxido de hidrogênio entre os isolados, ressaltando dois isolados de Lactococcus lactis, Z1S e Z2S, que produziram maior quantidade de peróxido de hidrogênio, 0,17 μg/mL. Os efeitos antimicrobianos foram determinados pelo método de difusão em ágar. Os isolados Lactococcus lactis Z1S e Z2S e Lactococcus cremoris Z6S foram capazes de inibir o crescimento de Staphylococcus aureus, E. coli e Pseudomonas aeruginosa.
Carasi et al. (2014) utilizaram em sua pesquisa seis cepas de Lactobacillus Kefiri CIDCA 8321, 8345, 8348, 83111, 83113 e 83115 isolados de Kefir para avaliar a segurança e propriedades antibacterianas. As bactérias patogênicas, Enterococcus faecalis ATCC 29212, Staphylococcus aureus ATCC 6538, Shigella flexneri ATCC 9199, Pseudomona aeruginosa ATCC 15442, Salmonella enterica serovar Enteritidis CIDCA 101, Escherichia coli enterohemorrágica EDL 933, Listeria monocytogenes ATCC 7644 e Bacillus cereus ATCC 10876 foram utilizadas para testar a atividade antimicrobiana das diferentes cepas de Lactobacillus Kefiri. Foram feitos vários testes, entre eles, a atividade hemolítica bacteriana, já que a hemólise é um fator de virulência comum entre os agentes patogênicos. A atividade hemolítica foi o primeiro parâmetro de segurança avaliado, e foi observado que nenhuma das cepas de Lactobacillus Kefiri causou α ou β hemólise.
Outro parâmetro de segurança avaliado foi a sensibilidade aos antibióticos, para isso avaliou-se as concentrações inibitórias mínimas (MICs). Os valores de corte microbiológico são estabelecidos estudando a distribuição de MICs nos antimicrobianos escolhidos em populações bacterianas pertencentes a uma única unidade taxonômica (espécie ou gênero). A maioria das cepas de Lactobacillus Kefiri testadas apresentaram MICs inferiores aos valores de corte recomendados para Lactobacillus heterofermentativos para tetraciclina, clindamicina, estreptomicina, ampicilina, eritromicina, canamicina e gentamicina. Apenas as cepas CIDCA 8321 e 8345 apresentaram valores superiores aos valores de corte, sendo resistentes ao cloranfenicol. Todas as amostras de Lactobacillus Kefiri, incluindo as cepas CIDCA 8321 e 8345, foram avaliadas pela técnica PCR (Reação em Cadeia da Polimerase) para detecção do gene de resistência ao cloranfenicol (cloranfenicol acetiltransferase – CAT), encontrando resultado negativo para todas as amostras. Mais pesquisas, como o estudo da MIC do cloranfenicol, são necessárias para determinar se a resistência é adquirida (não aceitável) ou intrínseca (aceitável) (CARASI et al., 2014).
Para avaliar a inibição do crescimento de agentes patogênicos bacterianos empregou-se o método ágar spot test. As suspensões celulares de cepas de Lactobacillus Kefiri foram inoculadas (5 μL) em spots em placas de Petri contendo ágar MRS e incubadas a 37 °C por 24 horas. Após este período, foram adicionados às placas meio BHI contendo os patógenos. Após 18 horas de incubação a 37 ° C os halos de inibição ao redor das colônias de Lactobacillus Kefiri foram medidos. Quanto maior o diâmetro, maior o grau de inibição exercido pelas cepas de Lactobacillus Kefiri. Os patógenos Gram-positivos apresentaram maior sensibilidade às cepas de Lactobacillus Kefiri do que os patógenos Gram-negativos, sendo que todas as amostras inibiram o crescimento de Bacillus cereus e Staphylococcus aureus, mas nenhuma delas inibiu Escherichia coli enterohemorrágica (EHEC). As cepas Lactobacillus Kefiri CIDCA 8321 e CIDCA 8348 foram capazes de inibir o crescimento dos demais patógenos testados, demonstrando ser as cepas mais ativas contra os agentes patogênicos estudados (Tabela 1).
Tabela 1 – Atividade antimicrobiana de estirpes de Lactobacillus Kefiri contra patógenos pelo método ágar spot test.
| Capacidade de inibição do crescimento | |||||||
| Cepas | CIDCA 8321 | CIDCA 8345 | CIDCA 8348 | CIDCA 83115 | CIDCA 83111 | CIDCA 83113 | |
| Bacilos Gram negativos | |||||||
| P. aeruginosa | ++ | + | ++ | + | + | + | |
| S. Enteritidis | + | – | + | – | + | + | |
| Shigella flexneri | + | – | + | – | + | – | |
| EHEC | – | – | – | – | – | – | |
| Bacilos Gram positivos | |||||||
| L. monocytogenes | + | – | + | – | – | – | |
| Bacillus cereus | ++ | + | ++ | + | + | ++ | |
| Cocos Gram positivos | |||||||
| E. faecalis | + | – | + | – | – | – | |
| S. aureus | ++ | + | ++ | + | ++ | + | |
Fonte: Adaptado de Carasi et al. (2014)
Caraci et al. (2014) selecionaram a cepa CIDCA 8348 para realizar estudos in vivo em camundongos. Os camundongos foram distribuídos de acordo com o peso corporal em dois grupos experimentais, sendo um controle, com cinco a sete animais cada grupo. Os camundongos receberam diariamente, durante 21 dias, uma suspensão de 100 μL de 108 UFC/mL de Lactobacillus Kefiri CIDCA 8348 (grupo Lk) e o grupo controle recebeu a quantidade de 100 μL de solução salina tamponada com fosfato. Após esse período os animais foram abatidos. Não se observou no íleo e no cólon sinais inflamação, edema, erosão, ulceração, perda de cripta ou infiltração de células mono e polimorfonucleares. Não se observou translocação de micro-organismos no sangue, baço ou fígado, o que significa que a permeabilidade intestinal não foi afetada. Não houve diferenças significativas entre o grupo Lk e o grupo controle em relação ao comprimento do cólon, níveis de secreção de citocinas pró-inflamatórias no intestino delgado e cólon e contagens de enterobactérias e bactérias ácido láticas no íleo. Os autores concluíram que Lactobacillus Kefiri CIDCA 8348 isolada do Kefir apresenta um grande potencial como probiótico para uso humano ou animal e pode ser usado também para produzir alimentos funcionais.
2.3 ATIVIDADE ANTICARCINOGÊNICA DO KEFIR
A atividade anticarcinogênica dos produtos lácteos fermentados pode ser atribuída à prevenção de câncer e supressão de tumores iniciais, prolongando as atividades enzimáticas, que convertem as células pro-carcinogênicas a carcinogênicas, ou ativando o sistema imunológico (SARKAR, 2007). A ingestão frequente da bebida Kefir é capaz de modular positivamente a composição da microbiota intestinal e do sistema imunológico do indivíduo que o consome. Consequentemente, acredita-se que este leite fermentado possa desempenhar um papel importante na modulação da carcinogênese (ROSA et al., 2017).
Liu et al. (2002) estudaram os efeitos do Kefir feito a partir de leite de vaca e de leite de soja sobre o crescimento tumoral em camundongos portadores de tumores e a resposta da imunoglobulina A da mucosa nesses camundongos. Os camundongos foram injetados com 0,2 x108 células de Sarcoma 180 (S180) durante sete dias antes de dar início à alimentação com a bebida. Os camundongos portadores de tumor foram divididos aleatoriamente em cinco grupos. O grupo controle positivo recebeu 5 ml de água destilada/kg de peso corporal, via oral, uma vez por dia. Os quatro grupos testes foram formados por camundongos que receberam 5 ml/kg de peso corporal de leite reconstituído, Kefir de leite, leite de soja e Kefir de leite de soja, por via oral, uma vez por dia. Os camundongos do grupo controle negativo (camundongos saudáveis) receberam 5 ml de água destilada/kg de peso corporal, por via oral, uma vez por dia. Foram utilizados 10 camundongos em cada grupo. Após 30 dias de tratamento, foi avaliado o crescimento tumoral e então os tumores foram removidos e pesados. O grupo de camundongos alimentados com Kefir de leite de soja apresentaram inibição de 70,9% do crescimento tumoral em relação ao grupo controle positivo, enquanto que o grupo alimentado com Kefir de leite de vaca apresentou inibição de 64,8%. A composição do polissacarídeo a partir de grãos de Kefir de leite de soja é diferente da composição do polissacarídeo a partir de grãos de Kefir de leite. São necessários novos estudos para verificar o efeito a composição do polissacarídeo na atividade antitumoral do Kefiran. Os volumes dos tumores dos grupos controle positivo e leite no dia 30 foram 5,80 e 7,24 vezes maiores que no dia 0, respectivamente. Enquanto os volumes dos tumores dos grupos Kefir de leite e Kefir de soja no dia 30 foram 1,97 e 1,63 maiores que no dia 0, respectivamente (Tabela 2).
Tabela 2 – Tamanho do tumor para os grupos de camundongos testadosa,b
| Tamanho do tumor /mm3 | Taxa de inibiçãoc % | ||||
| Dia 0 | Dia 10 | Dia 20 | Dia 30 | ||
| Controle positivo | 281±70 | 653±334* | 999±475* | 1631±753*† | |
| Leite | 292±82 | 648±218* | 1321±555* | 2115±901* | 29,7 |
| Kefir de leite | 290±76 | 372±204*,† | 469±287† | 574±335‡ | 64,8 |
| Leite de soja | 299±87 | 338±148† | 555±330† | 1017±770†,‡ | 37,6 |
| Kefir de soja | 290±94 | 389±254* | 414±207† | 475±292‡ | 70,9 |
a: Os valores são médias ± DP de 10 camundongos durante 0 a 30 dias após a administração oral de diferentes amostras. b: Os valores na mesma coluna sem os mesmos símbolos (*, †, ‡) são significativamente diferentes (P <0,05). c: Taxa de inibição = [1 – (avg tumor vol no grupo de tratamento / avg tumor vol no grupo de controle positivo)] × 100. FONTE: Adaptado de Liu et al., ( 2002)
Foi observado necrose no centro dos tumores desenvolvidos nos camundongos. Os volumes das regiões necróticas foram maiores para os grupos de Kefir de leite, leite de soja e Kefir de leite de soja. Além disso, os corpos apoptóticos observados nos tumores dos grupos Kefir de leite e Kefir de leite de soja confirmaram a apoptose. Devido à apoptose das células S180, os autores consideraram que a ingestão das bebidas de Kefir estimula o sistema imunológico do hospedeiro (LIU et al., 2002).
O processamento de antígenos e os eventos celulares iniciais da resposta imune no intestino ocorrem nas placas de Peyer, o tecido linfático intestinal. As placas de Peyer contém os precursores das células plasmáticas de Imunoglobulinas A (Ig A). A secreção de IgA no lúmen proporciona uma barreira imunológica à matéria estranha, particularmente micro-organismos patogênicos e proteínas alimentares alergênicas, impedindo sua adsorção ao epitélio da mucosa e penetração no organismo. Os autores observaram a formação de centros germinativos nas placas de Peyer para os grupos Kefir de leite e Kefir de leite de soja. Este achado indica que a ingestão de Kefir de leite ou Kefir de leite de soja ativa os folículos linfóides subepiteliais localizados em todo o intestino delgado, aumentando a produção endógena de Ig A, o que pode reduzir o risco associado à exposição a antígenos alimentares (LIU et al., 2002).
Estes resultados sugerem que o Kefir de leite e o Kefir de leite de soja podem ser considerados alimentos promissores em termos de prevenção do câncer e aumento da resistência mucosa a infecções gastrointestinais.
2.4 ATIVIDADE DA Β- GALACTOSIDASE DO KEFIR
A expressão “intolerância à lactose” é normalmente utilizada como sinônimo de má digestão da lactose, o que não é apropriado, pois má digestão de lactose é a incapacidade de digerir completamente a lactose, enquanto intolerância à lactose se refere à presença de diferentes ocorrências gastrointestinais (diarreia, dor abdominal, náusea, flatulência), sendo a intolerância à lactose uma consequência da má digestão da lactose (HERTZLER; CLANCY, 2003).
A lactose é o principal carboidrato do leite. No mundo, aproximadamente 75% dos adultos tem má digestão da lactose, sendo consequência da diminuição geneticamente programada na metabolização da lactose no intestino após idade de 3 a 5 anos (JOHN; DEESEENTHUM, 2015). Uma quantidade significativa da população mundial é intolerante à lactose, devido à insuficiente atividade intestinal da β-galactosidase. A enzima β-galactosidase degrada o dissacarídeo lactose nos monossacarídeos glicose e galactose. Sem atividade enzimática da β-galactosidase, a lactose é levada ao intestino, onde as bactérias intestinais, como os coliformes, a digerem produzindo dióxido de carbono, podendo causar desconforto e sintomas gastrointestinais (GUZEL-SEYDIM et al., 2011).
Muitas pessoas com má digestão da lactose podem tolerar a presença de pequena quantidade de lactose na dieta, nesse sentido o consumo de produtos de leite fermentado, como o Kefir, pode ser uma boa opção (AHMED et al., 2013). No Kefir, a diversa população microbiana possui atividade de β-galactosidase desdobrando a lactose em glicose e galactose, facilitando a sua digestão. Aproximadamente 20 a 40% da lactose presente no Kefir é metabolizada, podendo essa redução ser suficiente para muitos indivíduos com má digestão de lactose que toleram o leite fermentado na sua alimentação (RATTRAY; O’CONNELL, 2011).
De Vrese et al. (1992) avaliaram as concentrações de galactose venosa plasmática pós-prandial em dez suínos miniatura Gottingen alimentados com a bebida Kefir inoculada com grãos frescos e grãos tratados termicamente a 100°C por 10 minutos (controle). Os grãos de Kefir continham Lactobacillus Kefiri, Lactococcus lactis (subsp. lactis e cremoris), levedura fermentadora de lactose Candida kefyr e levedura não fermentada de lactose Saccharomyces unisporus. No grupo alimentado com Kefir de grãos frescos, houve um aumento de 30% da concentração média pós-prandial de galactose plasmática em relação ao outro grupo, indicando uma melhor digestão da lactose. Não houve indução de atividade de β-galactosidase intestinal. Os resultados desde estudo evidenciaram uma melhor digestão e absorção da lactose com a ingestão de Kefir devido à atividade da β-galactosidase microbiana.
Hertzler e Cleancy (2003) realizaram uma pesquisa com 15 adultos saudáveis com má digestão de lactose. Os indivíduos foram divididos em cinco tratamentos, leite, Kefir puro, Kefir saborizado com framboesa, iogurte puro e iogurte saborizado com framboesa. As porções de cada produto foram padronizadas para fornecer 20 g de lactose. As amostras de Kefir continham as bactérias Streptococcus lactis, Lactobacillus plantarum, Streptococcus cremoris, Lactobacillus casei, Streptococcus diacetylactis, Leuconostoc cremoris e a levedura Saccharomyces florentinus. Foi realizado o teste respiratório do hidrogênio expirado, sendo que as medidas do tratamento leite foram significativamente maiores que iogurte puro, Kefir puro e iogurte saborizado. Os iogurtes e Kefirs reduziram de forma semelhante a severidade percebida de flatulência em 54% a 71% em relação ao leite. Os autores concluíram que o Kefir melhorou a digestão da lactose, seu uso, portanto, pode ser uma estratégia potencial para superar a intolerância à lactose.
2.5 EFEITO HIPOCOLESTEROLÊMICO DO KEFIR
As doenças cardiovasculares (DCV) são a principal causa de mortalidade no mundo, todo ano morrem mais pessoas por essas enfermidades do que por qualquer outra causa. Estima-se que 17,5 milhões de pessoas morreram por doenças cardiovasculares em 2012, representando 31% de todas as mortes no mundo. Desses óbitos, estima-se que 7,4 milhões ocorrem devido às doenças coronarianas e 6,7 milhões devido a acidentes vasculares cerebrais (AVC) (OPAS, 2017).
A hipercolesterolemia é um aumento do colesterol total no sangue, triglicerídeos, colesterol de lipoproteínas de alta densidade (HDL) e colesterol de lipoproteínas de baixa densidade (LDL). Um dos métodos mais comuns e rápidos para controlar o colesterol e os triglicerídeos sanguíneos é a ingestão de fármacos (AAZMI et al., 2015). Devido aos elevados custos dos medicamentos e aos efeitos colaterais dos mesmos, o interesse em terapias probióticas para diminuir o colesterol sérico e o risco de doença arterial coronariana vem aumentando (RICHARDSON; EGGERSDORFER, 2015).
Os resultados em relação aos benefícios do kefir na redução do colesterol são controversos. Em um estudo realizado por St-Onge et al. (2002) o consumo de kefir (0,5 litros/dia) por homens adultos, hipercolesterolêmicos, durante 4 semanas, não afetou as concentrações circulantes de colesterol total, HDL, LDL ou triglicerídeos. Por outro lado, Lactobacillus plantarum MA2, isolado a partir de grãos de kefir originários do Tibete, foi efetivo na redução das concentrações de colesterol e triglicerídeos no plasma e no fígado de camundongos com dieta rica em gordura (WANG et al., 2009).
Outros benefícios associados ao kefir são relatados na literatura, como controle da glicemia plasmática, efeito anti-hipertensivo, efeito anti-inflamatório, atividade antioxidante, atividade antialérgica e cicatrizante.
3. CONCLUSÃO
O Kefir possui uma grande variedade de micro-organismos benéficos e compostos bioativos, sendo considerado um produto com um grande potencial como alimento funcional. Os efeitos fisiológicos descritos na literatura e apresentados neste trabalho apoiam os benefícios de promoção da saúde do Kefir. No entanto, há necessidade de mais estudos clínicos para avaliar e entender melhor os efeitos fisiológicos do kefir como parte de uma dieta.
REFERÊNCIAS
AAZMI, S.; TEH, L. K.; RAMASAMY, K.; ABDUL-RAHMAN, T. Comparison of the anti-obesity and hypocholesterolaemic effects of single Lactobacillus casei strain Shirota and probiotic cocktail. 2015.
AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA. Portaria nº 398 de 30 de abril 1999. Aprova o regulamento técnico que estabelece as diretrizes básicas para análise e comprovação de propriedades funcionais e ou de saúde alegadas em rotulagem de alimentos. Diário Oficial da União, Brasília (03 maio 1999); 2.
AHMED, Z.; WANG, Y.; AHMAD, A.; KHAN, S. T. Kefir and health: a contemporary perspective. Crit Rev Food Sci Nutr, 53, n. 5, p. 422-434, 2013.
BRASIL. Instrução Normativa nº 46 de 23 out 2007. Adota o Regulamento Técnico sw Identidade e Qualidade de Leites Fermentados. Diário Oficial da República Federativa do Brasil, Brasília,DF, 24 de outubro de 2007. Seção 1,p.5.
B GUZEL-SEYDIM, Z.; KOK-TAS, T.; K GREENE, A.; C SEYDIM, A. Review: Functional Properties of Kefir. 2011. 261-268 p.
CODEX ALIMENTARIUS. Milk and Milk Products. 2a ed. Roma: World Health Organization. Food and Agriculture Organization of the United Nations; 2011. 244p.
CANADIAN FOOD INSPECTION AGENCY. Probiotic Claims. [acesso 16 out 2017]. Disponível em: http://www.inspection.gc.ca/food/labelling/food-labelling-for-industry/health-claims/eng/1392834838383/1392834887794?chap=9.
CARASI, P.; DIAZ, M.; RACEDO, S. M.; DE ANTONI, G. Safety characterization and antimicrobial properties of kefir-isolated Lactobacillus kefiri. Biomed Res Int, 2014, p. 208974, 2014.
CHAMPAGNE, C. P.; ROSS, R. P.; SAARELA, M.; HANSEN, K. F. Recommendations for the viability assessment of probiotics as concentrated cultures and in food matrices. Int J Food Microbiol, 149, n. 3, p. 185-193, Oct 03 2011.
DE VRESE, M.; KELLER, B.; BARTH, C. A. Enhancement of intestinal hydrolysis of lactose by microbial beta-galactosidase (EC 3.2.1.23) of kefir. Br J Nutr, 67, n. 1, p. 67-75, Jan 1992.
FOOD AND AGRICULTURAL ORGANIZATION OF THE UNITED NATIONS AND WORLD HEALTH ORGANIZATION. Health and nutritional properties of probiotics in food including powder milk with live lactic acid bacteria. World Health Organization [online], http://www.who.int/foodsafety/publications/fs_management/en/probiotics.pdf (2001).
FOOD AND AGRICULTURAL ORGANIZATION OF THE UNITED NATIONS AND WORLD HEALTH ORGANIZATION. Joint FAO/WHO working group report on drafting guidelines for the evaluation of probiotics in food. Food and Agricultural Organization of the United Nations [online], ftp://ftp.fao.org/es/esn/food/wgreport2.pdf (2002).
GUARNER, F.; REQUENA, T.; MARCOS SÁNCHEZ, A. Declaraciones consensuadas en el workshop “probióticos y salud: evidencia científica”. 2010. 700-704 p.
HELANDER, I. M.; VON WRIGHT, A.; MATTILA-SANDHOLM, T. M. Potential of lactic acid bacteria and novel antimicrobials against Gram-negative bacteria. Trends in Food Science & Technology, 8, n. 5, p. 146-150, 1997.
HERTZLER, S. R.; CLANCY, S. M. Kefir improves lactose digestion and tolerance in adults with lactose maldigestion. J Am Diet Assoc, 103, n. 5, p. 582-587, May 2003.
HILL, C.; GUARNER, F.; REID, G.; GIBSON, G. R. Expert consensus document. The International Scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nat Rev Gastroenterol Hepatol, 11, n. 8, p. 506-514, Aug 2014.
JOHN, S.; DEESEENTHUM, S. Properties and benefits of kefir – A review. 2015. 275-282 p.
LEITE, A. M. O.; MIGUEL, M. A.; PEIXOTO, R. S.; RUAS-MADIEDO, P. Probiotic potential of selected lactic acid bacteria strains isolated from Brazilian kefir grains. J Dairy Sci, 98, n. 6, p. 3622-3632, Jun 2015.
LIU, J. R.; WANG, S. Y.; LIN, Y. Y.; LIN, C. W. Antitumor activity of milk kefir and soy milk kefir in tumor-bearing mice. Nutr Cancer, 44, n. 2, p. 183-187, 2002.
LOPITZ-OTSOA, F.; REMENTERIA, A.; ELGUEZABAL, N.; GARAIZAR, J. Kefir: a symbiotic yeasts-bacteria community with alleged healthy capabilities. Rev Iberoam Micol, 23, n. 2, p. 67-74, Jun 2006.
ORGANIZAÇÃO PAN-AMERICANA DA SAÚDE. Doenças cardiovasculares. [acesso 16 out 2017]. Disponível em: http://www.paho.org/bra/index.php?option=com_content&view=article&id=5253:doencas-cardiovasculares&Itemid=839.
OUWEHAND, A. C.; SALMINEN, S.; ISOLAURI, E. Probiotics: an overview of beneficial effects. Antonie Van Leeuwenhoek, 82, n. 1-4, p. 279-289, Aug 2002.
POWELL, J. E.; WITTHUHN, R. C.; TODOROV, S. D.; DICKS, L. M. T. Characterization of bacteriocin ST8KF produced by a kefir isolate Lactobacillus plantarum ST8KF. International Dairy Journal, 17, n. 3, p. 190-198, 2007/03/01/ 2007.
RATTRAY, F. P.; O’CONNELL, M. J. Fermented Milks | Kefir A2 – Fuquay, John W. In: Encyclopedia of Dairy Sciences (Second Edition). San Diego: Academic Press, 2011. p. 518-524.
RICHARDSON, D. P.; EGGERSDORFER, M. Opportunities for product innovation using authorised European Union health claims. International Journal of Food Science & Technology, 50, n. 1, p. 3-12, 2015.
ROSA, D. D.; DIAS, M. M. S.; GRZESKOWIAK, L. M.; REIS, S. A. Milk kefir: nutritional, microbiological and health benefits. Nutr Res Rev, 30, n. 1, p. 82-96, Jun 2017.
SARKAR, S. Potential of kefir as a dietetic beverage–a review. British Food Journal, 109, n. 4, p. 280-290, 2007.
ST-ONGE, M. P.; FARNWORTH, E. R.; SAVARD, T.; CHABOT, D. Kefir consumption does not alter plasma lipid levels or cholesterol fractional synthesis rates relative to milk in hyperlipidemic men: a randomized controlled trial [ISRCTN10820810]. BMC Complement Altern Med, 2, p. 1, 2002.
THARMARAJ, N.; SHAH, N. P. Selective Enumeration of Lactobacillus delbrueckii ssp. bulgaricus, Streptococcus thermophilus, Lactobacillus acidophilus, Bifidobacteria, Lactobacillus casei, Lactobacillus rhamnosus, and Propionibacteria. Journal of Dairy Science, 86, n. 7, p. 2288-2296, 2003/07/01/ 2003.
TOSCANO, M.; DE GRANDI, R.; MINIELLO, V. L.; MATTINA, R. Ability of Lactobacillus kefiri LKF01 (DSM32079) to colonize the intestinal environment and modify the gut microbiota composition of healthy individuals. Dig Liver Dis, 49, n. 3, p. 261-267, Mar 2017.
ULUSOY, B. H.; ÇOLAK, H.; HAMPIKYAN, H.; ERKAN, M. E. An in vitro study on the antibacterial effect of kefir against some food-borne pathogens. Turk Mikrobiyol Cem Derg, 37, n. 2, p. 103-107, 2007.
WANG, Y.; XU, N.; XI, A.; AHMED, Z. Effects of Lactobacillus plantarum MA2 isolated from Tibet kefir on lipid metabolism and intestinal microflora of rats fed on high-cholesterol diet. Appl Microbiol Biotechnol, 84, n. 2, p. 341-347, Aug 2009.
YÜKSEKDAĞ, Z. N.; BEYATLI, Y.; ASLIM, B. Determination of some characteristics coccoid forms of lactic acid bacteria isolated from Turkish kefirs with natural probiotic. LWT – Food Science and Technology, 37, n. 6, p. 663-667, 2004/09/01/ 2004.
[1] Mestre em ciência animal, graduado em Engenharia De alimentos.
[2] Doutora em Ciência Animal, mestra em ciência Animal, graduada em Medicina Veterinária.
[3] Doutora em Agronomia.
[4] Doutora em Ciência Animal.
[5] Doutor.
[6] Doutor.
[7] Orientadora. Doutora em Tecnologia de Alimentos, mestra Tecnologia e Inspeção de Produtos de Origem Animal e graduada em Medicina Veterinária.
Enviado: Março, 2021.
Aprovado: Maio, 2021.

