ARTIGO DE REVISÃO
HAZIME, Desirée Oliveira Karasek [1], SCHERWINSKI, Rubeneide da Rocha Ferreira [2], OLIVEIRA, Renato Leão [3]
HAZIME, Desirée Oliveira karasek. SCHERWINSKI, Rubeneide da Rocha Ferreira. OLIVEIRA, Renato Leão. A cirurgia damage control no paciente traumatizado. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano 03, Ed. 10, Vol. 05, pp. 121-130 Outubro de 2018. ISSN:2448-0959
RESUMO
A cirurgia de damage control é amplamente aceito e utilizado pelos médicos em pacientes traumatizados. Os pacientes em sua maioria vão a óbito devido a instalação da tríade letal (hipotermia, coagulopatia e acidose). Esse tipo de cirurgia surgiu com a finalidade de diminuir a mortalidade desses pacientes através da redução do tempo cirúrgico e estabilização dos parâmetros fisiológicos antes da reparação das lesões. Este estudo contextualizou as indicações da cirurgia e a tríade letal. Fica evidente a necessidade de um protocolo para orientação dos médicos na indicação da cirurgia damage control, evitando assim a subjetividade e a dependência da experiência desse profissional.
Palavras-chave: Damage Control, Controle de Danos, Cirurgia, Trauma.
1. INTRODUÇÃO
O termo damage control (controle de danos) tem origem na terminologia naval usada para designar as reparações estritamente necessárias a realizar num navio com o objetivo de terminar a missão e regressar ao porto, onde as reparações definitivas teriam lugar. (1) A cirurgia damage control parte do mesmo princípio, uma vez que um traumatizado grave, com baixas reservas fisiológicas, deve ser sujeito apenas aos procedimentos estritamente necessários no momento, interrompendo-se o procedimento cirúrgico até recuperação da estabilidade fisiológica numa unidade de cuidados intensivos(2).
Esta técnica cirúrgica, que começou a ser divulgada em 1983 por Stone et al. (3), foi realizada em pacientes que desenvolviam coagulopatia. A cirurgia era o mais breve possível, controlando-se a hemorragia através de tamponamento abdominal, de reparação de vasos maiores e de ligação seletiva dos restantes vasos(3).
Em 1993, Rotondo et al. introduziram pela primeira vez o termo “damage control”, descrevendo o procedimento em três fases consecutivas. A primeira fase consistia no controle cirúrgico da hemorragia e da contaminação, de forma rápida e eficaz, adiando a reparação definitiva e terminando o procedimento rapidamente após tamponamento intra-abdominal através do encerramento temporário da parede abdominal. A segunda fase tinha lugar na unidade de cuidados intensivos, com o objetivo de corrigir alterações fisiológicas e de otimizar os valores hemodinâmicos. A última fase consistia num segundo procedimento cirúrgico, com reparação definitiva das lesões intra-abdominais e encerramento do abdômen(2).
No estudo realizado por Rotondo, concluiu-se que em traumatizados muito graves, com um Injury Severity Score (ISS) médio de 23,8, a sobrevida dos doentes submetidos a damage control era muito superior à dos controles, sujeitos a laparotomia convencional (sobrevida de 77% nos sujeitos contra 11% nos controles). Concluiu-se assim o benefício da aplicação da técnica de damage control em pacientes selecionados com lesões vasculares major e múltiplas lesões viscerais(2).
A cirurgia de damage control está dividida em cinco fases distintas, a primeira das quais é a seleção de pacientes e a decisão para recorrer a damage control. Esta fase enfatiza a necessidade do reconhecimento precoce da potencial necessidade de damage control. Para esse efeito, foram desenvolvidos critérios de seleção de pacientes que ainda são controversos e que serão objeto de posterior desenvolvimento(1,4). A segunda fase consiste no procedimento propriamente dito, com controle da hemorragia através do tamponamento abdominal e da contaminação e do encerramento temporário do abdome(2,1). A terceira fase consiste no recobro numa unidade de cuidados intensivos, com recuperação das alterações fisiológicas. A quarta fase consiste na cirurgia definitiva, após estabilização do doente, com reparação definitiva das lesões, sendo ainda, controverso o tempo correto para a sua realização. Por último, o encerramento definitivo da parede abdominal, após a resolução do edema e da hemorragia, realizado sem tensão, para evitar desenvolvimento da síndrome do compartimento abdominal(1).
Segundo um estudo retrospectivo realizado em 2006, com o objetivo de identificar os erros mais comuns que contribuem para mortalidade evitável em contexto de trauma, 8% desses erros constituíram num atraso em recorrer a damage control em politraumatizados graves(5).
Carrilo et al. em 1993 propuseram como critérios para recorrer a damage control uma perda inicial de sangue superior a quatro litros ou doentes que tivessem determinados parâmetros fisiológicos, nomeadamente pH menor que 7.25 e temperatura corporal menor que 34ºC(6). Garrison et al. em 1996 sugeriram como indicadores pré-operatórios para realização de damage control um ISS superior a 35, tempo total de hipotensão superior a 70 minutos, tempo de protrombina (PT) superior a 19 segundos, tempo de tromboplastina ativada (aPTT) superior a 60 segundos, numero total de transfusões superior a 15 unidades de concentrado de eritrócitos e pH menor que 7.2(6).
2. OBJETIVO
Esta pesquisa teve como objetivo elucidar as indicações da cirurgia damage control no paciente traumatizado e discorrer sobre a tríade letal.
3. METODOLOGIA
Trata-se de um estudo do tipo descritivo o e retrospectivo bibliográfico.
Após a definição do tema foi feita uma busca em bases de dados virtuais em saúde, especificamente na Biblioteca Virtual em Saúde (BVS/Bireme). Foram utilizados os descritores: damage control, controle de danos, cirurgia, e trauma. Foram selecionados no total 17 artigos que estavam no Sistema Latino- Americano e do Caribe de informação em Ciências da Saúde (LILACS) e Scientific Electronic Library online (Scielo), com base nos quais foi feita uma revisão da literatura sobre o tema.
4. RESULTADOS E DISCUSSÃO
4.1 INDICAÇÕES DE CIRURGIA DAMAGE CONTROL
A. Fase 1: Seleção do Paciente
A primeira fase da cirurgia de damage control consiste na seleção de doentes, enfatizando-se a necessidade de um reconhecimento precoce dos doentes em risco de desenvolver a tríade letal. No passado, o damage control era visto como uma medida de último recurso, logo a decisão para realizar esta cirurgia era feita tardiamente, o que afetava negativamente no resultado(1).
As indicações para damage control são geralmente divididas em seis categorias: 1ª – incapacidade de conseguir uma hemostasia eficaz devido a coagulopatia. 2ª – lesões vasculares maiores e inacessíveis. 3ª – antecipação da necessidade de procedimentos complexos e morosos num doente com reservas fisiológicas limitadas. 4ª – necessidade de controle não cirúrgico de lesões que colocam a vida do paciente em risco. 5ª – incapacidade de fechar o abdome devido o edema visceral. E por último, necessidade de acessar posteriormente os conteúdos abdominais, como quando ocorrem lesões viscerais muito extensas(7).
B. Fase 2: Laparotomia Inicial
Controle da hemorragia intra-abdominal e contaminação, por meio do tamponamento intra-abdominal, seguido do fechamento temporário do abdome(8,9,10).
O abdome é inicialmente tamponado em quatro quadrantes separados(8,10). Depois se inicia o controle da contaminação por meio de compressas, clampeamento vascular, e cateteres munidos de balonetes(8,10,11).
C. Ressuscitação em Unidade de Terapia Intensiva – UTI
O paciente é levado à UTI para restauração de seu status fisiológico, a partir de aquecimento, correção da coagulopatia e acidose, redução da transfusão de cristalóides, suporte ventilatório, monitorização cardiorrespiratória, soluções de reposição, antibioticoterapia e transfusão sanguínea(8,10).
D. Cirurgia Definitiva
A cirurgia definitiva planejada o paciente encontra-se hemodinâmicamente estável, sem distúrbios de coagulação e com a homeostase restabelecida. Em alguns casos o paciente pode necessitar de reoperação não planejada devido hipertensão abdominal, hemorragia ou infecção intra-abdominal com o objetivo de salvar a vida(8,10).
E. Fechamento da Parede do Abdome
O fechamento ideal nem sempre é possível, mesmo recorrendo-se aos recursos semelhantes utilizados no primeiro ato operatório, até a diminuição do edema, diminuição do espaço entre fáscias musculares e reaproximação da pele sem exposição do conteúdo da cavidade ou excesso de tensão(8,9,1).
4.2 TRÍADE LETAL
A questão primordial diante de trauma grave é constituída pela instabilidade fisiológica que cursa com “a tríade da morte”, composta por hipotermia, acidose metabólica e coagulopatia(12).
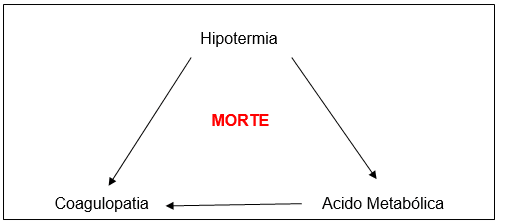
Figura 1: Tríade Letal
4.2.1 HIPOTERMIA
O prognóstico da hipotermia é muito mais grave nos pacientes traumatizados do que nos restantes dos casos, tendo-se estabelecido uma classificação própria. A hipotermia ligeira define-se como temperaturas no intervalo entre os 34ºC e os 35ºC, hipotermia moderada define-se como temperaturas entre os 34ºC e os 32ºC, e a hipotermia grave define-se como temperaturas inferiores a 32ºC(13).
Em um estudo demonstraram uma relação linear entre a taxa de mortalidade e o grau de hipotermia em doentes traumatizados, com taxa de mortalidade próxima de 100% para temperaturas inferiores a 32ºC, definindo assim a hipotermia como um fator de risco independente. No mesmo estudo, verificou-se uma relação linear inversa entre a gravidade do trauma (definido pelo Injury Severity Score) e a temperatura corporal. Verificou-se também uma maior necessidade de administração de fluídos, de transfusões sanguíneas e estadias hospitalares mais prolongadas no doente hipotérmico, quando comparado com um traumatizado equivalente normotérmico(14).
Uma vez instalada, a hipotermia deve ser prontamente corrigida, pois sua correção é um fator de extrema importância para o controle das demais alterações fisiológicas. Na tentativa de revertê-la, devem ser adotadas, além das medidas já descritas, o emprego de: colchões térmicos, sistemas de aquecimento pela circulação de ar aquecido, irrigação de sondas gástricas e vesicais com solução salina aquecida a 39-40ºC e/ou irrigação das cavidades torácica ou abdominal através de drenos de tórax ou cateteres de diálise peritonial(1,15,16).
A hipotermia provoca vários efeitos deletérios no organismo humano, sendo um dos mais reconhecidos a coagulopatia. As temperaturas corporais inferiores a 35ºC provocam alterações da cascata de coagulação por interferência enzimática, com prolongamento do tempo de protrombina e do tempo de ativação parcial da tromboplastina. A hipotermia também provoca disfunção plaquetária por diminuição da produção de tromboxano B2 e da expressão de moléculas de superfície plaquetárias. Ocorre também inibição do sistema fibrinolítico, por interferência com o alfa-2-antiplasmina e com o inibidor da ativação do plasminogénio(13).
4.2.2 COAGULOPATIA
A coagulopatia associada ao trauma é definida como hemorragia anormal ou excessiva de lesões traumáticas, superfícies mucosas ou serosas e acessos vasculares ou aparecimento de hematomas em locais não traumatizados, devido a alterações hemostáticas direta ou indiretamente associadas ao trauma(17).
A administração de fluidoterapia endovenosa é mais um mecanismo que reconhecidamente contribui para o desenvolvimento de coagulopatia, por diluição dos fatores de coagulação e das plaquetas e por contribuir para o aparecimento de hipotermia, que como já se referiu pode causar distúrbios hemorrágicos(18).
A acidose também desempenha um papel importante no desenvolvimento deste fenômeno, uma vez que a diminuição do pH para valores próximos de 7 resulta numa diminuição da atividade enzimática dos fatores de coagulação. Adicionalmente, o aumento da concentração de íons de hidrogênio interfere negativamente na interação entre os complexos de fatores de coagulação e os fosfolipídios expostos à superfícies de plaquetas ativadas, o que diminui o nível de atividade dos fatores de coagulação(17).
O médico deve ter em mente que o uso de cristaloides nos pacientes em estado de hipocoagulabilidade é extremamente limitado, pois uso de solução salina a 0,9% e de Ringer Lactato aumenta a lesão por reperfusão, induz adesão leucocitária e acarreta a hemodiluição(14). A reposição de fatores de coagulação e plaquetas é, portanto, fundamental nesses cenários. Para a correção da coagulopatia podem ser utilizados plasma fresco, concentrado de plaquetas, fator recombinante VIIa, crioprecipitados, ácido tranexâmico e/ou reposição de cálcio(19,20).
4.2.3 ACIDOSE METABÓLICA
A acidose metabólica é o fenômeno relevante, resultante da hipoperfusão celular secundária ao choque hemorrágico. Pacientes com pH <7,2 apresentam redução da contratilidade miocárdica e do débito cardíaco, vasodilatação, hipotensão, bradicardia, arritmias cardíacas, redução do fluxo sanguíneo renal/hepático e diminuição da resposta às catecolaminas endógenas e exógenas(21).
A correção da acidose metabólica exige o controle das perdas hemorrágicas e a otimização da distribuição tecidual de oxigênio, através de transfusões sanguíneas e do aumento farmacológico do débito cardíaco(18).
A avaliação do efeito da acidose metabólica no prognóstico destes pacientes é complexa, no entanto verificou-se que o tempo necessário para a normalização dos níveis séricos de lactato é um importante fator de prognóstico em traumatizados graves, observando-se melhoria da sobrevida quando a normalização ocorre nas primeiras 24 horas(22).
5. CONSIDERAÇÕES FINAIS
Nota-se que a falta de protocolos específicos para indicação do damage control, levam a dependência da experiência e/ou agilidade do médico cirurgião para seletiva dos pacientes politraumatizados graves e com isso diminuir a taxa de mortalidade nos mesmos.
Não há momento “divisor de águas” além do qual se deva interromper o ato cirúrgico e optar por “damage control”(8,10). A experiência clínica, até o presente momento, já demonstrou que quando feita de maneira correta e quando bem indicada, diminui a mortalidade em pacientes com traumas(1,6).
REFERÊNCIAS
01. Germanos S, Gourgiotis S, Villias C, Bertucci M, Dimopoulos N, Salemis N. Damage control surgery in the abdomen: an approach for the management of severe injured patients. Int J Surg. 2008 Jun;6(3):246-52.
02. Rotondo MF, Schwab CW, McGonigal MD, Phillips GR, 3rd, Fruchterman TM, Kauder DR, et al. ‘Damage control’: an approach for improved survival in exsanguinating penetrating abdominal injury. J Trauma. 1993 Sep;35(3):375-82; discussion 82-3.
03. Stone HH, Strom PR, Mullins RJ. Management of the major coagulopathy with onset during laparotomy. Ann Surg. 1983 May; 197(5):532-5.
04. Walker ML. The damage control laparotomy. J Natl Med Assoc. 1995 Feb;87(2):119-22.
05. Gruen RL, Jurkovich GJ, McIntyre LK, Foy HM, Maier RV. Patterns of errors contributing to trauma mortality: lessons learned from 2,594 deaths. Ann Surg. 2006 Sep;244(3):371-80.
06. Parreira JG, Solda S, Rasslan S. [Damage control: a tactical alternative for the management of exanguinating trauma patients]. Arq Gastroenterol. 2002 Jul-Sep;39(3):188-97.
07. Moore EE. Thomas G. Orr Memorial Lecture. Staged laparotomy for the hypothermia, acidosis, and coagulopathy syndrome. Am J Surg. 1996 Nov;172(5):405-10.
08. Lima RAC, Rocco PRM. Cirurgia para controle do dano: uma revisão. Rev Col Bras Cir. 2007; 34(4):257-63.
09. Stalhschmidt CMM, Formighieri B, Lubachevski FL. Controle de danos no trauma abdominal e lesões associadas: experi- ência de cinco anos em um serviço de emergência. Rev Col Bras Cir. 2006; 33(4): 215-9.
10. Pereira Jr. GA, Scarpelini S, Basile-Filho A, Andrade JI. Índices de trauma. Medicina (Ribeirão Preto). 1999; 32:237-50.
11. Kairinos N, Hayes PM, Nicol AJ, Kahn D. Avoiding futile damage control laparotomy. Injury Int J Care Injured. 2010; 41:64-8.
12. ABRANTES, WL. et al. Cirurgia para controle de danos: breve revisão. Rev Med Minas Gerais, Belo Horizonte. 2012; 22 (Supl 5): S14-S17.
15. Tsuei BJ, Kearney PA. Hypothermia in the trauma patient. Injury. 2004 Jan;35(1):7-15.
14. Jurkovich GJ, Greiser WB, Luterman A, Curreri PW. Hypothermia in trauma victims: an ominous predictor of survival. J Trauma. 1987 Sep;27(9):1019-24.
15. Jansen JO, Loudon MA. Damage control surgery in a non-trauma setting. Br J Surg. 2007;94(7):789-90.
16. Feliciano D, Moore EE, Mattox KL. Trauma. 4ª ed. New York: McGraw-Hill; 2000. Damage control and alternative wound closures in abdominal trauma; p.907-32.
17. Hess JR, Lawson JH. The coagulopathy of trauma versus disseminated intravascular coagulation. J Trauma. 2006 Jun;60(6 Suppl):S12-9.
18. Shapiro MB, Jenkins DH, Schwab CW, Rotondo MF. Damage control: collective review. J Trauma. 2000 Nov;49(5):969-78.
19. Krishna G, Sleigh JW, Rahman H. Physiological predictors of death in exsanguinating trauma patients undergoing conventional trauma surgery. Aust N Z J Surg. 1998 Dec;68(12):826-9.
20. Asensio JA, McDuffie L, Petrone P, Roldan G, Forno W, Gambaro E, et al. Reliable variables in the exsanguinated patient which indicate damage control and predict outcome. Am J Surg. 2001 Dec;182(6):743-51.
21. Wyrzykowski AD, Feliciano DV. Trauma damage control. In: Mattox KL, Moore EE, Feliciano DV, editors. Trauma. New York: Mc- Graw Hill; 2013. p.725-46.
22. Thorsen K, Ringdal KG, Strand K, Soreide E, Hagemo J, Soreide K. Clinical and cellular effects of hypothermia, acidosis and coagulopathy in major injury. Br J Surg. 2011 Jul;98(7):894-907.
[1] Graduanda em Medicina pela Universidade Brasil – Fernandópolis, Brasil.
[2] Graduanda em Medicina pela Universidade Brasil – Fernandópolis, Brasil.
[3] Médico Especialista em Cirurgia Oncológica pelo Hospital de Câncer de Barretos, Brasil. Especialista em Cirurgia Geral pela Santa Casa de Votuporanga, Brasil. Graduado em Medicina pela Universidade Brasil – Fernandópolis, Brasil. Professor do Curso de Medicina da Universidade Brasil – Fernandópolis, Brasil.
Enviado: Setembro, 2018
Aprovado: Outubro, 2018

