RELATO DE CASO
CARVALHO, Rayanne Rodrigues [1], CARVALHO, Jacqueline Rodrigues de [2], NEGREIROS, Sandra de Barros Cobra [3]
CARVALHO, Rayanne Rodrigues. CARVALHO, Jacqueline Rodrigues de. NEGREIROS, Sandra de Barros Cobra. Amiloidose primária, um diagnóstico facilitado pelo ecocardiograma: um relato de caso. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano. 08, Ed. 08, Vol. 03, pp. 50-60. Agosto de 2023. ISSN: 2448-0959, Link de acesso: https://www.nucleodoconhecimento.com.br/saude/amiloidose-primaria, DOI: 10.32749/nucleodoconhecimento.com.br/saude/amiloidose-primaria
RESUMO
A amiloidose cardíaca (AC) é uma doença rara que se enquadra no grupo de cardiomiopatias infiltrativas por depósito de amilóides, subdividida em grupos de acordo com as proteínas amiloides precursoras. A amiloidose primária ou AL é o segundo subtipo mais comum de amiloidose sendo que, em cerca de 50% dos casos há acometimento cardíaco. Como é uma doença sistêmica que afeta diversos órgãos, seu diagnóstico é um desafio por vezes tardio, o que interfere diretamente no tratamento e prognóstico desses pacientes. Reporta-se o caso de um homem de meia idade que apresentava sintomas de diferentes sistemas orgânicos e que teve o diagnóstico de amiloidose presumido após a realização de um ecocardiograma que mostrou sinais sugestivos da patologia. Os dados de anamnese, exames físicos e laboratoriais, foram coletados do prontuário e a revisão de literatura permitiram concluir que a ecocardiografia pode ser uma ferramenta valiosa nesses casos, tanto para suspeição e direcionamento para o tratamento, quanto para o acompanhamento desses pacientes.
Palavras-chave: Ecocardiografia,Strain longitudinal, Acessibilidade, Tratamento precoce, Prognóstico.
1. INTRODUÇÃO
A amiloidose cardíaca é um grupo de cardiomiopatias infiltrativas por depósito amiloide. Pode ser dividida em subgrupos de acordo com a proteína precursora (MANN et.al., 2018). Existem mais de 30 tipos de proteínas amiloidogênicas, contudo observa-se mais comumente cinco tipos que acometem o coração, são elas: cadeias leves anormais produzidas por uma discrasia plasmocitária (Amiloidose AL/primária), amiloide originário da transtirretina tipo selvagem (TTR) ou mutante (ATTR familiar), amilóide A e apoA1 (SIMÕES, et al., 2021). Aproximadamente 95% dos casos de amiloidose cardíaca são decorrentes dos subtipos AL e ATTR tanto em sua forma selvagem quanto em sua forma hereditária (MANN et al., 2018).
A forma AL ou primária está intimamente ligada ao mieloma múltiplo, têm predomínio no sexo masculino, a idade média para o aparecimento dos sintomas é 60 anos e a sobrevida é de aproximadamente 2-4 anos (MANN et.al., 2018; CORREIA et al., 2020; MONTEIRO et al., 2015).
Por se tratar de uma doença sistêmica, a amiloidose AL pode afetar quase todos os órgãos (SIMÕES et al., 2021) (MANN et al., 2018). As manifestações clínicas dependerão dos órgãos afetados. O acometimento cardíaco ocorre em cerca de 50% dos pacientes, no entanto, pode ser previsível um pior prognóstico, sobretudo naqueles em que a doença já se encontra avançada (MANN et al., 2018; CORREIA et al., 2020).
O método padrão-ouro para diagnóstico da amiloidose é a detecção de fibrilas amilóides no tecido biopsiado que se coram através da tintura vermelho do congo com birrefringência em maçã verde sob luz polarizada (SIMÕES et al., 2021; CORREIA et al., 2020). Para distinguir os tipos de amiloidose o melhor método é a realização da espectometria de massa (SIMÕES et al., 2021; DORBALA et al., 2020).
O diagnóstico definitivo de amiloidose AL é feito através da biópsia de possíveis órgãos afetados, mas para isso, é necessário que se tenha uma suspeição diagnóstica prévia. O presente caso tem como objetivo apresentar a relevância da ecocardiografia para o diagnóstico da amiloidose cardíaca visando o início mais precoce possível do tratamento e consequentemente, o impacto no prognóstico desses pacientes.
2. RELATO DE CASO
Paciente do sexo masculino, 49 anos, apresentava parestesia e paresia de membros inferiores há aproximadamente 1 ano. Devido aos sintomas de neuropatia periférica compareceu à consulta com neurologia para investigação do quadro, durante a avaliação além dos sintomas neurológicos relatados foi observado também um quadro de anasarca e espumúria. Diante dos sinais e sintomas relatados foi optada por internação hospitalar para elucidação diagnóstica.
No hospital o paciente realizou alguns exames complementares para investigação, dentre eles, a eletroneuromiografia que mostrou polineuropatia sensitivo-motora adquirida, em atividade. Os exames laboratoriais evidenciaram alteração da função renal (Creatinina de 1,74mg/dL e uréia de 45mg/dL) e a proteinúria de 24 horas constatou 6.179mg de proteínas em 900ml. Realizou ainda exames para pesquisa de doenças reumatológicas/ autoimunes (FAN, anti-RO, anti-LA, anti-cardiolipina, anticoagulante lúpico, anti-MPO, anti-PR3 e ANCA) que foram todos negativos.
Durante a internação paciente evoluiu com quadro de dispneia e elevação de peptídeo natriurético atrial-BNP (2.368mg/dL). Para complementar a investigação diagnóstica de um possível quadro de disfunção cardíaca foi solicitado um exame de Ecocardiogramae os achados foram: aumento da espessura das paredes miocárdicas (Septo e parede posterior de 16mm), miocárdico com aspecto de granulações heterogêneas semelhantes à um “vidro moído”, alterações de Doppler compatíveis com disfunção diastólica grau II, dilatação de ambos os átrios, espessamento valvar e do septo interatrial, bem como hipertrofia das paredes do ventrículo direito.
A análise do padrão de strain longitudinal do ventrículo esquerdo (SGLVE) demonstrou um padrão do tipo “Apical Sparing”, caracterizado pela redução da contração miocárdica nas regiões basal e medial do VE e preservação da contratilidade na região apical. A razão entre as médias do strain da região apical e as médias das regiões basal somada a média do VE foi de 1,6 (valor normal < 1) e a medida da razão entre a fração de ejeção (medida pelo método de Simpson) e o valor do SGLVE, foi de 6,9 (valor normal < 4). Os achados estão demonstrados na imagem 1.
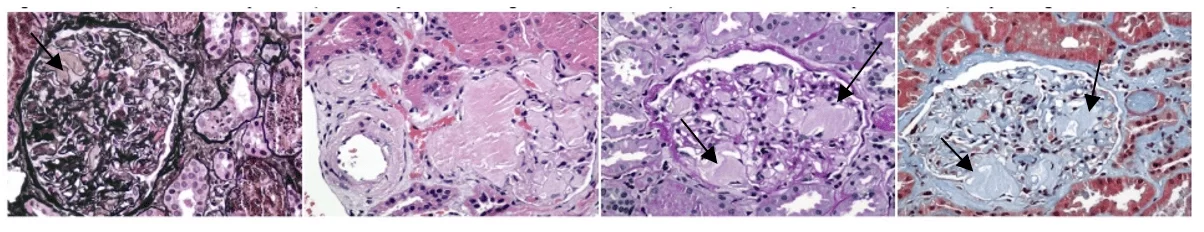
Na sequência da investigação diagnóstica, optou-se pela biópsia renal que evidenciou uma expansão mesangial intensa por material celular eosinofílico e amorfo que apresentaram coloração tintorial de Vermelho Congo e se polarizaram com a cor maçã verde, conforme mostra a imagem 2, configurando-se a partir daí o diagnóstico de Amiloidose.
Para definir qual o subtipo de amiloidose o paciente foi submetido ainda ao teste genético de pesquisa para alterações no gene TTR, cujo resultado foi negativo, descartando assim a forma TTR familiar. Realizou também a espectometria da biópsia renal que confirmou a existência de cadeias leves de imunoglobulina Lambda, o que indica o diagnóstico de amiloidose do tipo AL.
Após a confirmação de amiloidose AL foi realizada uma ressonância magnética cardíaca que mostrou hipertrofia parietal concêntrica com realce tardio miocárdico difuso com áreas de predomínio e transmuralidade no septo interventricular e na parede lateral mediobasal do ventrículo esquerdo, achados que são compatíveis com doença por depósito amilóide.
Outro exame realizado foi a biópsia de medula óssea com avaliação por imunofluorescência que mostrou 4,57% de plasmócitos com imunofenótipo anormal, achado compatível com gamopatia monoclonal.
Diante dos sintomas clínicos e exames complementares realizados foi iniciado o tratamento específico com o protocolo Cybord (Bortezomibe, ciclofosfamida e dexametasona) e tratamento sintomático da insuficiência cardíaca com diurético (furosemida) e realizada tentativa com inibidor da enzima conversora de angiotensina (enalapril), contudo, sem êxito devido à labilidade pressórica com hipotensão sintomática. O paciente segue em tratamento e acompanhamento com equipe multidisciplinar da hematologia, cardiologia e nefrologia. Foram programados 8 ciclos mensais do protocolo descrito, após 5 meses de tratamento apresentou melhora significativa dos sintomas cardíacos com redução de 70% do BNP (2.368mg/dL>714mg/dL), contudo ainda persiste com proteinúria significativa (7.713mg/24horas). Ao término dos 8 ciclos será avaliada a resposta renal e cardíaca ao tratamento, se positivas, paciente será encaminhado para transplante de medula óssea autólogo.
Imagem 1: As imagens 4CH, 2CH e APLAX mostram as curvas de deformação longitudinal do ventrículo esquerdo globalmente reduzidas, contudo um pouco mais preservadas nos segmentos apicais (Linhas verdes e roxas). Na imagem inferior direita se observa o strain longitudinal do ventrículo esquerdo representado na forma de Bulls eye evidenciando o padrão Apical Sparing – Redução da deformação longitudinal do ventrículo esquerdo com relativa preservação dos segmentos apicais
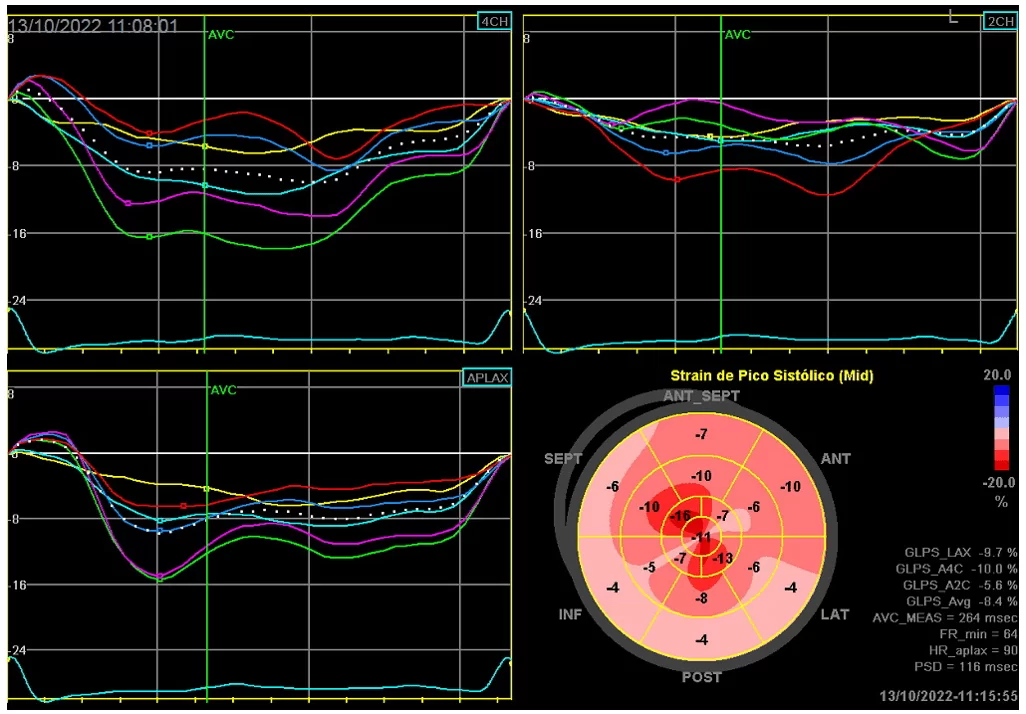
Imagem 2: Mostra a microscopia de luz do compartimento glomerular com a matriz mesangial aumentada à custa de depósito de material amorfo, acelular, eosinofílico, com aspecto de “algodão doce” (Setas). Tal material corou-se à coloração de Vermelho Congo e polarizou-se em “verde maçã”
3. DISCUSSÃO
Este relato descreve o quadro clínico de um paciente que vinha sendo investigado por apresentar sintomas neurológicos há um ano, seguidos por sintomas renais, mas sem uma linha de diagnóstico etiológico bem definida. A doença por depósito amilóide só foi suspeitada e confirmada, após ter sido feito o ecocardiograma transtorácico.
De acordo com a Simões et al.(2021), como a amiloidose é uma doença que afeta diversos sistemas orgânicos é por sua vez, subdiagnosticada, ou tem seu diagnóstico retardado devido à variação na apresentação clínica.
Os sintomas dependerão dos órgãos envolvidos. Algumas das manifestações extracardíacas habitualmente observadas são a neuropatia periférica ou autonômica, caquexia, macroglossia, púrpura periorbital (praticamente patognomônico de amiloidose AL) e alteração renal que pode se manifestar através, principalmente, de proteinúria acentuada (SIMÕES et al., 2021; MANN et al.,2018; CORREIA et al.,2020).
O acometimento cardíaco ocorre em cerca de 50% dos pacientes, os principais sintomas são os relacionados a um quadro restritivo de insuficiência cardíaca, angina típica e arritmias que decorrem da infiltração amilóide de pequenos vasos e do sistema de condução, respectivamente (PINTO et al., 2021).Também é possível notar síncope postural, que está associada a disfunção autonômica e/ou a débito cardíaco baixo quando a cardiopatia está num estágio avançado (SIMÕES et al., 2021; MANNet al., 2018; CORREIA et al., 2020; MONTEIRO et al.,2015).
O paciente ilustrado apresentou inicialmente os sintomas de neuropatia periférica e a alteração renal que se manifestou através da síndrome nefrótica. Quanto aos sintomas cardiovasculares, apresentou apenas dispnéia, que é o sintoma mais comum da amiloidose cardíaca, evidenciando uma insuficiência cardíaca de padrão restritivo, cujo acometimento miocárdico pela doença foi desnudado pelo exame ecocardiográfico.
De acordo com Vergaro et al. (2020), o ecocardiograma é importante para o diagnóstico de amiloidose cardíaca por ser acessível e permitir a identificação de sinalizadores da doença como a hipertrofia ventricular esquerda >12 mm, associada a hipertrofia de ventrículo direito. O miocárdio tem um aspecto granulado semelhante ao “vidro moído”, o que já desperta a suspeita diagnóstica. Outros achados que podemos observar neste exame de imagem são: aumento biatrial que ocorre tanto em decorrência do aumento de pressões no átrio esquerdo pela hipertrofia ventricular, quanto pelo depósito de proteínas amilóides na parede atrial. O espessamento valvar e a efusão pericárdica também podem ser encontrados (DORBALA et al.,2020; CUDDYet al., 2022).
A fração de ejeção do ventrículo esquerdo costuma estar preservada nos estágios avançados da doença, mas, nos estágios iniciais, já é possível detectar uma redução na contração longitudinal do ventrículo esquerdo predominantemente nos segmentos médios e basais, usando-se a técnica de avaliação ecocardiográfica da contração longitudinal do ventrículo esquerdo (DORBALA et al.,2020).
A avaliação ecocadiográfica da deformação longitudinal miocárdica do ventrículo esquerdo pela técnica do Speckle tracking (SGLVE) auxilia na diferenciação entre amiloidose cardíaca e outras causas de hipertrofia ventricular esquerda, bem como no diagnóstico mais precoce da própria amiloidose, uma vez que a redução da deformação longitudinal do miocárdio é uma das primeiras alterações cardíacas manifestas (DORBALA et al.,2020; CUDDY et al.,2022).
Os depósitos amilóides do miocárdio geram uma redução segmentar da deformação miocárdica, que é mais acentuada nas porções basais e mediais do ventrículo esquerdo com relativa preservação dos segmentos apicais, padrão chamado de Apical Sparing. Quando a relação das médias do SGLVE na região apical dividido pela soma das médias das deformações nas regiões medial e basal é > 1, sugere tratar-se de cardiomiopatia amilóide com sensibilidade de 93% e especificidade de 82%(DORBALA et al., 2020; PHELAN et al., 2012). Outra medida que auxilia no diagnóstico de amiloidose cardíaca é a razão entre a fração de ejeção do ventrículo esquerdo e a deformação longitudinal global, quanto maior essa relação maior a chance de tratar-se de depósitos amilóides, sendo o ponto de corte 4,1 (DORBALA et al., 2020; TERNACLE et al., 2016).
Nesse caso específico, pode-se constatar diversos achados ecocardiográficos que sugeriam amiloidose cardíaca, como o aumento da espessura das paredes do ventrículo esquerdo (16mm), hipertrofia ventricular direita, miocárdio granulado com aspecto de “vidro moído”, além do achado de um SGLVE com padrão denominado de “Apical Sparing”, com um valor medido pelas relações entre as porções medial e apical de 2e a relação da fração de ejeção dividida pelo valor do SGLVE de 5, achados que apresentam elevada sensibilidade e especificidade para amiloidose cardíaca (DORBALA et al., 2020; PHELAN et al., 2012; TERNACLE et al.,2016).
De acordo com a Simões et al.(2021), o método padrão-ouro para diagnóstico da amiloidose é a visualização de fibrilas amilóides no tecido biopsiado que se coram através da tintura vermelho do congo com birrefringência em maçã verde sob luz polarizada. Tais tinturas possuem sensibilidade entre 60-80% e especificidade que varia entre 90-100% (CORREIA et al., 2020). Para distinguir entre os tipos de amiloidose, fator crucial para determinar qual o tratamento adequado, o melhor método é a realização da espectometria de massa que possui sensibilidade >98% para o diagnóstico (SIMÕES et al., 2021; DORBALA et al., 2020). No paciente estudado o diagnóstico de amiloidose primária foi feito com base nas metodologias consideradas padrão-ouro: tintura de vermelho do congo e espectometria de massa.
O tratamento do subtipo AL tem como objetivo normalizar os níveis de cadeias leves e reverter as lesões nos órgãos acometidos pelos depósitos amilóides, que denominamos, respectivamente, de resposta hematológica e resposta orgânica. O hematologista é o profissional que conduz o tratamento para redução da discrasia plasmocitária com a quimioterapia associada a transplante de medula óssea autólogo, ou apenas a quimioterapia. Uma equipe multidisciplinar composta por diversos especialistas em conjunto com o hematologista, também conduzem o tratamento das lesões nos órgãos acometidos (SIMÕES et al., 2021).
A redução >30% do valor do peptídeo natriurético atrial (BNP) dosado no sangue e a melhora da classe funcional do paciente, são critérios de boa resposta ao tratamento instituído. Quanto ao rim, considera-se uma boa resposta orgânica a redução >50% da proteinúria em 6 meses sem redução da taxa de filtração glomerular maior que 25%. Após 3 meses do término da quimioterapia faz-se a avaliação das respostas hematológica e orgânica, se forem favoráveis o paciente pode ser candidato ao transplante de medula óssea autólogo (SIMÕES et al., 2021).
O paciente em discussão foi submetido ao tratamento quimioterápico e apresentou uma boa resposta cardíaca com redução > 70% do BNP e melhora de classe funcional; quanto ao aspecto renal ainda não apresentou critério de boa resposta, mantendo uma proteinúria próxima aos valores do diagnóstico, contudo a quimioterapia ainda está em curso, e ao término desta, será avaliada a presença de remissão hematológica e das lesões orgânicas, se o resultado for favorável o paciente será candidato ao transplante de medula óssea.
4. CONCLUSÃO
O diagnóstico de amiloidose primária é desafiador devido a ampla variabilidade de apresentações clínicas. A presença de acometimento cardíaco denota pior prognóstico nesses pacientes, logo se entende a necessidade de identificação da patologia nos estágios iniciais para que os pacientes possam receber o tratamento no momento oportuno lhes permitindo reduzir a progressão da doença. A ecocardiografia com avaliação da deformação miocárdica do ventrículo esquerdo se mostrou um valioso exame para aventar a suspeita diagnóstica de amiloidose cardíaca, visto a boa sensibilidade e especificidade do método para a doença. Diante disso, constatamos a necessidade de maior aplicação do ecocardiograma em pacientes com amplo espectro de manifestações clínicas para que se tenha mais celeridade no diagnóstico e tratamento da amiloidose cardíaca.
REFERÊNCIAS
CORREIA, Edileide de Barros et al. AMILOIDOSE CARDÍACA. Revista da Sociedade de Cardiologia do Estado de São Paulo, [S.L.], v. 30, n. 2, p. 206-217, 2020. Disponível em:http://dx.doi.org/10.29381/0103-8559/20203002206-17.
CUDDY, Sarah A.M. et al. Practical Points for Echocardiography in Cardiac Amyloidosis. Journal Of The American Society Of Echocardiography, [S.L.], v. 35, n. 9, p. 31-40,2022. Elsevier BV. Disponível em: http://dx.doi.org/10.1016/j.echo.2022.06.006.
DORBALA, Sharmila et al. How to Image Cardiac Amyloidosis. Jacc: Cardiovascular Imaging, [S.L.], v. 13, n. 6, p. 1368-1383,2020. Elsevier BV. Disponível em: http://dx.doi.org/10.1016/j.jcmg.2019.07.015.
MANN, L. et.al. Braunwald Tratado de Doenças Cardiovasculares. 10º edição.Rio de Janeiro:Elsevier, p. 424-426, 2018.
MONTEIRO, Natalia Fernandes et al. DIFICULDADE NO DIAGNÓSTICO DE AMILOIDOSE PRIMÁRIA: UM RELATO DE CASO. Revista de Medicina de Minas Gerais, v. 25, n. 2, p. 268-274, 2015.
PHELAN, Dermot et al.Relative apical sparing of longitudinal strain using two-dimensional speckle-tracking echocardiography is both sensitive and specific for the diagnosis of cardiac amyloidosis. Heart, [S.L.], v. 98, n. 19, p. 1442-1448,2012. BMJ. Disponível em: http://dx.doi.org/10.1136/heartjnl-2012-302353.
PINTO, Ibraim Masciarelli et al. AMILOIDOSE CARDÍACA: ainda uma doença rara?. Revista da Sociedade de Cardiologia do Estado de São Paulo, [S.L.], v. 31, n. 2, p. 187-197, 2021. Disponível em: http://dx.doi.org/10.29381/0103-8559/20213102187-97.
SIMÕES, Marcus Vet al.Posicionamento sobre Diagnóstico e Tratamento da Amiloidose Cardíaca – 2021. Arquivos Brasileiros de Cardiologia, [S.L.], v. 117, n. 3, p. 561-598, set. 2021. Sociedade Brasileira de Cardiologia. http://dx.doi.org/10.36660/abc.20210718.
TERNACLE, Julienet al. Causes and Consequences of Longitudinal LV Dysfunction Assessed by 2D Strain Echocardiography in Cardiac Amyloidosis. Jacc: Cardiovascular Imaging, [S.L.], v. 9, n. 2, p. 126-138, 2016. Elsevier BV. Disponível em: http://dx.doi.org/10.1016/j.jcmg.2015.05.014.
VERGARO, Giuseppeet al.Keys to early diagnosis of cardiac amyloidosis: red flags from clinical, laboratory and imaging findings. European Journal Of Preventive Cardiology, [S.L.], v. 27, n. 17, p. 1806-1815, 2020. Oxford University Press (OUP). Disponível em: http://dx.doi.org/10.1177/2047487319877708.
[1] Especialista e Cardiologia com área de atuação em Ecocardiografia, Especialista em Clínica Cédica e Graduada em Medicina. ORCID: 0009-0006-5692-9718. Currículo Lattes: http://lattes.cnpq.br/2586011351593591.
[2] Especialista e Cardiologia com área de atuação em Ecocardiografia, Especialista em Clínica Medicina. ORCID: 0009-0007-0897-6058. Currículo Lattes: http://lattes.cnpq.br/3605541654566769.
[3] Orientadora. Doutora em Ciências Médicas, Mestre em Ciências Médicas, Especialista em Cardiologia com área em Ecocardiografia, Especialista em Clínica Médica e Graduada em Medicina. ORCID: 0000-0003-0837-339X. Currículo Lattes: http://lattes.cnpq.br/3082276307677121.
Enviado: 22 de junho, 2023.
Aprovado: 27 de junho, 2023.

