ARTICLE ORIGINAL
DIOCESANO, Kamila Bezerra Fernandes [1], COSTA, Aurélio Antonio Ribeiro [2], LEITÃO, Glauber Moreira [3]
DIOCESANO, Kamila Bezerra Fernandes. COSTA, Aurélio Antonio Ribeiro. LEITÃO, Glauber Moreira. Cancer du sein multifocal/multicentrique : Profil clinique/épidémiologique et modèles immunohistochimiques parmi les foyers : Étude transversale. Revista Científica Multidisciplinar Núcleo do Conhecimento. An 05, Ed. 06, vol. 04, p. 73 à 94. juin 2020. ISSN: 2448-0959, Lien d’accès: https://www.nucleodoconhecimento.com.br/sante/multifocale-multicentrique, DOI: 10.32749/nucleodoconhecimento.com.br/sante/multifocale-multicentrique
RÉSUMÉ
Le cancer du sein multifocal/multicentrique (MF/MC) est une maladie qui comprend de nombreux paradigmes dans la pratique actuelle du cancer du sein. Pour lutter contre la morbidité et la mortalité de cette la meilleure option est une stratégie thérapeutique rationnelle, qui devrait commencer par une compréhension biologique claire de la multicentricité et la multifocalité, puisque cela est connu, le traitement correct peut être suivi. Notre objectif était de définir le profil des patients présentant le cancer du sein multifocal et multicentrique et d’évaluer s’il y a désaccord entre les foyers de tumeur concernant le récepteur hormonal et Her-2. Nous avons rétrospectivement analysé 89 patients présentant le cancer du sein invasif multifocal et multicentrique dans deux établissements tertiaires dans le nord-est du Brésil, évaluant le récepteur hormonal, Her-2 et ki67 dans chaque foyer de tumeur de 25 de ces patients, soulignant le désaccord ou pas entre eux, et le type et le grade histologique, la métastase de ganglion lymphatique et la distance et l’âge. De ces patients, 9% a présenté l’hétérogénéité entre les foyers de tumeur. La proportion de métastases dans le ganglion lymphatique axillaire était de 42% et seulement 10% pour les métastases lointaines. 45% des femmes dans l’étude ont eu le grade histologique II ou III. Nous avons trouvé une prévalence de 40,5% de l’Her-2 négatif et 45% du récepteur positif d’oestrogène. Il n’y avait aucune différence statistiquement significative entre le cancer multifocal et multicentrique. Nous concluons que le cancer du sein MF/MC montre l’hétérogénéité entre les foyers de tumeur par rapport aux paramètres biologiques, qui joue un rôle crucial dans la prise de décisions au sujet du traitement et par conséquent sur la répétition de tumeur, le pronostic et la métastase éloignée.
Mots clés: Cancer du sein, hétérogénéité, multifocale, multicentrique.
INTRODUCTION
Le cancer du sein est le néoplasme malin qui affecte le plus les femmes dans le monde entier. C’est la deuxième cause de décès par cancer dans les pays développés, derrière le cancer du poumon, et la principale cause de décès par cancer dans les pays en développement. En 2013, il y a eu environ 1,8 million de nouveaux cas dans le monde et 471 000 décès[1]. Pour le Brésil, l’estimation est d’environ 60 000 nouveaux cas de cancer du sein par an, avec un risque estimé à 56,20 cas pour 100 000 femmes. Dans l’État de Pernambuco est de 2.450 nouveaux cas, avec un taux d’incidence brut de 90,25 cas pour 100.000 habitants seulement pour Recife, la capital[2]e.
Le cancer du sein est classé comme multicentrique (MC) et/ou multifocal (MF) lorsqu’il présente plus d’une concentration tumorale et synchrone dans le même sein. La différence entre eux est basée sur l’emplacement, qu’ils soient situés dans différents quadrants du sein ou dans celui-ci, respectivemen[3,4]t.
L’incidence des tumeurs de MF et/ou de MC varie entre 6% et 60[5,6]%. Les caractéristiques clinique-pathologiques et pronostiques du cancer du sein multifocal et multicentrique ne sont pas encore bien établies.
Basé sur le raisonnement que les lésions avec l’histologie et le degré semblables devraient être biologiquement semblables, l’université américain de pathologie recommande caractérisant tous les foyers de MF/MC avec l’immunohistochimie seulement quand histologie et ou degré histologique diffèrent les uns des autre[7]s. Par conséquent, l’immunohistorichimie est demandée seulement pour la plus grande tumeur et les autres foyers ne sont pas évalué[8]s.
Une étude comprenant 113 patients, dans laquelle l’immunohistochimie de tous les foyers de tumeur a été évalué, a constaté que le désaccord entre les foyers était présent dans 4.4% – 18.6% des cas, étant indiqués différents traitements comparés à ce qui aurait été prescrit s’ils avaient pris en compte seulement l’immunohistochimie d’une seule focalisation, le plus gran[9]d.
La décision de choisir la meilleure option thérapeutique pour le cancer du sein MC/MF devrait commencer par une compréhension biologique et épidémiologique claire de la multicentricité et du multifocus, puisque ceux-ci sont connus, le traitement correct peut être suivi. L’évaluation immunohistochimique des tumeurs joue un rôle crucial dans la prise de décision dans le traitement du cancer du sein et lorsqu’elle est exprimée discordant dans les différents foyers peut fournir aux patients la possibilité de différentes thérapies.
Selon ce qui a été étudié, l’objectif de cette étude était de décrire le profil clinique et épidémiologique des femmes atteintes d’un cancer du sein MF/MC et les schémas immunohistochimiques des divers foyers du cancer du sein chez chaque femme dans deux hôpitaux tertiaires du nord-est du Brésil.
Méthodes
L’étude transversale descriptive a été réalisée à l’Instituto de Medidina Integral Prof. Fernando Figueira (IMIP) et l’hôpital Barão de Lucena (HBL), établissements de l’État de Pernambuco, se sont concentrés sur les soins médicaux dans diverses spécialités et se sont engagés à l’enseignement, la recherche et l’extension.
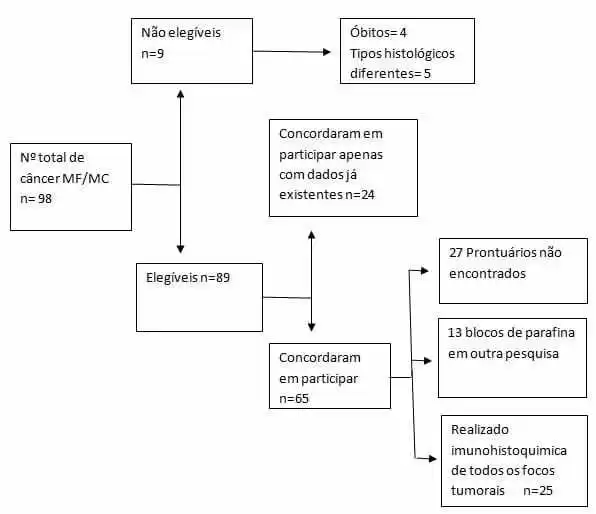
L’échantillon a été constitué de façon conventionnelle par des femmes identifiées rétrospectivement avec le cancer du sein MF ou MC assisté dans l’IMIP de janvier 2013 à juin 2016 et en HBL dans la période de janvier 2012 à juin 2016 qui répondent aux critères d’admissibilité de la recherche, qui sont: avoir deux foyers tumoraux ou plus diagnostiqués dans le même sein simultanément , sauf dans les cas de répétition d’une tumeur précédente, étant vivant et ayant le même type et degré histologique entre les foyers.
Des visites hebdomadaires ont été faites au laboratoire d’anatomie pathologique de HBL et au centre de sein d’IMIP et les résultats du spécimen histopathologique ou chirurgical de biopsie des tumeurs de sein des patients avec un profil compatible avec les critères d’admissibilité de l’étude ont été choisis.
Le tissu tumoral obtenu par biopsie de noyau ou au moment de la chirurgie définitive est préservé et emballé dans la formaline (10% de formaldéhyde) tamponné et transformé en blocs de paraffine. Ces blocs sont stockés à température ambiante jusqu’à une analyse plus approfondie, à la fois pour l’examen histopathologique et immunohistochimique.
Après avoir identifié ces patients, le chercheur a communiqué avec les patients qui ont été présentés à la recherche et invités à participer en signant le formulaire de consentement libre et éclairé.
L’immunohistochimie de chaque foyer de tumeur a été demandée. Ceci a été obtenu par les blocs de paraffine déjà stockés, ou, rétrospectivement, des enregistrements existants du foyer de tumeur étudié.
L’immunohistochimie est un outil vital dans l’étude des lésions mammaires. Utilisation d’anticorps spécifiques contre les protéines intracellulaires présentes en petite quantité dans le noyau, le cytoplasme et/ou la membrane cellulair[10]e. La technique immunohistochimique identifie dans la tumeur les récepteurs d’oestrogène et de progestérone, l’indice de prolifération de cellules tumorales et l’expression de la protéine de membrane HER-2. Il a été demandé pour toutes les tumeurs multiples présentes simultanément dans le même sein et a été exécuté dans un laboratoire avec un professionnel spécialisé dans la pathologie de sein, dans lequel il emploie la méthode de streptavidin-biotine marquée par la machine de PT-link de DAKO.
Les patients qui n’ont pas autorisé la demande d’immunohistorichimie ont accepté de participer à l’étude uniquement avec des informations contenues dans les dossiers médicaux et les données histopathologiques et immunohistorichemical existantes.
Récepteur hormonal, Her-2 et ki67 ont été évalués dans chaque foyer de tumeur, soulignant le désaccord ou pas entre eux ; type et degré histologique; métastase et distance des ganglions lymphatiques; invasion lymphovasculaire et l’âge du patient.
Figure 1. Diagramme de flux de capture des participants
Les informations collectées ont été saisies en double entrée (le chercheur et un collaborateur), à différents moments, dans une fiche de données (logiciel Microsoft Office Excel – 2010), créée dans le but de valider la saisie. La base de données a subi des tests de correction et de nettoyage pour détecter les erreurs ou les incohérences dans les données. Ce n’est qu’après avoir comparé les banques et effectué les tests de cohérence et de nettoyage que la base de données définitive utilisée pour l’analyse statistique a été utilisée.
Le logiciel SPSS 13.0 (Paquet statistique pour les sciences sociales) pour Windows et Excel 2010 ont été utilisés pour l’analyse des données. Pour analyser le comportement des variables de l’étude, des mesures de tendance centrale et leurs dispersions ont été effectuées, le test quiquadrado des tendances et l’exact de Fisher, à un niveau d’importance de 5%, le cas échéant. Tous les tests ont été appliqués avec 95% de confiance. Les résultats sont présentés sous forme de tableau avec leurs fréquences absolues et relatives respectives.
Résultats
L’incidence des tumeurs MF/MC dans notre étude était de 4% en 2013 et de 5% en 2015. Les données Imip pour 2012 et 2014 ne sont pas disponibles (tableau 1). 64 % des femmes atteintes d’un cancer de la MF/MC avaient plus de 50 ans. À l’exception du fait que de nombreuses données n’étaient pas disponibles, nous avons constaté une fréquence de 33 % des femmes brunes, de 24 % d’écoles primaires incomplètes et de 13 % des femmes mariées (tableau 2).
TABLEAU 1 – Incidence du cancer du sein unifocal, multifocal et multicentrique à l’Hôpital Barão de Lucena, HBL, et Instituto Materno Infantil Prof. Fernando Figueira, IMIP. Recife, Pernambuco
| CA de Mama | n (HBL/IMIP) | % (HBL/IMIP) |
| 2012 | ||
| Unifocal (Californie) | (195/-) | (92,4/-) |
| MC/MF | (16/-) | (7,6/-) |
| 2013 | ||
| Unifocal (Californie) | 477 (184/293) | 95,9 (93,4/97,7) |
| MC/MF | 20 (13/ 7) | 4,0 (6,6/2,3) |
| 2014 | ||
| Unifocal (Californie) | (150/-) | (92,6/-) |
| MC/MF | (12/12) | (7,4/-) |
| 2015 | ||
| Unifocal (Californie) | 523 (162/361) | 94,9 (89,5/97,6) |
| MC/MF | 28 (19/9) | 5,0 (10,5/2,4) |
Les données DEIP pour 2012 et 2014 ne sont pas disponibles.
Source: Recherche IMIP/HBL
TABLEAU 2 – Caractéristiques des patientes atteintes d’un cancer du sein multifocal et multicentrique opérées à l’hôpital Barão de Lucena, HBL, et à l’Instituto Materno Infantil Prof. Fernando Figueira, IMIP. Recife, Pernambuco
| Variables | n | % |
| Âge | ||
| < 50 | 26 | 29,2 |
| ≥ 50 | 57 | 64,1 |
| Cor | ||
| Branca | 16 | 18,0 |
| Noir | 2 | 2,2 |
| Marron | 30 | 33,7 |
| Scolarité | ||
| Analphabètes | 6 | 6,7 |
| École primaire incomplète | 22 | 24,7 |
| École primaire complète | 6 | 6,7 |
| École secondaire incomplète | 1 | 1,1 |
| Terminer l’école secondaire | 12 | 13,5 |
| Matrimonial | ||
| Union stable | 1 | 1,1 |
| Seul | 8 | 9,0 |
| Marié | 13 | 14,6 |
| Divorcé | 3 | 3,4 |
| Veuve | 9 | 10,1 |
Les données non informées pour chaque variable ont été omises du tableau.
Source: Recherche IMIP/HBL
Le type histologique ductal a été trouvé dans 82% des femmes dans notre étude. La proportion de métastases dans le ganglion lymphatique axillaire était de 42% et seulement 10% pour les métastases lointaines. 45% des femmes dans l’étude ont eu le grade histologique II ou III. Nous avons trouvé une prévalence de 40,5% de l’Her-2 négatif et 45% du récepteur positif d’oestrogène. Quant au Ki67, nous avons trouvé 41% avec un taux élevé de prolifération cellulaire. La proportion d’hétérogénéité entre les foyers était de 9 % et nous avons trouvé 65 % de MF et 17 % de MC (tableau 3).
TABLEAU 3 – Caractéristiques cliniques et tumorales des patientes atteintes d’un cancer du sein multifocal et multicentrique opéré à l’hôpital Barão de Lucena, HBL, et à l’Instituto Materno Infantil Prof. Fernando Figueira, IMIP. Recife, Pernambuco
| Variables | n | % |
| Re | ||
| Positif | 40 | 44,9 |
| Négatif | 20 | 22,5 |
| RP | ||
| Positif | 35 | 39,3 |
| Négatif | 25 | 28,1 |
| Her-2 | ||
| Positif | 18 | 20,2 |
| Négatif | 36 | 40,5 |
| Ki67 | ||
| <14% | 16 | 18,0 |
| >14% | 37 | 41,6 |
| Ganglions lymphatiques compromis | ||
| Sortie | 23 | 25,8 |
| 1 a 3 | 18 | 20,2 |
| 4 ou plus | 20 | 22,5 |
| Diplôme histologique | ||
| I | 9 | 10,1 |
| II | 27 | 30,4 |
| III | 13 | 14,6 |
| Type histologique | ||
| Canalaire | 73 | 82,0 |
| Lobulaire | 1 | 1,1 |
| Autres | 4 | 4,5 |
| Taille de la plus grande tumeur | ||
| <2 cm | 24 | 27,0 |
| 2-5 cm | 32 | 36,0 |
| >5 cm | 5 | 5,6 |
| Métastase lointaine | ||
| ouais | 9 | 10,1 |
| non | 48 | 53,9 |
| Invasion lymphovasculaire | ||
| ouais | 20 | 22,5 |
| non | 24 | 27,0 |
| Hétérogénéité entre les foyers | ||
| ouais | 8 | 9,0 |
| non | 17 | 19,1 |
| Distance entre les foyers | ||
| ≤ 4 cm (multifocal) | 58 | 65,2 |
| 4 cm (multicentre) | 15 | 16,9 |
Les données non informées pour chaque variable ont été omises du tableau.
Source: Recherche IMIP/HBL
Aucune différence significative n’a été observée dans la comparaison des variables entre les femmes avec ou sans hétérogénéité entre les foyers tumoraux (tableau 4) et entre MF et MC (tableau 5).
TABLEAU 4 – Caractéristiques cliniques et tumorales des patientes atteintes d’un cancer du sein multifocal/multicentrique opéré à l’hôpital Barão de Lucena, HBL, et à l’Instituto Materno Infantil Prof. Fernando Figueira, IMIP, par rapport à l’hétérogénéité entre les foyers. Recife, Pernambuco
| Hétérogénéité entre les foyers | |||
| Variables | ouais | non | valeur p |
| n (%) | n (%) | ||
| Ganglions lymphatiques compromis | |||
| Sortie | 2 (40,0) | 3 (60,0) | 1,000 * |
| 1 a 3 | 2 (33,3) | 4 (66,7) | |
| 4 ou plus | 3 (50,0) | 3 (50,0) | |
| Diplôme histologique | |||
| I | 2 (66,7) | 1 (33,3) | 0,748 * |
| II | 2 (25,0) | 6 (75,0) | |
| III | 1 (33,3) | 2 (66,7) | |
| Taille de la plus grande tumeur | |||
| <2 cm | 4 (57,1) | 3 (42,9) | 0,510 * |
| 2-5 cm | 3 (33,3) | 6 (66,7) | |
| >5 cm | 0 (0,0) | 2 (100,0) | |
| Métastase lointaine | |||
| ouais | 1 (20,0) | 4 (80,0) | 0,588 * |
| non | 5 (45,5) | 6 (54,5) | |
| Invasion lymphovasculaire | |||
| ouais | 4 (57,1) | 3 (42,9) | 0,592 * |
| non | 2 (28,6) | 5 (71,4) | |
(*) Test exact de Fisher
Source: Recherche IMIP/HBL
TABLEAU 5 – Caractéristiques cliniques et tumorales des patients atteints d’un cancer du sein multifocal et multicentrique opérés à l’hôpital Barão de Lucena, HBL, et à l’Instituto Materno Infantil Prof. Fernando Figueira, IMIP. Recife, Pernambuco
| Distance entre les foyers | |||
| Variables | ≤4cm (multifocal) | 4cm (multicentre) | valeur p |
| n (%) | n (%) | ||
| Re | |||
| Positif | 29 (80,6) | 7 (19,4) | 1,000 * |
| Négatif | 12 (80,0) | 3 (20,0) | |
| Rp | |||
| Positif | 26 (81,3) | 6 (18,7) | 1,000 * |
| Négatif | 15 (78,9) | 4 (21,1) | |
| Her-2 | |||
| Positif | 14 (82,4) | 3 (17,6) | 0,723 * |
| Négatif | 22 (75,9) | 7 (24,1) | |
| Ki67 | |||
| <14% | 13 (86,7) | 2 (13,3) | 0,695 * |
| >14% | 22 (75,9) | 7 (24,1) | |
| Ganglions lymphatiques compromis | |||
| Sortie | 16 (84,2) | 3 (15,8) | 0,839 * |
| 1 à 3 | 11 (73,3) | 4 (26,7) | |
| 4 ou plus | 16 (80,0) | 4 (20,0) | |
| Diplôme histologique | |||
| Je | 6 (66,7) | 3 (33,3) | 0,440 * |
| Ⅱ | 20 (87,0) | 3 (13,0) | |
| Ⅲ | 9 (81,8) | 2 (18,2) | |
| Type histologique | |||
| Canalaire | 49 (80,3) | 12 (19,7) | 0,370 * |
| Lobulaire | 1 (100,0) | 0 (0,0) | |
| Autres | 2 (50,0) | 2 (50,0) | |
| Taille de la plus grande tumeur | |||
| 2 cm (1,5 po) | 19 (79,2) | 5 (20,8) | 0,884 * |
| 2-5 cm | 20 (76,9) | 6 (23,1) | |
| 5 cm | 2 (66,7) | 1 (33,3) | |
| Métastase lointaine | |||
| ouais | 5 (62,5) | 3 (37,5) | 0,331 * |
| non | 35 (83,3) | 7 (16,7) | |
| Invasion lymphovasculaire | |||
| ouais | 13 (72,2) | 5 (27,8) | 0,256 * |
| non | 21 (87,5) | 3 (12,5) | |
(*) Fisher Exact Test Source: IMIP/HBL Research
Discussion
L’incidence des tumeurs de MF/MC était approximativement 5%, étant 65% MF et 17% MC, légèrement en dessous de celle trouvée dans la l[5,6,9]ittérature, qui découle très probablement du fait que ce taux varie en fonction de l’étendue de l’échantillonnage de tissu de sein analysé par le pathologiste sur la macroscopie, puisqu’il a été démontré qu’un échantillonnage plus complet a eu comme conséquence l’identification des lésions additionnelles ; avec l’absence d’une définition standard[5] MF/MC; et avec les différentes sensibilités des méthodes d’imagerie utilisées préopératoirement pour détecter les foyers malins multiple[3,4,11-13]s. Une étude américaine a[5] évalué 3 924 femmes atteintes d’un cancer du sein et a trouvé 24 % de MF/MC en utilisant uniquement des critères pathologiques dans leur sélection, 79 % MF et 20 % MC. Une méta-analyse comprenant 22 études et 67557 femmes a trouvé MF/MC dans 9,5% des cas, mais certaines études ont utilisé des méthodes d’imagerie préopératoire comme critère diagnostiqu[14]e.
Nous avons trouvé un plus grand échantillon de femmes brunes/noires et mariées. Le faible niveau scolaire observé dans cette étude reflète le degré de connaissance du patient, qui augmente à mesure que la scolarité augmente. Une étude brésilienne a [15]montré une association entre les connaissances sur les facteurs de risque pour le cancer du sein et les années d’étude, et il n’y avait aucune relation entre la couleur de la peau variables et l’état matrimonial. Une étude américaine[16] a associé les femmes afro-descendantes et n’ayant jamais été mariées, avec un stade avancé de la maladie, peut-être parce que ces femmes n’avaient pas le soutien financier et social fourni par le conjoint et par des facteurs culturels et socio-économiques liés à la couleur. Dans notre étude, bien que nous ayons eu une prévalence de femmes avec une faible scolarité, brun et noir, nous n’avons pas observé une augmentation du stade avancé.
La plupart des patients de l’étude avaient 50 ans ou plus (64 %). On sait que le cancer du sein est plus fréquent dans ce groupe d’âge, et c’est une explication possible pour cet échantillon. Certains rapports dans l’associé de littérature MF/MC avec les jeunes femmes de moins de 50 ans, le type [3,12]histologique lobulaire et une[17] plus grande participation de gangli[3,4,8,12,17]on lymphatique, soutenant l’hypothèse que MF/MC sont biologiquement plus agressifs, ont une plus grande propension à la diffusion métastatique et sont liés à un résultat plus mauvai[12]s.
La proportion de ganglions lymphatiques axillaires affectés dans notre étude était de 42% et seulement 10% pour les métastases lointaines. Les patients présentant des carcinomes invasifs multiples sont à un risque plus élevé de métastase dans les ganglions lymphatiques axillaires, cependant, il n’a pas été montré pour augmenter le risque de métastases lointaines pour les patients présentant la maladie négative de ganglio[4]n. Une étude australienne av[18]ec 848 femmes avec le cancer du sein unifocal et MF/MC a exécuté l’analyse multivariée comparant plusieurs variables avec la mesure de la taille du plus grand foyer de tumeur et avec la mesure de la somme des foyers de tumeur diverses, et a conclu que la tendance de métastase des tumeurs mammaires est un reflet de la charge totale de tumeur au lieu de la dimension de la plus grande concentration et que l’utilisation de la taille cumulative des foyers dans les tumeurs multifocales démontre une positivité de ganglion lymphatique identique à celle de la taille équivalente des tumeurs unifocales. En utilisant la taille de la mise au point dominante, il ya une plus grande probabilité de positivité des ganglions lymphatiques et peut-être un pronostic pire par rapport aux tumeurs unifocales de la même taille.
Le type histologique le plus fréquent était canal (82%), semblable à celui trouvé par plusieurs auteur[3,9,17,19]s. Lynch et coll[5]. décrivent une augmentation du taux de métastases aux ganglions lymphatiques régionaux par rapport aux tumeurs unifocales. Cette association soulève la question de savoir si MF/MC sont sous-estimés avec le système de stadification actuel, qui prend en compte seulement la plus grande concentration de tumeur, ou si elles ont simplement une biologie inhérente plus agressive.
Le degré histologique est un facteur pronostique connu dans le cancer du sein. De nombreuses études ont démontré son association significative avec la survie. En même temps, il s’agit d’une composante importante de la décision thérapeutique et a un rôle prédictif dans la réponse thérapeutiqu[20]e. Les études montrent une forte association entre MF/MC et histologique grade II/II[11,17,19]I. 45% des femmes dans l’étude ont eu le grade histologique II ou III.
Nous avons trouvé une prédominance de 40.5% de Her-2 et 45% du récepteur positif d’oestrogène, contre des données dans la littérature qui montrent une corrélation entre MF/MC et les facteurs cliniques pathologiques suggestifs des tumeurs plus agressives, avec l’association remarquable de Her2 positif et l’absence du récepteur hormonal d’oestrogèn[12]e. Nous croyons que la cause de cette différence peut être due à la petite taille de l’échantillon, caractérisant ainsi une erreur statistique de type II. En ce qui concerne le Ki67, 41 % correspondaient à une prolifération cellulaire élevée. En effet, certains cas de tumeurs hormono-sensibles seront menés à la chimiothérapie en raison de ce fait.
L’American College of Pathology consi[7]dère qu’il est suffisant que la caractérisation immunohistochimique des lésions multifocales avec le degré et l’histologie semblables soit basée seulement sur la plus grande lésion. Cependant, des études récentes [9,21,22]remettent en question cette recommandation, car elles ont démontré que, malgré la similitude des caractéristiques pathologiques, les lésions peuvent être différentes en termes de statut de récepteur d’oestrogène et d’Her-2, affectant potentiellement leur traitement. Dans notre étude, nous avons trouvé 9% de l’hétérogénéité entre les foyers, y compris l’analyse ki67. Buggi et co[9]ll. ont constaté un écart entre les foyers par rapport au Ki67 dans 15 % des cas.
Les récepteurs hormonaux étaient dissociants entre les foyers dans 8% de l’échantillon et Her-2 dans 4%, mais l’analyse de ces éléments a été altérée en raison du fait que dans plus de 50% des cas l’immunohistochimie a été obtenue seulement à partir de la concentration de tumeur la plus élevée. Bugpi et col[9]l. ont décrit un taux de désaccord entre les résultats des récepteurs hormonaux pour l’œstrogène de 4,4 % et celui de Her-2 de 9,7 % chez les foyers. Pekar[22] et Cho[21]i ont observé des taux d’écart entre 3-4% pour le récepteur d’oestrogène et 6% pour Her-2. Selon Pekar, l[22]es patients qui ont démontré l’hétérogénéité ont eu un pronostic plus mauvais comparé aux patients qui n’ont pas démontré l’hétérogénéité, qui n’a pas été trouvée dans notre étude, dans laquelle aucune différence significative n’a été observée entre l’hétérogénéité et les groupes homogènes, mais nous avons eu des limitations en raison du petit échantillon et des pertes dans l’analyse, qui pourraient changer ce scénario.
Il n’y avait aucune signification statistique dans la comparaison des variables entre MF et MC en raison d’une petite taille d’échantillon. Dans la littérature, nous n’avons pas observé de grandes différences entre MF/MC par rapport au type et au degré histologique, à la métastase de ganglion lymphatique et à la distance et à la taille de tumeu[5,13]r.
Les décisions cliniques dans la thérapie adjuvante systémique dans le cancer du sein sont basées sur des critères histologiques et le profil immunohistochimique de la plus grande concentration de tumeur, ignorant les foyers simultanés plus petits.
La présence de foyers supplémentaires n’est pas prise en compte dans la décision des thérapies adjuvantes. Si nous examinons seulement la plus grande tumeur dans de tels cas, nous pouvons perdre des patients qui ont eu besoin d’une thérapie spécifique. Les conséquences de l’hétérogénéité entre les foyers de tumeur pour la prise de décision thérapeutique et, par conséquent, pour la survie accrue de patient sont rarement adressées dans la littérature.
Par conséquent, une plus grande attention devrait être accordée aux tumeurs MF/MC et la possibilité d’avoir comme routine la demande d’immunohistorique pour tous les foyers de tumeur devrait être systématiquement évaluée, puisque par l’approche standard patients avec désaccord entre les foyers aurait cessé de recevoir le traitement hormonal et anti Her-2 pour le cancer du sein.
Notre analyse comporte certaines limites. Tout d’abord, nos travaux étaient rétrospectifs, bien que certaines des approches des données extraites aient été demandées au cours de l’étude, les données sur la tumeur histopathologique n’ont pas pu être détaillées, quand elles n’ont pas été faites au moment de la préparation du résultat histopathologique ; en plus du fait que certains blocs de paraffine étaient disponibles pour d’autres recherches, ce qui rend impossible l’immunohistochimie et, par conséquent, une petite taille d’échantillon. Ce fait peut ne pas mettre en évidence certaines associations qui pourraient exister, caractérisant ainsi une erreur statistique de type II. Ce fait nuit à la validation externe de nos résultats.
CONCLUSION
La plupart des cancers de MF/MC ont l’homogénéité parmi les foyers de tumeur, et l’évaluation de plus d’un foyer peut avoir des conséquences thérapeutiques dans seulement une minorité de cas, en plus d’augmenter le coût et le temps. Cependant, puisque le pronostic et le traitement des patients atteints de cancer du sein peuvent varier en fonction de la caractérisation moléculaire de la tumeur, on peut soutenir, du point de vue biologique, qu’analyser une seule mise au point, comme indiqué dans les recommandations actuelles, ne serait pas approprié. Il est de plus en plus évident que cette recommandation peut ne pas être durable au fil du temps et peut-être besoin d’être adapté pour être compatible avec l’évolution des paradigmes du cancer du sein.
Nous concluons que le cancer du sein MF/MC montre une petite proportion d’hétérogénéité entre les foyers par rapport aux paramètres biologiques, cependant, cela joue un rôle crucial dans la prise de décisions au sujet du traitement adjuvant et par conséquent sur le taux de pronostic, la répétition de tumeur et la métastase éloignée pour les femmes avec une telle conclusion. Il serait extrêmement intéressant de demander systématiquement l’immunohistorique pour tous les foyers tumoraux dans les cas de MF/MC. Toutefois, compte tenu de la charge financière supplémentaire potentielle pour les laboratoires lors de l’instauration de cette recommandation, les laboratoires de pathologie pourraient devoir élaborer des stratégies supplémentaires pour faire face à cette nouvelle proposition.
ASPECTS ÉTHIQUES
Ce projet est conforme aux lois actuelles du pays et aux postulats de la Déclaration d’Helsinki, app[23]rouvés par le Comité local d’éthique et de recherche (CEP).
RÉFÉRENCES
- Global Burden of Disease Cancer Collaboration. “The Global Burden of Cancer 2013.” JAMA oncology4 (2015): 505–527.
- MS/INCA. Estimativa 2016: Incidência de Câncer no Brasil/ Instituto Nacional de Câncer José Alencar Gomes da Silva, Coordenação de prevenção e vigilância. Rio de Janeiro: INCA, 2015. ISBN 978-85-7318-283-5, acessado em inca.gov.br/estimativa/2016/estimativa-2016-v11.pdf
- Zhou M, Tang Z, Li J, Fan J H, Pang Y, et al; Clinical and Pathologic Features of Multifocal and Multicentric Breast Cancer in Chinese Women: A Retrospective Cohort Study. Journal of Breast Cancer. 2013;16(1):77-83.
- Salgado R, Aftimos P, Sotiriou C, Desmedt C; Evolving paradigms in multifocal breast cancer. Semin Cancer Biol. 2015 Apr; 31:111-8.
- Lynch S P, Lei X, Chavez-MacGregor M, Hsu L, Meric-Bernstam F, et al; Multifocality and multicentricity in breast cancer and survival outcomes. Annals of Oncology 2012, 23: 3063–3069
- Lynch S P, Lei X, Hsu L, Meric-Bernstam F, Buchholz T A, et al; Breast Cancer Multifocality and Multicentricity and Locoregional Recurrence. The Oncologist 2013, 18:1167-1173.
- Fitzgibbons P L, Bose S, Chen Y, Connolly J L, Baca M E et al. Protocol for the examination of specimens from patients with invasive carcinoma of the breast. Version Invasivebreast 4.0.0.0 June 2017 cap.org/cancerprotocols 2017 College of American Pathologists (CAP)
- Weissenbacher T M, Zschage M, Janni W, Jeschke U, Dimpfl T, et al; Multicentric and multifocal versus unifocal breast cancer: is the tumor-node-metastasis classification justified? Breast Cancer Res Treat (2010) 122:27–34
- Buggi F, Folli S, Curcio A, Casadei-Giunchi D, Rocca A, et al; Multicentric/multifocal breast cancer with a single histotype: is the biological characterization of all individual foci justified? Annals of Oncology 2012 23: 2042–2046
- Chagas C R, et al. Tratado de Mastologia da SBM – Rio de Janeiro : Revinter, 2011. ISBN 978853720346-0
- Boros M, Podoleanu C, Georgescu R, Moldovan C, Molna C, et al; Multifocal/multicentric breast carcinomas showing intertumoral heterogeneity: a comparison of histological tumor and lymph node metastasis. Pol J Pathol 2015; (2): 125-132.
- Neri A, Marrelli D, Megha T, Bettarini F, Tacchini D, et al. “Clinical significance of multifocal and multicentric breast cancers and choice of surgical treatment: a retrospective study on a series of 1158 cases.” BMC Surgery. 2015;15(1):1.
- Kadioğlu H, Özbaş S, Akcan A, Soyder A, Soylu L, et al. Comparison of the histopathology and prognosis of bilateral versus unilateral multifocal multicentric breast cancers. World Journal of Surgical Oncology. 2014; 12:266.
- Vera-Badillo F E, Napoleone M, Ocana A, Templeton A J, Seruga B, et al.; Effect of multifocality and multicentricity on outcome in early stage breast cancer: a systematic review and meta-analysis. BreastCancer Res Treat 2014; 146: 235-244.
- Batiston A P, Tamaki E M, Souza L A, Santos M L M. ; Conhecimento e prática sobre os fatores de risco para o câncer de mama entre mulheres de 40 a 69 anos. RevBras Saúde MaternInfant, Recife; 2011; 11 (2): 163-171.
- Lannin D R, Mathews H F, Mitchell J; Influence of socioeconomic and cultural factors on racial differences in late stage presentation of breast cancer. JAMA. 1998; 279 (22): 1801-1807.
- Yerushalmi R, Kennecke H, Woods R, Olivotto I A, Speers C, et al. Does multicentric/multifocal breast cancer differ from unifocal breast cancer? An analysis of survival and contralateral breast cancer incidence. Breast Cancer Res Treat (2009) 117: 365.
- Coombs J, Boyages J; Multifocal and multicentric breast cancer: does each focus matter? J ClinOncol 2005; 23: 7497-7502.
- M, Marian. C, Moldovan. C, Stolnicu. S, Morphological heterogeneity of the simultaneous ipsilateral invasive tumor foci in breast carcinoma: A retrospective study of 418 cases of carcinomas, In Pathology – Research and Practice, 2012, (208): 604-609, ISSN 0344-0338.
- Curigliano G, Burstein H J, Winer E, Gnant M, Dubsky P, et al. De-escalating and escalating treatments for early-stage breast cancer: the St. Gallen International Expert Consensus Conference on the Primary Therapy of Early Breast Cancer 2017. Ann Oncol.2017 Aug 1;28(8):1700-1712.
- Choi Y, Kim E J, Seol H, Lee H E, Jang M J, et al. The hormone receptor, human epidermal growth factor receptor 2, and molecular subtype status of individual tumor foci in multifocal/multicentric invasive ductal carcinoma of breast. Hum Pathol.2012 Jan;43(1):48-55.
- Pekar, G., Gere, M., Tarjan, M., Hellberg, D. and Tot, T., Molecular phenotype of the foci in multifocal invasive breast carcinomas: Intertumoral heterogeneity is related to shorter survival and may influence the choice of therapy. Cancer, 2014 Jan 1; 120 (1): 26–34.
- Review C, Communication S, Principles G. World Medical Association Declaration of Helsinki: ethical principles for medical research involving human subjects. JAMA. 2013;310:2191-2194.
ANNEXE – CHIFFRES ET TABLEAUX EN ANGLAIS
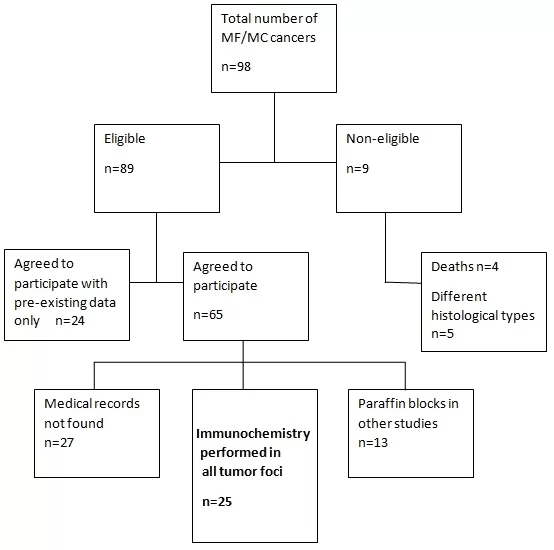
Fig. 1 Diagramme de flux de la sélection des participants
TABLEAU 1 – Incidence du cancer du sein unifocal, multifocal et multicentrique à l’Hôpital Baron de Lucena (HBL) et prof. Fernando Figueira Mother and Child Institute (IMIP). Recife (Pernambuco)
| Cancer du sein | n (HBL/IMIP) | % (HBL/IMIP) |
| 2012 | ||
| Unifocal | (195/-) | (92.4/-) |
| MC/MF | (16/-) | (7.6/-) |
| 2013 | ||
| Unifocal | 477 (184/293) | 95.9 (93.4/ 97.7) |
| MC/MF | 20 (13/7) | 4.0 (6.6/ 2.3) |
| 2014 | ||
| Unifocal | (150/-) | (92.6/-) |
| MC/MF | (12/ 12) | (7.4/-) |
| 2015 | ||
| Unifocal | 523 (162/361) | 94.9 (89.5/ 97.6) |
| MC/MF | 28 (19/ 9) | 5.0 (10.5/ 2.4) |
IMIP data for 2012 and 2014 are not available. Source: IMIP/HBL research
TABLE 2 – Characteristics of patients with multifocal and multicentric breast cancer operated at the Barão de Lucena Hospital (HBL) and Prof. Fernando Figueira Mother and Child Institute (IMIP). Recife, Pernambuco
| Variables | n | % |
| Age | ||
| <50 | 26 | 29.2 |
| ≥50 | 57 | 64.1 |
| Skin color | ||
| White | 16 | 18.0 |
| Black | 2 | 2.2 |
| Mixed race black | 30 | 33.7 |
| Schooling | ||
| Illiterate | 6 | 6.7 |
| Incomplete elementary school | 22 | 24.7 |
| Complete elementary school | 6 | 6.7 |
| Incomplete high school | 1 | 1.1 |
| Complete high school | 12 | 13.5 |
| Matrimonial | ||
| Union civile | 1 | 1.1 |
| Seul | 8 | 9.0 |
| Marié, Nouvel An | 13 | 14.6 |
| Divorced | 3 | 3.4 |
| Widowed | 9 | 10.1 |
Data not reported for each variable were omitted from the table. Source: IMIP/HBL research
TABLE 3 – Clinical and tumor characteristics of patients with multifocal and multicentric breast cancer operated at the Barão de Lucena Hospital (HBL) and Prof. Fernando Figueira Mother and Child Institute (IMIP). Recife, Pernambuco
| Variables | n | % |
| ER | ||
| Positive | 40 | 44.9 |
| Negative | 20 | 22.5 |
| PR | ||
| Positive | 35 | 39.3 |
| Negative | 25 | 28.1 |
| HER2 | ||
| Positive | 18 | 20.2 |
| Negative | 36 | 40.5 |
| Ki67 | ||
| <14% | 16 | 18.0 |
| >14% | 37 | 41.6 |
| Compromised lymph nodes | ||
| Absent | 23 | 25.8 |
| 1 to 3 | 18 | 20.2 |
| 4 or more | 20 | 22.5 |
| Histological grade | ||
| I | 9 | 10.1 |
| II | 27 | 30.4 |
| III | 13 | 14.6 |
| Histological type | ||
| Ductal | 73 | 82.0 |
| Lobular | 1 | 1.1 |
| Others | 4 | 4.5 |
| Size of the largest tumor | ||
| <2 cm | 24 | 27.0 |
| 2-5 cm | 32 | 36.0 |
| >5 cm | 5 | 5.6 |
| Distant metastasis | ||
| Yes | 9 | 10.1 |
| No | 48 | 53.9 |
| Lymphovascular invasion | ||
| Yes | 20 | 22.5 |
| No | 24 | 27.0 |
| Heterogeneity between foci | ||
| Yes | 8 | 9.0 |
| No | 17 | 19.1 |
| Distance between foci | ||
| ≤ 4 cm (multifocal) | 58 | 65.2 |
| > 4 cm (multicentric) | 15 | 16.9 |
Data not reported for each variable were omitted from the table. ER: Estrogen receptor PR: Progesterone receptor. Source: IMIP/HBL research
TABLE 4 – Clinical and tumor characteristics of patients with multifocal/multicentric breast cancer operated at the Barão de Lucena Hospital (HBL) and Prof. Fernando Figueira Mother and Child Institute (IMIP), in relation to heterogeneity between foci. Recife, Pernambuco
| Heterogeneity between foci | |||
| Variables | Yes | No | p-value |
| n (%) | n (%) | ||
| Compromised lymph nodes | |||
| Absent | 2 (40.0) | 3 (60.0) | 1.000 * |
| 1 to 3 | 2 (33.3) | 4 (66.7) | |
| 4 or more | 3 (50.0) | 3 (50.0) | |
| Histological grade | |||
| I | 2 (66.7) | 1 (33.3) | 0.748 * |
| II | 2 (25.0) | 6 (75.0) | |
| III | 1 (33.3) | 2 (66.7) | |
| Size of the largest tumor | |||
| <2 cm | 4 (57.1) | 3 (42.9) | 0.510 * |
| 2-5 cm | 3 (33.3) | 6 (66.7) | |
| >5 cm | 0 (0.0) | 2 (100.0) | |
| Distant metastasis | |||
| Yes | 1 (20.0) | 4 (80.0) | 0.588 * |
| No | 5 (45.5) | 6 (54.5) | |
| Lymphovascular invasion | |||
| Yes | 4 (57.1) | 3 (42.9) | 0.592 * |
| No | 2 (28.6) | 5 (71.4) | |
(*) Fisher’s Exact Test. Source: IMIP/HBL research
TABLE 5 – Clinical and tumor characteristics of patients with multifocal and multicentric breast cancer operated at the Barão de Lucena Hospital (HBL) and Prof. Fernando Figueira Mother and Child Institute (IMIP). Recife, Pernambuco
| Distance between foci | |||
| Variables | ≤4 cm (multifocal) | >4 cm (multicentric) | p-value |
| n (%) | n (%) | ||
| ER | |||
| Positive | 29 (80.6) | 7 (19.4) | 1.000 * |
| Negative | 12 (80.0) | 3 (20.0) | |
| PR | |||
| Positive | 26 (81.3) | 6 (18.7) | 1.000 * |
| Negative | 15 (78.9) | 4 (21.1) | |
| HER2 | |||
| Positive | 14 (82.4) | 3 (17.6) | 0.723 * |
| Negative | 22 (75.9) | 7 (24.1) | |
| Ki67 | |||
| <14% | 13 (86.7) | 2 (13.3) | 0.695 * |
| >14% | 22 (75.9) | 7 (24.1) | |
| Compromised lymph nodes | |||
| Absent | 16 (84.2) | 3 (15.8) | 0.839 * |
| 1 to 3 | 11 (73.3) | 4 (26.7) | |
| 4 or more | 16 (80.0) | 4 (20.0) | |
| Histological grade | |||
| I | 6 (66.7) | 3 (33.3) | 0.440 * |
| II | 20 (87.0) | 3 (13.0) | |
| III | 9 (81.8) | 2 (18.2) | |
| Histological type | |||
| Ductal | 49 (80.3) | 12 (19.7) | 0.370 * |
| Lobular | 1 (100.0) | 0 (0.0) | |
| Others | 2 (50.0) | 2 (50.0) | |
| Size of the largest tumor | |||
| <2 cm | 19 (79.2) | 5 (20.8) | 0.884 * |
| 2-5 cm | 20 (76.9) | 6 (23.1) | |
| >5 cm | 2 (66.7) | 1 (33.3) | |
| Distant metastasis | |||
| Yes | 5 (62.5) | 3 (37.5) | 0.331 * |
| No | 35 (83.3) | 7 (16.7) | |
| Lymphovascular invasion | |||
| Yes | 13 (72.2) | 5 (27.8) | 0.256 * |
| No | 21 (87.5) | 3 (12.5) | |
(*) Fisher’s Exact Test. Source: IMIP/HBL research
[1] Maîtrise en santé maternelle et infantile par le programme stricto sensu du professeur Fernando Figueira – IMIP, Pernambuco.
[2] Doctorat en tocoginécologie de l’Université d’État de Campinas, Brésil.
[3] Maîtrise en oncologie de l’Université de São Paulo, Brésil.
Envoyé : février 2020.
Approuvé : juin 2020.