URSPRÜNGLICHER ARTIKEL
ARAGÃO, José Aderval [1], ARAGÃO, Iapunira Catarina Sant’Anna [2], ARAGÃO, Felipe Matheus Sant’Anna [3], LOURENÇO, Bárbara Costa [4], ALMEIDA, João Victor Rocha de [5], PORTO, Luciano Conceição [6], GUERRA, Danilo Ribeiro [7], FEITOSA, Vera Lúcia Correa [8], REIS, Francisco Prado [9]
ARAGÃO, José Aderval. et al. Biometrie des Aufhängebandes der Schilddrüse und dessen Korrelation mit der Morphometrie der Schilddrüse in Leichen von menschlichen Feten. Revista Científica Multidisciplinar Núcleo do Conhecimento. Jahr. 08, Ausgabe 07, Band 05, S. 55-73. Juli 2023. ISSN: 2448-0959, Zugangslink: https://www.nucleodoconhecimento.com.br/gesundheit/biometrie-des-aufhaengebandes, DOI: 10.32749/nucleodoconhecimento.com.br/gesundheit/biometrie-des-aufhaengebandes
ZUSAMMENFASSUNG
Einleitung: Das Berry’s Ligament (BL) ist eine bekannte anatomische Struktur, die die Schilddrüse mit der Tracheawand verbindet, aber seine Biometrie wurde bisher wenig erforscht. Ziel: In der vorliegenden Studie haben wir versucht, die Biometrie des BL durchzuführen und sie mit der Morphometrie der Schilddrüse in Beziehung zu setzen. Material und Methode: Ohne die Hilfe optischer Instrumente wurden die BL von 24 Schilddrüsen von menschlichen Föten disseziert. Bei der Schilddrüse in anatomischer Position wurden biometrische Daten des BL und der Schilddrüse erfasst. Die Daten wurden statistisch aufbereitet, um die Korrelation zwischen Länge und Höhe des BL mit den biometrischen Daten der Schilddrüse festzustellen. Ergebnis: Signifikante Korrelationen wurden auf dem 5%-Niveau für die Breite der Schilddrüse und das Gewicht der Drüse gefunden, sowie für die Länge des linken Lappens und die Breite der rechten und linken Schilddrüsenlappen, jeweils in Bezug auf die Länge des BL. Es wurden auch Korrelationen für die Länge in Bezug auf die Breite der Drüse und den Isthmus der Schilddrüse festgestellt. Es gab keine signifikante Korrelation zwischen der Höhe des BL und den morphometrischen Befunden der rechten und linken Lappen sowie des Isthmus der Schilddrüse. Schlussfolgerung: Kenntnisse über die Anatomie des BL sind essenziell, um insbesondere Recurrent Laryngeal Nerve (RLN) bei Schilddrüsen- oder Nebenschilddrüsenentfernungen zu verhindern.
Schlüsselwörter: Berry’s Ligament, Aufhängeband der Schilddrüse, Recurrent Laryngeal Nerve, Zuckerkandl-Tuberkel, Schilddrüse, Biometrie.
1. EINLEITUNG
Das Aufhängeband der Schilddrüse oder Berry’s Ligament (BL) ist eine dichte Verdichtung des prätrachealen vaskulären Bindegewebes, die die Schilddrüse mit den cricotrachealen Strukturen der ersten bis dritten Luftröhrenringe verbindet (SASOU, NAKAMURA, KURIHARA, 1998; ARDITO et al., 2004; RANDOLPH et al., 2011; ASGHARPOUR et al., 2012; NGO NYEKI, 2015; SRITHARAN et al., 2016; MANTALOVAS et al., 2022). Es handelt sich um eine Region, die während einer Schilddrüsenentfernung aufgrund der medialen Lage des BL in Bezug auf den Verlauf des Recurrent Laryngeal Nerve (RLN) als besonders anfällig für Verletzungen angesehen wird, wenn dieser in den Kehlkopf eindringt (THOMPSON, OLSEN, HOFFMAN, 1973; LORÉ, KIM, ELIAS, 1977; ARDITO et al., 2004; ASGHARPOUR et al., 2012). Die Lage des RLN in Bezug auf das BL ist umstritten, und es wurde betont, dass seine Identifikation die Inzidenz von Nervenverletzungen während der Schilddrüsenentfernung verringert (LORÉ, KIM, ELIAS, 1977; DELBRIDGE et al., 1992). Ein besseres Verständnis dafür, wie oft der RLN in das BL eindringt, könnte Komplikationen reduzieren, da Traktionsverletzungen im Zusammenhang mit dem RLN auftreten können, wenn es in das BL eindringt (HUNT, POOLE, REEVE, 1968; ARDITO et al., 2004). Bislang wurden jedoch die Biometrie des BL und der Schilddrüse sowie ihre histologischen Eigenschaften selten beschrieben. In dieser Studie haben wir versucht, die Biometrie des BL durchzuführen und sie mit der Morphometrie der Schilddrüse in Beziehung zu setzen.
2. MATERIAL UND METHODEN
Dies ist eine deskriptive anatomische Studie mit morphometrischen Daten zum Aufhängeband der Schilddrüse. Die BL wurden (Abbildung 1) von 24 Schilddrüsen von menschlichen Föten disseziert, die dem Labor für menschliche Anatomie des Fachbereichs Morphologie der Bundesuniversität Sergipe angehören und gemäß dem Gesetz Nr. 8501 vom 30. November 1992, das die Verwendung nicht beanspruchter Leichen für Forschungszwecke regelt, erhalten wurden. Von den 24 Drüsen waren 12 von männlichen Föten und 12 von weiblichen Föten. Das Alter der Föten lag zwischen 20,3 und 36,8 Wochen mit einem Durchschnitt von 26,3 Wochen. Bei männlichen Föten lag das Alter zwischen 22 und 36,8 Wochen mit einem Durchschnitt von 27,3 Wochen, und bei weiblichen Föten betrug der Durchschnitt 25,3 Wochen und reichte von 20,3 bis 31,7 Wochen. Bei der Präparation wurde ein Hautschnitt gemacht, gefolgt von der Entfernung der infrahyoidalen Muskulatur, wodurch die Schilddrüse umgeben von ihrer falschen und wahren Kapsel freigelegt wurde. Die in die Studie einbezogenen Proben waren normal und wiesen makroskopisch keine pathologischen Veränderungen auf. Schilddrüsen,
die anatomische Variationen und Entwicklungsanomalien aufwiesen, wurden ausgeschlossen, wie z. B.: Agenesie, teilweises oder vollständiges Fehlen des Isthmus, zusätzliches Schilddrüsengewebe, ektopisches Schilddrüsengewebe und Schilddrüsenlappen.
Die biometrischen Daten des BL und der Schilddrüse wurden erfasst, während sich die Schilddrüse in ihrer anatomischen Lage befand. Die Messungen erfolgten mithilfe eines digitalen Schiebers mit einer Genauigkeit von 0,01 mm. Anschließend wurde die Schilddrüse aus ihrem Lager entfernt, mit einem Schwamm und Blotting-Papier getrocknet und auf einer digitalen Waage mit einer Genauigkeit von 0,01 g gewogen. Es wurde nicht versucht, die Nebenschilddrüsen zu entfernen, da ihr Gewicht als vernachlässigbar beschrieben wurde (SNYDER et al., 1975).
3. STATISTISCHE ANALYSE
Kategoriale Variablen wurden mithilfe von absoluter und relativer Häufigkeit, Prozentangabe beschrieben. Kontinuierliche Variablen wurden durchschnittlich, Standardabweichung, Median und interquartiles Bereich beschrieben. Die Korrelation nach Pearson zwischen den morphometrischen Variablen wurde geschätzt und getestet. Das festgelegte Signifikanzniveau betrug 5%, und die verwendete Software war R Core Team 2021.
Abbildung 1. Schilddrüsen-Aufhängeband oder Berry’s Ligament (Kreis)
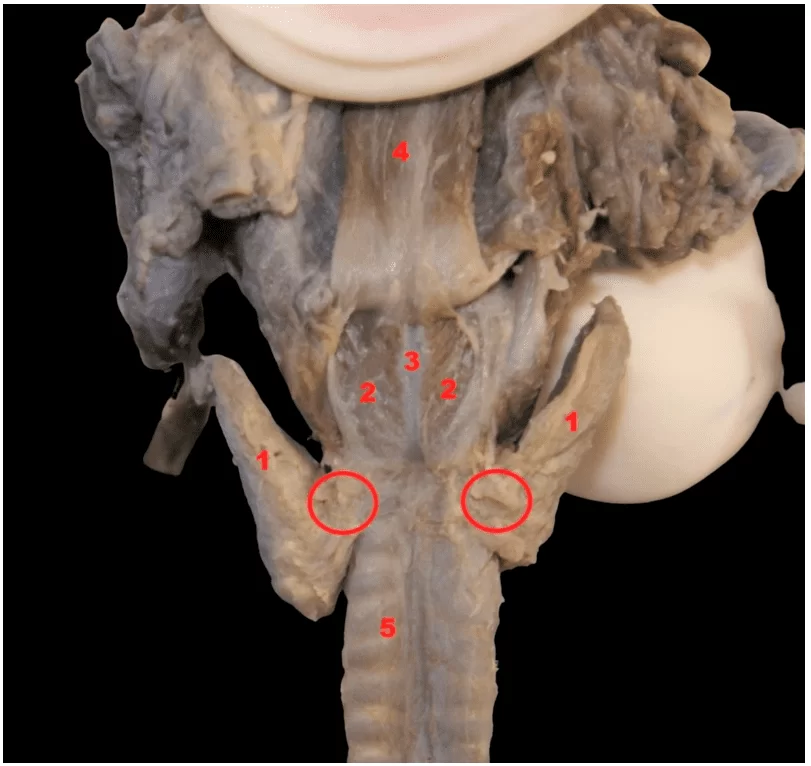
Legende
Lappen der Schilddrüse
Hinterer Cricoarytenoid-Muskel
Ringknorpel
Speiseröhre
Luftröhre
4. ERGEBNIS
Die BL (Berry’s Ligament) von 24 Schilddrüsen, die von menschlichen fetalen Kadavern entnommen wurden und dem Labor für menschliche Anatomie des Morphologie-Departments der Bundesuniversität Sergipe angehören, wurden gemäß dem Gesetz gewonnen, das die Verwendung von nicht beanspruchten Kadavern für die Forschung erlaubt. Von den 24 Drüsen stammten 12 von männlichen Feten und 12 von weiblichen Feten. Das Alter der Feten lag zwischen 20,3 und 36,8 Wochen, mit einem Durchschnitt von 26,3 Wochen. Bei männlichen Feten lag das Alter zwischen 22 und 36,8 Wochen mit einem Durchschnitt von 27,3 Wochen, während bei weiblichen Feten der Durchschnitt bei 25,3 Wochen lag und das Alter von 20,3 bis 31,7 Wochen reichte.
Tabelle 1 zeigt die Durchschnitte der morphometrischen Daten der BL und der Schilddrüse von Feten. Das durchschnittliche Alter in Wochen betrug 26,3 (SD: 4,6) und der Median 26,1 (IQR: 21,9-29,5), mit einer durchschnittlichen fetalen Höhe von 330 mm (SD: 104,8 mm) und einem Median von 337 mm (IQR: 302-375 mm). Die durchschnittliche Breite der Schilddrüse betrug 13,1 mm (SD: 2,8 mm) und der Median 12,7 mm (IQR: 11,5-13,7). Das durchschnittliche Gewicht der Schilddrüse betrug 0,3 g (SD: 0,2 g) und der Median 0,2 g (IQR: 0,2-0,5 g). Die Länge des Schilddrüsenlappens betrug durchschnittlich 11,7 mm (SD: 2,1 mm) und der Median 11,9 mm (IQR: 10,4-13,3 mm) auf der rechten Seite und durchschnittlich 10,8 mm (SD: 2,6 mm) und der Median 11,6 mm (IQR: 8,9-12,6 mm) auf der linken Seite. Die durchschnittliche Breite des Schilddrüsenlappens betrug 4,6 mm (SD: 1,2 mm) und der Median 4,6 mm (IQR: 3,8-5 mm) auf der rechten Seite sowie durchschnittlich 4,7 mm (SD: 1,4 mm) und der Median 4,2 mm (IQR: 3,7-6,3 mm) auf der linken Seite. Die Breite des Isthmus der Schilddrüse betrug durchschnittlich 5,5 mm (SD: 2,1 mm) und der Median 5,1 mm (IQR: 4,3-6,4 mm), während ihre Höhe durchschnittlich 4,8 mm (SD: 1,9 mm) und der Median 4,6 mm (IQR: 3,5-5,7 mm) betrug. Die durchschnittliche Länge der BL betrug 1,5 mm (SD: 0,6 mm) und der Median 1,4 mm (IQR: 1-2 mm) auf der rechten Seite sowie durchschnittlich 1,2 mm (SD: 0,4 mm) und der Median 1,1 mm (IQR: 1-1,4 mm) auf der linken Seite, während die Höhe durchschnittlich 2,8 mm (SD: 0,7 mm) und der Median 2,8 mm (IQR: 2,3-3 mm) auf der rechten Seite sowie durchschnittlich 2,6 mm (SD: 0,7 mm) und der Median 2,7 mm (IQR: 2,4-3,2 mm) auf der linken Seite betrug.
Tabelle 1. Morphometrie der Schilddrüse und der BL (Berry’s Ligament)
| n | % | Mittelwert | SD | Median | Q1 | Q3 | |
| Geschlecht | |||||||
| Weiblich | 12 | 50 | |||||
| Männlich | 12 | 50 | |||||
| Alter (Wochen) | 26.3 | 4.6 | 26.1 | 21.9 | 29.5 | ||
| Fetushöhe (mm) | 330.0 | 104.8 | 337.0 | 302.0 | 375.0 | ||
| Breite der Schilddrüse (mm) | 13.1 | 2.8 | 12.7 | 11.5 | 13.7 | ||
| Gewicht der Schilddrüse (g) | 0.3 | 0.2 | 0.2 | 0.2 | 0.5 | ||
| Länge des Schilddrüsenlappens (mm) | |||||||
| Rechts | 11.7 | 2.1 | 11.9 | 10.4 | 13.3 | ||
| Links | 10.8 | 2.6 | 11.6 | 8.9 | 12.6 | ||
| Breite des Schilddrüsenlappens (mm) | |||||||
| Rechts | 4.6 | 1.2 | 4.6 | 3.8 | 5.0 | ||
| Links | 4.7 | 1.4 | 4.2 | 3.7 | 6.3 | ||
| Breite des Isthmus der Schilddrüse (mm) | 5.5 | 2.1 | 5.1 | 4.3 | 6.4 | ||
| Höhe des Isthmus der Schilddrüse (mm) | 4.8 | 1.9 | 4.6 | 3.5 | 5.7 | ||
| Länge des Aufhängebandes der Schilddrüse (mm) | |||||||
| Rechts | 1.5 | 0.6 | 1.4 | 1.0 | 2.0 | ||
| Links | 1.2 | 0.4 | 1.1 | 1.0 | 1.4 | ||
| Höhe des Aufhängebandes der Schilddrüse (mm) | |||||||
| Rechts | 2.8 | 0.7 | 2.8 | 2.3 | 3.0 | ||
| Links | 2.6 | 0.7 | 2.7 | 2.4 | 3.2 |
Quelle: Autoren, 2023.
Legende: n – absolute Häufigkeit. % – prozentuale relative Häufigkeit. SD – Standardabweichung. Q1 – Erstes Quartil. Q3 – Drittes Quartil. IIQ – Interquartilsabstand
Abbildung 1 zeigt die Korrelationen zwischen der Länge des BL und: der Breite und dem Gewicht der Schilddrüse (A und B); Länge und Breite der Schilddrüsenlappen (C, D, E, F); und Breite und Höhe des Schilddrüsenisthmus (G, H). Es ist erkennbar, dass signifikante Korrelationen auf dem 5%-Niveau für die Breite der Schilddrüse (R: 0,7, positiv und stark) und das Gewicht der Drüse (R: 0,65, positiv und median) auftraten. Korrelationen traten auch für die Länge des linken Schilddrüsenlappens (R: 0,47, positiv und median) sowie für die Breite des rechten und linken Schilddrüsenlappens (R: 0,52 und 0,53, positiv und median) auf.
Abbildung 1. Korrelation zwischen der Länge des rechten Schilddrüsenaufhängebandes und der Schilddrüsenmorphometrie
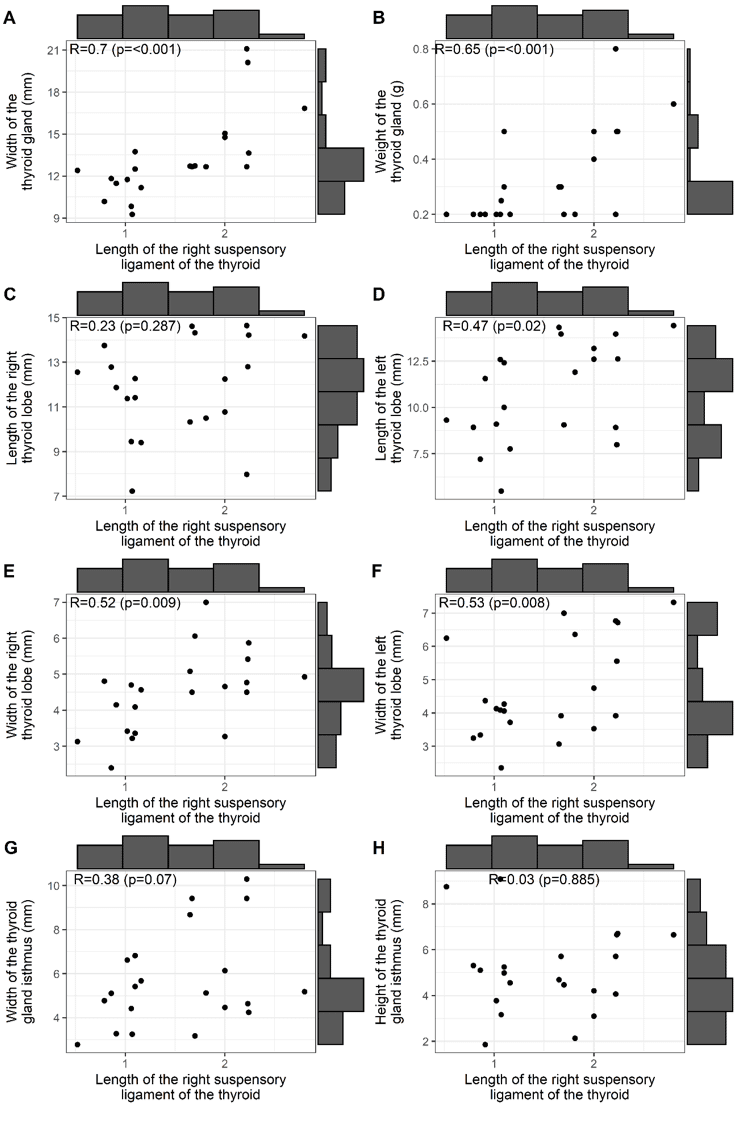
Abbildung 2 zeigt die Korrelationen zwischen der Länge des BL und: der Breite und dem Gewicht der Schilddrüse (A, B); den Längen der rechten und linken Lappen der Schilddrüse (C, D); den Breiten der rechten und linken Lappen der Schilddrüse (E, F); der Breite und Höhe des Isthmus der Drüse (G, H). Es ist zu beachten, dass nur Korrelationen auf dem 5%-Niveau signifikant waren für die Breite der Schilddrüse (R: 0,51, positiv und median) und die Breite des Isthmus der Schilddrüse (R: -0,56, negativ und median).
Abbildung 2 – Korrelation der BL-Länge mit: Breite und Gewicht, Länge und Breite der rechten und linken Lappen sowie Breite und Höhe des Isthmus der Schilddrüse
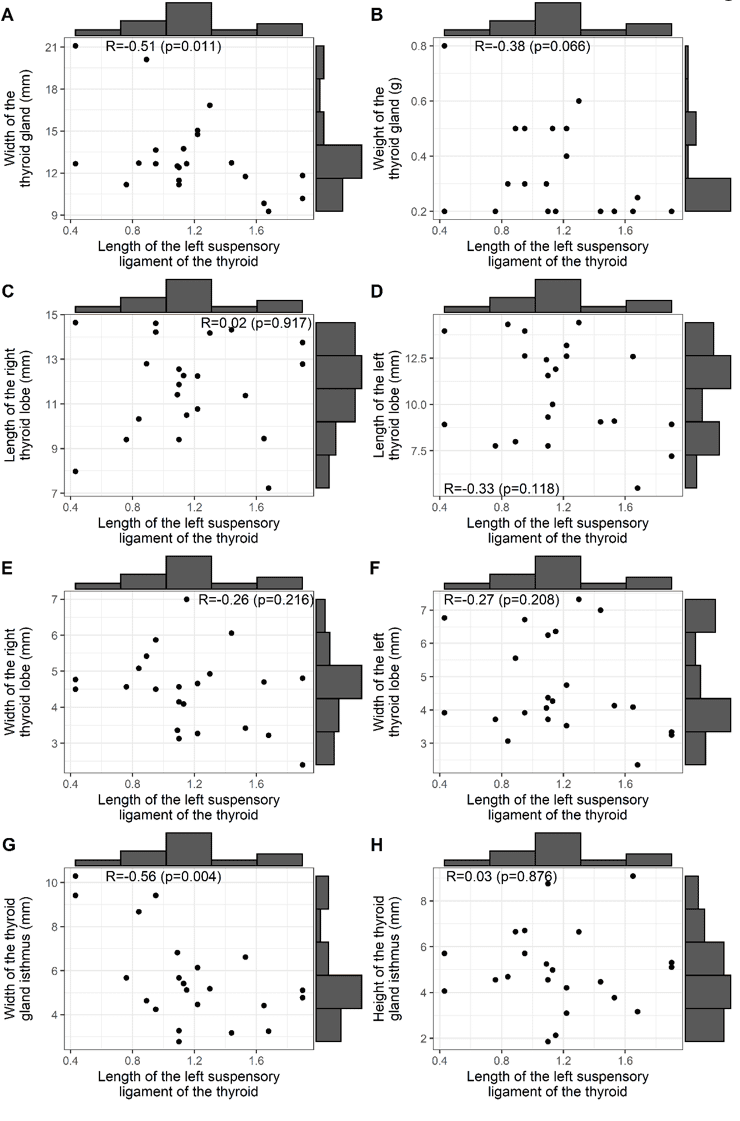
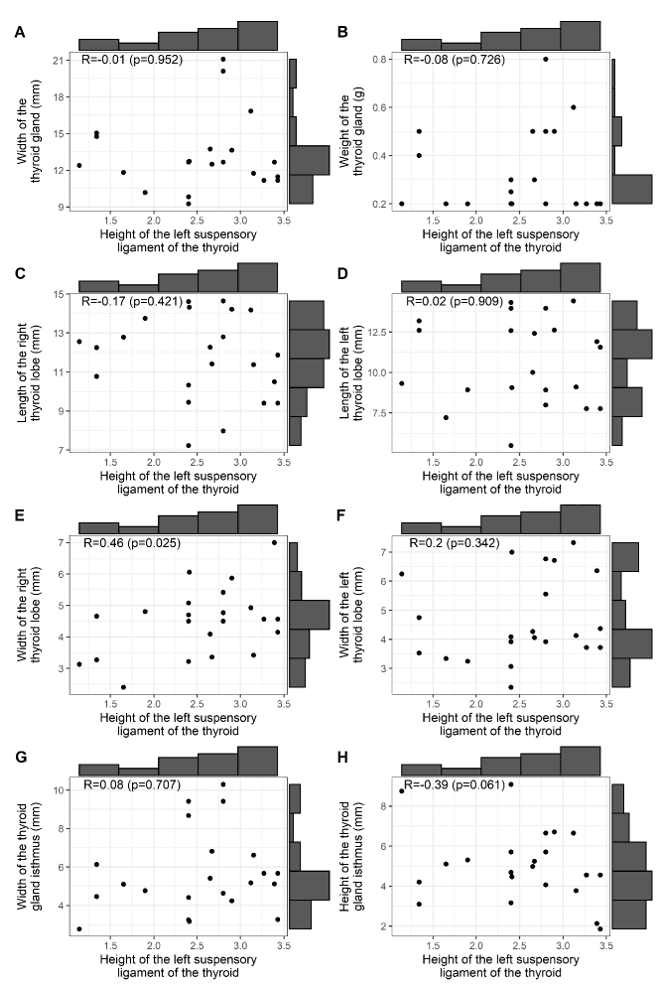
Abbildung 3 zeigt die Korrelationen zwischen der Höhe des rechten BL der Schilddrüse mit: der Breite und dem Gewicht der Schilddrüse (A, B); den Längen der rechten und linken Lappen der Schilddrüse (C, D); den Breiten der rechten und linken Lappen der Schilddrüse (E, F); der Breite und Höhe des Isthmus der Drüse (G, H). Beachten Sie, dass keine signifikante Korrelation zwischen der Höhe des BL und den morphometrischen Befunden der Schilddrüse und des Isthmus der Drüse besteht.
Abbildung 3 – Korrelation der BL-Höhe mit: Breite und Gewicht, Längen und Breiten der rechten und linken Lappen sowie Breite und Höhe des Isthmus der Schilddrüse
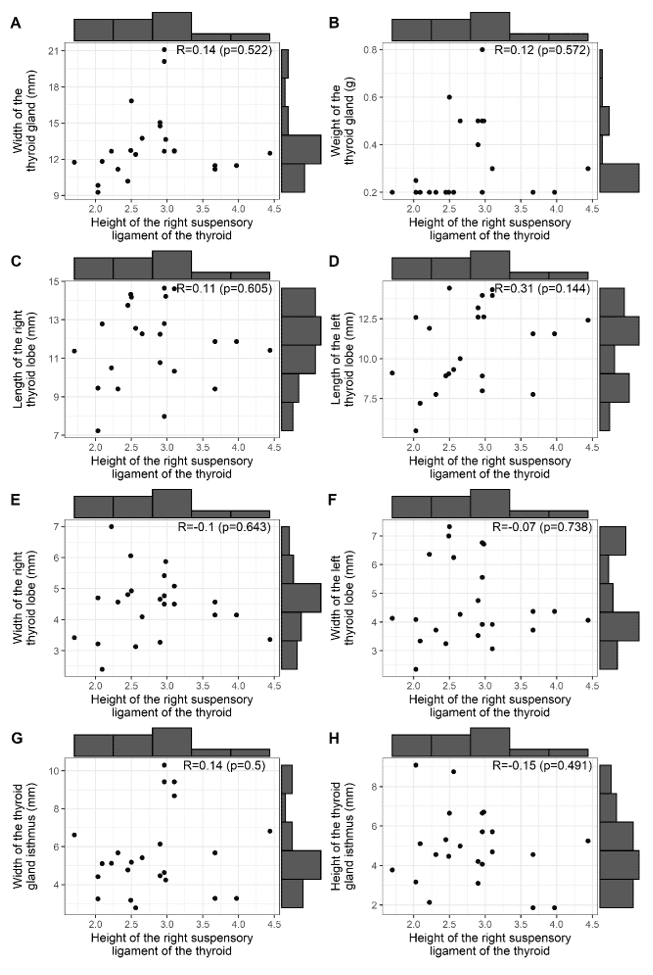
Abbildung 4 stellt die Korrelationen zwischen der Höhe des linken BL der Schilddrüse mit dar: der Breite und dem Gewicht der Schilddrüse (A, B); den Längen der rechten und linken Lappen der Schilddrüse (C, D); den Breiten der rechten und linken Lappen der Schilddrüse (E, F); der Breite und Höhe des Isthmus der Drüse (G, H). Beachten Sie, dass keine signifikante Korrelation zwischen der Höhe des BL und den morphometrischen Befunden der Schilddrüse und des Isthmus der Drüse besteht.
Abbildung 4 – Korrelation der Höhe des linken Schilddrüsen-BL mit: Breite und Gewicht der Schilddrüse, Längen der rechten und linken Lappen der Schilddrüse, Breiten der rechten und linken Lappen der Schilddrüse sowie Breite und Höhe des Drüsen-Isthmus
5. DISKUSSION
Die Schilddrüse, obwohl leicht mit einer Pinzette von der Luftröhre abgetrennt werden kann, wurde gemäß BL Sasou, Nakamura, Kurihara (1998) nicht getrennt. Sie beschrieben das BL als ein weißliches Band aus Bindegewebe, das die Schilddrüse mit der Luftröhrenwand verbindet, wenn die Schilddrüse von der Luftröhre getrennt und nach vorne gehoben wurde. Für Sritharan et al. (2016) handelt es sich um eine dichte Kondensation des prätrachealen vaskulären Bindegewebes, das die Schilddrüse mit den cricotrachealen Strukturen rückseitig verbindet. In unserer Studie wurde das BL auch als ein weißliches Band aus Bindegewebe beobachtet, das die Schilddrüse mit der Luftröhrenwand verbindet. Nach SERPELL (2010) würde diese relativ avaskuläre Bindegewebsschicht, das echte BL, medial und tief zum Recurrent Laryngeal Nerve (RLN) liegen.
Sasou, Nakamura, Kurihara (1998); Serpell (2010); Sritharan et al. (2016) beschrieben das BL bei Erwachsenen als ein dichtes Bindegewebsband vom Ringknorpel bis zu den ersten und dritten Trachealringen, das die Schilddrüse fest mit dem Kehlkopf und der Luftröhrenwand verbindet. Sie fanden eine Ligamentlänge von 8 bis 14 mm (Durchschnitt von 11,5 mm) und eine Breite von 2 bis 7 mm (Durchschnitt von 4,4 mm). In der vorliegenden Studie reichte die Länge des BL bei menschlichen Feten von 0,52 bis 2,24 mm auf der rechten Seite (Durchschnitt von 1,5 mm) und auf der linken Seite von 0,43 bis 1,68 mm (Durchschnitt von 1,2 mm), die Höhe reichte von 1,7 bis 4,44 mm (Durchschnitt 2,8 mm) auf der rechten Seite und 1,14 bis 3,43 mm (Durchschnitt 2,6 mm) auf der linken Seite. In der Literatur wurde oft auf einen Zusammenhang zwischen Verletzungen des RLN und des BL hingewiesen. RLN-Verletzungen sind eine der schwerwiegendsten Komplikationen bei Schilddrüsen- oder Nebenschilddrüsenoperationen, und das BL wurde als häufigster Ort der Nervenverletzung bezeichnet. Laut der American Society for Head and Neck Surgery reichen Stimmveränderungen nach Schilddrüsenentfernung von 30 bis 87%, während Schäden am NLR unterschätzt werden (3 bis 5%) und zu 10% zu steigen scheinen (JEANNON et al., 2009; FRANCIS et al., 2014; FUNDAKOWSKI et al., 2018). Nach Chiang et al. (2010); Chiang et al. (2011) nähern sich Stimmstörungen nach Schilddrüsenentfernung im Allgemeinen einem Anteil von 10%. Vor der Verwendung von intraoperativer Neurostimulation war der einzige Test zur Erkennung von RLN-Verletzungen die postoperative Laryngoskopie und Bewertung der Stimmbänder, wenn die Verletzung während der Operation nicht erkannt wurde. Die Fähigkeit, Zeitpunkt und Ort der Verletzung intraoperativ genau zu definieren, wurde durch einen Verlust des Signals während der NLR-Stimulation ermöglicht (MARCUS et al., 2003; SNYDER et al., 2008; CHIANG et al., 2010; CHIANG et al. al., 2011; DIONIGI et al., 2015; STOPA et al., 2017; WU et al., 2017; LIU et al., 2018; MANTALOVAS et al., 2022). Laut SNYDER et al. (2008) sind verletzte Nerven normalerweise intraoperativ intakt (0,45%) und werden einer Art funktioneller Nervenverletzung während der Schilddrüsenentfernung zugeschrieben. Chiang et al. (2008) erwähnten, dass funktionelle Nervenverletzungen mehr als 75% aller Verletzungen ausmachen. Diese Art von Schaden würde als Folge von Zugkräften auftreten, die während der zentralen Rotation der Schilddrüse auf das BL wirken.
Intraoperativ kann der RLN durch verschiedene Techniken identifiziert werden, wie Palpation, intraoperative Überwachung und direkte Inspektion anhand wichtiger anatomischer Landmarken wie dem BL, dem tracheoesophagealen Sulcus, der A. thyreoidea inferior und der Mittelpunkt des hinteren Randes
der Schilddrüse oder des Tuberkels von Zuckerkandl. Die Beziehung des Nervs zu diesen Landmarken ist variabel (Henry et al., 2017), verbessert jedoch die Sensitivität der intraoperativen Nervenüberwachung (PATRA et al., 2022).
Autoren wie Sasou, Nakamura, Kurihara (1998); Botelho et al. (2012) schlugen das BL als zuverlässige anatomische Landmarke vor, um den RLN intraoperativ zu lokalisieren. Dies wurde jedoch noch nicht weitgehend akzeptiert und als Standardverfahren umgesetzt (ASGHARPOUR et al., 2012). Einige Daten zeigten breite Variationen in der Lage des RLN in Bezug auf das BL: Der Nerv verläuft oberflächlich zum BL, mit einer Variation von null bis 100% (CAKIR et al., 2006; NOUSSIOS et al., 2020), während das Eindringmuster von 0 bis 31,6% variiert (CAKIR et al., 2006; HUNT et al., 1968; LEOW, WEBB, 1998; SASOU, NAKAMURA, KURIHARA, 1998; PRADEEP et al., 2012).
6. SCHLUSSFOLGERUNG
Kenntnisse über die BL-Biometrie und ihre anatomische Beziehung zur Schilddrüse und zum RLN sind unerlässlich, um insbesondere Verletzungen des RLN während einer Schilddrüsen- oder Nebenschilddrüsenoperation zu verhindern.
QUELLEN
ARDITO, G. et al. Revisited anatomy of the recurrent laryngeal nerves. Am J Surg, v. 187, n. 2, p. 249-53, 2004.
ASGHARPOUR, E. et al. Recurrent laryngeal nerve landmarks revisited. Head Neck, v. 34, n. 9, p. 1240-6, 2012.
BOTELHO, J.B. et al. Estudo das relações anatomocirúrgicas entre os nervos laríngeos recorrentes e o ligamento de Berry [Anatomic and surgical study of the recurrent laryngeal nerve and its involvement with the ligament of Berry]. Rev Col Bras Cir, v. 39, n. 5, p. 364-7, 2012.
CAKIR, B.O. et al. Reliable surgical landmarks for the identification of the recurrent laryngeal nerve. Otolaryngol Head Neck Surg, v. 135, n. 2, p. 299-302. 2006.
CHIANG, F.Y. et al. Standardization of intraoperative neuromonitoring of recurrent laryngeal nerve in thyroid operation. World J Surg, v. 34, n. 2, p. 223-9, 2010.
CHIANG, F.Y. et al. The mechanism of recurrent laryngeal nerve injury during thyroid surgery–the application of intraoperative neuromonitoring. Surgery, v. 143, n. 6, p. 743-9, 2008.
CHIANG, F.Y. et al. Does extensive dissection of recurrent laryngeal nerve during thyroid operation increase the risk of nerve injury? Evidence from the application of intraoperative neuromonitoring. Am J Otolaryngol, v. 32, n. 6, p. 499-503, 2011.
DELBRIDGE, L. et al. Total thyroidectomy: the technique of capsular dissection. Aust N Z J Surg, v. 62, n. 2, p. 96-9, 1992.
DIONIGI, G. et al. Continuous Intraoperative Neuromonitoring (C-IONM) Technique with the Automatic Periodic Stimulating (APS) Accessory for Conventional and Endoscopic Thyroid Surgery. Surg Technol Int, v. 26, p. 101-14, 2015.
FRANCIS, D.O. et al. Epidemiology of vocal fold paralyses after total thyroidectomy for well-differentiated thyroid cancer in a Medicare population. Otolaryngol Head Neck Surg, v. 150, n. 4, p. 548-57, 2014.
FUNDAKOWSKI, C. E. et al. Surgical management of the recurrent laryngeal nerve in thyroidectomy: American Head and Neck Society Consensus Statement. Head Neck, v. 40, n. 4, p. 663-675, 2018.
HENRY, B. M. et al. The Reliability of the Tracheoesophageal Groove and the Ligament of Berry as Landmarks for Identifying the Recurrent Laryngeal Nerve: A Cadaveric Study and Meta-Analysis. Biomed Res Int, 2017.
HUNT, P.S.; POOLE, M.; REEVE, T.S. A reappraisal of the surgical anatomy of the thyroid and parathyroid glands. Br J Surg, v. 55, n. 1, p. 63-6, 1968.
JEANNON, J.P. Diagnosis of recurrent laryngeal nerve palsy after thyroidectomy: a systematic review. Int J Clin Pract, v. 63, n. 4, p. 624-9, 2009.
LEOW, C.K.; WEBB, A.J. The lateral thyroid ligament of Berry. Int Surg, v. 83, n. 1, p. 75-8, 1998.
LIU X. et al. Laryngeal nerve morbidity in 1.273 central node dissections for thyroid cancer. Surg Oncol, v. 27, n. 2, p. A21-A25, 2018.
LORÉ, J.M. J.R.; KIM, D.J.; ELIAS, S. Preservation of the laryngeal nerves during total thyroid lobectomy. Ann Otol Rhinol Laryngol, v. 86, n. 6 Pt 1, p. 777-88, 1977.
MANTALOVAS, S. Surgical Significance of Berry’s Posterolateral Ligament and Frequency of Recurrent Laryngeal Nerve Injury into the Last 2 cm of Its Caudal Extralaryngeal Part (P1) during Thyroidectomy. Medicina (Kaunas), v. 58, n. 6, p. 755, 2022.
MARCUS, B. et al. Recurrent laryngeal nerve monitoring in thyroid and parathyroid surgery: the University of Michigan experience. Laryngoscope, v. 113, n. 2, p. 356-61, 2003.
NGO, NYEKI A. R. et al. Recurrent laryngeal nerve landmarks during thyroidectomy. Eur Ann Otorhinolaryngol Head Neck Dis, v. 132, n. 5, p. 265-9, 2015.
NOUSSIOS, G. et al. The Anatomical Relationship of Inferior Thyroid Artery and Recurrent Laryngeal Nerve: A Review of the Literature and Its Clinical Importance. J Clin Med Res, v. 12, n. 10, p. 640-646, 2020.
PATRA, A. et al. Identification of valid anatomical landmarks to locate and protect recurrent laryngeal nerve during thyroid surgery: a cadaveric study. Surg Radiol Anat, 2022.
PRADEEP, P.V.; JAYASHREE, B.; HARSHITA, S.S. A Closer Look at Laryngeal Nerves during Thyroid Surgery: A Descriptive Study of 584 Nerves. Anat Res Int, 2012.
RANDOLPH, G.W. et al. Electrophysiologic recurrent laryngeal nerve monitoring during thyroid and parathyroid surgery: international standards guideline statement. Laryngoscope. v. 121, Suppl 1:S1-16, 2011.
SASOU, S.; NAKAMURA, S.; KURIHARA, H. Suspensory ligament of Berry: its relationship to recurrent laryngeal nerve and anatomic examination of 24 autopsies. Head Neck, v. 20, n. 8, p. 695-8, 1998.
SERPELL, J.W. New operative surgical concept of two fascial layers enveloping the recurrent laryngeal nerve. Ann Surg Oncol, v. 17, n. 6, p. 1628-36, 2010.
SNYDER, S.K. et al. Elucidating mechanisms of recurrent laryngeal nerve injury during thyroidectomy and parathyroidectomy. J Am Coll Surg, v. 206, n. 1, p. 123-30, 2008.
SNYDER, W.S. et al. Report of the Task Group on Reference Man. Oxford: Pergamon Press, v. 23, n. 75, p. 80015-8, 1975. Disponível em: https://doi.org/10.1016/S0074-2740.
SRITHARAN, N. et al. The Ligament of Berry. In: RANDOLPH, G.W. (Ed.). The Recurrent and Superior Laryngeal Nerves. Switzerland: Springer, p. 103-113, 2016. Disponível em: https://doi.org/10.1007/978-3-319-27727-1_10.
STOPA, M.; BARCZYŃSKI, M. Prognostic value of intraoperative neural monitoring of the recurrent laryngeal nerve in thyroid surgery. Langenbecks Arch Surg, v. 402, n. 6, p. 957-964, 2017.
THOMPSON, N.W., OLSEN, W.R., HOFFMAN, G.L. The continuing development of the technique of thyroidectomy. Surgery, v. 73, n. 6, p. 913-27, 1973.
WU, C.W. et al. Recurrent laryngeal nerve injury with incomplete loss of electromyography signal during monitored thyroidectomy-evaluation and outcome. Langenbecks Arch Surg, v. 402, n. 4, p. 691-699, 2017.
[1] Berater. Ordentlicher Professor für Klinische Anatomie. ORCID: https://orcid.org/0000-0002-2300-3330. Currículo Lattes: http://lattes.cnpq.br/6911783083973582.
[2] Medizinische Klinik-Residentin. ORCID: https://orcid.org/0000-0002-5298-537X. Currículo Lattes: http://lattes.cnpq.br/6291628187714859.
[3] Medizinische Klinik-Residentin. ORCID: https://orcid.org/0000-0001-9211-7000. Currículo Lattes: http://lattes.cnpq.br/4619345212343744.
[4] Medizinstudent. ORCID: https://orcid.org/0000-0001-5924-8658. Currículo Lattes: http://lattes.cnpq.br/1862815448788019.
[5] Medizinstudent. ORCID: https://orcid.org/0000-0001-6974-169X. Currículo Lattes: http://lattes.cnpq.br/7562287657874077.
[6] Medizinstudent. ORCID: https://orcid.org/0009-0006-0486-3980. Currículo Lattes: http://lattes.cnpq.br/4418868415307533.
[7] Ordentlicher Professor für Klinische Anatomie. ORCID: https://orcid.org/0000-0002-2146-3499. Currículo Lattes: http://lattes.cnpq.br/3543011108453552.
[8] Ordentlicher Professor für Molekularbiologie. ORCID: https://orcid.org/0000-0001-5705-6433. Currículo Lattes: http://lattes.cnpq.br/3337321488338686.
[9] Ordentlicher Professor der Medizinischen Fakultät. ORCID: https://orcid.org/0000-0002-7776-1831. Currículo Lattes: http://lattes.cnpq.br/6858508576490184.
Eingereicht am: 10. Mai 2023.
Genehmigt am: 27. Juni 2023.


