GONÇALVES, Edvaldo de Souza [1], FROEHNER, Sandro José [2]
GONÇALVES, Edvaldo de Souza; FROEHNER, Sandro José. Uso de Peróxido Magnésio como Fonte de Oxigênio na Degradação de HPAs em Biopilhas. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano 03, Ed. 02, Vol. 04, pp. 70-88, Fevereiro de 2018. ISSN: 2448-0959
Resumo
Foram determinadas as degradações de três HPAs (fenantreno, antraceno e pireno) em pilhas de solo argiloso, com períodos compreendidos entre 1 e 45 dias. As pilhas foram montadas em 4 conjuntos, cada conjunto foi montado da seguinte maneira: O primeiro conjunto era composto por solo natural, o segundo por solo natural e 5% de peróxido de magnésio, o terceiro por solo natural esterilizado, a 180oC, durante 2 horas, e o quarto conjunto foi montado com solo esterilizado e adição de 5% de peroxido de magnésio. Foi caracterizada a formação do radical hidroxila resultado da reação entre o MgO2 e o Fe(II). O radical acelera a degradação. A pilha de solo natural com 5 % de MgO2, apresentou, ao final dos 45 dias, uma redução na concentração dos HPAs em 18,45% comparado com a pilha de solo natural sem o peroxido. Os dois conjuntos de pilhas com peróxido de magnésio em sua composição apresentaram as maiores taxas de degradação para os períodos de 1 e 15 dias para os 3 HPAs analisados. Após o período de 15 dias, as biopilhas que contendo peróxido de magnésio estabilizaram, indicando o declínio da disponibilidade de Fe(II), consumido devido a reação de Fenton modificada.
Palavras-Chave: HPAs, Peróxido de Magnésio, Biorremediação, Radical Hidroxila.
1. Introdução
Os processos de degradação de hidrocarbonetos policíclicos aromáticos (HPAs) por biopilha são, em geral, lentos, podendo levar meses ou até mesmo anos (ANDRADE et al., 2010). Entretanto, a técnica é muito utilizada dado à facilidade de construção e implementação, além da diversidade de compostos e produtos que podem ser tratados por esta técnica, tais como petróleo e seus derivados, pesticidas e compostos organoclorados (USEPA 1998e; KHAN et al., 2004). Para melhorar a eficiência e diminuir o tempo de degradação, vários pesquisadores tem se debruçado na tentativa de otimizar a técnica, seja pela introdução de aditivos químicos ou biológicos ou, até mesmo, por adaptações físicas no sistema.
Recentemente, foram testados agentes biológicos específicos, denominados bioaumentação. A bioaumentação é o incremento de agentes biológicos adaptados à degradação de compostos ou grupo específicos. Estes agentes são empregados com o objetivo de acelerar o processo de degradação de poluentes. Luo (2014) e colaboradores pesquisaram a utilização de um consórcio de bactérias e micro algas para acelerar a degradação do pireno em 30% comparada com uma degradação com apenas bactérias em uma biopilha.
Alterações físicas também têm sido propostas na tentativa de favorecer a degradação aeróbica de compostos orgânicos. A adição de materiais estruturantes no solo contaminado facilita a aeração e a retenção de água do meio. Geralmente, subprodutos ou rejeitos da produção de alimentos como cascas de cereais, cocos ou até mesmo bagaço de cana de açúcar são usados para esta finalidade (XU; LU 2010; SANTOS et al., 2007).
Os processos de remediação química de HPAs em solo contaminados estão classificados em dois grupos, os convencionais e, ou, processos oxidativos avançados. O processo químico convencional usa íons como agentes oxidantes, exemplo a utilização do KMnO4 que libera o íon permanganato. Já o processo oxidativos avançado utilizam diferentes reagentes para produzir o radical hidroxila (·OH). Exemplos desses métodos são os reagentes de Fenton (H2O2/Fe2+) e fóton-Fenton(H2O2/Fe2+/luz ultravioleta artificial ou solar) (USEPA, 1998).
Já a estimulação química, via introdução de oxigênio para incremento aeróbico é conhecida como bioestimulação. A adição de oxigênio nas biopilhas pode ocorrer de duas maneiras; i) pelo insuflamento, via sistema de bombeamento, ii) ou por compostos químicos que liberam gradativamente oxigênio quando em contato com água. Um exemplo é o peróxido de magnésio (MgO2) que, em contato com água, libera oxigênio. Entretanto, além de liberar oxigênio, o MgO2 pode produzir água oxigenada, que, por sua vez, pode reagir com ferro II disponível no solo ou nos resíduos a serem tratados, liberando o radical hidroxila. O radical hidroxila é altamente oxidante e sua contribuição na degradação de contaminantes não é mensurada separadamente e sim, computada na degradação biológica. O presente estudo tem como proposta avaliar a contribuição da adição de MgO2 na degradação dos HPAs no tratamento por biopilhas.
2. Materiais e métodos
Os métodos na sequência são para determinação da degradação do antraceno, pireno e fenantreno em quatro biopilhas compostas da seguinte maneira: i) Solo e HPAs, denominada abreviadamente por pilha SN a qual será o branco; ii) Solo, HPAs e MgO2, denominada abreviadamente por pilha SNP, a qual será analisado o aumento da eficiência na degradação dos HPAs pela adição de 5% de peroxido de magnésio no solo; iii) Solo esterilizado e HPAs, denominada abreviadamente por pilha SE a qual será o branco para análise de uma degradação química com a pilha iv, descrita na sequência ; iv) Solo esterilizado, HPAs e MgO2, denominada abreviadamente como pilha SEP sua utilizada para verificar a existência de degradação química no solo.
Preparação do solo
O solo utilizado nos experimentos foi coletado no Centro Politécnico da Universidade Federal do Paraná, coordenadas: 25o 27.228′ S 049o0,35′ O. Na coleta do solo, a parte superior foi descartada, sendo coletado apenas o solo abaixo de 15 cm da superfície.
O solo foi previamente seco em estufa e ao ar, a uma temperatura inferior a 40oC, durante 7 dias. Posteriormente, foi macerado e peneirado em peneira de 2mm para sua homogeneização. O método foi adaptado quanto ao destorroamento, ao invés de usar uma peça de couro e um cilindro para destorroar foi usado um pistilo e um almofariz, conforme Manual de Métodos de Análise Solo (Embrapa, 1997).
Esterilização do solo
O solo foi esterilizado, durante 2 horas, a 180oC, conforme descrito por SINEGANI e HOSSEINPUR (2010), para avaliar a degradação dos HPAs via MgO2 (agente de degradação radical hidroxila) sem microrganismos no solo.
Preparação da pilhas
O solo para a preparação das biopilhas foi umedecido em 15% em relação a sua massa total. Quatro biopilhas foram montadas em triplicatas, todas com 1000g de solo e 250mg de cada HPAs (antraceno , pireno e fenantreno).
A primeira pilha foi montada apenas com solo e os 3 HPAs contaminantes; a segunda pilha foi composta por solo, os 3 HPAs e 5% de MgO2; a terceira pilha foi composta com solo estéril e os 3 HPAs; e, finalmente, a quarta pilha, foi constituída por solo estéril e os 3 HPAs contaminantes.
Para melhor aplicação e incorporação dos contaminantes no solo, os HPAs foram adicionados na forma de uma solução em acetona. Os recipientes, contendo os experimentos (pilhas), foram fechados durante 5 min para permitir que o solvente se disperse, sendo evaporado em seguida. Este protocolo proporciona uma concentração de solvente de 2,5% (vol. / peso), ou seja, 25 ml do solvente com os contaminantes em toda a amostra de solo. Todas as misturas foram realizadas no béquer, com duração de 1 minuto, com uma espátula de metal (BRINCH et. al., 2002). Durante os experimentos, as pilhas ficaram cobertas com plástico filme com pequenos furos para ventilação e umidade das pilhas foram mantidas em 15%.
A primeira extração para análise dos HPAs foi realizada antes da contaminação, para verificar a quantidade deste HPAs pré-existente. Após contaminar o solo, foram realizadas extrações com os seguintes intervalos: 24 horas após a contaminação, 7 dias, 15 dias, 30 dias e 45 dias.
Caracterização físico-química do solo
O solo foi caracterizado segundo a composição química conforme Manual de Métodos de Análise Solo (Embrapa, 1997). (Tabela 1).
TABELA 1 – ANÁLISE QUÍMICA
| Elemento/medida | Método | Unidade | Resultados |
| pH | CaCl2 | 5,7 | |
| pH | SMP | 6,10 | |
| Al+3 | Cmolc /dm3 | 0,00 | |
| H+ + Al+3 | Cmolc /dm3 | 4,60 | |
| Ca+2 | Cmolc /dm3 | 12,80 | |
| Mg+2 | Cmolc /dm3 | 4,10 | |
| K+ | Cmolc /dm3 | 0,79 | |
| P | mg/dm3 | 6,80 | |
| S | mg/dm3 | —– | |
| C | g/dm3 | 7,8 | |
| Ca/Mg | ———— | 3,12 | |
| Cu | mg/kg | 1,30 | |
| Mn | mg/kg | 77,00 | |
| Fe | mg/kg | 28,90 | |
| Zn | mg/kg | 10,60 |
FONTE: O Autor (2016)
A caracterização física do solo revelou um solo do tipo argiloso, com composição física de 53,7% de argila, 23,8% de silte, 16,5% de areia grossa e 6,0% de areia fina. A caracterização física do solo foi executada pelo laboratório de análise física do Solo-UFPR, a classificação do tipo de solo foi baseada no diagrama trilinear textural do Bureal of Public Roads-EUA, que é empregado no Brasil para levantamento de solo.
Análise quantitativa dos HPAs
Extração
As extrações dos HPAs foram realizadas conforme o procedimento descrito por BANJOO e NELSON, (2005) e TABOR, (2015). Partindo-se de aproximadamente 1,0 g de amostra de solo, adição do 20µl de uma solução 1000mg/L do Surrogate antes da primeira extração, foram realizadas 3 extrações em série. Cada etapa da extração utilizou 10,0mL de uma mistura 2:1 diclorometano-metanol (v:v). Após a adição da mistura de solvente, os tubos de ensaio foram homogeneizados em vórtex por 1 minuto. Posteriormente, os tubos de ensaio foram postos em banho ultrassônico por 10 minutos, centrifugados por 6 minutos a 3000rpm, para cada extração. As três frações foram combinadas, foi utilizado um rotaevaporador para diminuir o volume das três frações a aproximadamente 1ml, adicionada 0,2g de alumina e seca sob fluxo de nitrogênio. A etapa seguinte consistiu na separação dos compostos de interesse (HPAs). A separação foi realizada a partir de colunas cromatográficas preenchidas com sílica gel ativada (aproximadamente 2 g) e 0,2 g de sulfato de sódio, ambas previamente tratadas. A coluna foi eluída com 4 ml de n-hexano o qual foi descartado, e os HPAs foram separados pela eluição de 4 mL de uma mistura n-hexano:tolueno (3:1) diminuído o volume por nitrogênio e analisado no GC.
Parâmetros e tempos cromatográficos a serem utilizados para determinação dos HPAs
A separação por cromatografia gasosa teve as seguintes condições:
Equipamento Varian, Modelo: GC 431, MS-220. Injetor em modo Splitless, temperatura 250°C, pressão: 6,1545 psi volume de injeção 1,0 uL. Coluna Modelo Zebron ZB-5MS, 30m x 0,25mm x 0,25μm, temperatura máxima 320ºC, fluxo de gás na coluna (gás de arraste) em 1,32 mL/min de Nitrogênio, rampa de temperatura, início 45°C por 1 min, elevação da temperatura a 25°C/min até 160°C, elevação da temperatura a 5°C/min até 270°C, permanecendo por 13 min, tempo Total de corrida: 42,0 minutos. Fluxo de gases no MS 30 mL/min de Hidrogênio, 300 mL/min de Ar, 15 mL/min de Nitrogênio, detector massa (MS), temperatura: 300ºC.
Determinação do pH no solo
Foi monitorada a variação do pH durante todas as coletas. A metodologia usada está descrita no Manual de Métodos de Análise de Solo da Embrapa, (1997). O procedimento consiste na imersão do eletrodo em suspensão (água, KCl ou CaCl2), 10g de solo, 25ml de líquido (água, KCl 1M ou CaCl2 0,01 M), em seguida, agita-se a amostra com bastão de vidro a deixa em repouso durante uma hora. Por fim, mergulham os eletrodos na suspensão homogeneizada e realiza-se a leitura do pH.
Ensaio de Recuperação
O ensaio de recuperação (ou fator de Recuperação) que é definido pela proporção de substância pré-existente ou adicionada na amostra, que, aplicando a técnica e metodologia de extração e análise na porção analítica, a substância de interesse possa ser quantificada e comparada (RIBANI et al., 2004), foi usando o surrogate, ou substituto, é utilizado como padrão para estimar a recuperação da substância em análise, sendo utilizado o Surrogate (9,10 DihidroAantraceno) fornecido pela Sigma-Aldrich com pureza 97%.
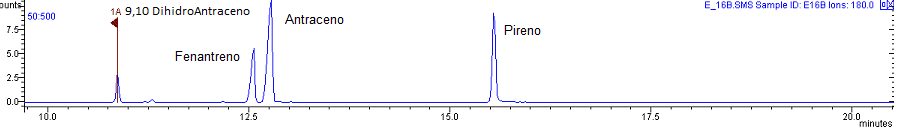
3. Resultados e discussões
Valores de pH das pilhas
O pH das pilhas SN (solo natural) e SE (solo estéril) com os três HPAs adicionados durante os 45 dias não apresentaram variação significativa no pH. O pH do solo medido antes da adição dos HPAs era de 6,4 e a média da pilha SN, medida durante os 45 dias do experimento, ficou em 6,3. Já a pilha SE obteve pH de 6,2, demonstrado a baixa atividade microbiana. As pilhas SNP (solo natural com peroxido) e SEP (solo estéril com peroxido) com adição de 5% peroxido de magnésio aumentaram seu pH de 6,4 para 9,2 e 9,3, respectivamente. A elevação do pH está relacionada à reação do peroxido de magnésio com água, produzido hidróxido de magnésio. Este, por sua vez, reage com íons H+ disponíveis, elevando o pH do meio.
Identificação do radical hidroxila (•OH)
A identificação da presença do radical hidroxila foi realizada a partir da decomposição de 300 mg/L de MgO2 (peroxido de magnésio) em meio ácido, pH 3, juntamente com 100 mg/L de catalisador (Fe2+ e Fe3+). Esta reação demonstrou a produção deste radical a partir do uso de MgO2, corroborando com os estudos que demonstram a degradação de pentaclorofenol em águas subterrâneas com a aplicação de MgO2 e adição de Fe2+-EDTA em pH 9 (VELOSO e NASCIMENTO, 2013).
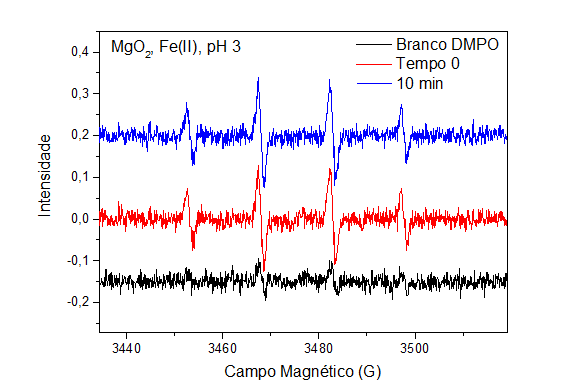
O branco da Figura 10 é o 5,5-dimethyl-1-pyrroline-N-Oxide (DMPO), sem entrar em contato com solo/peróxido ou outro material capaz de alterar sua estrutura por transferência de spin, representado pela linha preta. Já as linhas vermelha e azul foram geradas com DMPO, que sofreu transferência do spin do radical hidroxila, produzido pela reação MgO2 e Fe(II). Foi lido, primeiramente, em tempo inicial, gerando os 4 picos característicos de detecção de transferência de spin do material analisado para o DMPO. Após 10 minutos, efetuou-se uma nova leitura, para a confirmação da transferência.
Percentual de degradação média de cada HPAs na pilha
O valor de degradação percentual média obtido aos 45 dias para o fenantreno em todas as pilhas atingiu os maiores valores para os três HPAs analisados. Uma das características que facilita sua degradação é sua maior solubilidade em água (1,1 mg/L) a qual facilita sua reação com o radical hidroxila e sua disponibilidade para os microrganismo degradadores de HPAs, juntamente com sua com sua maior pressão de vapor (2,0×10-2 Pa, a 20oC) a qual faz evaporar parte deste HPA do solo. Já a solubilidade do antraceno é de 0,045 mg/L e do pireno é 0,13mg/L, além das pressões de vapor serem 20 e 100 vezes menores, respectivamente (THE MERCK INDEX, 1996).
Os valores de degradação percentual de fenantreno, amostrados no primeiro, sétimo e décimo quinto dia, nas séries de biopilhas com MgO2, apresentam os maiores valores de degradação inicial, indicando a possibilidade de um agente inicial na degradação do Fenantreno. No entanto, observou-se que estes valores estão dentro da faixa do desvio padrão dos demais valores das biopilhas sem MgO2. Outro ponto a ser observado, é que os valores de controle da pilha SE de solo estéril sem a adição de MgO2, apresentam degradação igual ou até mesmo maior a partir do período de 15 dias.
TABELA 2 – PERCENTUAL DE DEGRADAÇÃO MÉDIA PARA O FENANTRENO NOS PERÍODOS ANALISADOS
| Dias | SN | SNP | SE | SEP |
| 1 | 41,15 ± 31,66 | 54,21 ± 9,35 | 37,30 ± 22,27 | 64,17 ± 9,95 |
| 7 | 53,09 ± 13,52 | 78,71 ± 6,11 | 35,67 ± 19,97 | 42,79 ± 15,13 |
| 15 | 44,37 ± 18,98 | 80,14 ± 8,07 | 68,42 ± 5,70 | 70,36 ± 6,54 |
| 30 | 69,35 ± 5,08 | 81,09 ± 8,73 | 85,34 ± 2,37 | 82,58 ± 1,40 |
| 45 | 78,10 ± 18,12 | 95,44 ± 2,50 | 96,34 ± 0,94 | 92,13 ± 5,06 |
Fonte: O autor, 2016
Os valores mais condizentes com o esperado estão nas biopilhas SNP (biopilha de solo natural +5% de MgO2), onde a degradação do fenantreno, antraceno e pireno na pilha SNP foi de 17,34%, 18,72% e 19,29%, respectivamente, maior que na biopilha SN controle (biopilha de solo natural).
TABELA 3 – PERCENTUAL DE DEGRADAÇÃO MÉDIA DO ANTRACENO NOS PERIODOS ANALISADOS
| Dias | SN | SNP | SE | SEP |
| 1 | 52,47 ± 33,64 | 54,99 ± 21,24 | 46,81 ± 21,63 | 84,28 ± 5,12 |
| 7 | 63,79 ± 15,46 | 77,87 ± 6,07 | 38,68 ± 19,03 | 54,45 ± 8,06 |
| 15 | 45,21 ± 12,58 | 75,60 ± 4,96 | 70,06 ± 5,34 | 74,82 ± 4,23 |
| 30 | 72,53 ± 5,03 | 75,13 ± 10,39 | 78,54 ± 5,99 | 80,97 ± 5,43 |
| 45 | 64,57 ± 13,60 | 83,29 ± 3,95 | 88,31 ± 4,22 | 79,35 ± 3,61 |
Fonte: O autor, 2016
TABELA 4 – PERCENTUAL DE DEGRADAÇÃO MÉDIA DO PIRENO NOS PERIODOS ANALISADOS
| Dias | SN | SNP | SE | SEP |
| 1 | 47,10 ± 30,51 | 48,12 ± 15,02 | 41,39 ± 22,13 | 64,93 ± 2,63 |
| 7 | 56,95 ± 8,07 | 71,61 ± 4,67 | 31,00 ± 25,67 | 41,36 ± 16,71 |
| 15 | 34,15 ± 22,32 | 70,29 ± 5,78 | 59,95 ± 15,03 | 64,17 ± 4,91 |
| 30 | 62,59 ± 4,33 | 66,25 ± 11,56 | 67,50 ± 10,69 | 74,39 ± 5,93 |
| 45 | 62,70 ± 13,86 | 81,99 ± 5,12 | 78,82 ± 3,73 | 71,73 ± 4,54 |
Fonte: O autor, 2016
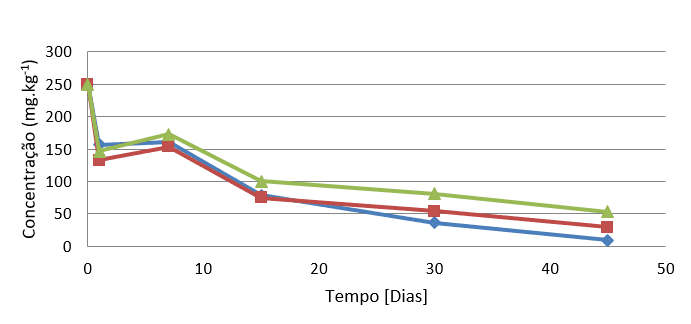
O decaimento gradual dos poluentes na pilha SN (FIGURA 3), demonstra a estabilização dos poluentes em solo natural e, consequentemente, sua diminuição quanto a perdas por evaporação e lixiviação dos poluentes, como será discutido na sequência.
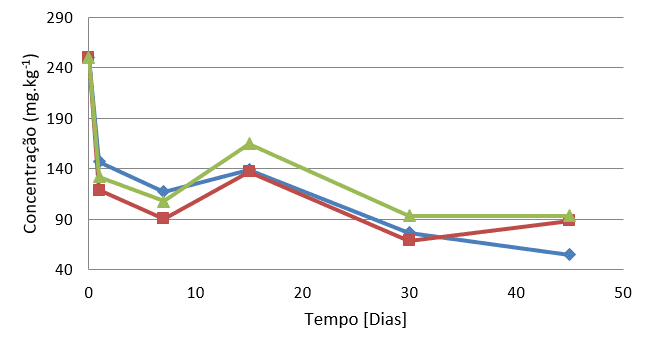
Na pilha com solo natural e 5% de peróxido de magnésio (SNP) (FIGURA 3) há um decaimento inicial alto dos três HPAs, entre o período de um e sete dias. Em seguida, há uma estabilização, seguida de outro decaimento, ocorrido após o trigésimo dia. Esse comportamento indica uma degradação química inicial, seguida de uma adaptação e crescimento da biota, desenvolvendo uma degradação biológica auxiliada pela liberação de oxigênio via peróxido.
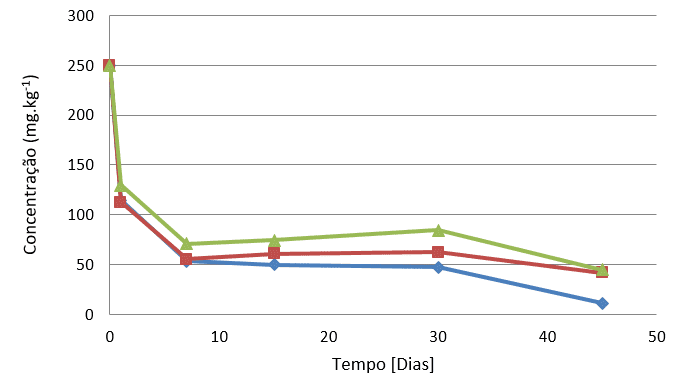
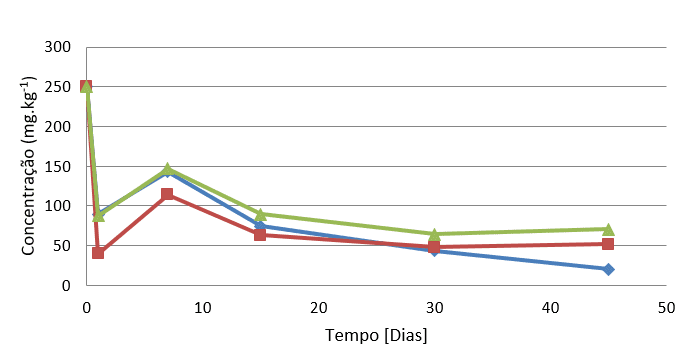
O decaimento dos HPAS na pilha SE de solo estéril sem adição de peróxido é relativamente continuo, demonstrando a ausência de uma ligação forte entre solo e contaminante. Esse comportamento difere da estabilidade na degradação existente na pilha SN e das pilhas com peróxido, que apresentam um decaimento inicial mais acentuado.
A pilha SEP demonstra um decaimento inicial de degradação química, porém após 15 dias se mantém relativamente estável com decaimento mais acentuado do fenantreno condizente a sua maior pressão de vapor, ou seja, perda de contaminante por evaporação.
Como citado por JACQUES (2005), a menor degradação do Pireno nas biopilhas era esperado, pois o mesmo tem quatro anéis aromáticos na sua estrutura. O anel aromático gera uma grande estabilidade na estrutura, a presença deste anel a mais, em relação aos outros dois compostos, possibilita maior resistência a ataques químicos ou biológicos. A diferença na degradação entre o Fenantreno e o Antraceno esta relacionada com sua geometria, visto que os dois compostos possuem três anéis e mesma massa. No entanto, o Antraceno mostra-se mais simétrico que o Fenantreno, ou seja, mais estável (SOLOMONS E FRYHLE, 2006).
As biopilhas com solo natural, sem adição de peróxido, demonstraram uma degradação lenta e gradual (figura 3). Esta tendência é confirmada por vários experimentos aplicados em teste de degradação de HPAs, COVs (compostos orgânicos voláteis) e demais compostos derivados do petróleo (JORGENSEN et al., 2000; SARKAR et al.; 2004; BAPTISTA E RIZZO, 2004; EPA, 2004b). Esta característica de degradação lenta das biopilhas naturais é devida a necessidade de adaptação dos microrganismos para esta nova fonte carbono disponível logo após a contaminação. A contaminação do solo por óleo, em geral, prova a diminuição da atividade microbiana, que resultando na redução da biomassa e causando efeito inibitório sobre as atividades da hidrolise envolvidas nos ciclos do nitrogênio, fósforo e do carbono ( LADUD et al., 2007).
As pilhas de solo natural com adição de 5% MgO2 apresentaram as melhores estabilidades na degradação dos 3 HPAs analisados. Este grupo obteve, inicialmente, uma das maiores médias nas degradações para um dia, sendo: 54,21±9,35% para Fenantreno, 54,99±21,24% para o Antraceno e 48,12±15,02% para o Pireno. Já para o tempo de 7 dias, obteve a maior degradação entre as pilhas: 78,71±6,11%, 77,87±6,07% e 71,61±4,67%, respectivamente, para os três HPAs.
A diminuição dos HPAs no branco (solo estéril) pode estar relacionada a perda de substâncias húmicas e biomassa do solo. Essa perda de matéria orgânica do solo é devido ao tratamento de esterilização (180oC, durante 2 horas) SINEGANI e HOSSEINPUR, (2010), visto que as substâncias minerais e húmicas estão intimamente ligadas, formando um complexo de adsorção coloidal que favorece a retenção de humidade. Este complexo coloidal dificulta a remoção dos poluentes, já que sua existência no solo retém eficientemente substancias orgânicas e inorgânicas por diversos mecanismos, desde adsorção física a formação de ligações químicas relativamente fortes (CADENA, CAZARES, 1996). O ponto de ebulição dos ácidos húmicos é de, aproximadamente, 100oC sendo estes evaporados do solo durante o processo de esterilização. Sendo assim, a ligação e estabilização dos HPAs no solo é prejudicada, e os HPAs ficam mais suscetíveis à evaporação.
As diferenças de degradação entre as pilhas de solo estéril (SE) e as pilhas de solo estéril com 5% de peróxido de magnésio (SEP) apresentam as maiores diferenças no período de um dia para os 3 HPAs analisados. Sendo a diferenças 26,87% para fenantreno, 37,48% para o antraceno e 23,55% para o pireno. Já para as pilhas de solo natural com peroxido de magnésio (SNP) e solo natural (SN) a diferença entre elas é maior no período de 30 dias para todos os três HPAs analisados, sendo para o fenantreno 35,77%, antraceno 30,38% e para o pireno 36,14%.
Nas pilhas de solo estéril com e sem o peróxido de magnésio temos o ápice de diferença percentual entre as pilhas referência SE e pilha teste SEP no período de um dia, esta diferença cai rapidamente ao período de 7 dias indicando que a partir deste período a perda dos HPAs nas pilhas é predominantemente por evaporação enquanto que inicialmente temos um possível degradação química. Como já citado anteriormente que solos estéreis por processo térmico perde material orgânico fazendo com que nestas pilhas a fixação dos HPAs no solo seja fraca. Já as pilhas SN e nas pilhas SNP a matéria orgânica existente se liga mais fortemente aos HPAs, dificultando sua evaporação e tendo nestas pilhas uma degradação maior na matriz solo via biológica e química e tendo se ápice no período de 30 dias. Outro detalhe é que a estabilização dos HPAs nas pilhas de solo naturais não ocorre da degradação das pilhas referências terem maior degradação que a pilha teste como ocorre nas pilhas de solo estéril.
TABELA 5 – DIFERENÇA PERCENTUAL DE DEGRADAÇÃO DO FENANTRENO ENTRE AS PILHA SE E PILHA SEP E ENTRE AS PILHAS SNP E SN
| Dias | SEP | SE | Diferença | SNP | SN | Diferença |
| 1 | 64,17 | 37,30 | 26,87 | 54,21 | 41,15 | 13,07 |
| 7 | 42,79 | 35,67 | 7,12 | 78,71 | 53,09 | 25,62 |
| 15 | 70,36 | 68,42 | 1,94 | 80,14 | 44,37 | 35,77 |
| 30 | 82,58 | 85,34 | -2,76 | 81,09 | 69,35 | 11,73 |
| 45 | 92,13 | 96,34 | -4,21 | 95,44 | 78,10 | 17,34 |
TABELA 6 – DIFERENÇA PERCENTUAL DE DEGRADAÇÃO DE ANTRACENO ENTRE AS PILHAS SEP E SE E ENTRE AS PILHAS SNP E SN
| Dias | SEP | SE | Diferença | SNP | SN | Diferença |
| 1 | 84,28 | 46,81 | 37,48 | 54,99 | 52,47 | 2,51 |
| 7 | 54,45 | 38,68 | 15,76 | 77,87 | 63,79 | 14,08 |
| 15 | 74,82 | 70,06 | 4,76 | 75,60 | 45,21 | 30,38 |
| 30 | 80,97 | 78,54 | 2,43 | 75,13 | 72,53 | 2,59 |
| 45 | 79,35 | 88,31 | -8,97 | 83,29 | 64,57 | 18,72 |
TABELA 7 – DIFERENÇA PERCENTUAL DE DEGRADAÇÃO DE PIRENO ENTRE AS PILHAS SEP E SE E ENTRE AS PILHAS SNP E SN
| Dias | SEP | SE | Diferença | SNP | SN | Diferença |
| 1 | 64,93 | 41,39 | 23,55 | 48,12 | 47,10 | 1,02 |
| 7 | 41,36 | 31,00 | 10,36 | 71,61 | 56,95 | 14,66 |
| 15 | 64,17 | 59,95 | 4,22 | 70,29 | 34,15 | 36,14 |
| 30 | 74,39 | 67,50 | 6,88 | 66,25 | 62,59 | 3,66 |
| 45 | 71,73 | 78,82 | -7,09 | 81,99 | 62,70 | 19,29 |
Conclusões
A avaliação da degradação dos HPAs (Fenantreno, Antraceno e Pireno) em solo siltosos com adição de 5% de MgO2 foi positiva, tendo degradado maior percentual de HPAs em biopilhas SNP (biopilha de solo natural +5% de MgO2) se comparadas às biopilhas SN (biopilha de solo natural) controle. A diferença percentual média de degradação do Fenantreno, Antraceno e Pireno na pilha SNP foi 17,34%, 18,72% e 19,29%, respectivamente, maior que na biopilha SN controle.
A identificação da presença do radical hidroxila, produzida a partir da decomposição de MgO2 (peroxido de magnésio), mesmo que não na amostra, mas sim em uma condição diferente do que a da pilha (meio aquoso ácido), indica a possibilidade de um agente químico na degradação da pilha SNP devido a adição do peróxido. Esta maior degradação demonstra a possível formação do radical hidroxila pela reação de Fenton modificado. Desta forma, cria-se a possibilidade de um novo foco para otimização do MgO2 na degradação de compostos orgânicos derivados de petróleo, uma vez que, anteriormente, somente tinha o intuito de promover a de liberação de oxigênio, que favorecia a biota aeróbica degradadora de compostos derivados de petróleo.
O uso do peróxido de magnésio para remediação do solo apresenta vantagens pela não liberação de metais tóxicos, além do pós-tratamento não necessitar de neutralização do solo, diferente do tratamento pela reação de Fenton tradicional, o qual acidifica o solo.
A conclusão quanto ao uso do peróxido de magnésio para degradação de HPAs no solo é favorável, pois seu uso melhora a degradação de agentes recalcitrantes como o pireno o qual tem resistência a degradação biológica, como diminui o tempo de degradação de compostos mais leves como o antraceno e fenantreno.
REFERÊNCIAS
ANDRADE, J. D. A., AUGUSTO, F., & JARDIM, I. C. S. F. (2010). Biorremediação de solos contaminados por petróleo e seus derivados. Eclética química,35(3), 17-43.
BANJOO, D.R.; NELSON, P. K. Improved ultrasonic extraction procedure for the determination of polycyclic aromatic hydrocarbons in sediments. Journal of Chromatography A, v.1066, p.9–18, 2005.
BAPTISTA, PAULA MACHADO; RIZZO, AC DE L. Acompanhamento do processo de atenuação natural de solo contaminado por petróleo. XII Jornada de Iniciação Científica do CETEM/MCT, 2004.
BRINCH, U. C.; EKELUND, F.; JACOBSEN, C. S. Method for Spiking Soil Samples with Organic Compounds. Applied And Environmental Microbiology, v.68, n.4, p. 1808-1816, 2002.
CADENA, F.; CAZARES, E.; in: SHAWNEY; B. (ed). Organic Pollutants in the Environment. Boulder, Colorado: The Clay Minerals Society, 1996, pp 69.
EMPRESA BRASILEIRA DE PESQUISA AGROPECUÁRIA – EMBRAPA. Manual de métodos de análise de solo. 2.ed. Rio de Janeiro, Centro Nacional de Pesquisa de Solos, 1997. 212p.
Estados Unidos da América. US Environmental Protection Agency – USEPA. Advanced Photochemical Oxidation Processes (EPA/625/R-98/004). Washington DC, 1998.
JACQUES, R.J.S, Biorremediação de Antraceno, Fenantreno e Pireno em Argissolo. 188 f. tese ( Doutorado em Ciência do Solo)- Faculdade de Agronomia , Universidade Federal do Rio Grande do Sul, Porto Alegre, 2005.
JORGENSEN, K. S., PUUSTINEN, J., & SUORTTI, A. M. (2000). Bioremediation of petroleum hydrocarbon-contaminated soil by composting in biopiles. Environmental pollution, 107(2), 245-254.
KHAN, F. I.; HUSAIN, T.; HEJAZI, R. An overview and analysis of site remediation technologies. Journal of Environmental Management, 71: 95–122. 2004
LABUD, V., GARCIA, C., & HERNANDEZ, T. (2007). Effect of hydrocarbon pollution on the microbial properties of a sandy and a clay soil. Chemosphere, 66(10), 1863-1871.
LUO, S., CHEN, B., LIN, L., WANG, X., TAM, N. F. Y., & LUAN, T. Pyrene degradation accelerated by constructed consortium of bacterium and microalga: Effects of degradation products on the microalgal growth.Environmental science & technology, 48(23), 13917-13924. 2014.
RIBANI, M., BOTTOLI, C. B. G., COLLINS, C. H., JARDIM, I. C. S. F., & MELO, L. F. C. (2004). Validação em métodos cromatográficos e eletroforéticos. Química nova, 27, 771-780.
SANTOS, R. M., RIZZO, A. C., & SOBRAL, L. G. (2007). Remediação de solo contaminado por petróleo em biopilhas–escala piloto. Campinas: Centro de tecnologia mineral CETEM.
SARKAR, D., FERGUSON, M., DATTA, R., & BIRNBAUM, S. (2005). Bioremediation of petroleum hydrocarbons in contaminated soils: comparison of biosolids addition, carbon supplementation, and monitored natural attenuation. Environmental pollution, 136(1), 187-195.
SINEGAN A.A.S.; HOSSEINPUR A. Evaluation of effect of different sterilization methods on soil biomass phosphorus extracted with NaHCO3, Plant Soil Environmetal., v.56,. p. 156–162 2010
SOLOMONS, T. W., & FRYHLE, C. B. (2006). Química orgânica 1. LTC.
TABOR,G.P., Estratégias para a utilização de peróxido de magnésio na remediação de solo contaminado por hidrocarbonetos policíclicos aromáticos. 116 f. Dissertação ( Mestrado em Eng. Ambiental ) Universidade Federal do Paraná. 2015.
VELOSA, A. C.; NASCIMENTO, CAO. avaliação do uso de mgo2 como fonte de h2o2 para a remediação de água subterrânea via reação de fenton modificada. Blucher Chemical Engineering Proceedings, v. 1, n. 2, p. 6726-6733, 2015.
XU, Y., & LU, M. (2010). Bioremediation of crude oil-contaminated soil: comparison of different biostimulation and bioaugmentation treatments.Journal of hazardous materials, 183(1), 395-401.
[1] Departamento de Engenharia Ambiental-Universidade Federal do Paraná
[2] Departamento de Engenharia Ambiental-Universidade Federal do Paraná

