ARTIGO ORIGINAL
VIEIRA, Cleiber Marques [1], MELO, Denise Carneiro [2]
VIEIRA, Cleiber Marques. MELO, Denise Carneiro. Padrões biogeográficos de variação do tamanho de quirópteros brasileiros: testando a regra de Bergmann. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano. 07, Ed. 12, Vol. 08, pp. 05-25. Dezembro de 2022. ISSN: 2448-0959, Link de acesso: https://www.nucleodoconhecimento.com.br/biologia/quiropteros-brasileiros, DOI: 10.32749/nucleodoconhecimento.com.br/biologia/quiropteros-brasileiros
RESUMO
O estudo dos padrões de variação do tamanho corporal em linhagens animais representa um dos principais objetivos modernos de áreas como a biogeografia e a macroecologia. A avaliação de amplos conjuntos de dados espaciais, temporais e de diversidade permitem testar hipóteses ecológicas e evolutivas a respeito da variação do tamanho do corpo. Uma delas é a Regra de Bergmann, uma correlação positiva entre o tamanho do corpo médio de espécies endotérmicas com a distribuição latitudinal (indicador de clima). De acordo com esta regra, tamanhos maiores parecem se distribuir mais frequentemente em regiões de altas latitudes (clima frio), para vários grupos analisados em diferentes partes do mundo. A ideia desse trabalho foi testar essa hipótese para dados de tamanho de 167 espécies de quirópteros (morcegos) com distribuição no território brasileiro (micro-quirópteros). Os dados foram coletados da literatura. Foram analisadas as relações entre a envergadura (cm) e peso (gr), separadamente, para todas as espécies. Os resultados não demonstraram uma associação significativa entre tamanho e clima, de forma global, para as espécies de micro-quirópteros analisados, ou seja, as espécies maiores não estão, significativamente, distribuídas mais na região sul do país. As espécies de quirópteros tropicais parecem responder mais diretamente aos padrões ecológicos locais, tais como as pressões seletivas associadas com cada população. Outra possibilidade é que as relações energético-funcionais em morcegos possam ser viesadas pela variação morfológica das asas. Provavelmente, o viés geométrico na morfologia dos animais voadores implica numa morfofisiologia diferente para o tamanho corporal.
Palavras-chave: Padrões Biogeográficos, Quirópteros, Regra De Bergmann.
1. INTRODUÇÃO
A investigação de padrões espaciais no tamanho do corpo dos vertebrados vem aumentando nas últimas décadas. Um número crescente de estudos evidencia a existência de variações do tamanho do corpo em mamíferos e aves (espécies endotérmicas – com maior controle interno da temperatura) como foi formulado, originalmente, pela regra de Bergmann: uma correlação positiva entre tamanho corporal e distribuição latitudinal. (BLACKBURN; GASTON, 1999; GASTON et al., 2008; ASHTON et al., 2000; ASHTON, 2002a; RODRIGUEZ; OLALLA-TÁRRAGA; HAWKINS, 2007; DINIZ-FILHO et al., 2009; OLSON et al., 2009; VILLALOBOS et al., 2017; MCQUEEN et al., 2022; BARSHEP et al., 2022).
Em aves e mamíferos, essa condição é peculiar devido à produção de calor durante o repouso ser proveniente dos órgãos viscerais, o que eleva o requerimento diário de energia. A variação sazonal da disponibilidade de alimento e da sua qualidade, acentua a problemática da manutenção do equilíbrio energético nesses animais, sendo que a composição do alimento e a capacidade digestiva e metabólica do animal influencia na quantidade de energia obtida na alimentação (LINDSTEDT; BOYCE, 1985; HAWKINS, 2001; HAWKINS; DINIZ-FILHO, 2004; WEIR; SCHLUTER, 2007; OLSON et al., 2009; MCQUEEN et al., 2022; BARSHEP et al., 2022).
Segundo a Regra de Bergmann, quanto mais frio for o clima maior será o tamanho corporal das espécies endotérmicas. Esses tamanhos maiores serão relativamente comparados com espécies filogeneticamente mais aparentadas e com distribuição em regiões de clima mais quente (baixas latitudes). Sendo assim, quanto maior for a latitude máxima de ocorrência de uma espécie, maior deverá ser seu tamanho corporal máximo atingido, se comparado com parentes de latitudes mais baixas (BELK; HOUSTON, 2002; ASHTON; FELDMAN, 2003; OLALLA-TÁRRAGA; RODRIGUEZ; HAWKINS, 2006; OLALLA-TÁRRAGA; RODRIGUEZ; OLALLA-TÁRRAGA; HAWKINS, 2007; ADAMS; CHURCH, 2008; VILLALOBOS et al., 2017; MCQUEEN et al., 2022; BARSHEP et al., 2022).
O tamanho do corpo dos animais também pode ser influenciado por padrões de crescimento alométrico, principalmente, nos casos em que adaptações morfológicas podem estar associadas com as relações energético-funcionais, tais como as relações entre massa e volume corporal e suas regras de manutenção de energia. Para grupos de animais com asas, como aves (provavelmente, os pterossauros no passado), tem sido observado um padrão alométrico entre o tamanho relativo do corpo e das asas, que parecem visar as relações morfológicas mais óbvias. Por exemplo, é esperado que espécies com tamanho do corpo maior (estimado com base no comprimento total) apresentem maior massa corporal (associada com o volume do corpo e, por consequência, com o maior requerimento de energia). Essa relação parece ser provável para a maior parte dos grupos de vertebrados, entretanto, quando um apêndice como as asas estão presentes numa espécie, essas expectativas podem ser alteradas. Em grupos de vertebrados endotérmicos a resistência ao frio (principalmente, em altas latitudes) parece estar associada com um volume corporal maior e uma superfície relativa menor (o que garantiria um aquecimento mais lento, nos períodos de insolação, entretanto, um desaquecimento, também, mais lento nos períodos noturnos). Se a superfície for relativamente aumentada, incrementando a área de perda e ganho de calor do corpo, essas relações serão viesadas, podendo mudar as expectativas associadas com as adaptações energético-funcionais. As asas parecem representar um desses possíveis incrementos que alteram as relações entre o volume e a superfície de um animal, já que animais com asas podem ganhar ou perder calor de forma diferente daqueles que não apresentam esse apêndice (BELK; HOUSTON, 2002; ASHTON; FELDMAN, 2003; OLALLA-TÁRRAGA; RODRIGUEZ; HAWKINS, 2006; OLALLA-TÁRRAGA; RODRIGUEZ; OLALLA-TÁRRAGA; HAWKINS, 2007; ADAMS; CHURCH, 2008; MCQUEEN et al., 2022; BARSHEP et al., 2022).
Apesar da discussão em torno da validade da regra de Bergmann estar associada ao tamanho do corpo e a conservação de calor, cada vez mais, estudos vêm demonstrando um padrão biogeográfico entre tamanho corporal e a distribuição espacial das espécies. Vários mecanismos já foram propostos para explicar a Regra de Bergmann, tais como aqueles associados com a) termorregulação, onde animais maiores poderiam suportar temperaturas mais frias por terem de produzir menos calor para elevar a temperatura; b) capacidade migratória, onde animais com massa corporal pequena parecem apresentar pouca habilidade de dispersão; c) resistência à fome, onde espécies com massas corporais maiores possuem mais resistência ao jejum, além de ser uma vantagem em locais de alta latitude, onde os recursos são escassos; d) disponibilidade de recursos, onde seria vantajoso tamanhos menores em baixas latitudes, em função da alta competição por recursos (alta diversidade), mesmo se comparado com a maior escassez dos ambientes frios (CALDER, 1984; LINDSTEDT; BOYCE, 1985; BLACKBURN; GASTON, 1999; ASHTON, 2001; OLALLA-TÁRRAGA; RODRIGUEZ; HAWKINS, 2006; OLALLA-TÁRRAGA; RODRIGUEZ; OLALLA-TÁRRAGA; HAWKINS, 2007; ADAMS; CHURCH, 2008; MCQUEEN et al., 2022; SILVA; BATES, 2022).
Estudos recentes têm demonstrado a relação entre fatores ecológicos e evolutivos na determinação dos padrões de diversidade de espécies, tais como os padrões de distribuição latitudinal de riqueza. Sistematas e biogeógrafos procuram entender como condições ambientais passadas (história evolutiva das espécies) influenciaram na distribuição e diversificação das linhagens atuais. Frequentemente, esses estudos com abordagens macroecológicas testam hipóteses ecológicas, tais como a Regra de Bergmann, analisando amplos conjuntos de dados, distribuídos em grandes escalas de tempo e/ou espaço (CHOWN; GASTON, 2000; RAHBEK; GRAVES, 2001; BLACKBURN; HAWKINS, 2004; RICKLEFS, 2004; JABLONSKI et al., 2006; HARRISON; CORNELL, 2007; ROY; GOLDBERG, 2007; CASSEMIRO, 2009; VILLALOBOS et al., 2017; SILVA; BATES, 2022).
Os padrões biogeográficos podem ser testados para vários grupos, como por exemplo os grupos com ampla distribuição geográfica e climática (latitudinal). A Ordem Chiroptera representa um grupo versátil de mamíferos devido à diversidade de hábitos alimentares, formas e adaptações. Os Quirópteros constituem o grupo de mamíferos mais diversificado em diversas regiões tropicais, desempenhando importantes funções ecológicas nos sistemas naturais (FLEMING; HOOPER; WILSON, 1972; WILLIG; KAUFMAN; STEVENS, 2003; WHITTAKER, 2005; REIS et al., 2007).
Os morcegos tiveram sucesso colonizando quase todas as regiões continentais no planeta, inclusive as de temperaturas mais baixas, ilhas oceânicas e arquipélagos, exceto a Antarctica. A riqueza de espécies de morcegos, mostra um forte aumento em direção ao equador, onde ocupam uma grande variedade de nichos tróficos e atuam como bioindicadores. Com 18 famílias, 202 gêneros e 1120 espécies, os quirópteros constituem a segunda maior ordem de mamíferos em número de espécies, representando um terço da diversidade de mamíferos do Brasil, contribuindo de forma notável para a riqueza e diversidade da mastofauna de vários ecossistemas neotropicais, além de desempenhar papeis importantes na predação de artrópodes e vertebrados, quanto na dispersão de pólen e sementes (PALMEIRIM et al., 1989; MARES; SCHMIDLY, 1991; ROHDE, 1992; KALKO et al., 1996; Nowak; Kunz; Pierson, 1994.; SAZIMA; SAZIMA; BUZATO, 1994; EMMONS; FEER, 1997; MARINHO-FILHO; GASTAL, 2001; ASHTON, 2002b; LOMOLINO, 2004; SIMMONS, 2005; REIS, 2006).
No Brasil são conhecidas 9 famílias 64 gêneros e 167 espécies, esse número pode aumentar com a realização de inventários onde existem lacunas de conhecimento, principalmente nas regiões Norte e Nordeste. O Brasil apresenta oito espécies endêmicas de morcegos e oito espécies ameaçadas de extinção (REIS et al., 2006; PACHECO et al., 2010; BERNARD et al., 2011; PAGLIA et al., 2012; AGUIAR et al., 2020). Espécies como Carollia perpicillata (LINNAEUS, 1758), Artibeus lituratus (OLFERS, 1818), Sturnira lilium (GEOFFROY, 1810), Glossophaga soricina (PALLAS, 1766), Desmodus rotundus (GEOFFROY, 1810), Myotis nigricans (SHINZ, 1821) e Molossus molossus (PALLAS, 1766) possuem ampla distribuição em território nacional, tanto antropizado como natural. Devido ao Brasil ser um país de proporções continentais, faltam dados completos referentes ao número total de espécies ocorrentes nas cidades brasileiras, sendo que alguns trabalhos indicam a prevalência de espécies insetívoras sobre as demais. Morcegos frugívoros possuem grandes deslocamentos em áreas urbanas e florestais, sendo assim a mobilidade de importância essencial para a sobrevivência de algumas espécies. Esses padrões de movimentações são determinados pela estrutura do hábitat e pelos padrões de comportamento de cada espécie (PALMEIRIM et al., 1989; KALKO et al., 1996; SAZIMA; SAZIMA; BUZATO, 1994; BREDT; UIEDA, 1996; ESBÉRARD, 2003; Castillo-Figueroa, 2020)
Os Quiropteros são divididos em duas subordens, Megachiroptera e Microchiroptera. Os Megachiropetos são representados por apenas uma família, Pteropodidae, com 150 espécies distribuídas pela África, Índia, Austrália e sudeste da Ásia, não ocorrendo no Brasil (FENTON, 1992). Os Microchiropteros são compostos por 17 famílias e 930 espécies no mundo, não ocorrendo somente nas regiões polares. São capazes de ocupar remanescentes de vegetação nativa em áreas urbanas ou rurais, ou até mesmo ambientes artificiais os quais ofereçam fonte de alimento e abrigo (SAZIMA; SAZIMA; BUZATO, 1994; REIS; LIMA; PERACCHI, 2002, PERINI; TAVARES; NASCIMENTO, 2003; ESBÉRARD, 2003; SIMMONS, 2005; LIMA, 2008; OPREA et al., 2009; Castillo-Figueroa, 2020).
O objetivo geral desta pesquisa é avaliar os padrões biográficos associados à variação do tamanho do corpo em quirópteros distribuídos no território brasileiro, relacionando variáveis macroecológicas com padrões espaciais, especificamente, a relação entre tamanho do corpo e distribuição latitudinal da espécie. Para isso, serão inferidas as seguintes hipóteses (SAX, 2001; Castillo-Figueroa, 2020):
I. Levantar e compilar uma base de dados macroecológica, com variáveis morfométricas (tamanho do corpo em mm e peso do corpo em g) e espaciais (distribuição latitudinal) para 167 espécies de quirópteros com ocorrência no território brasileiro;
II. Avaliar as relações morfométricas entre as variáveis tamanho do corpo (mm) e peso do corpo (g), com o objetivo de observar a existência de padrões alométricos entre as variáveis;
iii. Testar a hipótese de correlação positiva entre o tamanho do corpo (estimado pelo comprimento total, em mm, ou pelo peso, em gramas) e a distribuição latitudinal para as espécies de quirópteros com ocorrência no Brasil, ou seja, se as espécies com tamanho do corpo maior estão mais distribuídas nas altas do que nas baixas latitudes (Regra de Bergmann);
IV. Discutir os possíveis mecanismos e/ou processos ecológicos e evolutivos que poderiam explicar as relações observadas para as variáveis morfométricas e espaciais associadas com as espécies de morcegos brasileiros;
2. MATERIAIS E MÉTODOS
Foram coletados dados morfométricos, tais como o tamanho do corpo (mm), o peso (g), o comprimento do antebraço (mm), o comprimento da cabeça e corpo (mm), comprimento da cauda (mm), tamanho da orelha (mm) para 167 espécies de quirópteros com distribuição no território brasileiro. Foram observadas, também, as distribuições latitudinais (extensões latitudinais máximas, ao sul e ao norte) e os pontos médios latitudinais para todas as espécies analisadas. Entretanto, só foram utilizadas para as análises apresentadas nesse trabalho as variáveis morfométricas de tamanho do corpo (mm) e peso (g), que correspondem àquelas que melhor se ajustam para um teste da regra de Bergmann (correlação positiva entre o tamanho e a distribuição latitudinal).
Foram observadas muitas espécies com dados perdidos para ambas as variáveis analisadas, logo, o n final para o comprimento total (mm) foi igual a 93 e para o peso (g) foi igual a 96. Os dados foram coletados da literatura, bem como, comparados e analisados com dados de periódicos e bancos de dados digitais (REIS, 2007; EISENBERG; REDFORD, 1999; GINSBERG, 2001; SAZIMA; SAZIMA; BUZATO, 1994).
As espécies analisadas se distribuíram em 9 famílias, sendo elas: EMBALLORUNIDAE, PHYLLOSTOMIDAE, MORMOOPIDAE, NOCTILIONIDAE, FURIPTERIDAE, THYROPTERIDAE, NATALIDAE, MOLOSSIDAE e VESPERTILIONIDAE, e 64 gêneros: Centronycteris, Comura, Cyttarops, Diclidurus, Peropteryx, Rhynchonycteris, Saccopteryx, Desmodus, Diaemus, Anoura, Diphylla, Choeroniscus, Glossophaga, Lichonycteris, Scleronycteris, Lionycteris, Lonchophylla, Xeronycteris, Chorotopterus, Glyphonycteris, Lampronycteris, Lonchorhina, Macrophyllum, Micronycteris, Mimon, Neonycteris, Phylloderma, Phyllostomus, Tonatia, Trachops, Trinycteris, Vampyrum, Carollia, Rhinophylla, Ametrida, Artibeus, Chiroderma, Enchisthenes, Mesophilla, Platyrrhinus, Pygoderma, Sphaeronycteris, Sturnira, Uroderma, Vampyressa, Vampyrodes, Pteronotus, Noctilio, Furipterus, Thyroptera, Natalus, Cynomops, Eumops, Molossops, Molossus, Nyctinomops, Promops, Tadarida, Epstesicus, Lasiurus, Rhogeesa, Histiotus, Myotis.
Foram observadas as distribuições de frequência para todas as variáveis analisadas no trabalho. Foram testadas as correlações entre as variáveis morfométricas comprimento total (mm) e peso (g), e as variáveis espaciais ponto médio latitudinal e extensão latitudinal máxima para todas as espécies com dados disponíveis. Essas análises tiveram como objetivo testar a associação entre o tamanho do corpo dos morcegos brasileiros com o seu padrão de distribuição latitudinal.
Todas as análises, assim como todos os gráficos gerados, foram processadas com o pacote estatístico STATPLUS for MacOS, Analystsoft Inc., 2021.
3. RESULTADOS E DISCUSSÃO
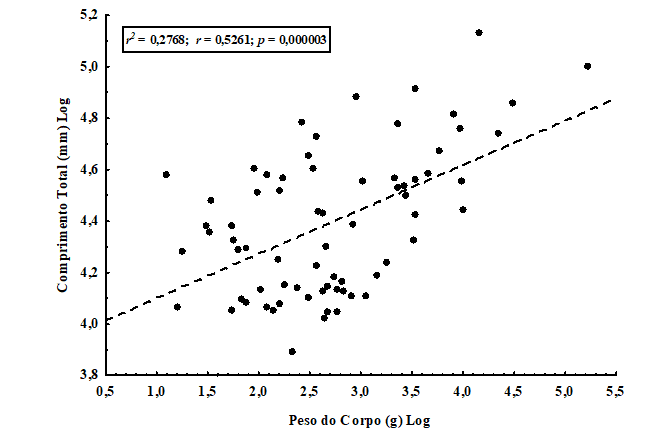
Foi observada inicialmente, para as espécies analisadas, uma baixa correlação, estatisticamente significativa, entre o comprimento do corpo (mm) e o peso (g) para 71 espécies de quirópteros brasileiros (r2 = 0,2768; r = 0,5261; p = 0,000003), onde somente 27% (aproximadamente) da variação do comprimento do corpo (mm) pode ser explicado pela variação no peso do corpo (g) (figura 1).
Figura 1. Correlação entre o comprimento total (mm) e o peso do corpo (g) para 71 espécies de quirópteros com distribuição no território brasileiro
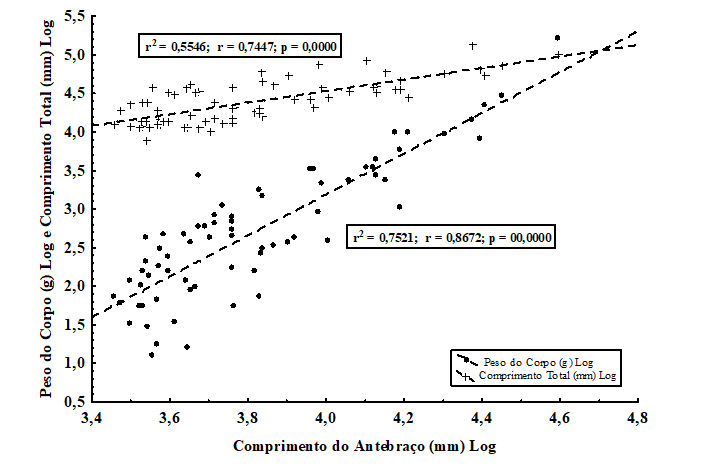
Essa relação pode indicar um viés morfométrico para esse conjunto de dados, já que se espera que tamanhos maiores estejam associados com pesos maiores. Em função disso, foi testado se a presença das asas poderia estar influenciando uma diferença no tamanho corporal, ou seja, se o comprimento se relaciona com as asas da mesma forma que o peso do corpo. Observou-se um diferente padrão de relação entre o comprimento do antebraço (mm) com o comprimento total (mm) e com o peso (g), sendo que o peso (g) apresentou uma correlação positiva, estatisticamente significativa, com o tamanho do antebraço (mm) (r2 = 0,7521; r = 0,8672; p = 00,0000), maior do que o que pôde ser demonstrada para o comprimento total (mm) (r2 = 0,5546; r = 0,7447; p = 0,0000) (Figura 2). Isso pode indicar que o comprimento do corpo, apesar de ser uma variável de fácil acesso na literatura sobre morcegos, pode mascarar uma relação alométrica ligada à massa total do corpo, já que se relaciona menos com a presença do volume e da massa das asas na composição geral do corpo dos quirópteros. Assim, essas duas variáveis podem ser estimadores diferentes do tamanho do corpo quando são usadas para testar relações macroecológicas, tais como o tamanho e a distribuição espacial. Talvez a utilização do peso do corpo, nesses casos, seja mais indicada do que o comprimento, já que parece incorporar melhor a influência das asas.
Figura 2. Relações entre o comprimento total (mm) e o peso do corpo (g) para 71 espécies de quirópteros com distribuição no território brasileiro, com o comprimento (logaritmizados) do antebraço (mm). Observe uma relação positiva mais forte entre o antebraço (estimador do tamanho da asa) e do o peso
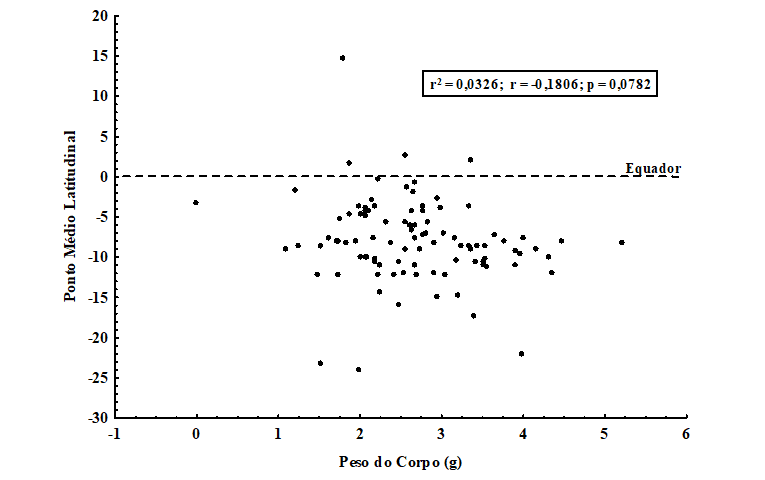
Assim, foram observadas as relações entre o tamanho dos quirópteros brasileiros com sua distribuição latitudinal, estimada pelos pontos médios de latitude das áreas de distribuição geográfica de cada espécie. Foi observada uma baixa correlação positiva (estatisticamente não-significativa) entre o peso (g) e o ponto médio latitudinal para 96 espécies analisadas (r2 = 0,0326; r = -0,1806; p = 0,0782) (figura 3). Isso parece demonstrar que as espécies que apresentam um peso maior (teoricamente, maior tamanho do corpo) não são aquelas que apresentam suas áreas mais distribuídas nas regiões de altas latitudes (mais ao sul da América do Sul).
Figura 3. Correlação entre o peso do corpo (g) (logaritmizado) e a distribuição latitudinal (ponto médio de latitude) para 96 espécies de quirópteros com distribuição no território brasileiro. Observe o não ajuste à Regra de Bergmann
Entretanto, quando foi analisada a correlação entre o comprimento total (mm) e a distribuição latitudinal (com base nos pontos médios de latitude) para 93 espécies de quirópteros brasileiros, observou-se uma correlação positiva (estatisticamente significativa) (r2 = 0,1063; r = -0,3260; p = 0,0014), indicando uma tendência das espécies do corpo maior estarem distribuídas nas regiões mais ao sul (Figura 4). Apesar da relação não ser muito forte (apenas 10%, aproximadamente, da variação da distribuição poder ser explicada pelo comprimento), essa tendência poderia sugerir um ajuste para a Regra de Bergmann nos dados de morcegos brasileiros.
Figura 4. Correlação entre o comprimento total (mm) (logaritmizado) e a distribuição latitudinal (ponto médio de latitude) para 93 espécies de quirópteros com distribuição no território brasileiro. Observe uma tendência de ajuste à Regra de Bergmann
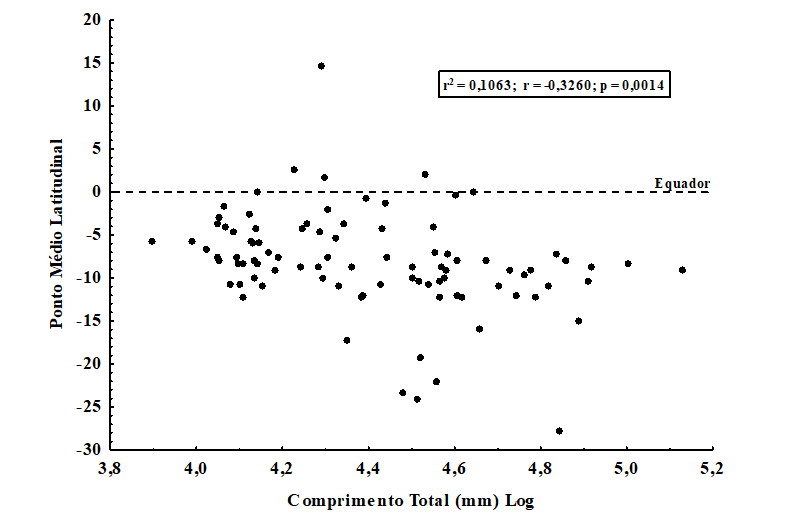
Essa resposta diferente para as duas variáveis pode estar relacionada com o que já foi discutido anteriormente, em relação ao problema alométrico que pode estar ligado aos dados morfométricos para grupos que apresentam asas. Como o comprimento, de certa forma, subestima parte da influência da asa pode ser um viés associar corpos maiores com latitudes mais altas quando é possível que espécies com tamanho, relativamente, menor (baseado apenas no comprimento) poderiam compensar o eixo principal de comprimento do corpo com maior volume e superfície das asas, alterando assim, suas expectativas energético-funcionais.
Alguns autores vêm discutindo, para dados com variados grupos (p. ex., aves e pterossauros) que a utilização de variáveis espaciais ligadas aos pontos médios de latitude pode produzir um viés quando ocorre muita sobreposição nas áreas de distribuição geográfica.
Esse padrão foi observado para os dados analisados nesse trabalho, onde pode ser demonstrada uma alta concentração dos pontos médios de distribuição latitudinal, tanto para as espécies com base nos dados de peso (g) quanto para os dados de comprimento total (mm) (Figura 5).
Figura 5. Frequência de distribuição dos pontos médios latitudinais para as espécies analisadas de quirópteros com distribuição no território brasileiro com base nas variáveis peso (g) e comprimento total (mm)
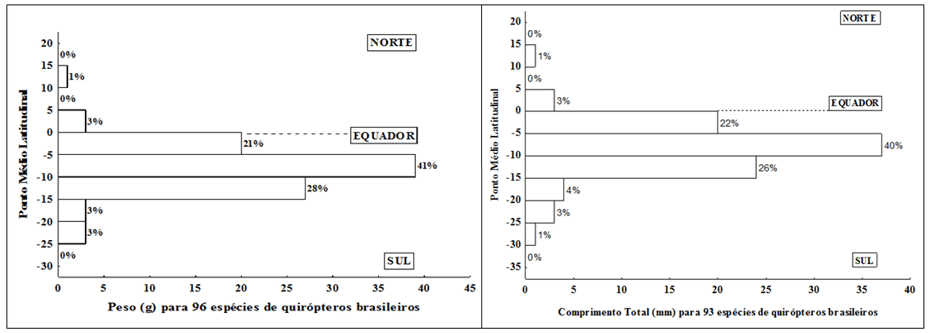
É importante notar que há uma nítida concentração dos pontos médios de distribuição latitudinal entre as latitudes 0º e 15º, respectivamente, 90% das áreas das espécies quando se utiliza a variável peso (g) e 88% quando se utiliza a variável comprimento total (mm).
Para reduzir esse aparente viés, foram observadas as extensões latitudinais máximas de ocorrência das espécies. Como um número muito reduzido de espécies de quirópteros apresentou suas áreas de distribuição acima da linha do Equador (0º), consideramos nesse trabalho como extensão latitudinal máxima apenas aquelas ao longo do eixo latitudinal sul (entre 0º e -35º S, que corresponde a extensão máxima da área do território brasileiro). O ponto médio de latitude parece subestimar a distribuição real das populações. Por exemplo, quando se observa um ponto médio latitudinal para uma área em -15º S isso deveria representar uma média da distribuição dos indivíduos da espécie dentro da área, entretanto, não significa necessariamente que organismos não possam ocorrer até nos pontos máximos de registro da espécie. Do ponto de vista, das relações biogeográficas, tais como a Regra de Bergmann que associa o tamanho às adaptações que condicionam a espécie num determinado clima (espécies com indivíduos, em média, maiores suportariam climas frios mais rigorosos – regiões mais ao sul do Brasil), não significa que a média da variabilidade fenotípica da espécie deveria ocorrer nos pontos médios de distribuição latitudinal. Ou seja, apesar da latitude média estar em -15º S, talvez fosse possível encontrarmos uma variância grande de tamanhos para os organismos dentro da espécie se distribuindo ao longo de toda a área de distribuição geográfica.
No caso dos dados observados aqui, essa distribuição concentrada em torno de 0º e -15º S poderia, inclusive, ser um artefato da forma geométrica do continente sul-americano e, por consequência, da área do território brasileiro.
Quando foram utilizados os dados de extensão latitudinal máxima para correlacionar o tamanho das espécies de morcegos (respectivamente, 96 para peso g e 93 para comprimento total mm) com as variáveis morfométricas, observou-se um padrão diferente daquele observado para os pontos médios (figura 6). Fica nítido, em ambos os casos que uma variância grande de tamanhos (tanto para a variável peso g quanto para o comprimento mm) pode ser observada ao longo de toda extensão latitudinal de ocorrência das espécies e não uma concentração em torno de 0º e -15º S, como observado anteriormente. Isso parece indicar que registros de espécies de morcegos com tamanhos maiores podem ser encontrados em áreas mais ao sul do território brasileiro.
Figura 6. Frequência de distribuição das extensões latitudinais máximas para as espécies analisadas de quirópteros com distribuição no território brasileiro com base nas variáveis peso (g) e comprimento total (mm)
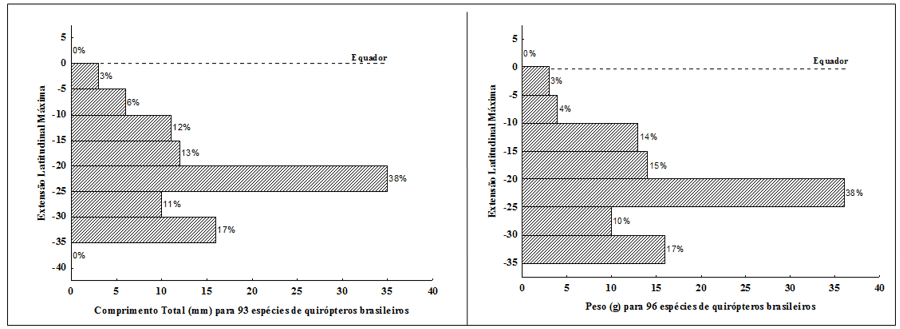
Foram re-analisadas as relações entre as variáveis morfométricas e a extensão latitudinal máxima para todas as espécies, com o objetivo de testar novamente a Regra de Bergmann. Foi observada uma correlação positiva, estatisticamente significativa, entre o comprimento total (mm) e a extensão latitudinal máxima para as 93 espécies analisadas (r2 = 0,1131; r = -0,3363; p = 0,0010) (figura 7). Isso poderia sugerir uma fraca associação com a Regra de Bergmann, com uma tendência para as espécies de comprimento do corpo maior estarem distribuídas em áreas mais ao sul do território brasileiro. Entretanto, como já foi discutido anteriormente, o comprimento total pode subestimar a presença das asas como contribuição para a massa do animal, gerando desse modo um viés na associação.
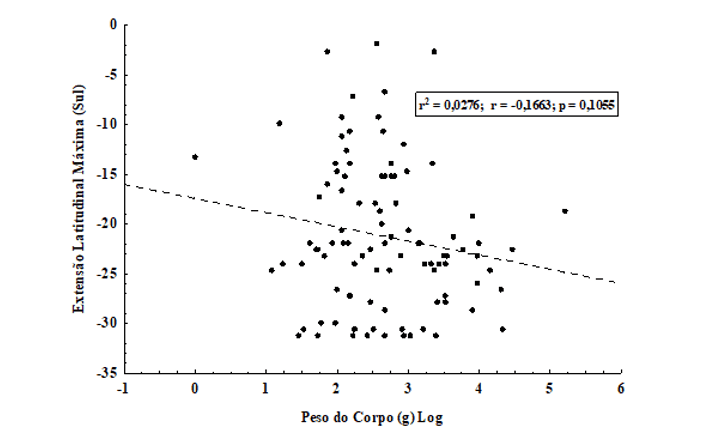
Dessa forma, foi testada também, a correlação entre o peso do corpo (g) e extensão latitudinal máxima para 96 espécies de quirópteros brasileiros. Foi observada uma correlação positiva, estatisticamente não-significativa (r2 = 0,0276; r = -0,1663; p = 0,1055) (figura 8), o que sugere que para essa relação um não ajuste à Regra de Bergmann. O que, como já discutido, provavelmente se deve ao fato de que o peso do corpo agregue, também, a influência das asas dos morcegos para a composição do tamanho total do corpo.
Figura 7. Correlação entre o comprimento total (cm) (logaritmizado) e a extensão latitudinal máxima para 96 espécies de quirópteros com distribuição no território brasileiro. Observe o não ajuste à Regra de Bergmann
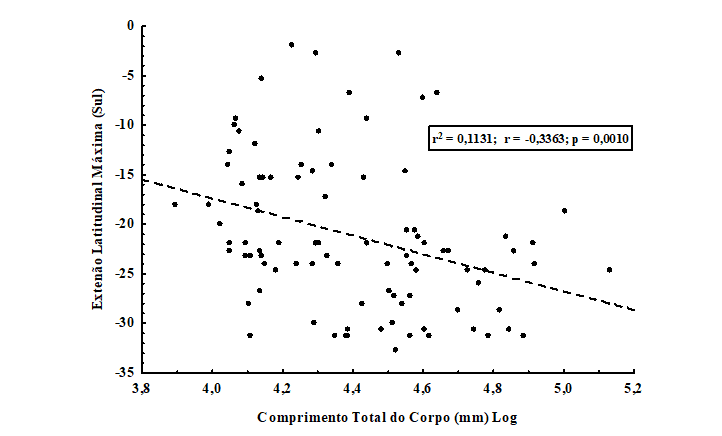
Figura 8. Correlação entre o peso do corpo (g) (logaritmizado) e a extensão latitudinal máxima para 96 espécies de quirópteros com distribuição no território brasileiro. Observe o não ajuste à Regra de Bergmann
4. CONCLUSÃO
Os dados analisados neste trabalho sugerem que, assim como já foi detectado para outros grupos de animais vertebrados (p. ex. peixes, aves etc.), a Regra de Bergmann não se ajusta com os padrões de distribuição biogeográfica dos microquirópteros sul-americanos, com distribuição no território brasileiro. Isto é, os morcegos brasileiros parecem apresentar uma fraca associação do tamanho corporal com a distribuição latitudinal quando a relação pode ser interpretada como um viés produzido pelos dados de comprimento total do corpo. Como já abordado, parece menos confiável associar o comprimento como estimador do tamanho já que ele tende a subestimar a presença das asas. Assim, quando são utilizados dados de peso, que provavelmente refletem melhores relações de volume e superfície (considerando nesse dado a massa total, inclusive as asas) pode-se perceber uma redução da significância da correlação entre tamanho e latitude, rejeitando a Regra de Bergmann.
A distribuição de morcegos no continente americano, talvez, seja melhor explicada por questões associadas aos padrões locais de distribuição e não aos padrões globais. Por exemplo, pressões seletivas que modularam adaptações locais, tais como, as relações entre os tamanhos corporais e as demandas energéticas para animais cujos filhotes têm que ser carregados pela fêmea durante o vôo talvez expliquem melhor a distribuição dos tamanhos dos morcegos no Brasil. Relações macroecológicas analisadas para outros grupos de vertebrados parecem sugerir uma forte associação entre o tamanho do corpo e o tamanho das áreas de distribuição, assim espécies com filhotes maiores por consequência seriam selecionadas em áreas de forrageamento maiores. Nesse caso, talvez a geometria do território brasileiro poderia produzir restrições nos tamanhos e extensões das áreas de distribuição, entretanto, isso não foi testado aqui para o nosso conjunto de dados. Outras explicações ecológicas e/ou evolutivas locais poderiam estar ligadas às especificidades alimentares dos morcegos que podem apresentar uma grande variedade de adaptações alimentares (os microquirópteros podem ser frugívoros, nectarívoros, insetívoros e/ou hematófagos). Por exemplo, animais que caçam outras espécies e as capturam no ar apresentam devem apresentar um efeito seletivo mais evidente para maiores áreas do corpo (extensão produzida pelos patágios e uropatágios dos morcegos que capturam insetos), apresentado uma forte associação local com as áreas de alimentação que faria com que a heterogeneidade dos hábitats tivesse um maior poder de seleção sobre os tamanhos de corpo das espécies. Apesar das relações apresentadas aqui não serem muito fortes as análises com dados de microquirópteros continuam sendo muito importantes para o conhecimento mais profundo da ecologia e dos processos e mecanismos que moldaram a evolução do grupo. Desta forma, o presente trabalho apresenta uma abordagem inédita para esse conjunto de dados.
REFERÊNCIAS
ADAMS, D. C.; CHURCH, J. O. Amphibians do not follow Bergmann`s rule. Evolution, v. 62, pp. 413-420, 2008. Disponível em: https://doi.org/10.1111/j.1558-5646.2007.00297.x. Acesso em: 19 dez. 2022.
Aguiar, L. M. S.; Pereira, M. J. R.; Zortéa, M.; Machado, R. B. Where are the bats? An environmental complementarity analysis in a megadiverse country. Diversity and Distributions, v. 26, pp. 1510-1522, 2020. Disponível em: https://doi.org/10.1111/ddi.13137. Acesso em: 19 dez. 2022.
ASHTON, K. G. et al. Is Bergmann’s Rule Valid for Mammals? American Naturalist, v. 156. pp. 390-415. 2000. Disponível em: https://doi.org/10.1086/303400. Acesso em: 19 dez. 2022.
ASHTON, K. G. Are ecological and evolutionary rules being dismissed prematurely? Diversity and Distributions, Oxford, v. 7., pp. 289-295, 2001. Disponível em: https://doi.org/10.1046/j.1366-9516.2001.00115.x. Acesso em: 19 dez. 2022.
ASHTON, K. G. Do amphibians follow Bergman’s rule? Canadian Journal Zoology, v. 80, pp. 708-716, 2002a. Disponível em: 10.1139/z02-049. Acesso em: 19 dez. 2022.
ASHTON, K. G. Patterns of Within-Species Body Size Variation of Birds: Strong Evidence for Bergmann’s Rule. Global Ecology and Biogeography, v. 11, pp. 505-523, 2002b. Disponível em: https://www.jstor.org/stable/3182682. Acesso em: 19 dez. 2022.
ASHTON, K. G.; FELDMAN, C. R. Bergmann’s rule in nonavian reptiles: turtles follow it, lizards and snakes reverse it. Evolution, v. 57, pp. 1151-1163, 2003. Disponível em: 10.1111/j.0014-3820.2003.tb00324.x. Acesso em: 19 dez. 2022.
BELK, M. C.; HOUSTON, D. Bergmann’s Rule in Ectotherms: A Test Using Freshwater Fishes. American Naturalist, v. 160, pp. 803-808, 2002. Disponível em: 10.1086/343880. Acesso em: 19 dez. 2022.
BARSHEP, Y. et al. Bergmann’s Rule Holds in Birds Inhabiting Southern Guinea Forests but Not in the Northern Savanna of Nigeria. Frontiers in Ecology and Evolution, v. 10, n. 741755, 2022. Disponível em: https://doi.org/10.3389/fevo.2022.741755. Acesso em: 19 dez. 2022.
BERNARD, E.; TAVARES, V. C.; SAMPAIO, E. Compilação atualizada das espécies de morcegos (Chiroptera) para a Amazônia Brasileira. Biota Neotropica, vol. 11, n. 1, 2011. Disponível em: https://doi.org/10.1590/S1676-06032011000100003. Acesso em: 19 dez. 2022.
BLACKBURN, T. M; GASTON, N. L. Geographic gradients in body size: a clarification of Bergmann’s rule. Diversity and Distribuitions, v. 5, pp. 165-174, 1999. Disponível em: https://doi.org/10.1046/j.1472-4642.1999.00046.x. Acesso em: 19 dez. 2022.
BLACKBURN, T. M.; HAWKINS, B. A. Bergmann’s rule and the mammal fauna of northern north America. Ecography, v. 27, pp. 715-724, 2004. Disponível em: https://www.jstor.org/stable/3683671. Acesso em: 19 dez. 2022.
BREDT, A.; UIEDA, W. Bats from urban and rural environments of the Distrito Federal, Mid-western Brazil. Chiroptera Neotropical, v. 2, pp. 54-57, 1996. Disponível em: https://doi.org/10.1590/S0101-81751999000300012. Acesso em: 19 dez. 2022.
CASSEMIRO, F. A. da S. A teoria metabólica da ecologia e o padrão espacial de riqueza de espécies de anfíbios do Novo Mundo. Pós – Graduação em Biologia Animal – UnB. 2009.
CALDER, W. A. Size, function and life history. Harvard Univ. Press, 1984.
Castillo-Figueroa, D. Ecological Morphology of Neotropical Bat Wing Structures, Zoological Studies, vol. 59, n. 60, 2020. Disponível em: 10.6620/ZS.2020.59-60. Acesso em: 19 dez. 2022.
CHOWN, S. L.; GASTON, K. J. Areas, cradles and museums: the latitudinal gradient in species richness. Trend in Ecology and Evolution, v. 15, pp. 311-315, 2000. Dsiponível em: 10.1016/S0169-5347(00)01910-8. Acesso em: 19 dez. 2022.
DINIZ-FILHO, J. A. F. et al. Climate history, human impacts and global body size of Carnivora (Mammalia: Eutheria) at multiple evolutionary scales. Journal Biogeography, v. 36, pp. 2222-2236, 2009.
EMMONS, L.; FEER, F. Neotropical rainforest mammals: a field guide. (Second edition.) University of Chicago Press, Chicago, Illinois 60637, USA,1997.
EISENBERG, J. F.; REDFORD, K. H. Mammals of the Neotropics: the central neotropics, Vol. 3, The University of Chicago Press, Chicago, USA, 1999.
ESBÉRARD, C. E. L. Diversidade de morcegos em área de Mata Atlântica regenerada no Sudeste do Brasil. Revista Brasileira de Zoociência, v. 5. pp. 189-204, 2003.
FENTON, M. B. Bats. New York: Facts on file. Inc. 1992. p. 207.
FLEMING, T. H.; HOOPER, E. T.; WILSON, D. E. Three Central American bat communities: structure, reproductive cycles and movement patterns. Ecology, v. 53, pp. 553-569, 1972. Disponível em: https://doi.org/10.2307/1934771. Acesso em: 19 dez. 2022.
GASTON, K. J. et al. Ecogeographical rules: elements of a synthesis. Journal Biogeography, v. 35, pp. 483-500, 2008. Disponível em: https://doi.org/10.1111/j.1365-2699.2007.01772.x. Acesso em: 19 dez. 2022.
GINSBERG, J. R. Biodiversity of mammals. In: Encyclopedia of Biodiversity. v. 3 Academic Press, Nova York, pp. 777-810. 2001.
HARRISON, S.; CORNELL, H. V. Introduction: Merging Evolutionary and Ecological Approaches to Understanding Geographic Gradients in Species Richness. The American Naturalist, v. 170, pp. 4, 2007. Disponível em: 10.1086/519011. Acesso em: 19 dez. 2022.
HAWKINS, B. A. Ecology`s oldest pattern? Trends in Ecology and Evolution, v. 16, pp. 470, 2001. Disponível em: https://doi.org/10.1016/S0169-5347(01)02197-8. Acesso em: 19 dez. 2022.
HAWKINS, B. A.; DINIZ-FILHO, J. A. F. Latitude and geographic patterns. Ecography, v. 27, pp. 268-272, 2004. Disponível em: https://doi.org/10.1111/j.0906-7590.2004.03883.x. Acesso em: 19 dez. 2022.
JABLONSKI, D.; ROY, K.; VALENTINE, J. W. Out of the Tropics: Evolutionary Dynamics of the Latitudinal Diversity Gradient. Science, v. 314, pp. 102-106, 2006. Disponível em: 10.1126/science.1130880. Acesso em: 19 dez. 2022.
Kalko, E. K. V.; Handley Jr, C. O.; Handley, D. Organization, diversity, and long-term dynamics of a neotropical bat community, pp. 503-553. In: CODY, M. L.; SMALLWOOD, J. A. (Eds). Long-term studies of vertebrate communities. New York, Academic Press, 1996.
LIMA, I. P. Espécies de morcegos (Mammalia, Chiroptera) registradas em parques nas áreas urbanas do Brasil e suas implicações no uso deste ambiente. pp. 71-85. In: REIS, N. R; PERACCHI, A. L; SANTOS, G. A. S. D. (Org). Ecologia de morcegos. Londrina: Technical Books Editora, 2008.
LINDSTEDT, S. L.; BOYCE, M. S. Seasonality, fasting endurance, and body size in mammals. American Naturalist, v. 125, pp. 873-878, 1985. Disponível em: 10.1086/284385. Acesso em: 19 dez. 2022.
LOMOLINO, M. V.; SAX, D.; BROWN, J. H. Foundations of Biogeography. Chicago University Press, Chicago, E.U.A., 2004.
Marinho-Filho, J.; Gastal, M. L. Mamíferos das Matas Ciliares dos Cerrados do Brasil Central. In: Rodrigues R.R.; Leitão-Filho H.F. (Eds). Matas Ciliares: Conservação e Recuperação. 2aed. EDUSP, São Paulo, pp. 209-221. 2001.
MCQUEEN, A. et al. Thermal adaptation best explains Bergmann’s and Allen’s Rules across ecologically diverse shorebirds, Nature, vol. 13, n. 4727, 2022.
MARES, M. A.; SCHMIDLY, D. J. Latin American Mammalogy: history, biodiversity and conservation, University of Oklahoma Press. Norman and London, 1991.
OLALLA-TÁRRAGA, M. A.; RODRIGUEZ, M. A.; HAWKINS, B. A. Broad-scale patterns of body size in squamate reptiles of Europe and North América. Journal Biogeography, v. 33, pp. 781-793, 2006. Disponível em: 10.1111/j.1365-2699.2006.01435.x. Acesso em: 19 dez. 2022.
OLALLA-TÁRRAGA, M. A.; RODRIGUEZ, M. Á. Energy and interspecific body size patterns of amphibian faunas in Europe and North América: anurans follow Bergmann’s rule, urodeles its converse. Global Ecology and Biogeography, v. 16, pp. 606-617, 2007. Disponível em: https://doi.org/10.1111/j.1466-8238.2007.00309.x. Acesso em: 19 dez. 2022.
OLSON, V. A. et al. Global biogeography and ecology of body size in birds. Ecololy Letters, v. 12, pp. 249-259, 2009. Disponível em: 10.1111/j.1461-0248.2009.01281.x. Acesso em: 19 dez. 2022.
OPREA, M.; MENDES, P.; VIEIRA, T. B..; DITCHFIELD, A. D. Do wooded streets provide connectivity for bats in an urban landscape? Biodiversity Conservation, v. 18, pp. 2361-2371, 2009.
PACHECO, S. M. et al. Morcegos urbanos: status do conhecimento e plano de ação para a conservação no Brasil. Chiroptera Neotropical, v. 16, n. 1, p. 629-647, 2010.
Paglia, A. P; et al. Annotated Checklist of Brazilian Mammals, 2nd Edition, Occasional Papers in Conservation Biology, No. 6. Conservation International, Arlington, VA. pp. 1-76, 2012. Disponível em: https://www.conservation.org/docs/default-source/brasil/annotated_checklist_of_brazilian_mammals_2nd_edition.pdf. Acesso em: 19 dez. 2022.
Palmeirim, J. M.; Gorchov, D. L.; Stoleson, S. Trophic structure of a neotropical frugivore community: is there competition between birds and bats? Oecologia 79, pp. 403-411, 1989. Disponível em: https://doi.org/10.1007/BF00384321. Acesso em: 19 dez. 2022.
PERINI, F. A.; TAVARES, V. da C.; NASCIMENTO, C. M. D. Bats from the city of Belo Horizonte, Minas Gerais, Southeastern Brazil. Chiroptera Neotropical, v. 9, pp. 169-173, 2003.
Nowak, R. M.; Kunz, T. H.; Pierson, E. D. Walker’s Bats of the WORLD, Johns Hopkins University Press, USA, 296 pages, 1994.
RAHBEK, C.; GRAVES, G. R. Multiscale assessment of patterns of avian species richness, PNAS, vol. 98, n. 8, pp. 4534–4539, 2001. Disponível em: https://doi.org/10.1073/pnas.071034898. Acesso em: 19 dez. 2022.
REIS, N. R. dos.; LIMA, I. P. de.; PERACCHI, A. L. Morcegos (Chiroptera) da área urbana de Londrina, Paraná, Brasil. Revista Brasileira de Zoologia, v. 19, n. 3, pp. 739-746, 2002. Disponível em: https://doi.org/10.1590/S0101-81752002000300011. Acesso em: 19 dez. 2022.
REIS, N. R. dos. et al. Mamíferos do Brasil. Londrina. pp. 437. 2006. Disponível em: http://www.uel.br/pos/biologicas/pages/arquivos/pdf/Livro-completo-Mamiferos-do-Brasil.pdf. Acesso em: 19 dez. 2022.
REIS, N. R. dos. et al. Morcegos do Brasil. Londrina. pp. 253. 2007. Disponível em: http://www.uel.br/pos/biologicas/pages/arquivos/pdf/Morcegos_do_Brasil.pdf. Acesso em: 19 dez. 2022.
RICKLEFS, R. E. A comprehensive framework for global patterns in biodiversity. Ecology Letters, v. 7, pp. 1-15, 2004. Disponível em: https://doi.org/10.1046/j.1461-0248.2003.00554.x. Acesso em: 19 dez. 2022.
RODRIGUEZ, M. Á; OLALLA-TÁRRAGA, M. Á; HAWKINS, B. A. Bergmann’s rule and the geography of mammal body size in the western Hemisphere. Global Ecology Biogeography, v. 17, pp. 274-283, 2007. Disponível em: https://doi.org/10.1111/j.1466-8238.2007.00363.x. Acesso em: 19 dez. 2022.
ROHDE, K. Latitudinal gradients in species diversity: the search for the primary cause. Oikos, v. 65, pp. 514-527, 1992. Disponível em: https://doi.org/10.2307/3545569. Acesso em: 19 dez. 2022.
ROY, K.; GOLDBERG, E. E. Origination, Extinction, and Dispersal: Integrative Models for Understanding Present‐Day Diversity Gradients. The American Naturalist, v. 170, pp. 571-585, 2007. Disponível em: https://doi.org/10.1086/519403. Acesso em: 19 dez. 2022.
SAZIMA, M.; SAZIMA, I.; BUZATO, S. Nectar by day and night: Syphocampylus sulfureus (Lobeliaceae) pollinated by hummingbirds and bats. Plant Systematics and Evolution, v. 191, pp. 237-246, 1994. Disponível em: 10.1007/BF00984668. Acesso em: 19 dez. 2022.
SAX, D. F. Latitudinal gradients and geographic ranges of exotic species: implications for biogeography. Journal of Biogeography, v. 28, pp. 139-150, 2001.
SILVA, J. M. C. da; BATES, J. M. Biogeographic Patterns and Conservation in the South American Cerrado: A Tropical Savanna Hotspot, BioScience, v. 52, n. 3, pp. 225-234, 2002. Disponível em: http://dx.doi.org/10.1641/0006-3568(2002)052[0225:BPACIT]2.0.CO;2. Acesso em: 19 dez. 2022.
SIMMONS, N. B. Order Chiroptera. In: WILSON, D. E.; REEDER, D. M. (Eds). Mammal species of the world: a taxonomic and geographic reference. 3. ed. Baltimore: Johns Hopkins University Press. v. 1 pp. 312-529, 2005.
VILLALOBOS, F.; ÓLLALA-TÁRRAGA, M. A.; VIEIRA, C. M.; MAZZEI, N. D; Spatial dimension of body size evolution in pterosauria: Bergmann’s rule does not drive Cope’s rule. Evolutionary Ecology Research, vol. 18, n. 02, p. 169-186, 2017
WEIR, J. T.; SCHLUTER, D. The latitudinal gradient in recent speciation and extinction rates of birds and mammals. Science, v. 315, pp. 1574-1576 2007. Disponível em: 10.1126/science.1135590. Acesso em: 19 dez. 2022.
WHITTAKER, R. J. et al. Conservation Biogeography: assessment and prospect. Diversity and Distributions, v. 11, pp. 3-23, 2005. Disponível em: https://doi.org/10.1111/j.1366-9516.2005.00143.x. Acesso em: 19 dez. 2022.
WILLIG, M. R.; KAUFMAN, D. M; STEVENS, R. D. Latitudinal Gradients of Biodiversity: Pattern, Process, Scale, and Synthesis. Annual Reviews in Ecology, Evolution and Systematic, v. 34, pp. 273-309, 2003. Disponível em: 10.1146/annurev.ecolsys.34.012103.144032. Acesso em: 19 dez. 2022.
[1] Doutor em Ciências Ambientais/UFG, Mestre em Ecologia Animal/UFG e Bacharel em Ciências Biológicas/UFG. ORCID: 0000-0001-9958-5261.
[2] Graduação em Ciências Biológicas, Universidade Estadual de Goiás; Especialização em Assistência Virtual. ORCID: 0000-0001-8882-3549.
Enviado: Novembro, 2022.
Aprovado: Dezembro, 2022.