SANTOS, Enrico Jardim Clemente [1], WINCK, Caroline Pinho [2], BRAGA, Camila Landim [3]
SANTOS, Enrico Jardim Clemente; WINCK, Caroline Pinho; BRAGA, Camila Landim. Estudo Eficácia e Segurança Terapêutica das Células-Tronco Mesenquimais Alogênicas no Tratamento de Felinos Acometidos pela Doença Renal Crônica e Resistentes a Eritropoetina Sintética. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano 02, Vol. 01. pp 296-309, Abril de 2017. ISSN 2448-0959
RESUMO
A doença renal crônica (DRC) tem grande importância na medicina veterinária de pequenos animais, pois representa grande casuística não apresentando cura até o momento. Uma das consequências da DRC é a resistência a eritropoetina sintética, o que tende a resultar em uma aplasia medular ocasionando mais danos ao quadro clínico do animal. A aplasia de medular leva a um esgotamento de células oriundas da medula óssea, caracterizada por uma pancitopenia, sendo o paciente submetido à repetidas transfusões sanguíneas para melhora dos sinais clínicos. Neste trabalho relatamos o caso clínico de 9 gatos sem raça definida, de 3 a 4 anos de idade, com diagnóstico de aplasia medular secundária a DRC. Após 2 anos de tratamento convencional suporte para doença renal, os animais desenvolveram um quadro de aplasia medular responsiva apenas ao tratamento sintomático com transfusões de sangue. Os felinos foram submetidos a duas aplicações de células-tronco mesenquimais (CTMs) obtendo cura da aplasia medular e normalização da função renal. Os resultados com o tratamento das CTMs demonstraram resposta medular, com elevação da porcentagem do hematócrito até a estabilidade total da medula. Nesse sentido, este estudo demonstra que em casos de aplasia mieloide secundária a DRC, a terapia com CTs aliada ao tratamento convencional é essencial para a cura, bem como, a melhoria na qualidade de vida dos animais.
Palavra-Chave: Terapia Celular, Anemia Hipoplásica, Tecido Adiposo, Nefropatia.
INTRODUÇÃO
A doença renal (DR) é uma síndrome que se caracteriza pelo comprometimento do metabolismo renal resultando em consideráveis índices de morbidade e mortalidade (1,2). As terapias convencionais, visando promover uma melhora na qualidade de vida dos animais, incluem a fluidoterapia, orientação dietética (3-5). Entretanto, mesmo utilizando-se das terapias conservativas, a injúria estrutural tende a evoluir favorecendo a redução da massa renal e consequentemente a falência do órgão.
No transcorrer da DR, animais que apresentam um quadro de falência renal avançada tendem a apresentar uma reduzida capacidade de sintetizar eritropoietina (o córtex renal produz aproximadamente 90%), ocasionando um quadro de anemia hipoplásica da linhagem eritróide o que torna o animal dependente de eritropoietina sintética (6). Tratamentos muito prolongados tendem a ocasionar um processo de uma resistência a eritropoietina sintética levando o animal a apresentar um quadro de aplasia medular (7).
A aplasia medular se caracteriza por apresentar um quadro de pancitopenia na circulação sanguínea periférica e uma hipoplasia dos três tipos celulares (eritróide, mielóide e megacariocítica) uma vez que ocorre, na medula óssea, a substituição do tecido hematopoiético pelo tecido adiposo (6,7). Perante este estado clínico, faz-se necessário que o paciente seja submetido a repetidas transfusões sanguíneas visando a recuperação da capacidade de transporte de oxigênio (8) e, por conseguinte, a melhora dos sinais clínicos. Uma vez que estes pacientes necessitam de periódicas transfusões sanguíneas outras fontes de tratamento para a aplasia medular devem ser consideradas, dentre elas a utilização da terapia com células tronco mesenquimais (CTMs).
As CTMs são células indiferenciadas capazes de dar origem aos diversos tipos celulares que constituem todos os tecidos que compõem o organismo. Sendo caraterizadas com base no seu potencial de autorenovação, proliferação e diferenciação celular, as CTMs são responsáveis por assegurar a homeostase tecidual durante o transcorrer da vida do animal. As CTMs apresentam um grande número de moléculas bioativas, que atuam modulando a resposta inflamatória, angiogênese, e mitose das células envolvidas no processo de reparação tecidual (9-12). Quando introduzidas no organismo adquirem tanto a morfologia como a funcionalidade de qualquer tipo celular que constitui o tecido lesado de forma a reparar a região injuriadas. Na medicina veterinária as células-tronco vêm sendo utilizadas e sua eficácia demonstrada em estudos relacionados à osteoartrites (13-19), lesões tendíneas (20-22), lesões na córnea (23), sequela de cinomose (24), lesão medular (25-27), aplasia medular (28) e ulceras (29,30) dentre outras.
O objetivo no presente estudo é descrever a eficácia do tratamento com células tronco alogênicas derivada de tecido adiposo de felino (CTMs-TAF) e expostas ao processo de criopreservação, no tratamento de nove gatas acometidas por aplasia medular secundária a doença renal crônica por meio da utilização de CTMs-TAF, visando a melhora da qualidade de vida dos felinos.
MATERIAL E MÉTODOS
Os animais foram selecionados a partir de populações de pacientes de clínicas veterinárias da cidade de São Paulo mediante ao consentimento livre e esclarecido por parte dos proprietários. As CTMs utilizadas no presente estudo foram obtidas a partir de animais jovens, saudáveis com até seis meses de vida (Figura 1).
Foi coletada uma amostra de sangue para a análise da presença de coronavírus felino (FCoV), vírus da imunodeficiência felina (FIV), vírus da leucemia felina (FeLV), Chlamydia pistácia (CPS), herpes vírus felino (FHV-1), Haemobartonella felis (HFE) e micoplasma através da amplificação de fragmentos dos respectivos genomas pelo método da reação em cadeia de polimerase (PCR) em materiais extraídos (RNA e DNA). Os RNAs foram extraídos com Trizol LS (Invitrogen) e utilizados para síntese de cDNA através de transcrição reversa com superscript II (Invitrogen). DNAs foram extraídos utilizando-se o DNAzol (Invitrogen). Reações positivas apresentam fragmentos de DNA de 185 pb e 410 pb (FCoV), 557 pb (FIV) 166 pb (FeLV), 167 pb (CPS), 173 pb (FHV-1), 205 pb (FCV), 170 pb (HFE) e 510 pb (micoplasma). Foram submetidas a cada pesquisa duas amostras extraídas, controles positivos e negativos.
O tecido adiposo obtido no momento da castração foi lavado em 1x PBS de forma a retirar sangue e debris. Após a lavagem o tecido foi mantido durante 30 minutos a 370C/5% de CO2 em presença de 0,075% de colagenase tipo IV (Sigma). Foi adicionado 5 ml de meio basal sendo o sobrenadante retirado e centrifugado durante 5 minutos a 200 g. O precipitado foi ressuspenso e transferido para uma garrafa de cultivo de 25 cm2 a qual foi mantida a 370C/5% CO2 durante 48 horas em presença de meio basal quando o mesmo foi trocado. Os repiques subsequentes forma feitos por meio de ação enzimática utilizando 0.025% de tripsina (Invitrogen) (31). As CTMs-TAF foram divididas em alíquotas de 2 x 106, ressuspensas em meio de congelamento (10% de DMSO, 70% de soro fetal bovino e 20% de meio basal contendo) e armazenadas em nitrogênio líquido. Para serem aplicadas nos felinos, as células forma descongeladas em banho-maria por 2 minutos a 370C, o meio de criopreservação removido e as células transferidas para garrafa de cultivo de 25 cm2 a qual foi mantida a 370C/ 5% CO2 para posteriormente realizar as aplicações terapêuticas (Figura 1).
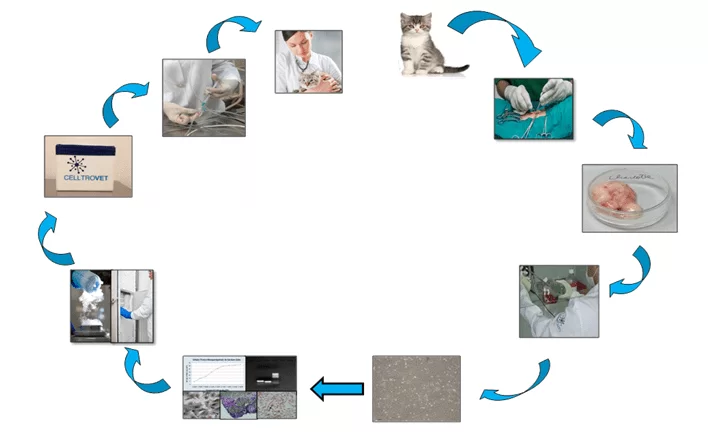
A análise do potencial tumorigênico foi realizado por meio da introdução de 1×106 células, 4a passagem, através da via subcutânea. As CTMs-TAF foram ressuspensas em 2 ml e introduzidas subcutaneamente em três camundongos da linhagem nude. Os animais foram mantidos em ambiente estéril durante o período de sete semanas.
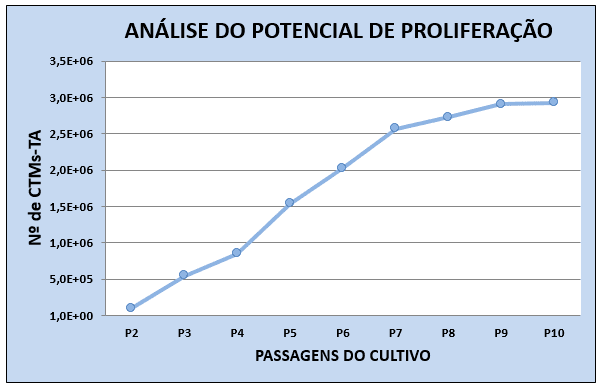
Para a análise proliferativa as CTMs-TAF foram distribuídas, em triplicatas, em garrafas de 25 cm2 na concentração de 105 células. Após três dias as células foram removidas, contadas em câmara de Neubauer e distribuídas em três novas garrafas de 25 cm2. O processo foi repetido até a 10a passagem (32) (Figura 2).
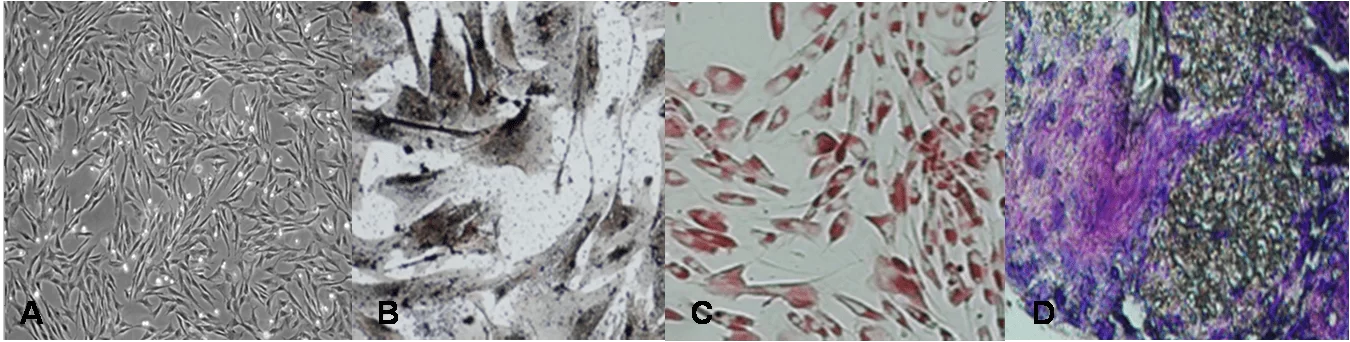
A análise do potencial de diferenciação osteogênico das CTM-TAF foi realizado na 4ª passagem. As células foram cultivadas em meio basal Dulbecco’s Modified Eagle’s Medium–High Glucose (DMEM-HG; Invitrogen), 15% de soro fetal bovino (FBS; HyClone, Logan, Utah), 1% de antibiótico (Penicilina g 10.00u/ml; Invitrogen, Streptomicina 10.000 mg/ml; Invitrogen), 1% de l-glutamina (200mm; Invitrogen) e 1% de aminoácidos não essenciais (200mm; Invitrogen) durante o período de 24 horas na concentração inicial de 1×105 células. Após 24 h, o meio foi trocado para o de diferenciação osteogênica Dulbecco’s Modified Eagle’s Medium – Low Glucose (DMEM-LG; Invitrogen), 1% de 10-5M de dexametasona (Sigma), 1% 5mM de ácido ascórbico (Sigma), 10% de soro fetal bovino (FBS; HyClone, Logan, Utah) e 1% Streptomicina/Penicilina (Penicilina g 10.00u/ml, Streptomicina 10.000 mg/ml; Invitrogen). A troca do meio foi feita a cada 3 ou 4 dias. No 10o dia foi adicionado 1% de 200mM de b-glicerolfosfato (Sigma) ao meio de cultura e também nas trocas subsequentes. As células foram mantidas em cultura até o 21o dia de diferenciação. A caracterização das células foi feita por meio da coloração de Von Kossa (31) (Figura 3a).
Para a análise do potencial de diferenciação adipogênico as CTM-TAF foram cultivadas, na 4ª passagem, em meio basal durante por 24 h na concentração inicial de 1×105 células. Após 24 horas o meio foi trocado para o de diferenciação adipogênica composto por Dulbecco’s Modified Eagle’s Medium – HIGH Glucose (DMEM-HG; Invitrogen), 10% de soro fetal bovino (FBS; HyClone, Logan, Utah), 1 mM de dexametasona (Sigma), 100 mM de endomentacina (Sigma), 0,5M de isobutilmetilxantina (Sigma) + 10 µM de insulina (Sigma) e 1% de antibiótico (Penicilina g 10.00u/ml; Invitrogen, Streptomicina 10.000 mg/ml; Invitrogen), sendo a troca do meio foi feita a cada 3 ou 4 dias. As células foram mantidas em cultura até o 21o dia de diferenciação. As células foram então fixadas por 60 minutos a temperatura ambiente em presença de paraformaldéido 4%, lavadas 3 vezes com etanol 70%, mantidas a temperatura ambiente por cinco minutos com OilRed O , sendo posteriormente lavadas 3 vezes com água destilada (31) (Figura 3c).
Para a análise do potencial de diferenciação condrogênico as CTM-TAF, na 4ª passagem, foram transferidas, na concentração 1 x 106, para tubos falcon de 15 ml, centrifugadas a 200g por 5 minutos. Em seguida foram cultivadas na presença de meio Dulbecco’s Modified Eagle’s Medium – HIGH Glucose (DMEM-HG; Invitrogen) suplementado com 1% de soro fetal bovino (FBS; HyClone, Logan, Utah), 6,25 mM de insulina (Sigma), 0,1 mM de dexametasona (Sigma), 1 mM de piruvato de sódio (Invitrogen), 10 ng/ml TGF-β1(R&D System, LGC Biotechnology) e 1% de antibiótico (Penicilina g 10.00u/ml; Invitrogen, Streptomicina 10.000 mg/ml; Invitrogen) sendo que a troca do meio indutor foi realizada diariamente durante 21 dias. Posteriormente o pellet esférico formado foi fixado, incluso, cortado e corados com azul de toluidina (Sigma) (33) (Figura 3d).
Neste estudo nove gatos sem raça definida, entre 3 e 4 anos de idade, tratados há pelo menos 2 anos para DRC estando classificados, segundo a IRIS, como estágio 2 da DRC, submetidos a fluidoterapia em dias alternados, foram submetidos a exames físicos, laboratoriais (hemograma, perfil hepático e renal, urinálise e dosagem eletrolítica) e anamnese junto aos proprietários. Foram solicitados raio-x de tórax e ultrassom abdominal de foram a minimizar a possibilidade de neoplasia. Os animais se encontravam laboratorialmente e clinicamente estáveis a pelo menos duas semanas. Felinos que apresentassem evidencias de ureterólise, pielonefrose, anormalidades anatômicas como rim policístico, hipertensão ou hipotensão ou doenças sistêmicas foram excluídos do estudo. Os animais forma submetidos há transfusões sanguíneas sempre que os hematócrito se encontravam abaixo de 13%. Os níveis de ureia e creatinina, mantiveram-se em torno de 90 mg/dL e 3,0mg/dL respectivamente, sendo os animais submetidos a fluidoterapia em dias alternados, com 250 ml de solução fisiológica 0.9%. Foi realizada a aplicação de duas doses de CTMs-TAF (2×106), após descongelamento, sendo uma injunsão realizada pela via endovenosas pela veia cefálica e a outra intramedular com intervalo de 30 dias. A análise do perfil renal e hemogramas foram realizados quinzenalmente.
RESULTADOS
Após a realização dos exames físicos nos nove felinos constatou-se quadros de ausência de dor, ausculta cardiopulmonar sem alterações, desidratação entre leve a moderada, mucosas oculares, bucal e vulvar hipocoradas, linfonodos de tamanho e consistência normais. Na anamnese, os proprietários descreveram: apetite seletivo e prostração. Todos os animais tinham vacinas, vermifugações e controle de ectoparasitas atualizados. A análise do quadro clínico e laboratorial dos animais demonstrou uma reticulocitose insuficiente para a recuperação dos valores eritróides, bem como hemácias normocíticas e normocrômicas. Detectou-se uma redução progressiva nos valores de hematócrito durante o período de tratamento dos animais para DRC sendo posteriormente diagnosticado um quadro de aplasia medular secundária a DRC, não responsiva a eritropoietina. Os níveis de ureia e creatinina, mantiveram-se em torno de 90 mg/dL e 3,0mg/dL, respectivamente sendo os animais submetidos a fluidoterapia em dias alternados.
Foram aplicadas duas doses de CTMs-TAF, após o descongelamento, com intervalos de 30 dias sendo a primeira pela via endovenosa e a posterior via intramedular, na tentativa de reverter o quadro de aplasia medular. Após a primeira aplicação, via sistêmica, os resultados da função renal apresentaram uma tênue redução para em torno de 85 mg/dL ureia e 2,7mg/dL de creatinina tendo sido detectado uma elevação dos valores do hematócrito. Os animais apresentaram maior disposição se locomovendo, alimentando e bebendo água de forma satisfatória. O espaçamento da transfusão ocorreu de 15 dias para o período de 21 à 23 dias (Figura 3).
Após a realização da segunda aplicação de CTMs-TA pela via intramedular os animais restabeleceram os parâmetros de referência hematimétricos (43 à 45%), mantendo os valores de ureia estáveis e creatinina estáveis sendo a fluido terapia realizada em um intervalo de dias alternados (Figura 3).
Tabela 1 – Tabela representativa da variação dos níveis de hematócrito após o início da terapia com células tronco. No gráfico são apresentados os valores relativos aos índices de hematócritos analisados semanalmente. Ocorreram duas aplicações de CTMs-TAF sendo a primeira pela via endovenosa (Dia 0) e a segunda pela via intramedular (Dia 30).
| HEMATÓCRITO | ||||||||||
| Dias | Gato 1 | Gato 2 | Gato 3 | Gato 4 | Gato 5 | Gato 6 | Gato 7 | Gato 8 | Gato 9 | |
| 0 | 14% | 15% | 17% | 16% | 18% | 14% | 19% | 20% | 22% | |
| 7 | 18% | 19% | 21% | 18% | 19% | 20% | 23% | 24% | 24% | |
| 14 | 17% | 20% | 19% | 18% | 17% | 18% | 22% | 19% | 24% | |
| 21 | 14% | 12% | 11% | 10% | 14% | 14% | 13% | 15% | 16% | |
| 28 | 16% | 17% | 15% | 15% | 18% | 19% | 17% | 17% | 22% | |
| 30 | 16% | 16% | 14% | 15% | 18% | 18% | 17% | 17% | 21% | |
| 37 | 21% | 21% | 23% | 25% | 24% | 25% | 26% | 24% | 26% | |
| 44 | 36% | 39% | 32% | 31% | 34% | 34% | 38% | 32% | 35% | |
| 51 | 44% | 44% | 39% | 39% | 42% | 44% | 43% | 40% | 44% | |
| 58 | 43% | 44% | 43% | 42% | 44% | 43% | 43% | 44% | 42% | |
| 65 | 43% | 44% | 44% | 43% | 44% | 43% | 43% | 43% | 43% | |
Os tratamentos foram finalizados há mais de 24 meses. Os animais apresentam quadros estáveis e com as funções preservadas, não estando sendo submetidos a qualquer tratamento relacionado a aplasia medular. Os felinos realizam controle semestral de hemograma completo, apresentado os índices hematológicos dentro dos valores de referência. Alimentam-se normalmente, apenas com ração terapêutica renal, realizando atividades físicas normais, o que demonstra grandes mudanças, tanto clínica como laboratorial.
DISCUSSÃO
Os nove pacientes vinham sendo tratados para DRC à aproximadamente dois anos. Baseado tanto nos sinais clínicos de apatia e mucosas oculares, bucal e vulvar hipocoradas como dados laboratoriais que demonstraram uma diminuição dos valores de hematócrito característicos de processos anêmicos não regenerativos os animais foram diagnosticados com um quadro de aplasia medular. Embora o tratamento com a eritropoietina sintética inicialmente tenha se mostrado eficaz na estimulação da eritropoiese medular, aumentando a massa circulante de eritrócitos e por consequência melhorando o quadro anémico, os animais terminaram tornando-se não responsivos a eritropitina sintética (6,7).
A terapia com CTMs vêm apresentado resultados extremamente relevantes no campo da medicina veterinária. Dentre as doenças mais comumente tratadas temos as lesões osteoarticulares(13-19), onde se observa uma melhora significativa na claudicação, dor e amplitude do movimento e as tendíneas onde se constata uma melhor qualidade do tecido tendíneo minimizando a taxa de rencidivas (20-22). Em se tratando de aplasia mielóide, resultados promissores vêm sendo apresentados abrindo uma nova perspectiva no tratamento de animais acometidos pela doença (28,34).
No tratamento dos pacientes em questão, foram utilizadas CTMs alogênicas isoladas a partir do tecido adiposo de um felino jovem e clinicamente saudável, após terem sido exposta ao processo de criopreservação. Tal abordagem é possível devido a atividade imunossupressora apresentadas pelas CTMs(35)
Estudos demonstraram que as CTMs possuem a capacidade de regular a resposta imune por meio da inibição da maturação das células dendríticas, assim como a supressão da proliferação e função tanto das células natural killer como dos linfócitos T e B. Em razão das CTMs possuírem uma baixa expressão tanto de moléculas co-estimulatórias, necessárias para a ativação das células T como do complexo de histocompatibilidade classe II (MHC-II), tornam-se imperceptíveis ao sistema imunológico(36).
Com base nos exames hematológicos foram realizadas transfusões sanguíneas quando os hematócrito se encontravam abaixo de 13% visando a normalização dos quadros clínicos e laboratoriais de forma a tornar mais efetiva a primeira aplicação das CTMs-TAF, realizada pela via endovenosa por meio da veia cefálica. Em razão do estado clínico dos animais, optou-se inicialmente pela utilização da via endovenosa por meio da punção da veia cefálica, uma vez que esta via se mostra de fácil acesso e pouco traumática (37). Embora não tenha sido observada uma pequena melhora no quadro hematopoiético após a primeira aplicação das CTMs-TAF, apenas um espaçamento entre as transfusões sanguínea de 15 para 21 à 23 dias em decorrência de uma queda mais lenta dos níveis de hematócrito, constatou-se uma tênue redução nos índices de ureia e creatinina. A fluidoterapia foi mantida de forma constante em dias alternados. Estes dados sugerem que as CTMs-TAF oriundas da primeira aplicação tenham atuado de forma a melhorar o quadro renal em detrimento do hematopoiético. Estudos vêm demonstrando que a infusão sistêmica resulta na retenção das CTMs transplantadas em outros órgãos o que sugere que, em razão do quadro debilitado dos animais, as CTMs-TAF tenham migrado para os rins (38).
Após a segunda aplicação das CTMs-TAF, por meio da via intramedular, observou-se uma elevação significativa das taxas de hematócrito atingindo níveis entre 43% e 45%, os quais não haviam sido obtidos desde o início do quadro de aplasia medular, não sendo necessárias transfusões posteriores. Estes resultados sugerem uma maior retenção das CTMs-TAF na medula reduzindo a taxa de migração das células transplantadas para os demais órgãos (39). Estudos demonstram que o sucesso da terapia com CTMs está diretamente relacionado a permanência das células transplantadas no local lesionado, propiciando uma atuação mais efetiva das células (40).
Os dados obtidos sugerem uma possível recuperação do ambiente hematopoiético o qual é composto por CTMs, responsáveis por dar origem a diversas linhagens que constituem o estroma medular assim como células tronco hematopoiéticas (CTHs) responsáveis pela produção das células sanguíneas (41). Os índices de ureia e creatinina permaneceram estáveis sendo a fluidoterapia espaçada para cada 3 dias.
CONCLUSÕES
Este estudo piloto apresenta uma nova possibilidade para o tratamento da aplasia medular em decorrência da doença renal, aliada com a terapia convencional, visando a melhoria da qualidade de vida dos animais. Embora os resultados demonstrem um quadro estável e dentro dos padrões de referência de normalidade, não podermos descartar a possibilidade da reincidência do quadro de aplasia medular.
REFERÊNCIAS
1 – LEES G.E. Early diagnosis of renal disease and renal failure. Vet Clin North Am Small Anim Pract., 34(4):867-85, 2004.
2 – PRESSLER B.M. Clinical approach to advanced renal function testing in dogs and cats. Vet Clin North Am Small Anim Pract., 43(6):1193-208, 2013.
3 – FISCHER J.R, et. al. Veterinary hemodialysis: advances in management and technology. Vet Clin North Am Small Anim Pract., 34(4):935-67, vi-vii, 2004.
4 – CASTRO M.C.N. Prolongando a vida do paciente com insuficiência renal crônica. Clínica Veterinária, São Paulo, 58: 50-58, set./out 2005.
5 – QUEIROZ L.L., Tratamento da doença renal crônica em cães e gatos. Goiânia: Escola de Veterinária e Zootecnia da Universidade Federal de Goiás, 2013.
06 – FELDMAN, B.F.; et. al. Aplastic anemia In: Weiss, D.J. Schalm’s veterinary hematology. Ed.5, Philadelphia: Lippincott Williams & Wilkins, p.212-215, 2000.
07 – WEISS, D.J. New insights into the physiology and treatment of acquired myelodysplastic syndromes and aplastic pancytopenia. The Veterinary Clinics of North America – Small Animal Practice, Philadelphia, 33(6):1317- 1334, 2003.
08 – ROCHA, J.R.; et. al. Avante, M.L. Histórico, evolução e correlação da transfusão sanguínea com os principais animais domésticos: revisão literária. Revista Científica Eletrônica de Medicina Veterinária, 7(13):12-18, 2009.
09 – DIMARINO A.M.,et. al. Mesenchymal stem cells in tissue repair. Front Immunology, 4; 4:201, 2013;.
10 – MURPHY M.B., et. al. Mesenchymal stem cells: environmentally responsive therapeutics for regenerative medicine. Exp Mol Medicine, p. 45-54, 2013.
11 – CAPLAN A.I., et. al. The MSC curtain that stops the immune system. Immunol Lett., 168(2):136-9, 2015a.
12 – CAPLAN A.I., et. al. Body Management: Mesenchymal Stem Cells Control the Internal Regenerator. Stem Cells Transl Med., 4(7):695-701, 2015b.
13 – BLACK L.L., et. al. Effect of adipose-derived mesenchymal stem and regenerative cells on lameness in dogs with chronic osteoarthritis of the coxofemoral joints: a randomized, double-blinded, multicenter, controlled trial. Veterinary Therapeutics: Research in Applied Veterinary Medicine, 8(4):272-284, 2007.
14 – BLACK L.L., et. al. Effect of intraarticular injection of autologous adipose-derived mesenchymal stem and regenerative cells on clinical signs of chronic osteoarthritis of the elbow joint in dogs. Veterinary Therapeutics: Research in Applied Veterinary Medicine, 9(3):192-200, 2008.
15 – GUERCIO A., et. al. Production of canine mesenchymal stem cells from adipose tissue and their application in dogs with chronic osteoarthritis of the humeroradial joints. Cell Biology International, 36(2):189-194, 2012.
16 – CUERVO B.; et. al. Hip osteoarthritis in dogs: a randomized study using mesenchymal stem cells from adipose tissue and plasma rich in growth factors. Int J Mol Sci., 15(8):13437-60, 2014.
17 – VILAR J.M.; et. al. Controlled, blinded force platform analysis of the effect of intraarticular injection of autologous adipose-derived mesenchymal stem cells associated to PRGF-Endoret in osteoarthritic dogs. BMC Veterinary Research, 9:131, 2013.
18 – VILAR J.M.; et. al. Assessment of the effect of intraarticular injection of autologous adipose-derived mesenchymal stem cells in osteoarthritic dogs using a double blinded force platform analysis. BMC Veterinary Research, 10:143, 2014.
19 – VILAR P.M.; et. al. Serum Collagen Type II Cleavage Epitope and Serum Hyaluronic Acid as Biomarkers for Treatment Monitoring of Dogs with Hip Osteoarthritis. PLoS One, 11(2):e0149472, 2016.
20 – SMITH R.K.; et. al. Harnessing the stem cell for the treatment of tendon injuries: heralding a new dawn? British Journal of Sports Medicine, 39(9):582-584, 2005;.
21 – LEE S.Y.; et. al. Treatment of Lateral Epicondylosis by Using Allogeneic Adipose-Derived Mesenchymal Stem Cells: A Pilot Study. Stem Cells, 33(10):2995-3005, 2015.
22 – EDMONDS R.E.; et. al. Influence of commonly used pharmaceutical agents on equine bone marrow-derived mesenchymal stem cell viability. Equine Veterinary Journal, May 10, 2016.
23 – MORIYAMA H.; et. al. Anatomical location and culture of equine corneal epithelial stem cells. Vet. Ophthalmology, 17:106-112, 2014.
24 – BRITO H.F.V.; et. al. Tratamento de sequelas neurológicas em cães, causadas por infecção pelo vírus da cinomose, através do transplante alogênico de células mononucleares de medula óssea. Revista Científica de Medicina Veterinária. Pequenos Animais e Animais de Estimação, 24(8):26-29, 2010;
25 – PENHA E.M.; et al. Use of autologous mesenchymal stem cells derived from bone marrow for the treatment of naturally injured spinal cord in dogs. Stem Cells Int., 437521, 2014;.
26 – KIM Y.; et. al. Antioxidant and anti-inflammatory effects of intravenously injected adipose derived mesenchymal stem cells in dogs with acute spinal cord injury. Stem Cell Research Therapy, 26, 6:229, 2015.
27 – KIM Y.; et. al. Transplantation of adipose derived mesenchymal stem cells for acute thoracolumbar disc disease with no deep pain perception in dogs. Journal Veterinary Science, 17(1):123-6, 2016.
28 – GATTI A.; et. al. Terapia celular no tratamento de anemia não regenerativa por hipoplasia da série eritroide. Revista Científica de Medicina Veterinária, 12(14);296-303, 2014.
29 – ALY L.A.; et. al. Efficiency of systemic versus intralesional bone marrow-derived stem cells in regeneration of oral mucosa after induction of formocresol induced ulcers in dogs. Dent Res J (Isfahan), 11(2):212-21, 2014.
30 – ALAMOUDI N.M.; et. al. Treatment of oral ulcers in dogs using adipose tissue-derived mesenchymal stem cells. J Clin Pediatr Dent., 38(3):215-22, 2014.
31 – ZUK P.A.; et. al. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Engineering, v.7, n.2, p.211-228, 2001.
32 – WINCK C.P. Cultivo e caracterização de células-tronco de membrana amniótica canina (Trabalho de Conclusão de Curso). Universidade de Santo Amaro. 2009.
33 – JOHNSTONE B.; et. al. In vitro chondrogenesis of bone marrow-derived mesenchymal progenitor cells. Exp Cell Research, 238(1):265–272, 1998.
34 – OZDOĞU H.; et. al. Use of mesenchymal cells to modulate immune suppression and immune reconstruction in a patient with aplastic anemia complicated by invasive sino-orbital aspergillosis. Turk J Haematology, 31(2):181-3, 2014.
35 – YI T.; et. al. Immunomodulatory properties of mesenchymal stem cells and their therapeutic applications. Arch Pharm Research, 35(2):213-21, 2012.
36 – TANG R.; et. al. Swine dental pulp stem cells inhibit T-cell proliferation. Transplantation Proceedings, 43(10):3955-3959, 2011.
37 – WEI H.; et. al. Cell delivery and tracking in post-myocardial infarction cardiac stem cell therapy: an introduction for clinical researchers. Heart Failure Reviews, 15(1):1-14, 2010.
38 – BARBASH I.M.; et. al. Systemic delivery of bone marrow-derived mesenchymal stem cells to the infarcted myocardium: feasibility, cell migration, and body distribution. Circulation, 108(7):863-868, 2003.
39 – LI L.; et. al. Effects of administration route on migration and distribution of neural progenitor cells transplanted into rats with focal cerebral ischemia, an MRI study. Journal of Cerebral Blood Flow and Metabolism,; 30(3):653-662, 2010.
40 – FUCHS E.; et. al. Stem cells: a new lease on life. Cell, 100(1):143-155, 2000.
41 – SORDI V.; et. al. Bone marrow mesenchymal stem cells express a restricted set of functionally active chemokine receptors capable of promoting migration to pancreatic islets. Blood, 106(2):419-427, 2005;.
[1] Biocientista. Mestre, Doutor, Pós-Doutor. Diretor de Inovação Tecnológica da CELLTROVET.
[2] Bióloga, Mestre. Gestora do Laboratório de Biotecnologia da CELLTROVET.
[3] Médica Veterinária, Especialista em Nefrologia. Médica Veterinária na Clínica Veterinária RenalVet.

